叶酸水平及HPV16感染对妇女发生宫颈癌变的协同作用研究
2016-09-12许晓燕兰艳丽
许晓燕 邢 辉 兰艳丽 刘 韵
叶酸水平及HPV16感染对妇女发生宫颈癌变的协同作用研究
许晓燕邢辉兰艳丽刘韵
目的探讨叶酸水平、HPV16感染及HPV16 E2和E6 mRNA水平与宫颈癌变的关系,并研究叶酸水平及HPV16感染在宫颈癌变中的协同作用。方法选择新发宫颈炎症(CI)患者40例、宫颈上皮内瘤样变(CIN)患者80例(CINⅠ患者36例,CINⅡ/Ⅲ44例)、宫颈鳞状细胞癌(SCC)患者48例作为研究对象,采用微生物法测定血清叶酸和红细胞叶酸含量,采用PCR检测宫颈癌组织HPV16的感染情况,采用荧光定量PCR检测宫颈癌组织和叶酸体外干预后Caski宫颈癌细胞中HPV16 E2及E6 mRNA水平,检测不同叶酸浓度对Caski和C33A细胞抑制情况。结果CINⅠ组、CINⅡ/Ⅲ组和SCC组HPV16感染率分别与CI组宫颈组织HPV16感染率比较,差异具有统计学意义(P<0.05)。CINⅠ、CINⅡ/Ⅲ、SCC 各组HPV16 E2和E6 mRNA水平与CI组比较差异均具有统计学意义(P<0.0001)。宫颈癌的严重程度与HPV16 E2和E6 mRNA水平均呈明显正相关性,与血清叶酸和红细胞叶酸含量均呈显著负相关性。叶酸浓度与Caski细胞和C33A细胞的相对抑制率及HPV16 E2和E6 mRNA水平呈明显负相关性。结论叶酸水平低、HPV16感染及HPV16 E2及E6 mRNA低表达均与宫颈癌变有关,补充叶酸明显抑制宫颈癌细胞的增殖,逆转HPV16 E2及E6高表达,提示叶酸水平及HPV16感染在宫颈癌变的过程中具有协同作用。
叶酸;HPV16; E2;E6; 宫颈癌
(ThePracticalJournalofCancer,2016,31:875~878)
宫颈癌是全球妇女中仅次于乳腺癌和结直肠癌的第三个常见的恶性肿瘤,也是最常见的女性生殖道恶性肿瘤,其病因与许多因素有关[1],其中高危型的HPV持续性感染是宫颈癌发生的主要危险因素,90%以上的宫颈癌伴发高危型人乳头状瘤病毒(HPV)感染,HPV16为HPV的其中一个亚型,据报道,HPV16感染是导致子宫颈腺癌发生的重要原因[2-3]。国内外的研究报道显示[4],宫颈癌的发生和发展与叶酸的缺乏呈密切的正相关。本研究一方面通过检测宫颈癌患者HPV16 感染状态、HPV16 E2和E6 mRNA水平、血清叶酸、红细胞叶酸水平,另一方面研究叶酸干预对HPV16阳性的CaSki宫颈癌细胞中HPV16 E2及E6 mRNA水平的影响,从两个方面探讨叶酸水平及HPV16感染对妇女发生宫颈癌变的协同作用研究。
1 材料与方法
1.1研究对象
选择2010年7月-2014年9月在我院经病理学检查确诊的新发宫颈炎症(CI)患者40例,宫颈上皮内瘤样变(CIN)患者80例,其中低度CIN患者36例,高度CIN患者44例,宫颈鳞状细胞癌(SCC)患者48例,在入院后、系统治疗前采集所有研究对象清晨空腹静脉血和手术或活体宫颈组织标本,置于-80℃保存,用于后续叶酸水平、HPV16 感染情况及HPV16E2及E6 mRNA水平检测。排除标准:溶血性疾病、营养性巨幼细胞性贫血、消化道疾病、其他肿瘤患者,以及 3个月内B族维生素使用者。
1.2细胞系的选择与叶酸干预
选择HPV16阳性宫颈癌细胞Caski和HPV16阴性宫颈癌细胞C33A为研究的细胞系(均购于中国医学科学院基础研究所),在10%胚胎牛血清的DMEM培养液中进行培养、传代,对数生长期的Caski细胞培养18 h后,转入含不同浓度叶酸培养液中进行培养,以叶酸浓度为1 μg/ml为对照,以浓度为0.1 μg/ml为叶酸缺乏组,5个干预组的叶酸浓度分别为20 μg/ml、100 μg/ml、200 μg/ml、1 000 μg/ml、2 000 μg/ml。检测不同叶酸浓度干预下癌细胞生长情况、HPV16 E2及E6基因的mRNA水平。
1.3检测方法
①按试剂盒操作说明抽提宫颈癌组织DNA (组织DNA抽提试剂盒,购于北京全式金生物技术有限公司),以抽提DNA为模板,通过常规PCR检测宫颈癌组织HPV16的感染情况,所用引物序列:HPV16F:5’-GTATACGGTCAAGGAGTACGTA-3’,HPV16R:5’-CACCGAGCTTATCCGTAAGCGG-3’。②采用微生物法测定血清叶酸和红细胞叶酸含量,具体操作参照文献[5]。③采用常规四甲基偶氮噻唑蓝( MTT) 法检测叶酸干预对Caski细胞和Hela细胞增殖的影响,具体操作参照文献[6]。④采用RNA抽提试剂盒(购于北京全式金生物技术有限公司)提取癌组织和癌细胞总RNA,浓度及纯度符合要求的RNA进行合成cDNA第一链,cDNA第一链的合成按照First Strand cDNA synthesis Kit操作说明(Takara公司,日本)。合成的cDNA通过实时荧光定量PCR反应检测HPV16 E2及E6基因的mRNA水平(TransStart Top Green qPCRSuperMix试剂盒,购于北京全式金生物技术有限公司),以GAPDH基因为参考基因,E2-F:5’-GACGACCCGTCTCAAGGAG-3’,E2-R:5’-GATCCACTACTCAGGCTTC-3’,扩增片段长度为115 bp;E6-F:5’-CATGCTCAGTTACCTGAT-3’,E6-R:5’-ACGGATACTCAGCTGACTAGA’,扩增片段长度为107bp; 以GAPDH作为参考基因,引物序列为:5’-CGACGTAGTCTCATCTGACTT-3’,5’-GTTGCAGTCGACATAATCGTTGA-3’,片段长度为114 bp,引物均由上海生工有限公司合成。PCR反应体系为:cDNA第一链1 μl,2xTrans Start Top Green qPCRSuperMix 10 μl,引物1(10 μM)0.6 μl,引物2(10 μM)0.6 μl,Passive Reference Dye 0.4 μl,ddH2O 7.4 μl,反应在ABI7500荧光定量PCR仪中进行,扩增程序为:95 ℃预变性3 min,95 ℃10 s;58 ℃20 s;72 ℃30 s,40个循环,同时进行溶解曲线的分析,程序为:60 ℃1 min;95 ℃30 s。在ABI7500分析软件上分析E2、E6、GAPDH基因(参考基因)的Ct值,采用2- Ct法计算CaSki细胞处理前后E2、E6、GAPDH的表达量,采用公式Ct=Ct(目的基因)- Ct(GAPDH基因)。
1.4统计学处理
应用SPSS 18.0统计分析软件进行统计学处理,组内比较采用t检验,多组间比较采用单因素方差分析,相关性分析采用Pearson或Spearman分析,以P<0.05为具有统计学差异。
2 结果
2.1不同宫颈癌组织中HPV16的感染情况
CINⅠ组、CINⅡ/Ⅲ组和SCC组HPV16感染率分别与CI组宫颈组织HPV16感染率比较,差异具有统计学意义(P<0.05),见表1。
2.2不同宫颈癌组织HPV16 E2和E6 mRNA水平检测
不同宫颈癌组织中,HPV16 E2 mRNA水平从CI到SCC明显升高,各组之间的总体差异显著,具有统计学意义(F=196.2,P<0.0001),同时,HPV16 E6 mRNA水平从CI到SCC也明显升高,各组之间的总体差异具有统计学意义(F=129.9,P<0.0001)。CINⅠ,CINⅡ/Ⅲ,SCC 各组HPV16 E2和E6 mRNA水平分别与CI组HPV16 E2和E6 mRNA水平进行比较,差异均具有统计学意义(P<0.0001),见表2。相关性的分析结果显示,宫颈癌的严重程度与HPV16 E2和E6 mRNA水平均呈明显的正相关性(E2:γ=0.9928,P=0.0072;E6:γ=0.9990,P=0.0010)。
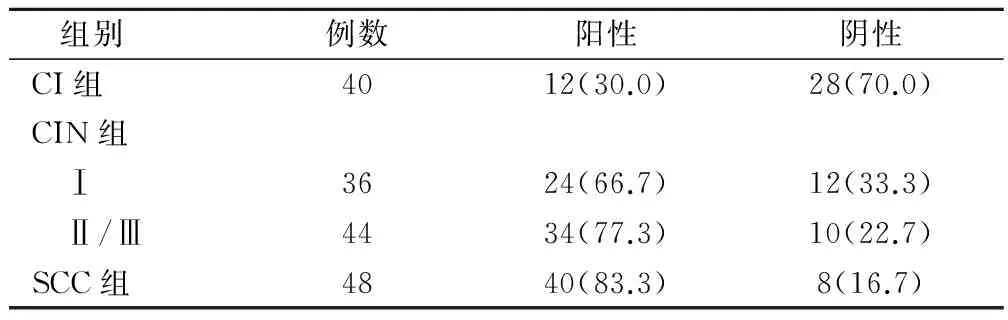
表1 不同宫颈癌组织中HPV16的感染情况(例,%)
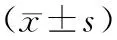
表2 不同宫颈癌组织中HPV16 E2和E6 mRNA水平检测
注:*与CI组比较,P<0.05。
2.3不同宫颈癌患者中血清叶酸和红细胞叶酸含量检测
血清叶酸和红细胞叶酸含量检测结果显示,各组间总体血清叶酸含量和红细胞叶酸含量差异显著,均具有统计学意义(F值分别为33.82,14.35,P<0.0001)。CINⅠ、CINⅡ/Ⅲ、SCC 各组患者血清叶酸和红细胞叶酸含量分别与CI组进行比较,差异均具有统计学意义(P<0.05),见表3。相关性的分析结果表明,宫颈癌的严重程度与血清叶酸和红细胞叶酸含量均呈显著负相关(E2:γ=-0.9847,P=0.0153;E6:γ=-0.9957,P=0.0043)。
表3不同宫颈癌组织中血清叶酸和红细胞叶酸含量比较
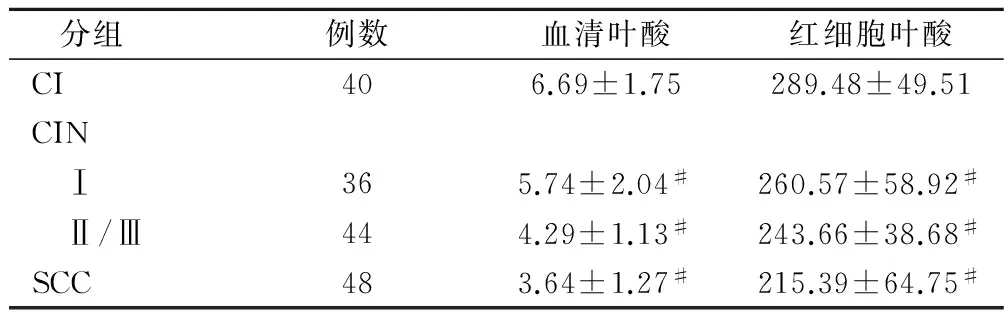
分组 例数血清叶酸红细胞叶酸CI406.69±1.75289.48±49.51CIN Ⅰ365.74±2.04#260.57±58.92# Ⅱ/Ⅲ444.29±1.13#243.66±38.68#SCC483.64±1.27#215.39±64.75#
注:#为与CI组比较,P<0.05。
2.4叶酸干预对Caski细胞和C33A细胞增殖的影响
不同叶酸浓度均抑制Caski细胞和C33A细胞的增殖,与对照组相比,不同叶酸干预组Caski和C33A细胞的增殖情况差异均具有统计学意义(P<0.0001);且叶酸缺乏组与对照组Caski和C33A细胞增殖情况比较差异显著,均具有统计学意义(P<0.05),见表4。相关性分析结果显示,叶酸浓度与Caski细胞和C33A细胞的相对抑制率具有明显相关性(Caski:γ=-0.7656,P=0.0448;C33A:γ=-0.7791,P=0.0389)。
表4 叶酸干预对Caski细胞和C33A细胞增殖的影响±s)
注:a为与对照组比较,P<0.05。
2.5叶酸干预对Caski细胞HPV16 E2和E6 mRNA水平的影响
随着叶酸浓度的升高,HPV16 E2和E6 mRNA水平均明显下降,与对照组相比,差异具有统计学意义(P<0.05),见表5。相关性的分析结果表明,叶酸浓度与HPV16 E2和E6 mRNA水平呈明显的负相关性(E2:γ=-0.8163,P=0.0251;E6:γ=-0.8172,P=0.0248),见表5。
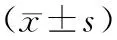
表5 叶酸干预对Caski细胞HPV16 E2和E6 mRNA水平的影响
注:b为与对照组比较,P<0.05。
3 讨论
HPV能入侵皮肤、粘膜、生殖器组织中的上基部角蛋白细胞和上皮细胞,引起癌症或性病。目前的研究认为90%以上的宫颈癌与持续性的高危型 HPV感染有关[5]。在HPV亚型中,HPV16是引起HPV相关癌症中最普遍的一种类型,据报道[6],大约50%~60%的癌症涉及HPV16。也有报道指出[7],子宫颈腺癌HPV亚型则以HPV18、HPV16及HPV45为主。本文从HPV16角度进行研究,对不同时期的宫颈病变进行HPV16感染率的检测,结果显示,在新发宫颈炎症、宫颈上皮内瘤样变、宫颈鳞状细胞癌组织中均检测到HPV16,且随着病变程度的加重,HPV16的感染率也上升,表明HPV16与宫颈癌变有关,与研究报道一致[8]。E6是 HPV16亚型编码的主要的致癌基因,在病毒的复制和致癌进程中起着重要的作用,E6通过与肿瘤抑癌基因形成特殊的复合物调控肿瘤生长的信号通路,而E2调控致癌基因的转录过程,进一步影响E6基因功能的发挥[9],本文对新发宫颈炎症、宫颈上皮内瘤样变、宫颈鳞状细胞癌组织进行E6和E2 mRNA水平的检测,结果显示,随着宫颈组织病变程度的加重,E6和E2 mRNA水平也呈明显上升,且与宫颈组织病变程度呈显著的正相关。
叶酸对细胞的分裂生长及核酸、氨基酸、蛋白质的合成起着重要的作用,已有研究指出叶酸营养状况好与食道癌、胃癌、乳腺癌、结直肠癌、宫颈癌等多种癌症患病危险性低有关联[10]。本研究采用微生物法对新发宫颈炎症、宫颈上皮内瘤样变、宫颈鳞状细胞癌的血清叶酸和红细胞叶酸的含量进行检测,结果显示血清叶酸和红细胞叶酸的含量与宫颈癌变呈现明显的负相关,与研究报道一致[11]。体外实验结果进一步证实了叶酸的干预可明显抑制Caski宫颈癌细胞和C33A宫颈癌细胞的增殖。
叶酸的缺乏可使DNA链断裂、修复障碍、突变增加以及低甲基化。在癌症发生的过程中,HPV致癌基因与宿主细胞DNA进行整合是癌症发生的必要条件,易发生于染色体脆性位点,而低叶酸营养状态大大增加了HPV DNA整合到脆性位点的几率[12],鉴于此,本文进一步从体外实验研究叶酸水平与HPV16的相互关系,选择HPV16阳性的Caski宫颈癌细胞为研究对象,进行不同叶酸浓度干预后,检测Caski细胞E6和E2 mRNA水平,结果显示随着叶酸浓度的升高,Caski细胞中E2和E6 mRNA水平均明显的下降,且与对照组相比,差异具有统计学意义(P<0.05)。相关性的分析结果进一步表明,叶酸浓度与E2及E6 mRNA水平均呈明显的负相关性,提示补充叶酸可明显逆转HPV16引发的癌症中E2和E6高表达,叶酸水平及HPV16感染在宫颈癌变的过程中可能具有协同作用,其具体的作用机制仍有待进一步的研究。
综上所述,叶酸水平低、HPV16感染及E2及E6 mRNA低表达均与宫颈癌变有关,补充叶酸明显抑制宫颈癌细胞的增殖,逆转HPV16引发的癌症中E2及E6高表达,提示叶酸水平及HPV16感染在宫颈癌变的过程中具有协同作用。
[1]张怀念,张咏莉.宫颈癌分子遗传机制及其相关基因功能研究〔J〕.安徽医药,2015,19(2):219-221.
[2]张敏鸽,刘明辉.高危HPV与宫颈癌发生的相关性〔J〕.实用癌症杂志,2012,27(6):670-672.
[3]田斌,胡敏.宫颈炎患者人乳头状瘤病毒16和18亚型的检测分析〔J〕.安徽医药,2010,14(12):1450-1451.
[4]聂小凤,许榕仙,李健.叶酸与相关因素的交互作用对宫颈癌的影响〔J〕.中国妇幼保健,2014,29(1):106-109.
[5]孙雪松,丁玲,陈芳,等.叶酸缺乏及其与HP V16 感染的交互效应对宫颈癌变的影响〔J〕.中华流行病学杂志,2014,35(4):437-441.
[6]丁玲,马景丽,周芩,等.叶酸对人宫颈癌细胞增殖抑制的作用及其与 HPV16相互关系的研究〔J〕.卫生研究,2013,43(5):748-753.
[7]Xiong YH,Chen L,Luo PY.N-Benzylcinnamide Induces -
Apoptosis in HPV16 and HPV18 Cervical Cancer Cells via Suppression of E6 and E7 Protein Expression〔J〕.IUBMB Life,2015,67(5):374-379.
[8]Tan S,de Vries EG,vander Zee AG,et al.Anticancer drugs aimed at E6 and E7 activity in HPV-positive cervical cancer〔J〕.Curr Cancer Drug Targets,2012,12(2):170-184.
[9]黄灵坚,苏敏,周小萍,等.HPV及亚型在不同子宫颈腺癌中的表达情况分析〔J〕.安徽医药,2014,18(9):1744-1745.
[10]易黎.妇科门诊妇女 HPV感染状况及其影响因素研究〔J〕.安徽医药,2014,18(4):653-656.
[11]Lee D,Kwon JH,Kim EH,et al.HMGB2 stabilizes p53 by interfering with E6/E6AP-mediated p53 degradation in human papillomavirus positive HeLa cells〔J〕.Cancer Lett,2010,292(1):125-132.
[12]高海翟,包金,黄晶.叶酸和维生素B12与肿瘤关系的研究进展〔J〕.广东医学,2014,35(10):1620-1621.
(编辑:吴小红)
Study of Synergistic Effect of Folate Levels and HPV16 Infection on Cervical Carcinogenesis
XUXiaoyan,XINGHui,LANYanli,etal.
TheFirstPeople'sHospitalofJiangxiaDistrict,Wuhan,430200
ObjectiveTo investigate the relationship of level of folate,HPV16 infection,mRNA levels of HPV16 E2 and E6 and cervical carcinogenesis,and the synergistic effect of folate levels and HPV16 infection on development of cervical cancer.Methods40 patients with cervical inflammation (CI),80 patients with cervical intraepithelial neoplasia (CIN) (36 cases of CINⅠ,44 cases of CINⅡ/Ⅲ) and 48 patients with cervical squamous cell carcinoma (SCC) were chosen for the study.The content of serum folate and red blood cell folate were detected with microbiological method.And the HPV16 infection and mRNA levels of HPV16 E2 and E6 in cervical cancer tissues and CaSki cervical cancer cells were tested using quantitative PCR.Meanwhile,the vitro effect of folic acid intervention on proliferation of HPV16-positive CaSki cervical cancer cells and HPV-negative C33A cervical cancer cells.Results① HPV16 infection in CINⅠgroup,CINⅡ/Ⅲ group and SCC group showed statistically significant compared with that in CI group (P<0.05).② mRNA levels of HPV16 E2 and E6 in groups of CIN,CINⅡ/Ⅲ and SCC were statistically significant differences when compared with those in CI group(P<0.0001).The severity of the cancer showed a positive correlation with mRNA levels of HPV16 E2 and E6,but showed a negative correlation with content of serum folate and RBC folate.③ The content of serum folate was negatively correlated with the relative inhibition rate of Caski and C33A as well as mRNA levels of HPV16 E2 and E6.ConclusionThe decreased folate levels and lower mRNA expression of HPV16 E2 and E6 mRNA as well as HPV16 infection are associated with lower development of cervical cancer.Adding folic acid could significantly inhibit the proliferation of cancer cells and reverse the high expression of HPV16 E2 and E6,implying the synergistic effect of folate levels and HPV16 infection on development of cervical cancer.
Folate;HPV16;E2;E6;Cervical cancer
湖北省卫生计生委基金项目(编号:WJ2015MA024)
430200 武汉市江夏区第一人民医院(许晓燕);441021 襄阳市中心医院(邢辉,兰艳丽,刘韵)
刘韵
10.3969/j.issn.1001-5930.2016.06.002
R737.33
A
1001-5930(2016)06-0875-04
2015-08-07
2016-04-21)
