铜绿假单胞菌抗药表型研究进展
2016-09-09王金英夏海华
于 冲,王金英,潘 钰,原 韬,夏海华
ResearchandDevelopment研究与开发
铜绿假单胞菌抗药表型研究进展
于冲,王金英,潘钰,原韬,夏海华
(黑龙江省科学院微生物研究所,哈尔滨 150010)
铜绿假单胞菌因其对多种抗生素呈现耐药性而使其成为临床治疗最棘手的问题。目前经研究确定的铜绿假单胞菌最重要的耐药机制有:水解酶的产生、膜通透性降低、外膜蛋白表达下降、外排泵系统、拓扑异构酶突变。这些机制经常共同作用并导致多重耐药株的产生。最常见的耐药机制是β-内酰胺酶的生成(超广谱β-内酰胺酶、Am pC、carbapenem ases),它能够决定各种β-内酰胺酶抵抗的变种表型,这些表型与氨基糖苷类和喹诺酮类抗生素的耐药相关。膜通透性降低和青霉素结合蛋白的修饰等其他抗药机制相关。目前检测这些耐药机制表型的常用方法包括K-B纸片法、"cutoff"值评价(美国临床与实验室标准化协会药敏实验标准)。
超广谱β-内酰胺酶;头孢菌素酶;碳青霉烯;基因型耐药;表型耐药
铜绿假单胞菌属于革兰氏阴性肝菌,其内在性耐药水平较高,由于该菌的膜通透性较差,并且外膜蛋白表达减少等原因而难于治疗[1]。临床上,健康人体内感染发生的几率很小,而在一些特定条件下,住院病人铜绿假单胞菌感染率较高,尤其在气管、支气管炎、囊性肺纤维化等疾病中,铜绿假单胞菌已经成为一种重要的致病菌,在病人体内的繁殖速度也很快。
多重药物耐药性在院内细菌、健康辅助细菌和社区细菌中迅速增长蔓延。天然具有耐药性的菌株称为野生型,可以作为考察抗生素抗菌广谱性的参考菌株,其耐药基因天然存在于基因组中。敏感群中经常产生获得性耐药菌株,其变化频率很高,受外来基因影响较大,如质粒、噬菌体、转座子。了解耐药表型对于合理选择的抗生素进行治疗极为重要[2-3]。
1 抗β-内酰胺酶铜绿假单胞菌表型
主要的机制有:外膜通透性、外排泵系统、水解酶的产生或靶向修饰。这些因素通常共同作用,难于区分表型。
1.1天然耐药
天然耐药与头孢菌素酶的产生有关,这种酶由氨基青霉素和第一代头孢菌素诱导产生,通透性的变化和外排系统可以使这种酶的产量成倍增加。其表型表现为氨基青霉素耐药,对β-内酰胺酶抑制剂、对一代及二代头孢菌素的使用影响较大。替卡西林、羧苄青霉素)、酰脲类青霉素(哌拉西林、美洛西林)、第三及第四代头孢菌素类、碳青霉烯类和单酰胺类抗生素仍然敏感。
1.2获得性耐药
与酶联机制(青霉素酶、头孢菌素酶、广谱β-内酰胺酶、金属β-内酰胺酶)或非酶促机制(通透性,外排和靶向修饰)相关。
酶获得性耐药与β-内酰胺酶的产生相关,它是β-内酰胺的主要耐药机制,根据氨基酸序列可以将其分为四个亚类(Ambler分类系统)。A、C和D类通过基于丝氨酸的机制发挥作用,而B类需要锌才能发挥作用。其中最重要的β-内酰胺酶包括:青霉素酶、超广谱β-内酰胺酶、头孢菌素酶和碳青霉烯酶。
第一,青霉素酶。对羧基青霉素、酰脲类青霉素和头孢哌酮具有耐药性,并且对头孢他啶、头孢吡肟、亚胺培南和β-内酰胺酶抑制剂敏感。
第二,超广谱β-内酰胺酶(ESBLs)。能够水解广谱头孢菌素类(头孢他啶、头孢吡肟、头孢曲松)和单酰胺类(氨曲南),但不受β-内酰胺酶和碳青霉烯酶抑制剂的影响。超广谱β-内酰胺酶本身不具有水解第二代头孢菌素的能力,但在与羟氨苄青霉素耦联后能够将其水解。最重要的超广谱β-内酰胺酶包括TEM、SHV、PER,、VEB(A类),它们对亚胺培南、羧基青霉素类+β-内酰胺酶抑制剂、脲基类青霉素+β-内酰胺酶抑制剂敏感。2000年以前,与临床交叉感染相关的主要超广谱β-内酰胺酶为TEM和SHV,2000年以后,CTX-M(头孢噻肟酶)成为主要的超广谱β-内酰胺酶并且广泛传播[4-5]。
第三,AmpCβ-内酰胺酶(C类)。可分为组成型和可诱导型,通过染色体和质粒介导传播。AmpCβ-内酰胺酶受氨曲南抑制,对克拉维酸、他唑巴坦和舒巴坦敏感。第二代头孢菌素可以被其水解,但第四代头孢菌素不能被其水解[6]。
第四,碳青霉烯酶。过度使用碳青霉烯类药物(超广谱β-内酰胺酶的传播)导致碳青霉烯酶的产生。
A类:NMC(非金属酶碳青霉烯酶),能够水解亚胺培南,但是不被EDTA抑制。它们的代表物为质粒碳青霉烯酶:KPC(Klebsiella pneumonia carbapenemase),GES (Guyana extended spectrum 1-12)。它们的底物以青霉素、头孢菌素类、碳青霉烯类为代表。此类酶不受EDTA的抑制,并且不能水解氨曲南、哌拉西林或哌拉西林/三唑巴坦[7-8]。
B类:金属β-内酰胺酶,IMC(亚胺培南碳青霉烯酶),VIM(整合子编码金属β-内酰胺酶),NDM(新德里金属β-内酰胺酶),能够水解任何一代碳青霉烯类和头孢菌素类抗生素,但不能水解氨曲南。VIM往往存在于铜绿假单胞菌株,并在全球范围内迅速蔓延[9-10]。
C类:CMY,2006年曾报道一株极具攻击性的产气肠杆菌,它通过质粒途径传播至另一种革兰氏阴性细菌中。
D类:OXA-苯唑西林酶(OXA-2,OXA-10),仅对亚胺培南敏感,这类酶的存在导致巨大的治疗难度。
2010年,Nimish Patel等发表在 48届 Annual Reunion of IDSA(2010)的一项研究显示,用环丙沙星治疗铜绿假单胞菌感染,能够降低铜绿假单胞菌对亚胺培南的耐药性。由于环丙沙星使用的减少和环丙沙星活性的逐步降低,诱导了细菌外排泵的高表达,而被诱导的外排泵又与亚胺培南的耐药性相关。因此建议减少环丙沙星的使用,从而能够控制医院内因铜绿假单胞菌对碳杂青霉烯类的耐药性而产生的交叉感染。
1.3非酶促获得性耐药机制
外排泵,包括以下三种机制:第一,MexA-MexBOprM(膜蛋白诱导的天然外排泵系统的表达),耐羧基青霉素类和氨曲南。第二,MexC-MexD-OprJ,耐头孢吡肟和头孢匹罗。第三,MexE-MexF-OprN(机制上常与D2孔减少相关),耐亚胺培南。
膜孔减少,对碳青霉烯类的多变耐药。
青霉素结合蛋白(PBP)修饰:PBP2或PBP4对亚胺培南耐药。PBP3对所有的β-内酰胺耐药,而对亚胺培南敏感[11-13]。
2 铜绿假单胞菌氨基糖苷类耐药表型
野生型对所有的氨基糖苷类均敏感,获得性耐药是通过多种机制产生的:通透性、外排、酶失活、呼吸突变或这些机制不同组合的共同作用。对铜绿假单胞菌来说,通透性通常是引起氨基糖苷耐药性的主要机制,酶也是引发耐药性的常见机制之一,主导这类耐药性的三种酶分别是:氨基糖苷磷酸转移酶(APH),氨基糖苷核苷酸基转移酶(ANT)和氨基糖苷乙酰转移酶(AAC)[11,14]。
铜绿假单胞菌耐药表型如下:
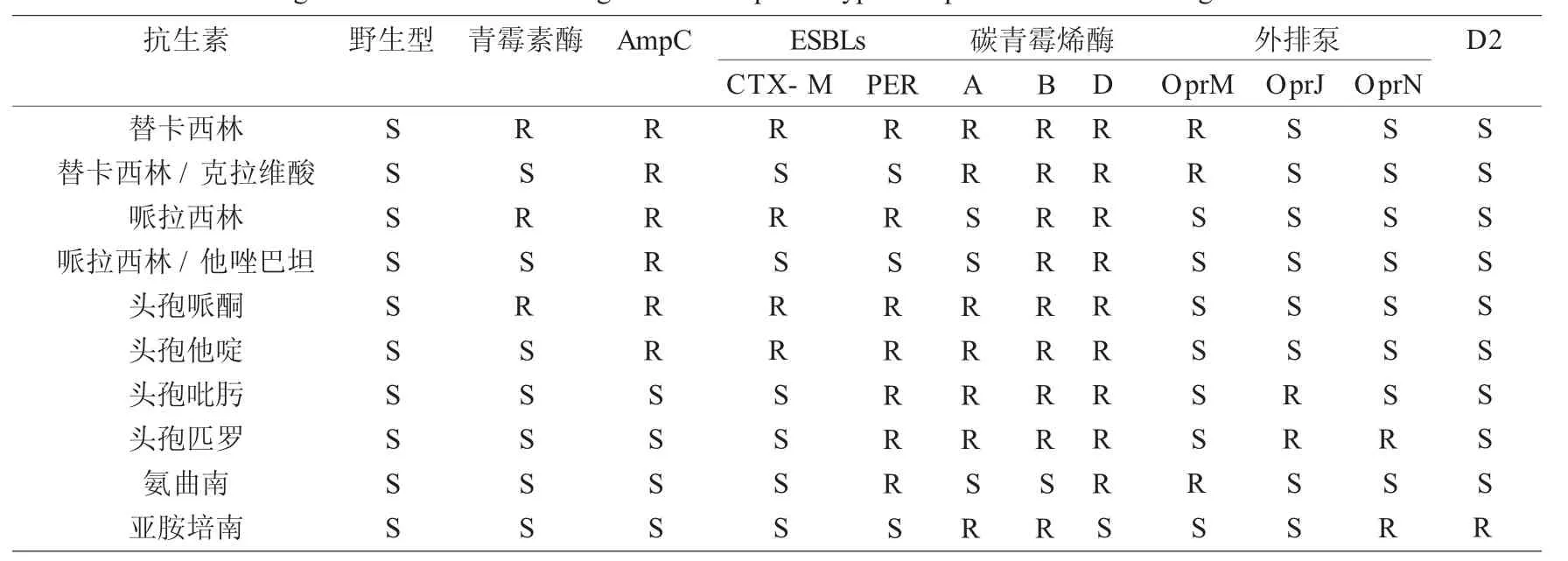
表1 铜绿假单胞菌对β-内酰胺药物耐药表型Fig.1 Betalactam ase drug-resistant phenotype o f pseudomonas aeruginosa
G:对庆大霉素耐药;对妥布霉素、奈替米星、阿米卡星、异帕米星敏感。
GNt:对庆大霉素、奈替米星耐药,对妥布霉素、阿米卡星、异帕米星敏感。
GT:对庆大霉素、妥布霉素耐药,对奈替米星、阿米卡星、异帕米星敏感。
GNtT:对庆大霉素、妥布霉素、奈替米星耐药,对阿米卡星、异帕米星敏感。
TNtA:对妥布霉素、奈替米星、阿米卡星耐药,对庆大霉素、异帕米星敏感。
GTNtA:对庆大霉素、妥布霉素、奈替米星、阿米卡星耐药,对异帕米星敏感。
评估与监督个人在外语学习效率的能力是学习的一个重要的技能,对外语学习成为自主学习来说尤为重要,可以帮助让学习者发现自己的问题并且找到适合自己学习的方式[5]。在自主学习过程中,评估具有回顾和预期的功能,它可以让学习者对过去的学习经验进行反思,并转化成对未来学习行为的计划。此外,除了自我评估之外,学生评价也必不可少。它可以减轻教师评价学生的繁重的负担,尤其是当班级学生比较多的时候,教师不能始终对每一个学生的表现进行评估,可以起到很好的补充和辅助作用。
通透性表型:对庆大霉素、妥布霉素、奈替米星、阿米卡星、异帕米星耐药。
3 铜绿假单胞菌喹诺酮类耐药表型
在体外其野生型表型对诺氟沙星、培氟沙星、氧氟沙星、环丙沙星、左氧氟沙星敏感,而实际应用中只对环丙沙星敏感。获得性耐药通过多种不同机制产生,通透性:膜孔和LPS(对于喹诺酮类,膜孔是其通过外膜的主要途径)。靶向亲和修饰:DNA旋转酶亚基A和B以及DNA拓扑异构酶亚基C和D。
主动外排:OprM、OrpJ、OprN(低耐药)。
铜绿假单胞菌耐药性表型如下:
I(野生型表型):对诺氟沙星、培氟沙星、氧氟沙星/左氧氟沙星敏感。
II:对环丙沙星敏感,对诺氟沙星、培氟沙星、氧氟沙星/左氧氟沙星中度敏感。
III:对环丙沙星敏感,对诺氟沙星、培氟沙星、氧氟沙星/左氧氟沙星耐药。
IV:对环丙沙星、诺氟沙星、培氟沙星、氧氟沙星/左氧氟沙星耐药。
外排表型:对诺氟沙星、环丙沙星耐药,对培氟沙星、氧氟沙星/左氧氟沙星敏感。
4 其他耐药表型
铜绿假单胞菌原本对复方新诺明和呋喃妥因耐药,其主要原因是对靶点酶结合效率降低。铜绿假单胞菌对黏菌素耐药性很差,所以一些学者认为使用碳青霉烯类药物作为一线抗菌治疗已经不再有效。这些学者提出抗铜绿假单胞菌感染的最有效疗法是将黏菌素与其他活性抗生素联合使用,可以有效防止黏菌素耐药株的产生[15]。
5 ESBLs检测方法
对于ESBLs的检测,目前常采用K-B纸片法或E-test法,其检测标准参照CLSI药敏试验标准。
筛选实验:头孢菌素和单酰胺菌素的平板检测。头孢曲松<25mm,头孢噻肟<27mm,头孢他啶<22mm,头孢泊肟<17mm,氨曲南<27mm。
确认实验:头孢菌素/克拉维酸协同作用结果。
5.1双纸片法
将含有阿莫西林+克拉维酸(20μg+10μg)的纸片贴于M-H平板中心,距中心20~35mm处贴头孢曲松、头孢噻肟、头孢他啶、头孢泊肟及氨曲南,任意一种纸片与头孢菌素/克拉维酸出现协同作用即为ESBL阳性。

图1 双纸片法Fig.1 Double discmethod
5.2组合纸片法
比较头孢菌素纸片和头孢菌素+克拉维酸纸片抑菌圈直径大小(头孢噻肟或头孢他啶30μg)。如果细菌产生ESBL,含克拉维酸纸片的抑菌圈至少大于其他纸片抑菌圈5mm。

图2 组合纸片法Fig.2 Com bined discmethod
5.3E-test法
使用两端分别含有头孢他啶/头孢噻肟、头孢他啶/头孢噻肟+克拉维酸的药敏试条检测。

图3 E-testFig.3 E-test.
6 结论
铜绿假单胞菌是一种常见的耐药性最强的细菌之一,因此了解其抗性表型对于临床医生应用于靶向治疗和成功分辨感染类型具有重要意义。微生物实验室在发现细菌多重耐药性机制方面发挥着重要的作用,因此实验室与临床医生紧密联系,对于病人、临床医生以及微生物研究人员都是非常重要的。
[1] Barlow G,NathwaniD-Is Antibiotic Resistance a Problem.A Practical Guide for Hospital Clinicians[J].Postgraduate Medical Journal,April2005,(81):680-692.
[2] CDC.definitions for nosocomial infections.National Nosocomial Inflections Surveillance System(NNISS[)S].2004.
[3] Carmeli Y,Triollet N,Elopoulos GM,Samore MH-Emergence of antibiotic resistant Pseudomonas aeruginosa:comparison of risks associted with different antipseudomonadalagent[sJ].Amtimicrob.AgentsChemother,1999,43(6):1379-1382.
[4] FalagasME,KarageorgopoulosDE.Extended-spectrumbeta-lactamase-prodbetalactamase-producingorganisms[J].Journal of Hospital infection 2009,(73): 345-354.
[5] Drieux L,Brossier F,SougakoffW,Jarlier V.Phenotypic detection of extended spectrum beta-lactamaseproduction in Enterobacteriaceae:review and bench guide[J].Clinmicrobioland Infect2008,(14):90-103.
[6] Poirel L,Ronco E,Naas T,Nordmann P.Extended-spectrumβ-lactamase TEM-4 in Pseudomonasaeruginosa[J].Clin Microbiol Infect1999,(5):651-652.
[7] Carmeli Y.-The Role of Carbapenems:The Predictive Factors for Multi-Drug Resistant Gram-Negatives[EB/OL],http://www.invanz.co.il,2006-06-12/2016-03-03.
[8] Studemeister AE,Quinn JP.Selective imipenem resistance in Pseudomonas aeruginosa associatedwithdiminishedouter membrane permeability[J]. Antimicrob AgentsChemother,1988,(32):1267-1268.
[9] Pic ?o RC,Andrade SS,Nicoletti AG,et al.Metallo-β-lactamase detection: comparative evaluation of double-disk synergy versuscombined disk tests for IMP,GIM,SIM,SPM,or VIM producing organisms[J].Clin Microbiol 2008,(46):2028-2037.
[10]Walsh TR,Weekers J,Livermore DM,Toleman MH."Dissemination of NDM-1-positive bacteria in the New Delhi environment and its implications for human health:an enveronmental point prevalence study"[J].Lancet Infect.Dis. 2011,(11):355-362.
[11]Francois Jehl,Monique Chomarat,Michele Weber,et al.Antibioticele: clasificare,spectru simecanisme de actiune[J].De la antibiograma la prescriptie. 2003:12-30.
[12]Nobuhisa Masuda,Eiko Sakagawa,SatoshiOhya etal.Substrate Specificities of MexAB-OprM,MexCD-OprJ,and MexXY-OprM Efflux Pumps in Pseudomonas aeruginosa[J].Antimicrobial Agents and Chemotherapy,2000,44(2):3322-3327.
[13]Poole K,N.Gotoh,H.Tsujimoto,etal.Overexpression of themexC-mexD-oprJ efflux operon in nfxB-typemultidrug-resistant strains of Pseudomonas aeruginosa[J].MolMicrobiol1996,(21):713-724.
[14]Poole K.Aminoglycoside resistance in Pseudomonas aeruginosa[J].Antimicrob AgentsChemother2005,(49):479-487.
[15]Levin AS,Barone AA,Penco J,etal.IntravenousColistin as Therpy forNosocomial Infections Caused by Multidrug-Resistant Pseudomonas aeruginosaand Acinetob acter baumannii[J].Clinical InfectionsDeseases.1999,28,(5):1008-1011.
Research progress in drug-resistant phenotype of pseudo monas aeruginosa
YUChong,WANG Jin-ying,PAN Yu,YUAN Tao,XIA Hai-hua
(InstituteofMicrobiology,Heilongjiang Academy ofSciences,Harbin 150010,China)
Pseudomonas aeruginosa genus bacteria are well known for their increased drug resistance(phenotypic anggenotypic resistance).Themost important resistancemechanisms are:enzyme production,reduction of pore expression, reduction of the externalmembrane proteins expression,efflux systems,topoisomerasemutations.Thesemechanisms often accumulate and lead tomultidrug ressitance strains emergence.Themost frequent acquired resistancemechanisms are betalactamas e-typeenzyme production(ESBLs,AmpC,carbapenemases),which determine variable phenotypesofbetalactamines resistance,phenotypes which are associated with aminoglycosides and quinolones resistance.The nonenzymatic drug resistance mechanisms are caused by efflux systems,pore reduction and penicillin-binding proteins(PBP) modification,which are often associate d to other resistance mechanisms.Phenotypic methods used for testing these mechanisms are based on highlighting these phenotypes using Kirby Bauer antibiogram,clinical breakpoints,and"cutoff" values recommended by CLSI(MS100-25)standard.
ESBLs;AmpC,Garbapenemase;Genotypic resistance;Phenotypic resistance
Q939.11
A
1674-8646(2016)04-0004-04
2016-01-08
黑龙江省科学院预研项目(YY13BYCV07);黑龙江省科学院学部委员项目(XB15BYCV08)
于冲(1979-),男,河北乐亭人,副研究员,硕士,主要从事医学微生物方面工作。
夏海华(1971-),女,辽宁清源人,研究员,硕士,主要从事医学微生物方面工作。e-mail:328116773@qq.com
