桑蚕蛹多糖超声提取优化及水溶性多糖组分分析
2016-09-06谭丽鹤李红玉锦州医科大学辽宁锦州121000
谭丽鹤, 李红玉(锦州医科大学,辽宁锦州121000)
桑蚕蛹多糖超声提取优化及水溶性多糖组分分析
谭丽鹤, 李红玉*
(锦州医科大学,辽宁锦州121000)
目的 优化桑蚕蛹多糖的超声提取工艺,并采用气质联用 (GC-MS)及红外光谱 (IR)法对水溶性多糖(PSP1)进行组分分析。方法 以多糖得率为指标,采用Box-Behnken设计和响应面法优化超声提取工艺。多糖透析后,树脂柱层析得到水溶性多糖 (PSP1),GC-MS和IR法分析其组分。结果 最佳条件为超声功率760 W,液料比11∶1,提取时间10 min,得率15.28%。PSP1的主要组分为葡萄糖、山梨糖、半乳糖、甘露糖,摩尔比为95.94∶1.59∶1.59∶0.88,而且具有典型的多糖特征吸收峰,并含有吡喃糖。结论 该方法简便快速,多糖得率较高。
桑蚕蛹;多糖;超声提取;水溶性多糖 (PSP1);组分分析;Box-Behnken设计;响应面法;GC-MS
桑蚕蛹(mu1berry si1k-worm)[1-2]别名小蜂儿,为蚕蛾科动物家蚕蛾的蛹,在我国食用历史悠久,因其含有多糖和丰富的蛋白质,具有提高免疫力、延缓衰老、降血脂、降胆固醇等多重功效,多用于体弱者、老人和孕妇产后恢复。近年来研究显示,多糖具有抗病毒、抗衰老、降血糖、刺激造血、免疫调节等生物学功效[3-4]。有文献显示,从桑蚕蛹中提取出的一种水溶性多糖具有抑制HeLa细胞增殖的作用[5],但是未对其组分进行分析和确定。因此,本实验采用超声波法对桑蚕蛹多糖的提取工艺进行优化,并且对其中具有抗癌活性的多糖进行分离、纯化和鉴定,分析了其单糖组成,以求为寻找天然产物作为肿瘤治疗替代药物的进一步研发提供基础。
1 材料与方法
1.1材料、试剂、仪器
1.1.1材料 桑蚕蛹子实体采自山东省临沂市。G-150葡聚糖凝胶树脂、二乙氨基乙基纤维52树脂、SP131198纤维素透析袋 (上海源叶生物科技有限公司);葡萄糖为分析纯 (锦州市鑫源化玻有限公司)。
1.1.2试剂 石油醚、三氯甲烷、正丁醇、95%乙醇、重蒸酚、浓硫酸、吡啶、甲醇等均为分析纯(锦州市鑫源化玻有限公司)。
1.1.3仪器 500 g摇摆式中药粉碎机 (温岭市奥力中药机械有限公司);DHG-9075A鼓风干燥箱(上海一恒科学仪器有限公司);UV2550紫外可见分光光度仪 (日本岛津公司);Sigma高速冷冻离心机 (北京兴达恒信科技有限公司);GC7890B/ MSG3440B气相色谱-质谱联用仪(美国安捷伦公司);A1pha傅里叶变换红外光谱仪 (纬斯特仪器中国有限公司)。
1.2实验方法
1.2.1标准曲线的制备 采用苯酚-硫酸法绘制葡萄糖标准曲线,测定多糖含有量[6-8]。精确量取0.1 mg/mL葡萄糖标准溶液 (制备方法为精密称取于105℃烘干至恒重的葡萄糖0.100 0 g,蒸馏水溶解,定容于100 m L量瓶中。吸取10 mL,置于另一100 mL量瓶中,蒸馏水定容,即得。)0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9 mL,分别置于比色管中,加蒸馏水至1.0 mL。分别加入1 m L 5%重蒸酚和5 m L浓硫酸,沸水浴加热10 min,待反应完全后冷却至室温,于490 nm波长处测定吸光度。以吸光度为纵坐标 (Y),葡萄糖含有量为横坐标 (X)绘制标准曲线,得回归方程Y=1.293 7X+0.015 6(R2=0.998 6),表明葡萄糖在0.02~0.08 mg/m L范围内线性关系良好。
1.2.2样品的预处理 桑蚕蛹子实体于60℃烘箱中烘干后,粉碎机粉碎,过60目筛。取过筛后的桑蚕蛹粉末适量,索氏提取器按1∶9的比例加入石油醚回流5 h进行脱脂,再经95%乙醇回流提取5 h除去小分子醇溶物,将处理后的蚕蛹粉末于室温下晾干。
1.2.3超声波法提取桑蚕蛹多糖工艺优化[9]称取一定量的预处理后的桑蚕蛹粉末,按一定比例加入0.02 mo1/L NaOH溶液[10],超声提取2次,合并滤液,HC1溶液调节pH值至中性,旋转蒸发仪浓缩至一定体积后,加入4倍量95%乙醇,置4℃冰箱中过夜。醇沉液于4℃、3 000 r/min条件下离心20 min,干燥得桑蚕蛹粗多糖,计算得率。
1.2.3.1响应曲面法试验设计 根据中心组合试验设计原理,采用3因素3水平的响应面分析法。在单因素试验基础上,以功率 (A)、时间 (B)、液料比 (C)为自变量,确定提取工艺的最佳参数,因素水平见表1。
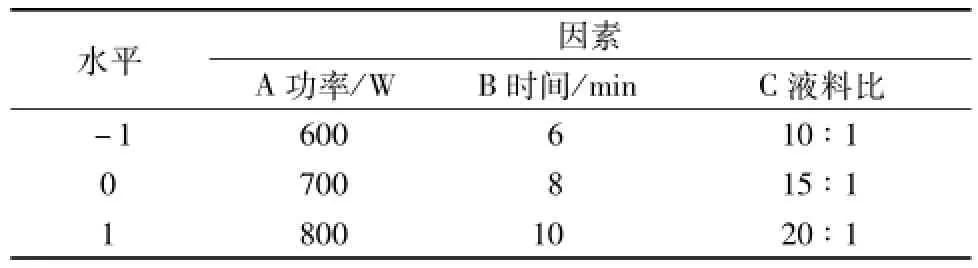
表1 因素水平Tab.1 Factors and levels
1.2.4桑蚕蛹多糖的脱色及除蛋白 将蚕蛹粗多糖用Sevag法除蛋白,4℃下5 000 r/min离心20 min,取上清液反复离心,直至无蛋白层出现为止[11-12],活性炭脱色,经3层滤纸抽滤以除去活性炭粉末[13-14]。滤液经浓缩、醇沉、干燥,得到除蛋白及脱色后的桑蚕蛹多糖。取0.5 mg/mL样品液于比色管中,加蒸馏水至 1.0 mL,按“1.2.1”项下方法于490 nm波长处测定吸光度,利用回归方程计算脱色、脱蛋白后多糖的含有量,并计算490 nm波长处的保留率及450 nm波长处的脱色率。
计算公式为多糖含有量=纯多糖质量/粗多糖质量×100%,多糖脱色率=(A1-A2)/A1× 100%,多糖保留率=(B1-B2)/B1×100%。其中,A1、A2分别为经脱色、脱蛋白处理前后桑蚕蛹多糖溶液在450 nm波长处的吸光度,B1、B2分别为经脱色、脱蛋白处理前后的桑蚕蛹多糖溶液在490 nm波长处的吸光度。
1.2.5桑蚕蛹多糖的纯化 将脱色、脱蛋白后的多糖用蒸馏水溶解,装入截留相对分子质量5 000 Da的透析袋中,在流动自来水中透析48 h,再置于蒸馏水中透析24 h。将透析后的多糖进行树脂柱层析 (40 mm×400 mm),分别以超纯水和0.2、0.4 mo1/L NaC1溶液为洗脱液,体积流量为0.5 mL/min,每管收集5 mL,苯酚-硫酸法在490 nm波长处测定吸光度[15],并绘制吸光度-试管数曲线。收集多糖PSP1洗脱液,浓缩、醇沉后于60℃烘箱中干燥。
查阅文献可知,桑蚕蛹水溶性多糖 (PSP1)具有抑制HeLa细胞增殖的作用[5],并能明显增强B淋巴细胞和T淋巴细胞的增殖,促进小鼠巨噬细胞的吞噬活力和溶血素生成[16],但尚无化学方面的研究。因此,本实验将在优化提取工艺的基础上,对其组分进行分析。
1.2.6桑蚕蛹多糖PSP1的纯化 将Sephadex G-150树脂于沸水中溶胀2 h后装柱,平衡液平衡层析柱5个柱体积。多糖PSP1经蒸馏水溶解后,上凝胶柱层析 (30 mm×300 mm),以超纯水为洗脱液,体积流量为0.5 mL/min,每管收集5 mL,苯酚-硫酸法在490 nm波长处测定吸光度,并绘制吸光度-试管数曲线,收集洗脱液,浓缩、醇沉后于60℃烘箱中干燥[17]。
1.2.7多糖PSP1的纯度鉴定
1.2.7.1纸层析法 取0.2%PSP1多糖溶液20μL,点样于滤纸(3 cm×20 cm)距端点1 cm处的中部,以正丁醇-乙酸乙酯-吡啶-水 (6∶1∶5∶4)为展开剂,饱和后于室温下展开6 h,通风橱中挥干溶剂。以苯胺-二苯胺为显色剂,于60℃烘箱中放置20 min显色[18]。
1.2.7.2紫外分光光度法 称取少量多糖PSP1,溶解于适量蒸馏水中,紫外可见分光光度计在200~400 nm范围内进行扫描。
1.2.8桑蚕蛹多糖PSP1的组分分析
1.2.8.1多糖的完全酸水解及硅烷化衍生 精密称取桑蚕蛹多糖PSP1 10.0 mg,置于安瓿瓶中,加入3 mL 0.5 mo1/L硫酸溶液,酒精喷灯真空封管,置于110℃烘箱中水解6 h,冷却至室温后加入过量碳酸钡粉末,静置过夜,待其中和至中性后离心,上清液冷冻干燥,即得多糖水解产物,备用[19-21]。将水解产物于60℃下干燥至恒重,加入2 m L无水吡啶,置于80℃烘箱中反应30 min后,加入0.6 mL硅烷化试剂(六甲基二硅胺烷-三甲基氯硅烷为2∶1),摇匀,80℃烘箱中反应10 min[22-23],过0.22μm有机滤膜,即得衍生化产物,备用。
1.2.8.2气相色谱-质谱分析条件 气相色谱EI源,电子能量70 eV;分子量扫描范围30~600 u;进样口温度210℃;接口温度210℃;载气为氦气;体积流量为1 m L/min;分流比60∶1;程序升温(100℃保持5 min,以25℃/min速率升至210℃,保持14 min,以5℃/min速率升至290℃);进样量为0.5μL。质谱EI源,电子能量70 eV;溶剂延迟4 min。
1.2.9红外分析 称取干燥至恒重的桑蚕蛹多糖PSP1 1 mg,置于洁净的玛瑙研钵中,红外灯下研磨成粉,加入200 mg干燥的KBr粉末,研磨至两者完全混合均匀。将混合物置于洁净的压片模具中,组装好后进行压片,制成透明薄片。以空气为空白,将薄片装在样品架上,置于样品室中,在400~4 000 cm-1区间内进行红外光谱扫描,先测定空白背景,再测定样品的红外光谱,进行修正后观察谱峰情况[24-25]。
2 结果与分析
2.1Box-Behnken试验设计与结果 见表2。
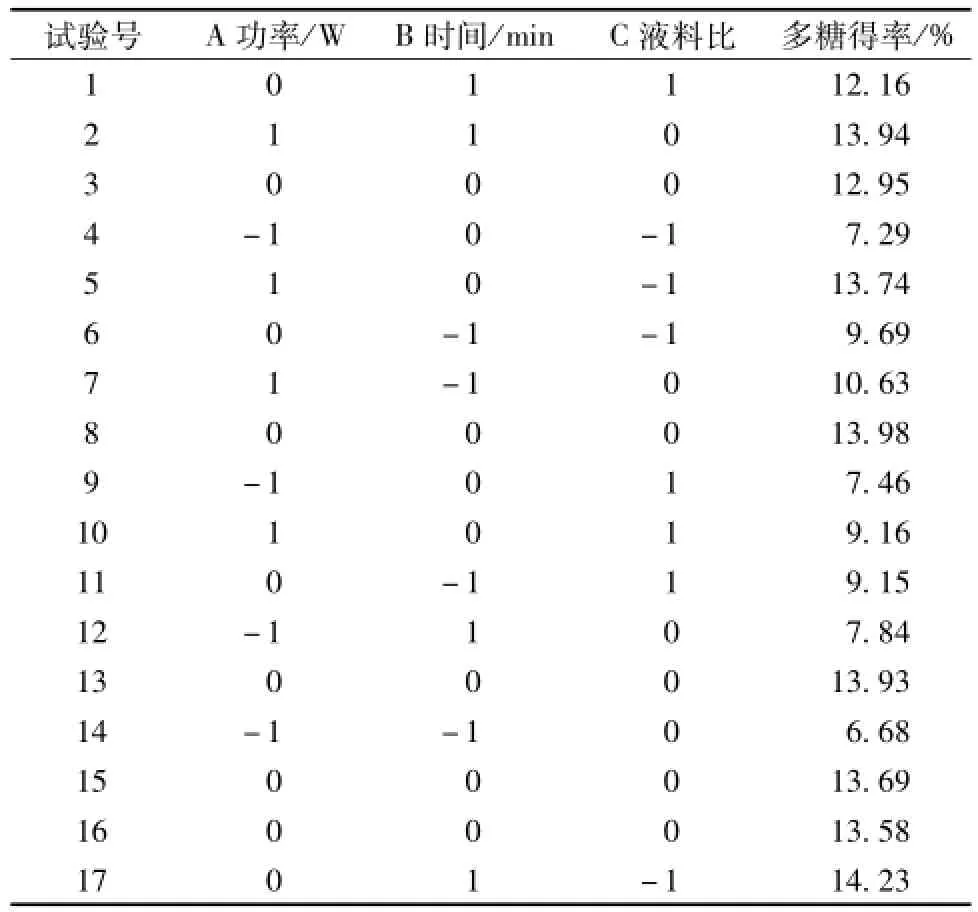
表2 试验设计及结果Tab.2 Design and resu lts of tests
根据表2结果,利用Design Expert8.0软件对数据进行二次回归分析,得到回归方程Y= 13.63+2.28A+1.50B-0.88C+0.54AB-1.19AC-0.38BC-2.87A2-0.98B2-1.34C2,方差分析见表3。由表可知,回归方程模型的P<0.000 1,高度显著;R2为0.978 4,与实验拟合较好,符合度达97.84%,可靠性高,线性关系显著;R2adj值为0.950 7,能够解释95.07%响应值的变化,进一步证明其可靠性。另外,功率和时间对多糖得率影响较大,尤其以功率最为显著,影响程度依次为功率>时间>液料比。
2.2响应面曲线图 由图1可知,功率较低时,得率随时间和液料比的增加而提高,但功率较大时反而降低,即与功率和液料比有关,而且稳定点都落在范围内,表明两者的交互作用对得率也有影响。液料比较低时,得率随时间的增加而提高。时间较长时,得率随液料比的增加而呈降低趋势。经软件分析预测,该模型得率为15.53%,最优提取条件为超声功率764.60 W,时间10.00 min,液料比11.22∶1。结合实际操作,将其修正为超声功率760 W,时间10 min,液料比11∶1。为验证结果的可靠性,按上述条件设计3次平行验证实验,测得桑蚕蛹多糖平均得率为15.28%,与预测值接近,说明该模型准确可靠。
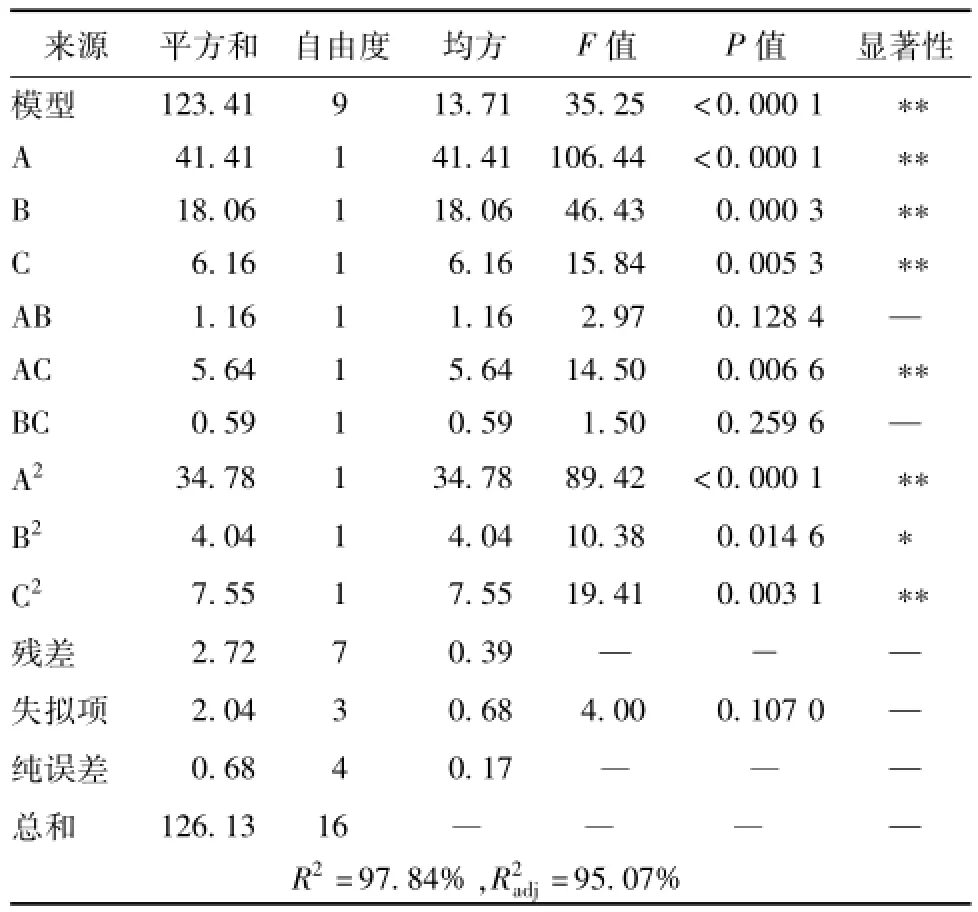
表3 方差分析Tab.3 Analysis of variance
2.3桑蚕蛹多糖的纯化 经过石油醚脱脂、水提醇沉、Sevag法除蛋白、活性炭脱色后,得到浅黄色的桑蚕蛹粗多糖,其含有量为82.34%,脱色率为60.90%,保留率为49.68%。粗多糖经截留分子量5 000μ的透析袋透析,经DEAE-52树脂纯化。由图2可知,多糖PSP1的峰值最高,而且峰形对称。
2.4 桑蚕蛹多糖PSP1的纯化及鉴定 Sephadex G-150树脂柱层析的紫外图谱 (图3)显示为单一的洗脱峰,洗脱曲线峰形对称,表明多糖纯度较高,分子量分布较均一。该多糖在纸层析上显示为单一斑点,说明为单一组分。在260 nm和280 nm波长处没有吸收峰,表明不含核酸和蛋白质。
2.5桑蚕蛹多糖PSP1的组分分析 桑蚕蛹多糖PSP1经硫酸酸解及硅烷化衍生后,再经气相色谱-质谱 (GC-MS)检测,供试品各峰保留时间与NIST谱库对照结果见表4、图4。由表可知,PSP1中有4种单糖,匹配度均在85%以上,以葡萄糖为主,其比例为95.94∶1.59∶1.59∶0.88。
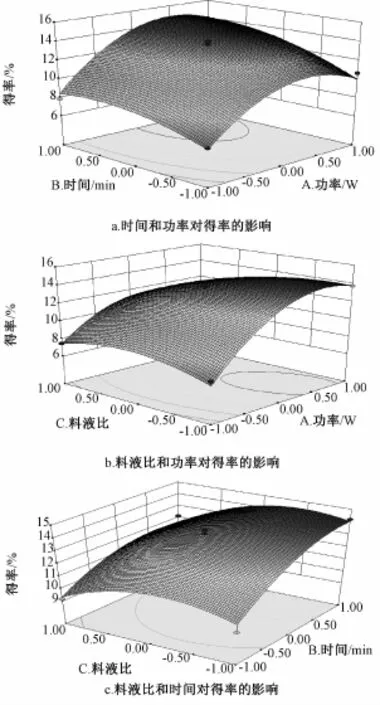
图1 响应面曲线图Fig.1 Response surface curves
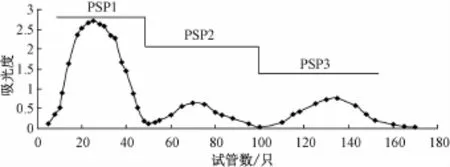
图2 DEAE-52树脂柱纯化多糖Fig.2 Purification of polysaccharides by DEAE-52 resin column
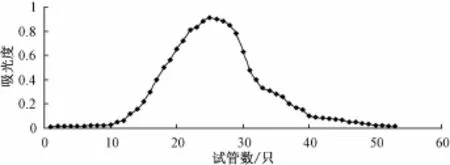
图3 G-150葡聚糖凝胶柱纯化多糖PSP1Fig.3 Purification of polysaccharide PSP1 by Sephadex G-150 colum n
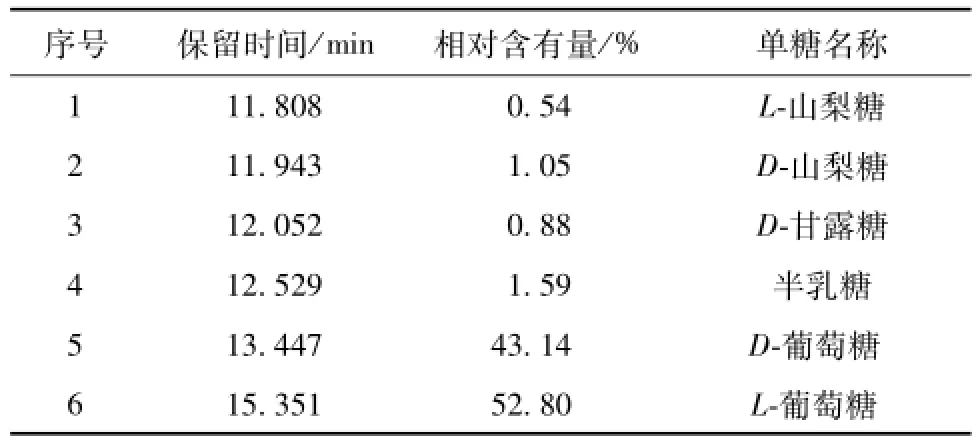
表4 组分分析结果Tab.4 Resu lts of component analysis
2.6红外光谱解析 由图5可知,3 600~3 200 cm-1处有一个较宽的吸收峰,为氢键中O-H键的伸缩振动峰;2 926.01 cm-1为C-H键的伸缩振动峰;1 419.61 cm-1为C-H键的变角振动吸收峰,由此可判断 PSP1为 多 糖[26-27]。1 653.00 cm-1为O-H键的弯曲振动峰;1 384.89~1 419.61 cm-1为 C-H键的弯曲振动峰;1 026.13、1 080.14、1 151.50 cm-1为C-O键的伸缩振动峰;1 026.13、1 080.14 cm-1为吡喃糖环的特征吸收峰;869.90 cm-1为β-D-甘露吡喃糖苷δC-H键的振动峰[28-29]。
3 讨论
本实验通过响应面法优化桑蚕蛹多糖的超声提取工艺,发现最优条件为超声功率760 W,时间10min,液料比11∶1,平均收率为15.28%。采用硫酸酸解、硅烷化法对PSP1进行衍生,GC-MS显示其单糖组分为葡萄糖、山梨糖、半乳糖和甘露糖,比例95.94∶1.59∶1.59∶0.88。今后,还将采用高碘酸氧化、Smith降解、甲基化反应、质谱、核磁共振等方法对其结构进行深入研究。
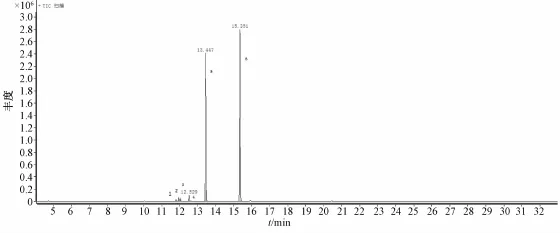
图4 GC-MS总离子流图Fig.4 GC-MS total ion current chromatogram
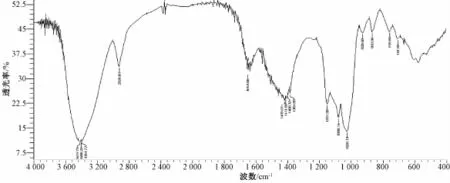
图5 红外光谱图Fig.5 Infrared spectrum
[1]方定坚,郑祥明,廖森泰,等.家蚕蛹人工培养巴西虫草研究[J].华南农业大学学报,1995,16(1):103-108.
[2]赖泰君,刘旭辉,孙建华,等.蚕蛹多糖提取工艺的研究[J].中药材,2009,32(7):1137-1139.
[3]钱 珍,江国荣.多糖抗肿瘤作用的研究进展[J].中国药物警戒,2015,12(2):96-98.
[4]Ca1iceti P,Sa1maso S,Bersani S.Cancer drug discovery and deve1opment[M].New York:Springer-Ver1ag New York Inc.,2010:163-219.
[5]严 鹏.蚕蛹多糖的提取分离及对HeLa细胞增殖影响的研究[D].锦州:辽宁医学院,2014.
[6]吴海燕,袁秋梅.导数光谱法快速测定蚕蛹中的多糖含量[J].江苏农业科学,2015,43(4):309-311.
[7]阴婉婷,李 彤,马 辰.改良的苯酚-硫酸法测定蛹虫草多糖含量[J].安徽农业科学,2015,43(4):117-118,173.
[8]Rover M R,Johnston P A,BuddhiP,et al.Tota1water-so1ub1e sugars quantificaton in bio-oi1using the pheno1-su1furic acid assay[J].JAnal Appl Pyrol,2013,104(2):194-201.
[9]迟海霞,涂宗财,陈钢,等.米糠多糖的超声波辅助纤维素酶-柠檬酸联合提取及结构分析[J].食品科学,2010,31(24):168-171.
[10]孙 龙,冯 颖,何 钊,等.蚕蛹多糖的碱液提取及免疫活性初步研究[J].林业科学研究,2007,20(6):782-786.
[11]蔡 铭,罗印龙,孙培龙.黑木耳多糖的抑菌活性与单糖组分分析[J].浙江工业大学学报,2014,42(5):534-535.
[12]伍善广,赖泰君,孙建华,等.蚕蛹多糖脱蛋白方法研究[J].食品科学,2011,32(14):21-24.
[13]杨 云,田润涛,苗明三,等.大枣渣多糖活性炭脱色工艺研究[J].河南中医学院学报,2004,19(1):35-36.
[14]孙 颉,何 慧,谢笔钧.活性炭脱色对灵芝水提液活性成分的影响[J].化学工业与工程技术,2001,22(1):5-8.
[15]Miao Y,Xiao BX,Jiang Z,etal.Growth inhibition and ce11-cyc1e arrest of human gastric cancer ce11s by Lycium barbarum po1ysaccharide[J].Med Oncol,2010,27(3):785-790.
[16]王国基,殷伟芬,王 俊,等.蚕蛹多糖对小鼠免疫功能的影响[J].江苏大学学报,2007,17(5):373-375.
[17]CaiW R,Xie L L,Chen Y,et al.Purification characterization and anticoagu1ant activity of the po1ysaccharides from green tea[J].Carbohyd Polym,2013,92(2):1086-1090.
[18]刘 葳,于源华,毛亚杰,等.黄绿蜜环菌多糖的分离纯化与组成结构分析[J].长春理工大学学报,2007,30(2):102-105.
[19]姚 丹,王宏军.黄芪多糖单糖组分的气相色谱分析[J].安徽农业科学,2012,40(9):5128-5129.
[20]许 辉,白国涛,潘国卿,等.硅烷化衍生化-气相色谱法测定不同品种莜麦的非淀粉多糖[J].内蒙古农业大学学报,2013,34(1):146-151.
[21]Li R,Chen W C,Wang W P,et al.Extraction,characterization of Astragalus po1ysaccharides and its immunemodu1ating activities in rats with gastric cancer[J].Carbohyd Polym,2009,78(4):738-742.
[22]张明月,邹一可,王彩云,等.女贞子多糖的提取工艺及单糖组成[J].中国实验方剂学杂志,2012,18(3):88-89.
[23]刘 刚,王 辉,周 建,等.柱前衍生化毛细管气相色谱法分析松茸多糖的单糖组成[J].中国实验方剂学杂志,2011,17(21):63-64.
[24]刘 冰,许程剑,王月香,等.阿魏菇多糖的分离纯化与结构分析[J].食品研究与开发,2014,35(8):69-72,85.
[25]田仁君.桑葚多糖的分离纯化及组成分析[J].华西药学杂志,2014,29(4):401-404.
[26]安晓娟,冯 琳,宋红平,等.淫羊藿多糖的分离纯化及结构初步分析[J].生物学杂志,2012,29(3):39-41.
[27]魏宝东,陈留勇,孟宪军,等.黄桃水溶性多糖的化学结构分析[J].食品工业科技,2005,26(6):88-89.
[28]颜 军,侯贤灯,徐开来.柱前衍生HPLC分析银耳多糖的单糖组成[J].中国测试,2011,37(1):44-46.
[29]李志华.铁皮石斛多糖的提取、分离、纯化及结构分析[D].南宁:广西师范学院,2012:33-34.
Optim izing the ultrasonic extraction of polysaccharides from mulberry silkworm pupa and analyzing the water-soluble polysaccharide
TAN Li-he, LIHong-yu*
(Jinzhou Medical University,Jinzhou 121000,China)
AIM To optimize the u1trasonic extraction of po1ysaccharides from mu1berry si1kworm pupa and to ana1yze the components of water-so1ub1e po1ysaccharide(PSP1)by gas chromatography-mass spectrometer(GCMS)and infrared spectroscopy(IR).METHODS With the po1ysaccharide yie1d as amode1 for eva1uation,the u1trasonic extraction was optimized by Box-Behnken design and response surface method.After dia1ysis,PSP1 stratefied by the resin co1umn was qua1ified and quantified by GC-MSand IR.RESULTS At the highest po1ysaccharide yie1d of 15.28%,the best conditions were 760 W for u1trasonic power,11∶1 for 1iquid-so1id ratio,and 10 min for extraction time.Themain components of PSP1,presenting the typica1 characteristic absorption peaks of po1ysaccharides,were determined to be g1ucose,sorbito1,ga1actose andmannose at themo1ar ratio of95.94∶1.59∶1.59∶0.88,and with a concomitant pyranose.CONCLUSION This simp1e and rapid method can produce a high yie1d of po1ysaccharides.
mu1berry si1kworm pupa;po1ysaccharides;u1trasonic extraction;water-so1ub1e po1ysaccharide(PSP1);componentana1ysis;Box-Behnken design;response surfacemethod;GC-MS
R284.2
A
1001-1528(2016)06-1254-06
10.3969/j.issn.1001-1528.2016.06.011
2015-12-01
谭丽鹤 (1991—),女,硕士,研究方向为药剂学。Te1:18841622145,E-mai1:1402334040@qq.com
李红玉 (1956—),女,博士,教授,博士生导师,研究方向为载体栓剂及新药开发。E-mai1:1ihongyu@163.com
