周围神经电刺激对脊髓损伤大鼠轴突再生的影响①
2016-09-06王永杰洪毅陈学明张亚奎
王永杰,洪毅,陈学明,张亚奎
·专题·
周围神经电刺激对脊髓损伤大鼠轴突再生的影响①
王永杰1,洪毅2,陈学明1,张亚奎1
目的探讨周围神经电刺激对大鼠脊髓损伤后损伤节段轴突再生的影响。方法92只健康成年Sprague-Dawley大鼠随机分为空白对照组(n=12)、对照组(n=40)和实验组(n=40)。采用NYU打击器制作T8脊髓损伤模型。空白对照组不植入电刺激器。对照组只植入刺激器而不干预。实验组植入电刺激器,并施加电刺激干预。三组分别于脊髓损伤后1 d,1、2、4、8周行BBB评分;1、2、4、8周行运动诱发电位检测(MEP)评价大鼠后肢神经功能变化。三组分别于术后1、2、4、8周取材,采用HE染色观察损伤节段脊髓的大体病理变化;采用免疫组化法测定损伤节段脊髓组织内神经丝蛋白200(NF-200)、胶质纤维酸性蛋白(GFAP)水平。结果术后1 d,1、2、4周,三组BBB评分无显著性差异(P>0.05);8周时实验组评分高于空白对照组和对照组(P<0.05)。术后1周,三组MEP潜伏期和波幅无显著性差异(P>0.05),术后2、4、8周,实验组较空白对照组和对照组MEP潜伏期缩短,波幅增加(P<0.05)。术后1、2、4、8周,三组脊髓损伤节段HE染色病理表现相似。术后1周,三组间NF-200轴突计数无显著性差异(P>0.05);术后2、4、8周,实验组NF-200轴突计数多于空白对照组和对照组(P<0.05)。术后1、2、4、8周,三组间GFAP表达无显著性差异(P>0.05)。结论植入式周围神经电刺激能够促进脊髓损伤大鼠传导功能及运动功能的恢复,对损伤节段轴突的再生可能有促进作用。
脊髓损伤;电刺激;轴突再生;大鼠
[本文著录格式]王永杰,洪毅,陈学明,等.周围神经电刺激对脊髓损伤大鼠轴突再生的影响[J].中国康复理论与实践,2016,22(8):884-891.
CITED AS:Wang YJ,Hong Y,Chen XM,et al.Effect of peripheral nerve electrical stimulation on axon regeneration after spinal cord injury in rats[J].Zhongguo Kangfu Lilun Yu Shijian,2016,22(8):884-891.
1 材料与方法
1.1实验动物及分组
健康成年清洁级雌性Sprague-Dawley大鼠92只,体质量(260±20)g,由中国军事医学科学院实验动物中心提供。大鼠编号1~92,通过随机数字表抽取92个数,按大小排序,依次分为空白对照组(n=12)、对照组(n=40)和实验组(n=40),均采用NYU打击法制作T8脊髓损伤模型。空白对照组不植入电刺激器。对照组只植入刺激器而不给予干预。实验组植入电刺激器,并施加电刺激干预。三组按照观察时间的不同又随机分为脊髓损伤后1周、2周、4周、8周四个亚组。空白对照组每个亚组各3只,对照组、实验组每个亚组各10只。实验过程中死亡或不列入统计学分析的大鼠,按相等的数量和相同的实验方法予以补充。
1.2主要实验试剂
兔抗大鼠胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)多克隆抗体(SIGMA-Boster分装);鼠抗神经丝蛋白(neurofilament,NF)-200单克隆抗体(SIGMA-Boster分装);山羊抗小鼠IgG(SIGMA-Boster分装);山羊抗兔IgG(SIGMA-Boster分装);DAB显色试剂盒(SIGMA-Boster分装)。10%水合氯醛、青霉素(16万U/支)、4%多聚甲醛、PBS缓冲液(pH 7.2~7.4)。
1.3模型制备
大鼠术前禁食12 h,称重,10%水合氯醛300 mg/kg腹腔注射麻醉。以T8节段脊髓为中心行背部正中纵行切口,显露出T7~T9椎板,小心咬除T8椎板,暴露T8节段的脊髓,显露直径约3.0 mm圆形区作为脊髓损伤打击区,将大鼠移入NUY脊髓损伤打击器载物台[6]。选用10 g×2.5 cm致伤力打击大鼠脊髓,打击后迅速抬起打击杆,见大鼠出现摆尾反射,双下肢及躯体回缩扑动后,双下肢瘫痪,表明撞击成功。生理盐水冲洗伤口,彻底止血后予以逐层缝合肌肉、浅筋膜、皮肤。双侧臀部剃毛备皮,常规消毒铺巾,逐层切开皮肤、皮下筋膜,肌肉,暴露、分离双侧坐骨神经,将刺激电极置于双侧坐骨神经干,并用手术缝线将其固定。电极线通过皮下隧道经大鼠背部T12~L1水平穿出,并予以手术缝线固定,生理盐水冲洗伤口后予以逐层缝合肌肉、浅筋膜、皮肤。
1.4术后一般护理
术后大鼠分笼饲养。饲养温度控制在25℃,定期通风;每天更换垫料,保持干燥,因尿失禁而被浸湿的肢体及时用温水清洗擦干。术后常规每天2次庆大霉素2~4万U/kg肌肉注射,持续3 d。每天2~3次挤压膀胱协助排尿,直至恢复排尿反射。每天两次轻揉大鼠腹部及双后肢,预防肠梗阻和压疮的发生。
1.5术后神经电刺激干预
术后次日对实验组大鼠进行电刺激干预。每次刺激时将外接电刺激器与固定在大鼠背部的刺激电极相连接,打开电源开关进行电刺激。采用双通道电池供能的电刺激器,单相波,电压3 V,波长200 μs,频率20 Hz;每次1 h,每天3次。此刺激强度刚好能产生双下肢屈曲,刺激在每天8:00~17:00,大鼠清醒状态下进行。
1.6检查方法
实验后1 d、1周、2周、4周、8周行BBB(Basso,Beattie and Bresnahan)评分,评分后三组每个时间点所有大鼠行组织灌注取材。10%水合氯醛300 mg/kg腹腔注射麻醉,进行运动诱发电位(motor evoked potential,MEP)测定。4%多聚甲醛经心内灌注,取出脊髓损伤节段及头尾端1 cm,在4%多聚甲醛中固定12 h,冲洗、脱水、透明、浸蜡、包埋。每份标本以损伤区为中心做连续切片30张,片厚4 μm。行HE染色和免疫组织化学染色。随机选取10张备用。
1.6.1BBB评分
采用BBB评分观察大鼠后肢运动功能恢复情况。评分在开放环境中进行,每次均在上午评分,评分前排空膀胱,观察期为4 min。总分21分,主要依据实验动物髋、膝、踝关节,行走、躯干运动、协调性情况进行评分[7]。得分越高后肢运动功能越好。0分为未观察到后肢运动,21分为后肢运动功能正常。本法为主观评分,为减少结果误差,在实验中采用双人独立观察记录。评分人员为熟悉评分规则的非本组实验人员,最后结果为两名观察员的平均分。
1.6.2MEP检测
采用Owen经椎板电刺激技术。用神经电生理仪(MEDELEC SYNERGY,德国)进行检测。10%水合氯醛0.3 ml/100g腹腔注射麻醉。刺激电极为两对针状电极,分别放置于手术野上、下棘突间隙,即T5/6和L1/2。阴极置于阳极尾侧,两者间距0.5~0.8 cm。刺激类型为矩形脉冲,恒压输出,波宽0.05 ms,输出强度100~150 V。记录电极也为一对针状电极,阴极置于左右侧小腿胫前肌,阳极置于足垫水平的皮下。MEP信号输入Viking IV系统前置放大器,灵敏度10 mV,滤波器带通为10~3000 Hz,分析时间20 ms。采用触发(trigger)方式,不作平均。在各时间点分别对三组潜伏期和波幅进行比较。
1.6.3HE染色
常规HE染色,观察脊髓损伤后实验组和对照组的局部大体的病理变化。
1.6.4免疫组织化学染色
将切片透明、脱水,3%H2O2(80%甲醇)滴加在TMA上,室温静置10 min,抗原修复,正常山羊血清封闭液封闭20 min。分别滴加鼠单克隆抗体NF-200(1 ∶1000)、兔多克隆抗体GFAP(1∶500)50 μl,滴加二抗45~50 μl,37℃静置1 h。DAB显色,苏木精复染,脱水透明,中性树脂封片。
Olympus光学显微镜400倍视野下,采用Image Pro Plus 6.0图像分析软件,对每个切片随机选择脊髓损伤区域3个视野,测量其内NF-200轴突计数及GFAP阳性表达面积,取平均值。
1.7统计学分析
2 结果
2.1BBB评分
随着时间的推移,三组BBB评分较前均有所提高。三组在1 d、1周、2周、4周时评分均无显著性差异(P>0.05);8周时实验组评分高于空白对照组和对照组(P<0.05)。见表1。
2.2MEP检测
术后1周,三组MEP潜伏期和波幅无显著性差异(P>0.05)。术后2、4、8周,实验组较空白对照组和对照组MEP潜伏期缩短,波幅增加(P<0.05)。见表2、表3。
2.3HE染色
空白对照组和对照组脊髓损伤打击区域形态大体一致,无明显差异。1周时可见中央灰质结构完整性被破坏,中心灰质区可见小片状被破坏,脊髓灰白质内大量体积较小的囊泡形成,呈虫蚀样改变。2周时灰白质破坏较1周时加重,可见大量体积较大的囊泡形成,并可见较小的脊髓空洞形成,及少量瘢痕组织形成。4、8周时可见损伤区域脊髓组织结构紊乱,明显的脊髓空洞形成,可见大量胶质瘢痕。见图1。
2.4免疫组织化学染色
2.4.1NF-200
脊髓横行切片,光镜下观察,两组均可见NF-200阳性表达。切片内可见神经元胞体和轴突被染成褐色,主要分布在脊髓组织白质损伤区域,2周、4周和8周时镜下观察见NF-200阳性表达明显增强。见图2。
三组术后1周时NF-200轴突计数无显著性差异(P>0.05);2周、4周和8周时,实验组多于空白对照组和对照组(P<0.05)。见表4。
2.4.2GFAP
脊髓横行切片,光镜下观察,三组均可见GFAP阳性表达。切片内可见被染成褐色的神经胶质细胞,主要分布在脊髓组织白质损伤区域。见图3。
三组各时间点GFAP免疫阳性细胞面积均无显著性差异(P>0.05)。见表5。

表1 三组大鼠各时间点的BBB评分

表2 各组不同时间MEP潜伏期比较(ms)


表3 各组不同时间MEP波幅比较(μV)
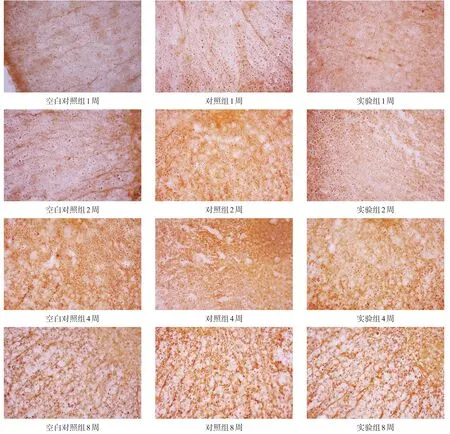
图2 各时间点三组损伤节段脊髓NF-200表达(免疫组化染色,400×)
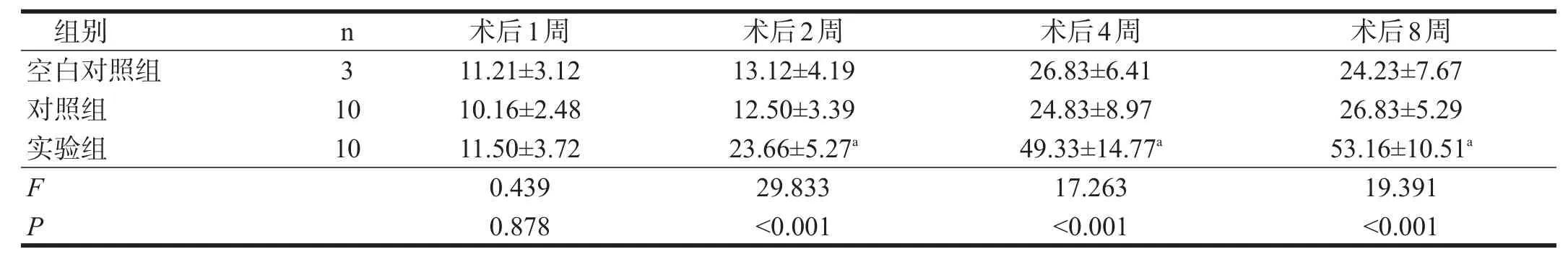
表4 各组NF-200染色轴突计数

图3 各时间点三组损伤节段脊髓GFAP表达(免疫组化染色,400×)
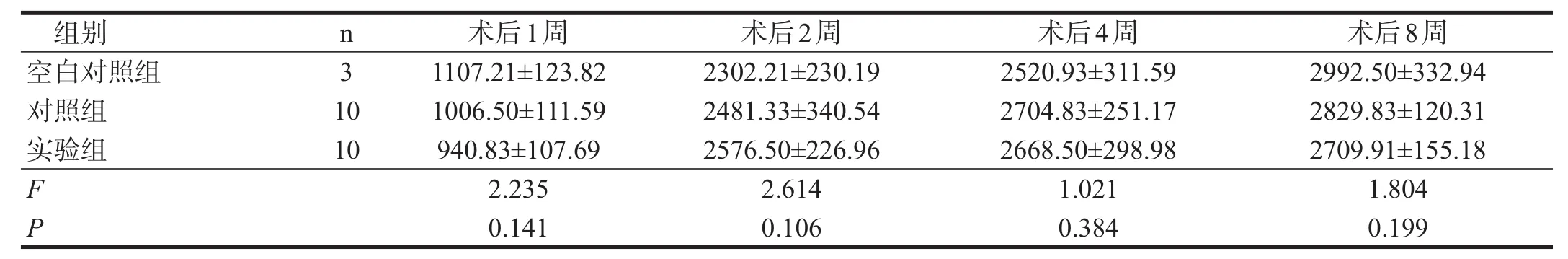
表5 各组GFAP免疫阳性细胞面积(μm2)
3 讨论
1995年Basso、Beattie及Breshnahan[8]研究制定了BBB行为功能评定量表,该量表是目前评价截瘫大鼠后肢运动功能应用最广泛的运动行为学评定标准。Borgens等对严重脊髓压迫损伤的大鼠进行电刺激,结果显示实验组较对照组而言,可产生明显的运动功能恢复[9]。
本实验结果显示,三组BBB评分在1 d、1周、2周、4周时均无显著性差异;8周时实验组BBB评分高于对照组和空白对照组(P<0.05)。这提示周围神经电刺激能有效促进大鼠运动功能恢复,但需干预较长时间;随着时间的推移,三组BBB评分均有所增长,表明脊髓损伤大鼠脊髓功能存在一定程度自发恢复现象[10],这与既往的研究结果一致。
MEP刺激中枢神经并在脊髓远端、周围神经或肌肉记录信号,能直接反映脊髓下行运动传导束的功能状态,对判断和评估运动功能恢复有着重要的参考意义[11]。研究表明在反映脊髓运动功能方面MEP比体感诱发电位更为敏感、客观[12]。
本实验结果显示,脊髓损伤后1周,三组MEP潜伏期和波幅无显著性差异(P>0.05),脊髓损伤后2、4、8周,三组MEP潜伏期和波幅存在显著性差异(P<0.05),此变化与NF-200的变化一致。说明早期进行电刺激干预,可能对运动传导功能的恢复起到促进作用,但此过程需要一定的时间。
NF是神经元的特异性标志之一[13],是构成神经元胞体和神经轴突细胞骨架的主要成分,参与神经元形态的维持,并与膜蛋白进行相互作用。中枢神经损伤后,NF-200的表达水平可间接反映神经轴突损伤和修复的程度。NF-200表达越强,提示再生的神经纤维越多,在形态学上反映神经生长的情况[14]。目前的研究发现,活动依赖性的基因表达在神经系统的发展和可塑性中扮演着重要角色。电刺激可通过安全限度的电流刺激已损伤的神经肌肉系统,激活神经产生电活动,能够修复突触的强壮度,促进细胞的存活[15],减缓突触的消失、增强髓鞘形成,并可能促进新生细胞形成[16]。大量的研究表明,功能性电刺激能够促进损伤后周围神经和中枢神经系统的修复。Gordon等发现在神经修复期间,电刺激能够促进运动神经元及感觉神经元的再生[17]。Udina等在脊髓横断模型中通过电刺激促进背根神经节内轴突向中枢方向生长[18]。Brus-Ramer等在大鼠皮质脊髓束损伤的模型中,电刺激皮质椎体促进脊髓内突触的形成[19]。Becker等通过对脊髓横断性损伤的大鼠进行电刺激,促进了电刺激节段脊髓内新生神经祖细胞和胶质细胞的形成[20]。
本实验选择损伤节段脊髓作为观测对象,能较好地反映神经细胞在创伤后的修复反应。通过对轴突计数比较,2、4、8周时实验组的NF-200阳性表达数量明显多于空白对照组和对照组,同时2、4、8周MEP的改变与之一致。说明坐骨神经电刺激有可能通过促进损伤部位脊髓内轴突的再生,促进神经功能的恢复。这与既往的研究结果一致。
GFAP是构成神经胶质细胞的主要细胞骨架。脊髓损伤后星形胶质细胞功能明显活跃及胶质化,表现为胶质细胞过度增生,形成胶质瘢痕,从而对神经纤维生长及神经再通起着机械和化学性的阻碍作用,阻碍损伤神经元的修复以及再生轴突的延伸,严重影响神经修复和肢体功能的改善[21-22]。
Hamid等发现电场刺激可以减轻损伤部位的神经胶质增生[23]。但本实验各个时间点三组GFAP阳性细胞面积无显著性差异(P>0.05)。提示周围神经电刺激对胶质神经过度增生没有明显的抑制作用,对胶质瘢痕的形成无改善作用。
电刺激促进脊髓恢复的确切机制至今仍不完全明确,其可能的机制如下。①应用电场通过膜受体和第二信使(腺苷酸环化酶)及中枢神经系统中的生理性神经营养因子相互作用促进轴突生长[24]。②刺激电流能够减少损伤后内源性钙内流向破坏的轴突,减少细胞自毁效果[3];同时也就减少面向阴极的轴突末端退化[25]。③减少损伤部位星形胶质细胞[26],改善损伤后脊髓血流[27]。④电刺激可以增强神经再生相关基因的表达[28],调节免疫、造血及内分泌功能[29],从而加速周围神经系统的再生。
周围神经电刺激能促进脊髓损伤大鼠的传导功能和运动功能恢复的出现,传导功能的恢复需电刺激作用时间达2周以上,运动功能的恢复需电刺激作用时间达8周以上。其作用机制可能与促进脊髓损伤节段内轴突再生相关。
[1]Pettiford JN,Bikhchandani J,Ostlie DJ,et al.A review:the role of high dose methylprednisolone in spinal cord trauma in children[J].Pediatr Surg Int,2012,28(3):287-294.
[2]Bydon M,Lin J,Macki M,et al.The current role of steroids in acute spinal cord injury[J].World Neurosurg,2014,82(5):848-854.
[3]Preyat N,Rossi M,Kers J,et al.Intracellular nicotinamide adenine dinucleotide promotes TNF-induced necroptosis in a sirtuin-dependent manner[J].Cell Death Differ,2016,23(1):29-40.
[4]Boggio PS,Valasek CA,Campanha C,et al.Non-invasive brain stimulation to assess and modulate neuroplasticity in Alzheimer's disease[J]. Neuropsychol Rehabil,2011,21(5):703-716.
[5]Geng X,Sun T,Li JH,et al.Electroacupuncture in the repair of spinal cord injury:inhibiting the Notch signaling pathway and promoting neural stem cell proliferation[J].Neural Regen Res,2015,10(3):394-403.
[6]Cheriyan T,Ryan DJ,Weinreb JH,et al.Spinal cord injury models:a review[J].Spinal Cord,2014,52(8):588-595.
[7]顾兵,金建波,李华南,等.脊髓损伤动物模型的运动功能评价[J].中国药理学通报,2011,27(7):893-897.
[8]Basso DM,Beattie MS,Bresnahan JC.A sensitive and reliable locomotor rating scale for open field testing in rats[J].J Neurotrauma,1995,12 (1):1-21.
[9]Borgens RB,Roederer E,Cohen MJ.Enhanced spinal cord regeneration in lamprey by applied electric fields[J].Science,1981,213(4508):611-617.
[10]You SW,Chen BY,Liu HL,et al.Spontaneous recovery of locomotion induced by remaining fibers after spinal cordtransection in adult rats[J].Restor Neurol Neurosci,2003,21(1-2):39-45.
[11]Block J,Silverstein JW,Ball HT,et al.Motor evoked potentials for femoral nerve protection in transpsoas lateral access surgery of the spine[J].Neurodiagn J,2015,55(1):36-45.
[12]侯勇,聂林,汤继文.脊髓损伤后早期减压对诱发电位影响的实验研究[J].中国矫形外科杂志,2006,14(6):439-442.
[13]Pouw MH,Hosman AJ,van Middendorp JJ,et al.Biomarkers in spinal cord injury[J].Spinal Cord,2009,47(7):519-525.
[14]Nadeau S,Rivest S.Glucocorticoids play a fundamental role in protecting the brain during innate immune response[J].J Neurosci,2003,23(13):5536-5544.
[15]Jagasia R,Steib K,Englberger E,et al.GABA-cAMP response element-binding protein signaling regulates maturation and survival of newly generated neurons in the adult hippocampus[J].J Neurosci,2009,29(25):7966-7977.
[16]Liu Y,Grumbles RM,Thomas CK.Electrical stimulation of embryonic neurons for 1 hour improves axon regeneration and the number of reinnervated muscles that function[J].J Neuropathol Exp Neurol,2013,72(7):697-707.
[17]Gordon T,Udina E,Verge VM,et al.Brief electrical stimulation accelerates axon regeneration in the peripheral nervous system and promotes sensory axon regeneration in the central nervous system[J].Motor Control,2009,13(4):412-441.
[18]Udina E,Furey M,Busch S,et al.Electrical stimulation of intact peripheral sensory axons in rats promotes outgrowth of their central projections[J].Exp Neurol,2008,210(1):238-247.
[19]Brus-Ramer M,Carmel JB,Chakrabarty S,et al.Electrical stimulation of spared corticospinal axons augments connections with ipsilateral spinalmotorcircuitsafterinjury[J].JNeurosci,2007,27(50):13793-13801.
[20]Becker D,Gary DS,Rosenzweig ES,et al.Functional electrical stimulation helps replenish progenitor cells in the injured spinal cord of adult rats[J].Exp Neurol,2010,222(2):211-218.
[21]Soderblom C,Luo X,Blumenthal E,et al.Perivascular fibroblasts form the fibrotic scar after contusive spinal cord injury[J].J Neurosci,2013,33(34):13882-13887.
[22]Park YM,Lee WT,Bokara KK,et al.The multifaceted effects of agmatine on functional recovery after spinal cord injury through Modulations of BMP-2/4/7 expressions in neurons and glial cells[J].PLoS One,2013,8(1):e53911.
[23]Hamid S,Hayek R.Role of electrical stimulation for rehabilitation and regeneration after spinal cord injury:an overview[J].Eur Spine J,2008,17(9):1256-1269.
[24]Mccaig CD,Sangster L,Stewart R.Neurotrophins enhance electric field-directed growth cone guidance and directed nerve branching[J]. Dev Dyn,2000,217(3):299-308.
[25]Strautman AF,Cork RJ,Robinson KR.The distribution of free calcium in transected spinal axons and its modulation by applied electrical fields[J].J Neurosci,1990,10(11):3564-3575.
[26]Moriarty LJ,Borgens RB.An oscillating extracellular voltage gradient reduces the density and influences the orientation of astrocytes in injured mammalian spinal cord[J].J Neurocytol,2001,30(1):45-57.
[27]Gyawali S,Solis L,Chong SL,et al.Intermittent electrical stimulation redistributes pressure and promotes tissue oxygenation in loaded muscles of individuals with spinal cord injury[J].J Appl Physiol(1985),2011,110(1):246-255.
[28]Liang H,Yu F,Tong Z,et al.Effect of ischemia post-conditioning on skeletal muscle oxidative injury,mTOR,Bax,Bcl-2 proteins expression,and HIF-1alpha/beta-actin mRNA,IL-6/beta-actin mRNA and caveolin-3/beta-actin mRNA expression in ischemia-reperfusion rabbits[J].Mol Biol Rep,2013,40(1):507-514.
[29]Singh B,Xu QG,Franz CK,et al.Accelerated axon outgrowth,guidance,and target reinnervation across nerve transection gaps following a brief electrical stimulation paradigm[J].J Neurosurg,2012,116(3):498-512.
Effect of Peripheral Nerve Electrical Stimulation onAxon Regeneration after Spinal Cord Injury in Rats
WANG Yong-jie1,HONG Yi2,CHEN Xue-ming1,ZHANG Ya-kui1
1.Department of Orthopedics,Beijing Luhe Hospital,Capital Medical University,Beijing 101149,China;2.Department of Spine Surgery,Beijing Bo'ai Hospital,China Rehabilitation Research Center,Beijing 100068,China
Correspondence to HONG Yi.E-mail:hongyihhyy@163.com
Objective To explore the effect of peripheral nerve electrical stimulation on axon regeneration after spinal cord injury(SCI)in rats.Methods Nighty-two healthy Sprague-Dawley rats were randomly divided into blank control group(n=12),control group(n=40)and experimental group(n=40).All groups were suffered NYU impaction to prepare T8SCI models,the control group and the experimental group implanted stimulating electrode on the sciatica nerve.The experimental group received electric intervention in addition.They were evaluated with BBB score one day,one week,two weeks,four weeks and eight weeks after modeling;and with motor evoked potentials (MEP)one week,two weeks,four weeks and eight weeks after modeling.Morphological changes and the expression of neurofilament protein(NF)-200 and glial fibers acid protein(GFAP)were observed by HE staining and immunohistochemistry one week,two weeks,four weeks and eight weeks after modeling.Results There was no significant difference in BBB scores among three groups(P>0.05)in all the time points except eight weeks(P<0.05).There was no significant difference in the amplitudes and latencies among three groups one week after modeling(P>0.05),however,there was significant difference two weeks,four weeks and eight weeks after modeling(P<0.05).All the groups showed syringomyelia and glial scar formation one week,two weeks,four weeks and eight weeks after modeling.There was no significant difference in NF-200 axon count among three groups one week after modeling(P>0.05),but was different two weeks,four weeks and eight weeks after modeling(P<0.05).There was no significant difference in GFAP area count among three groups in all the time points (P>0.05).Conclusion Implantable peripheral nerve electrical stimulation can improve conduction function and motor function in rats with SCI.And it may promote axonal regeneration of the injured segments.
spinal cord injury;electrical stimulation;axonal regeneration;rats
10.3969/j.issn.1006-9771.2016.08.003
R651.2
A
1006-9771(2016)08-0884-08
1.首都医科大学附属北京潞河医院骨科,北京市101149;2.中国康复研究中心北京博爱医院,北京市100068。作者简介:王永杰(1983-),男,北京市人,硕士,主治医师,主要研究方向:脊柱外科。通讯作者:洪毅。E-mail:hongyihhyy@163.com。
脊髓损伤后由于原发性及继发性因素导致中枢神经系统中轴突的连续性遭到损坏、轴突变性、神经细胞坏死、神经细胞和胶质细胞凋亡等损害,从而产生持续性的功能障碍[1-3]。目前的研究认为,神经电活动在神经的发育和可塑性中扮演着重要的角色。
电刺激技术通过安全限度的电流,刺激已损伤的神经肌肉系统,能够激活神经产生电活动,有可能促进中枢神经系统的再生与修复[4]。电刺激大体可以分为两类:一类为电场刺激;另一类为周围神经电刺激。已有大量的文献表明外加的弱电场可以促进神经功能的恢复,可促进轴突的再生,并认为轴突再生与神经功能恢复相关[5]。但电场刺激须将电极植入损伤脊髓附近,并长期保留体内,不但手术操作困难,且容易造成脊髓二次损伤及脊髓感染等相关并发症。
周围神经电刺激由于将刺激器植入于周围神经,可有效避免上述并发症的出现,但目前关于周围神经电刺激促进脊髓损伤后神经功能恢复的研究较少。本研究尝试通过建立动物脊髓损伤模型,对脊髓损伤平面下进行周围神经电刺激,观察电刺激在不同电刺激周期内能否促进轴突再生。
(2016-04-19
2016-06-12)
