LIGHT作为EBNA1 DNA疫苗佐剂的免疫效应研究
2016-09-05卢晓华邹军辉杨建设西北师范大学生命科学学院甘肃兰州730070中国科学院深圳先进技术研究院生物医药与技术研究所广东深圳58055
卢晓华,邹军辉,郑 威,杨建设,王 蒲△(.西北师范大学生命科学学院,甘肃兰州730070;.中国科学院深圳先进技术研究院生物医药与技术研究所,广东深圳58055)
LIGHT作为EBNA1 DNA疫苗佐剂的免疫效应研究
卢晓华1,2,邹军辉2,郑威2,杨建设1,王蒲2△(1.西北师范大学生命科学学院,甘肃兰州730070;2.中国科学院深圳先进技术研究院生物医药与技术研究所,广东深圳518055)
目的研究LIGHT作为免疫佐剂在EB病毒核抗原1(EBNA1)DNA疫苗诱导免疫反应中的作用。方法以Balb/c小鼠肝脏cDNA为模板,PCR扩增构建真核表达载体pcDNA3.1-LIGHT;转染细胞,验证LIGHT蛋白的表达;采用电脉冲方法,以LIGHT质粒为佐剂与EBV DNA疫苗联合免疫小鼠,测定血清中EBNA1特异性抗体;分离和收集小鼠脾脏淋巴细胞,经EBNA1抗原刺激后,测定细胞因子干扰素-γ(IFN-γ)的分泌水平。结果PCR扩增出LIGHT目的片段,大小为720 bp;蛋白质免疫印迹法(Western blotting)鉴定结果:在蛋白Marker相对分子质量26×103上方有单一清晰目的条带,表明有LIGHT蛋白表达;免疫小鼠血清测定实验结果:LIGHT联合DNA疫苗实验组的抗体滴度是单独DNA疫苗免疫组的3倍;脾淋巴细胞因子测定结果表明LIGHT联合免疫组能明显增强IFN-γ的分泌。结论LIGHT作为免疫佐剂,可依赖其介导的信号通路对抗体的产生和相关细胞因子的分泌具有显著促进作用。
疱疹病毒4型,人;疫苗,DNA;佐剂,免疫;LIGHT;电脉冲免疫
EB病毒(Epstein-Barr virus,EBV)是一种人类γ疱疹病毒,在人群中感染非常普遍[1],与多种疾病的发生有关,如鼻咽癌、霍奇金淋巴瘤和胃癌等[2]。EB病毒核抗原1(EBNA1)是EBV感染人体后编码表达的DNA结合蛋白,是EBV DNA复制、病毒基因维持终生感染和B淋巴细胞永生化过程中唯一必需的病毒蛋白[3-4]。DNA疫苗将编码EBNA1的基因构建到真核表达载体,再直接导入机体,激发机体产生特异性体液和细胞免疫应答。为了提高DNA疫苗的免疫原性和免疫效果,一方面在疫苗中加入佐剂联合免疫,增强机体免疫应答水平[5-6];另一方面采用电脉冲(electric pulse,EP)介导的免疫方法[7-9],提升DNA疫苗的表达水平,从而提高疫苗的免疫原性[7]。LIGHT属于肿瘤坏死因子超家族成员(TNFSF14)[10-11],是一种非CD28依赖的共刺激分子;LIGHT与其功能受体结合介导的LIGHT-HVEM/LTβR信号通路,通过刺激T细胞活化和增殖[12]及诱导靶细胞凋亡[13],在抗病毒感染免疫中发挥重要作用[14-15]。本研究以LIGHT质粒DNA作为EBNA1 DNA疫苗的佐剂,通过LIGHT的表达增强EBNA1特异性抗体的产生和T淋巴细胞活化,有效增强DNA疫苗的免疫效应。
1 材料与方法
1.1材料
1.1.1实验动物选择雌性Balb/c小鼠24只,年龄6~8周,无特定病原体级(SPF级),购自广东省医学实验动物中心。
1.1.2菌株与试剂大肠埃希菌DH5α及质粒pcD-NA3.1(+)和质粒pcDNA3.1-EBNA1为本实验室保存,限制性内切酶EcoRⅠ和HindⅢ、T4 DNA连接酶购自Takara公司,DNA Marker、蛋白Maker、质粒提取试剂盒和胶回收试剂盒购自北京全式金生物技术有限公司。
1.2方法
1.2.1LIGHT全长序列的PCR扩增根据LIGHT全长序列(239个氨基酸),利用软件Primer Premier 5.0进行引物设计。上游引物LIGHT-F:5′CCCAAGCTTGCCGCCACCATGGAGAGTGTGGTACAGCC 3′、下游引物LIGHTR:5′GGAATTCGACCATGAAAGCTCCGAAAT 3′;其中上游引物和下游引物分别添加HindⅢ和EcoRⅠ限制性酶切位点,引物均由Invitrogen公司合成。从Balb/c小鼠肝脏组织中提取总RNA,然后反转录合成cDNA;再以cDNA为模板,利用LIGHT特异性引物,进行PCR扩增,以小鼠肝脏cDNA为模板,扩增LIGHT膜外区全长。PCR反应体系(100 μL):5×Buffer 20 μL、dNTP mix 8 μL、DNA 6 μL、LA Taq酶1 μL、引物混合物4 μL、双蒸水61μL;反应参数为:95℃2min,95℃15s,68℃15s,72℃3 min,共35个循环,最后再72℃延伸8 min。采用琼脂糖凝胶电泳鉴定,并回收PCR产物。
1.2.2LIGHT重组质粒的构建和鉴定将1.2.1项回收的PCR产物和pcDNA3.1(+)质粒,利用限制性内切酶HindⅢ和EcoRⅠ分别进行酶切反应,再分别进行酶切产物琼脂糖凝胶电泳回收,然后分别将回收的酶切产物LIGHT以摩尔比6∶1的比例与pcDNA3.1(+)酶切产物混合,加入T4 DNA连接酶,22℃连接1 h,进行连接反应。将连接产物转化感受态DH5α,然后用含氨苄青霉素抗性的平板筛选阳性克隆,挑取阳性单克隆经菌落PCR和质粒双酶切鉴定后,送Invitrogen公司测序鉴定,最后大量抽提无内毒素的重组质粒。
1.2.3LIGHT蛋白的表达和鉴定将无内毒素pcDNA-LIGHT质粒利用jetPRIME转染试剂转染到生长密度已达80%的人源胚胎肾细胞(HEK)293 T细胞,在5%CO2、37℃条件下用10%胎牛血清(FBS)DEME培养基培养48 h后,分离和收集培养细胞,采用蛋白质免疫印迹法(Western blotting)分析并鉴定293 T细胞中LIGHT蛋白表达水平。
1.2.4电脉冲免疫方法和动物免疫SPF级Balb/c小鼠,随机分为四组(6只/组),先分别肌内注射EBNA1质粒DNA疫苗和LIGHT质粒佐剂混合液,每只每次剂量为50 μg;再利用NEPA GENE动物电转仪,在电压80 V、脉冲次数6次、脉冲间隔25 ms、频率2 Hz条件下电转刺激;于第0、2、4、6周观察免疫反应,第7周处死Balb/c小鼠,检测特异性细胞免疫和体液免疫应答。
1.2.5免疫小鼠血清分离和抗体滴度的检测
1.2.5.1血清制备分别在3、5、7周于Balb/c小鼠眼眶取血约100 μL,血样室温静置1 h,离心分离血清,血清样品保存于-20℃待测。
1.2.5.2血清中EBNA1抗体滴度的检测首先将原核表达纯化的EBNA1蛋白包被于微孔板,经封闭和洗涤后;将分离的血清倍比稀释分别加入到酶标板孔内,同时做阳性和阴性对照孔,37℃孵育;再经洗涤步骤后加入辣根过氧化物酶(HRP)标记的二抗,依次经过孵育和洗涤步骤后;加入3,3′,5,5′-四甲基联苯胺(TMB)底物显色液,孵育3 min后,加入2 mol/L硫酸溶液终止反应,于450 nm测定吸光度值。将免疫小鼠第3、5周的血清收集和分离后,利用酶联免疫吸附试验(ELISA)测定血清中EBNA1特异性抗体滴度。
1.2.6小鼠脾细胞悬液制备和细胞因子的检测
1.2.6.1小鼠淋巴细胞的制备(1)处死免疫的小鼠后,于75%乙醇中浸泡消毒,在无菌超净工作台进行操作;无菌条件下取出小鼠脾脏,置于DMEN无血清培养基中,研磨分散脾细胞,离心,弃上清液;(2)加入4℃预冷的红细胞裂解液(Tris1.3g,NH4Cl3.55g,定容至500mL,调节pH至7.2,高压灭菌,4℃保存备用),裂解后,离心,弃上清液;(3)加入无血清培养基洗涤细胞2次后,离心,弃上清液,再用含10%FBS的完全培养基重悬细胞,混匀;(4)在细胞计数仪中进行细胞计数,按照所得细胞数调整细胞浓度至每毫升1×107个;(5)最后每孔加入50μL制备的淋巴细胞,总体积200 μL(每孔细胞总数为5× 105个);实验组加入终浓度为1μg/mL的EBNA1蛋白(阳性对照不加蛋白),加入终浓度为1 μg/mL的ConA,阴性对照不加蛋白,然后加完全培养液。置于37℃CO2培养箱中培养36 h。
1.2.6.2细胞因子IFN-γ的检测将分离的细胞培养上清,严格按照IFN-γ检测试剂盒说明书,测定细胞表达分泌IFN-γ水平。
2 结 果
2.1LIGHT编码区全长基因的克隆及重组质粒载体的构建经琼脂糖凝胶电泳,可见720 bp大小的LIGHT片段(图1)。将PCR扩增产物回收后,经HindⅢ和EcoRⅠ双酶切后与真核表达载体pcDNA3.1(+)连接,构建重组质粒pcDNA3.1-LIGHT。LIGHT质粒转化大肠埃希菌感受态DH5α和筛选后,菌落PCR和双酶切鉴定结果(图2)显示,双酶切后的质粒在720 bp处有明显目的条带;质粒DNA测序结果进一步证明pcDNA3.1-LIGHT载体构建成功。

图1 PCR扩增LIGHT目的片段
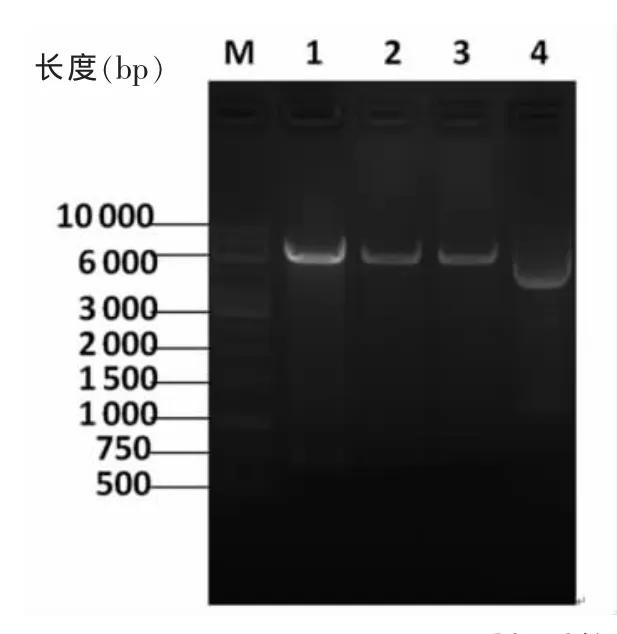
图2 LIGHT重组质粒的双酶切鉴定结果
2.2LIGHT真核载体在HEK 293T细胞中的表达
LIGHT编码区全长基因编码239个氨基酸,蛋白相对分子质量为26 340(单体且未糖基化时)。LIGHT质粒转染293T细胞后,分别收集细胞和培养上清液,蛋白质免疫印迹法结果显示,在蛋白Marker 26×103上方附近处显示单一清晰条带,与LIGHT的预期相对分子质量26 340相符;LIGHT真核表达载体在293T细胞中正确表达,且所表达的目的蛋白具有很好的免疫原性。见图3。

图3 LIGHT真核载体的表达鉴定
2.3LIGHT佐剂对EBNA1 DNA疫苗特异性抗体滴度的影响ELISA测定结果显示,单独的EBNA1 DNA疫苗能够产生特异性抗体,滴度达4.5×104,而加入LIGHT佐剂的DNA疫苗较单独的疫苗,其EBNA1特异性抗体滴度高2.6倍,抗体滴度达1.16×105,说明LIGHT佐剂能够增强DNA疫苗体液免疫应答。见图4。
2.4LIGHT佐剂对DNA疫苗细胞免疫应答的影响
免疫周期的第5周,将Balb/c小鼠处死,在无菌条件下分离脾淋巴细胞,以EBNA1蛋白作为特异性抗原刺激、ConA为阳性对照,测定DNA疫苗细胞免疫应答效应,同时也分析LIGHT佐剂的免疫增强效应。淋巴细胞经EBNA1蛋白刺激后,重组DNA疫苗免疫小鼠的淋巴细胞较阴性对照组具有更强分泌IFN-γ的能力,混合LIGHT佐剂的EBNA1DNA疫苗免疫组(LIGHT+EBNA1),其细胞因子IFN-γ分泌水平较EBNA1蛋白刺激免疫组提高1倍,也证实了LIGHT佐剂混合重组EBV DNA疫苗能提高疫苗的细胞免疫应答反应能力。见图5。

图4 不同免疫小鼠血清EBNA1特异性抗体滴度测定情况

图5 各组免疫小鼠脾淋巴细胞分泌IFN-γ水平测定情况
3 讨 论
EBV作为一种致瘤病毒,由于其感染的广泛性和普遍性,迫切需求EB病毒疫苗的研发,目前已初步研究出多种疫苗[12,16-17];选择更好的靶点、免疫方式和免疫佐剂,以最大限度地阻断EB病毒感染和杀伤感染细胞是EBV疫苗研究的发展方向。
DNA疫苗由于其易于改造、可塑性强、生产便捷、稳定性好、安全性高、运输方便,以及不仅能诱导机体体液免疫应答,还能增强细胞免疫应答等诸多优点而备受关注;在病毒性疾病和自身免疫性疾病等领域已经取得重大进展,并已有疫苗获批上市。免疫原性和有效性是DNA疫苗研发的重点和难度,在疫苗发挥免疫效应过程中,抗原提呈细胞(特别是树突状细胞)扮演着重要角色;因此,从促进树突状细胞功能角度出发,是提高DNA疫苗免疫效应的可行策略。
LIGHT与其功能性受体LTβR和HVEM结合[11,13,18]所介导的信号通路是树突状细胞数量的维持和迁移的重要基础,能够诱导树突状细胞的成熟[19-20],促进其抗原提呈能力,从而增强机体的细胞免疫应答[5,14](包括刺激T细胞的增殖和分化、细胞因子IFN-γ的分泌);此外,LIGHT还可促进B淋巴细胞的分化及特异性IgG 和IgM的产生,增强机体的体液免疫应答[14]。
电脉冲免疫方法[21]是利用电脉冲的作用首先在细胞质膜上形成亲水性的孔,增加质膜的通透性,以便于质粒DNA借助电泳作用进入细胞。有研究表明,电脉冲免疫法能够显著提高DNA进入细胞的数量,从而提高质粒的细胞转染率;进而增加目的蛋白的表达,有研究表明,电脉冲免疫方法比纯DNA注射,其目的蛋白表达增加100~1 000倍[7],有效增强DNA疫苗的免疫原性,表现为高抗体滴度和特异性T细胞应答增加。
本研究结果也证实了混合LIGHT的EBNA1 DNA疫苗所诱导的体液免疫应答和细胞免疫应答均显著高于单独的EBNA1DNA疫苗。因此,LIGHT有望成为EBNA1 DNA疫苗的免疫佐剂,为开发EBV相关肿瘤和疾病的治疗性疫苗奠定基础。
[1]Cohen JI.Epstein-barr virus vaccines[J].Clin Transl Immunology,2015,4(1):e32.
[2]Thompson MP,Kurzrock R.Epstein-barr virus and vancer[J].Clin Cancer Res,2004,10(3):803-821.
[3]Rowe M,Lear AL,Croom-Carter D,et al.Three pathways of epstein-barr virus gene activation from EBNA1-positive latency in B lymphocytes[J]. J Virol,1992,66(1):122-131.
[4]Sivachandran N,Wang X,Frappier L.Functions of the Epstein-Barr virus EBNA1 protein in viral reactivation and lytic infection[J].J Virol,2012,86(11):6146-6158.
[5]Jiang W,Chen R,Kong X,et al.Immunization with adenovirus LIGHT-engineered dendritic cells induces potent T cell responses and therapeutic immunity in HBV transgenic mice[J].Vaccine,2014,32(35):4565-4570.
[6]Kanodia S,Da Silva DM,Karamanukyan T,et al.Expression of LIGHT/ TNFSF14 combined with vaccination against human papillomavirus Type 16 E7 induces significant tumor regression[J].Cancer Res,2010,70(10):3955-3964.
[7]Sardesai NY,Weiner DB.Electroporation delivery of DNA vaccines:prospects for success[J].Curr Opin Immunol,2011,23(3):421-429.
[8]Mir LM,Bureau MF,Gehl J,et al.High-efficiency gene transfer into skeletal muscle mediated by electric pulses[J].Proc Natl Acad Sci USA,1999,96(8):4262-4267.
[9]杨海燕,陈光明,崔一民,等.电脉冲介导的治疗性双质粒HBV DNA疫苗的临床安全性及免疫原性研究[J].解放军医学杂志,2013,38(3):204-209.
[10]Tamada K,Shimozaki K,Chapoval AI,et al.LIGHT,a TNF-like molecule,costimulates T cell proliferation and is required for dendritic cell-mediated allogeneic T cell response[J].J Immunol,2000,164(8):4105-4110.
[11]Zhai Y,Guo R,Hsu TL,et al.LIGHT,a novel ligand for lymphotoxin beta receptor and TR2/HVEM induces apoptosis and suppresses in vivo tumor formation via gene transfer[J].J Clin Invest,1998,102(6):1142-1151.
[12]Cohen JI,Mocarski ES,Raab-Traub N,et al.The need and challenges for development of an Epstein-Barr virus vaccine[J].Vaccine,2013,31 Suppl 2:B194-196.
[13]Pasero C,Speiser DE,Derré L,et al.The HVEM network:new directions in targeting novel costimulatory/co-inhibitory molecules for cancer therapy[J].Curr Opin Pharmacol,2012,12(4):478-485.
[14]Duhen T,Pasero C,Mallet F,et al.LIGHT costimulates CD40 triggering and induces immunoglobulin secretion;a novel key partner in T celldependent B cell terminal differentiation[J].Eur J Immunol,2004,34(12):3534-3541.
[15]李权,李涛,李瑞鹏,等.CD258(LIGHT)在肿瘤免疫治疗中的研究进展[J].细胞与分子免疫学杂志,2016,31(1):118-121.
[16]Cui X,Cao Z,Sen G,et al.A novel tetrameric gp350 1-470 as a potential Epstein-Barr virus vaccine[J].Vaccine,2013,31(30):3039-3045.
[17]Hui EP,Taylor GS,Jia H,et al.Phase I trial of recombinant modified vaccinia ankara encoding Epstein-Barr viral tumor antigens in nasopharyngeal carcinoma patients[J].Cancer Res,2013,73(6):1676-1688.
[18]Del Rio ML,Fernandez-Renedo C,Scheu S,et al.Therapeutic blockade of LIGHT interaction with herpesvirus entry mediator and lymphotoxin β receptor attenuates in vivo cytotoxic allogeneic responses[J].Transplantation,2014,98(11):1165-1174.
[19]Holmes TD,Wilson EB,Black EV,et al.Licensed human natural killer cells aid dendritic cell maturation via TNFSF14/LIGHT[J].Proc Natl Acad Sci USA,2014,111(52):E5688-5696.
[20]Morel Y,Truneh A,Sweet RW,et al.The TNF superfamily members LIGHT and CD154(CD40 Ligand)costimulate induction of dendritic cell maturation and elicit specific CTL activity[J].J Immunol,2001,167(5):2479-2486.
[21]Lin F,Shen X,McCoy JR,et al.A novel prototype device for electroporation-enhanced DNA vaccine delivery simultaneously to both skin and muscle[J].Vaccine,2011,29(39):6771-6780.
Study on immune effect of LIGHT as adjuvant of EBNA1 DNA vaccine
Lu Xiaohua1,2,Zou Junhui2,Zheng Wei2,Yang Jian-
she1,WangPu2△(1.CollegeofLifeScience,NorthwestNormalUniversity,Lanzhou,Gansu730070,China;2.InstituteofBiomedicine and Biotechnology,Shenzhen Institutes of Advanced Technology,Chinese Academy of Sciences,Shenzhen,Guangdong 518055,China)
ObjectiveTo study the effect of LIGHT as an adjuvant in the immune responses induced by EB viral nuclear antigen1(EBNA1)DNA vaccine.MethodsThe liver cDNA of Balbc/c mouse served as the template.The eukaryotic expression vector pcDDNA3.1-LIGHT was constructed by PCR amplification;the cell transfection was conducted,the LIGHT protein expression was verified;by adopting the electric pulse method,the mouse was immunized with the LIGHT plasmid as the adjuvant combined with EBV DNA vaccine.The specific antibody of serum EBNA1 was detected.The mouse spleen lymphocytes were separated and collected.After stimulation by EBNA1 antigen,cytokine IFN-γ secretion level was detected.ResultsThe LIGHT target fragment was amplified by PCR,which was about 720 bp,the Western blot identification results showed that a single clear target band was above 26×103,demonstrating that LIGHT protein was expressed;the serum detection results in the immune mouse showed that the antibody titer in the LIGHT combined DNA vaccine experimental group was 3 times of that in the single DNA vaccine immune group;the spleen lymphocyte factor detection results showed that the LIGHT combined immune group could significantly increase the IFN-γ secretion.ConclusionLIGHT as the adjuvant has significant promoting effect in the generation of antibody and secretion of related cytokines by depending on its mediated signal pathway.
Herpesvirus 4,human;Vaccines,DNA;Adjuvants,immunologic;LIGHT;Electroporation
10.3969/j.issn.1009-5519.2016.11.006
A
1009-5519(2016)11-1618-04
卢晓华(1990-),硕士研究生,主要从事病毒疫苗的研究。
△
,E-mail:pu.wang@siat.ac.cn。
(2016-02-21)
