绿咖啡豆中绿原酸的分离纯化
2016-09-02张由明章银军沈雪亮
张由明,章银军,沈雪亮
(浙江工业大学生物工程学院,浙江杭州310014)
绿咖啡豆中绿原酸的分离纯化
张由明,章银军,沈雪亮
(浙江工业大学生物工程学院,浙江杭州310014)
对未烘焙绿咖啡豆中绿原酸的分离纯化进行深入研究。采用热水重复分批浸提法,在单因素实验基础上,采用Box-Behnken中心组合实验设计响应面分析法,获得了绿咖啡豆中绿原酸的最佳提取条件:温度79.8℃,溶剂pH值2.8,料液比1∶6,提取时间3.0 h,绿原酸的最大提取得率为92.0%。比较了多种不同规格的树脂对绿原酸的分离纯化效果,最终选用XDA-8大孔树脂,在优化后的最适工艺条件下,绿原酸含量可达70.9%,回收率达85.4%。进一步采用高效液相制备色谱获得了高纯度(95.2%)的绿原酸。所建立的绿原酸制备工艺操作简便、高效环保,产品功效明确,具有良好的市场应用前景。
绿原酸;绿咖啡豆;提取;纯化;树脂
绿咖啡豆是茜草科植物咖啡树的种子,含有丰富的活性物质[1],其中绿原酸及其同系物是咖啡豆主要的多酚类活性成分,在新鲜咖啡豆中含量占2%~8%[2]。绿原酸是植物体有氧呼吸代谢的产物[3],具有多种生物活性,如心血管保护作用、抗氧化作用、抗诱变及抗癌作用、抗菌作用、抗病毒作用、降脂降糖作用、免疫调节作用等[4-7],在医药、化工和食品等领域都具有广泛的应用。美国科学家最新研究认为,绿咖啡豆提取物具有良好的减肥、降血压功能[8-9],目前以绿咖啡豆提取物为主要成分的多种保健品已大量推向市场。
目前文献中用于提取绿原酸的底物主要有金银花[10-12]和杜仲叶[13-15],而少有从绿咖啡豆中提取绿原酸并进行应用性试验的报道。通过前期对比实验发现:采用醇提取工艺需要消耗大量的乙醇;酶法提取常常由于受到提取温度和pH值的限制,使绿原酸得率偏低;而水提法既克服了消耗乙醇产生的成本问题,又可以通过调节温度和溶剂pH值来提高绿原酸得率。所以实验是以绿咖啡豆中绿原酸为研究对象,应用响应面法优化水提工艺条件,进一步采用大孔树脂和高效液相制备色谱分离、纯化绿原酸[16-18],旨在建立一条操作简单、得率较高、绿色环保的绿原酸提取分离纯化工艺流程,为绿咖啡豆中绿原酸的工业化生产及应用奠定良好的基础。
1 材料与方法
1.1材料
绿咖啡豆(Coffee arabica):未经烘焙,由浙江天草生物科技有限公司提供。
大孔树脂:型号分别为D101、XDA-8、LSA-10、LSA-21、HZ-806、HZ-816、HZ-818、AB-8、HPD-850、D4020、NKA-9、DM-130。
1.2方法
1.2.1绿原酸提取工艺
按照下述工艺流程,提取次数为3次,每次2 h,料液比1∶8(W/V),温度80℃,pH值为3,分别考察温度(65、70、75、80、85、90℃)、溶剂pH值(2、3、4、5、6、7)、料液比(1∶2、1∶4、1∶6、1∶8、1∶10)、提取时间(1、2、3、4、5 h)等因素对绿原酸得率的影响。
工艺流程:磷酸氢二钠-柠檬酸缓冲液提取→过滤→合并提取液→称量体积→液相检测含量
1.2.2响应面法试验设计
利用响应面法,采用Box-Benhnken模型,对提取条件进行优化。以提取得率作为响应值,设计因素及水平见表1。
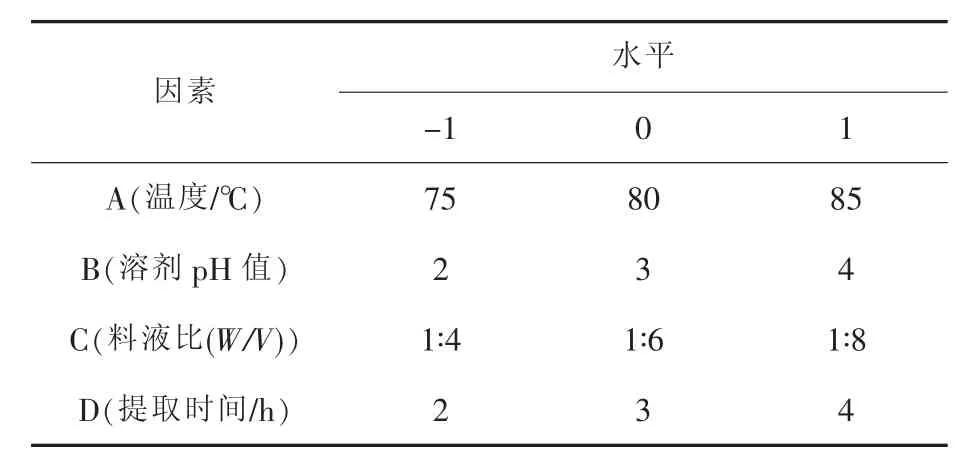
表1 响应面设计因素及水平
1.2.3绿咖啡豆提取液中绿原酸的纯化
1)不同树脂对绿原酸的静态吸附和解析性能比较:选取12种不同规格的大孔树脂,预处理后分别准确称取1.0 g于50mL锥形瓶中,分别加入20mL已知绿原酸含量的绿咖啡豆提取液,在25℃、200 r/min的恒温振荡器中振荡24 h,吸附完成后过滤,测定滤液中绿原酸的含量,计算各树脂的吸附量和吸附率;将静态吸附饱和的树脂放入50 mL锥形瓶中,分别加入70%的乙醇20 mL,同上条件下振荡24 h,待解析完全后过滤,测定滤液中绿原酸的含量,计算各树脂的解析量和解析率。每种树脂进行3次重复实验,计算其平均值。
2)大孔树脂XDA-8对绿原酸的动态吸附和解析工艺研究:准确称取10 g XDA-8大孔树脂,经预处理后湿法装入16 mm×300 mm的玻璃层析柱中作为吸附柱,使用前用超纯水冲洗至无醇味,动态上样吸附,乙醇解析纯化绿咖啡豆提取液中的绿原酸,对不同的工艺条件进行优化。
1.2.4绿原酸含量测定
1)色谱条件:绿原酸含量的测定采用高效液相色谱法(HPLC)。检测条件:ODS-C18色谱柱(Welchrom 5μm,4.6mm×250mm);流动相A:V(乙腈)∶V(水)∶V(甲酸)=250∶750∶1;流动相B:V(乙腈)∶V(水)∶V(甲酸)=100∶900∶1;采用梯度洗脱(0~2min,保持溶液B 100%不变;2~25min,溶液B 100%~0%;25~28min,溶液B 0%不变;28~30 min,溶液B 0%~100%;30~35 min,溶液B 100%不变);柱温:25℃;进样:10μL;流速:1mL/ min;检测波长:327 nm。
2)标准曲线制定:准确称取绿原酸标准品14.4 mg,用50%甲醇稀释成28.8、57.6、86.4、115.2、144μg/mL梯度浓度标样,HPLC检测,制作标准曲线得到回归方程:y=29 570x-190 000。
3)绿原酸提取得率计算:依据HPLC色谱条件进行检测,分别检测绿咖啡豆原料及提取液中绿原酸的含量,按照以下公式计算绿原酸的提取得率。
1.2.5吸附量和解析量计算方法
式中:Q为吸附量(mg/g);a为吸附率(%);C0为起始浓度(mg/mL);Cv为滤液浓度(mg/mL);V1为溶液体积(mL);W为树脂质量(g)(此计算方法假设吸附前后体积不变);Q2为解析量(mg/g);C2为解析液浓度(mg/mL);V2为解析液体积(mL);b为解析率(%)。
1.2.6高纯度绿原酸分离纯化
采用ODS-BP-L,SP-120-15柱,以乙腈和0.4%磷酸溶液按体积比12∶88混合成的溶液为流动相,控制流速为4 mL/min,进样10 mL浓缩液制备高纯度绿原酸。分段收集流出液,并液相检测。
2 结果与讨论
2.1绿原酸提取工艺研究
2.1.1单因素实验结果
实验比较了温度、溶剂pH、料液比和提取时间对绿原酸提取得率的影响,结果见图1。由图1 (a)可知:由于绿原酸的邻二酚羟基结构不稳定,高温加热易氧化分解,所以随着提取温度的升高,绿原酸提取得率先升后降;由图1(b)可知:随着溶剂pH值的上升,绿原酸的提取得率先升高后降低,这是由于绿原酸本身是一种有机酸,酸性条件有利于绿原酸的提取,而酸性太强会造成绿原酸的酸解;由图1(c)可知:随着料液比的比值降低,绿原酸提取得率逐渐达到最大值;由图1(d)可知:由于绿原酸结构的不稳定性,长时间的高温会使一部分绿原酸分解。综合考虑温度、溶剂pH、料液比和提取时间对绿原酸提取得率的影响,确定进行响应面试验因素提取条件范围为:提取温度75~85℃,溶剂pH值2~4,料液比1∶4~1∶8,提取时间2~4 h。
2.1.2响应面实验
运用Design-Expert软件,对绿咖啡豆中绿原酸提取得率显著性影响进行响应面分析,Box-Behnken设计试验结果见表2,得到绿咖啡豆中绿原酸提取得率(Y)的多元二次回归模型:Y= 91.76-1.55A-2.48B+0.16C+0.97D-5.67AB+2.39AC-2.41AD-0.27BC+5.10BD+1.94CD-6.06A2-6.33B2-1.37C2-4.83D2(R2=0.9212)
式中:A为提取温度;B为溶剂pH值;C为料液比;D为提取时间;Y为绿原酸提取得率。
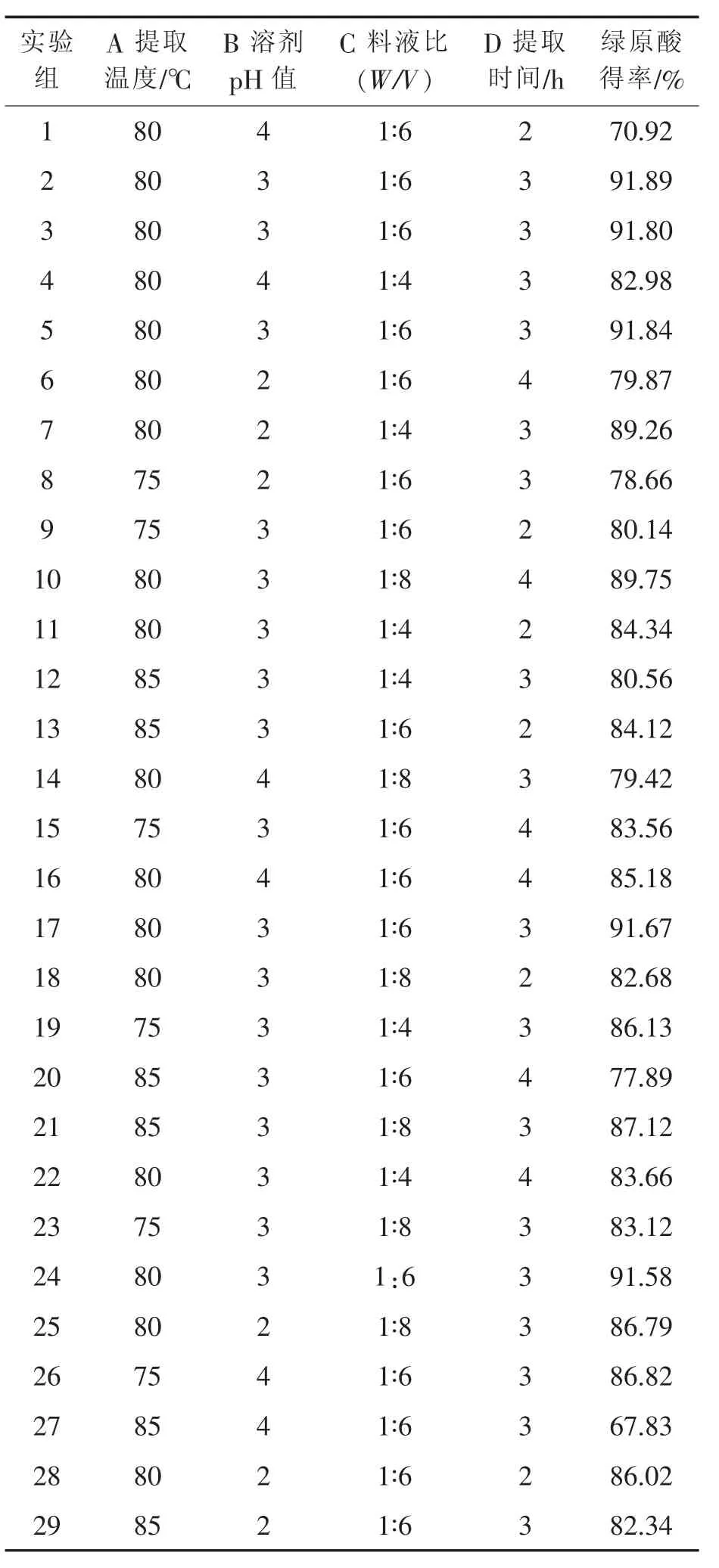
表2 Box-Behnken设计试验结果
实验结果的方差及显著性分析(表3)的结果表明:A、B、AB、BD、A2、B2、D2因素影响显著(p< 0.05),即提取温度与pH、pH与提取时间交互作用是影响绿咖啡豆中绿原酸提取的显著因素。
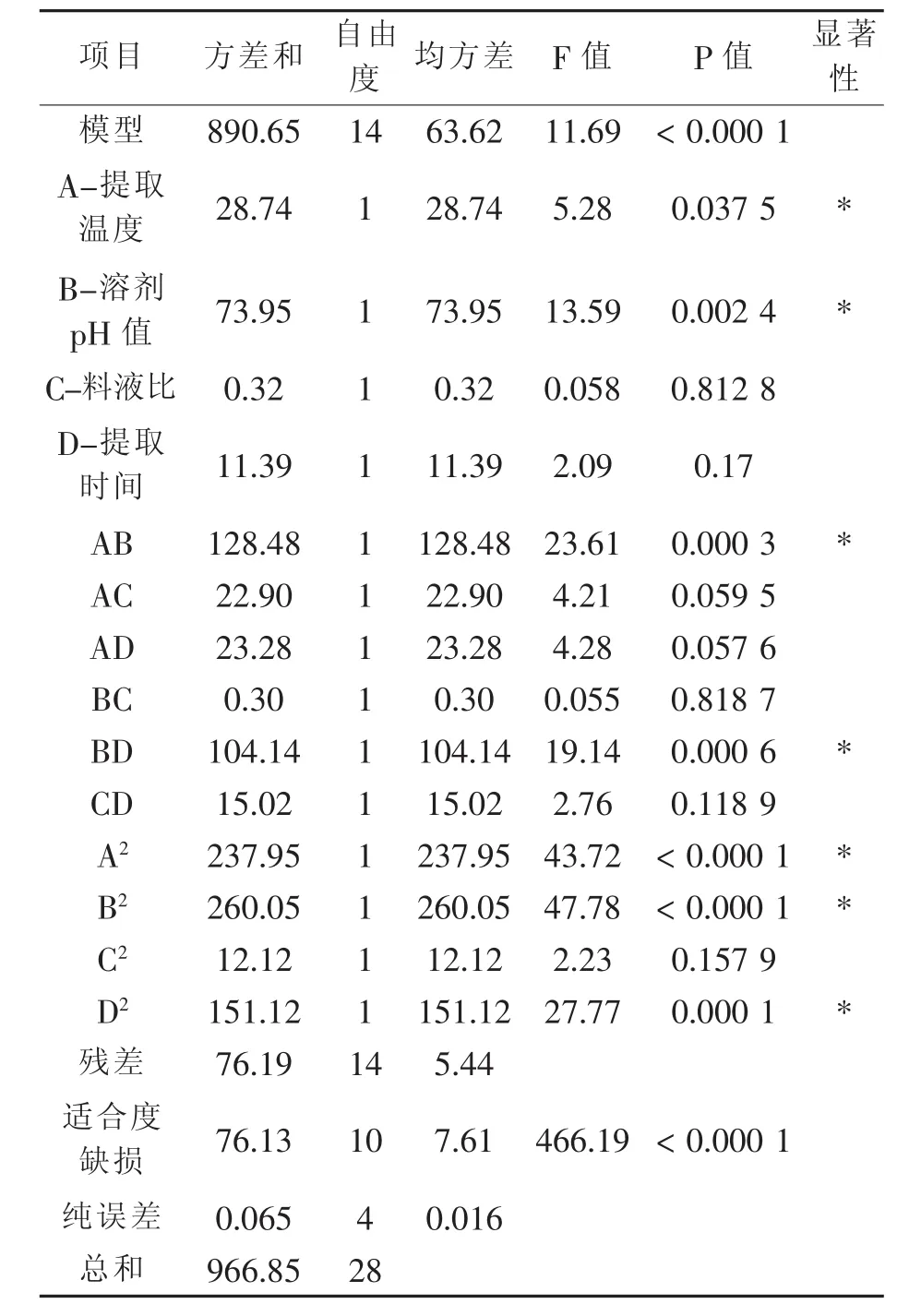
表3 回归模型方程的方差分析
利用Box-Behnken试验得到的回归模型对应的响应面及等高线图可以用于评价试验因素对绿咖啡豆中绿原酸提取得率影响的两两交互作用以及确定各个因素的最佳水平范围。
图2表明:固定提取温度,绿原酸提取得率随着溶剂pH值的变化先增加后降低,pH过高降低了绿原酸在溶剂中的溶解度,导致提取绿原酸得率降低;固定提取溶剂pH,绿原酸提取得率随着提取温度的变化先增加后减小。图3表明:提取时间延长有利于提高绿原酸提取得率,但由于绿原酸结构的不稳定性,长时间高温提取会使部分绿原酸结构裂解进而降低绿原酸的提取率。图2和图3的等高线图均呈现椭圆形,说明提取温度与pH、pH与提取时间的交互作用较强,影响显著。
根据所建立的模型进行参数最优分析,得出绿咖啡豆中绿原酸提取得率最高的参数条件为提取温度79.8℃,溶剂pH值2.8,料液比1∶6,提取时间3.0 h,在此条件下绿原酸提取得率预测值为92.0%。为方便试验将参数修改为:提取温度80℃、pH 3、料液比1∶6、提取时间3 h,用于验证实验,实测绿原酸提取得率为91.9%,基本与预测值保持一致。
2.2绿咖啡豆提取液中绿原酸的分离纯化
2.2.1不同树脂对绿原酸的静态吸附和解析性能比较
12种不同规格的大孔树脂,在同等条件下,经过24 h吸附和24 h乙醇解析,过滤后测定滤液中绿原酸的含量,每种树脂3次重复实验,计算各树脂的吸附量和吸附率平均值,以及对应树脂解析量和解析率的平均值,结果见表4。
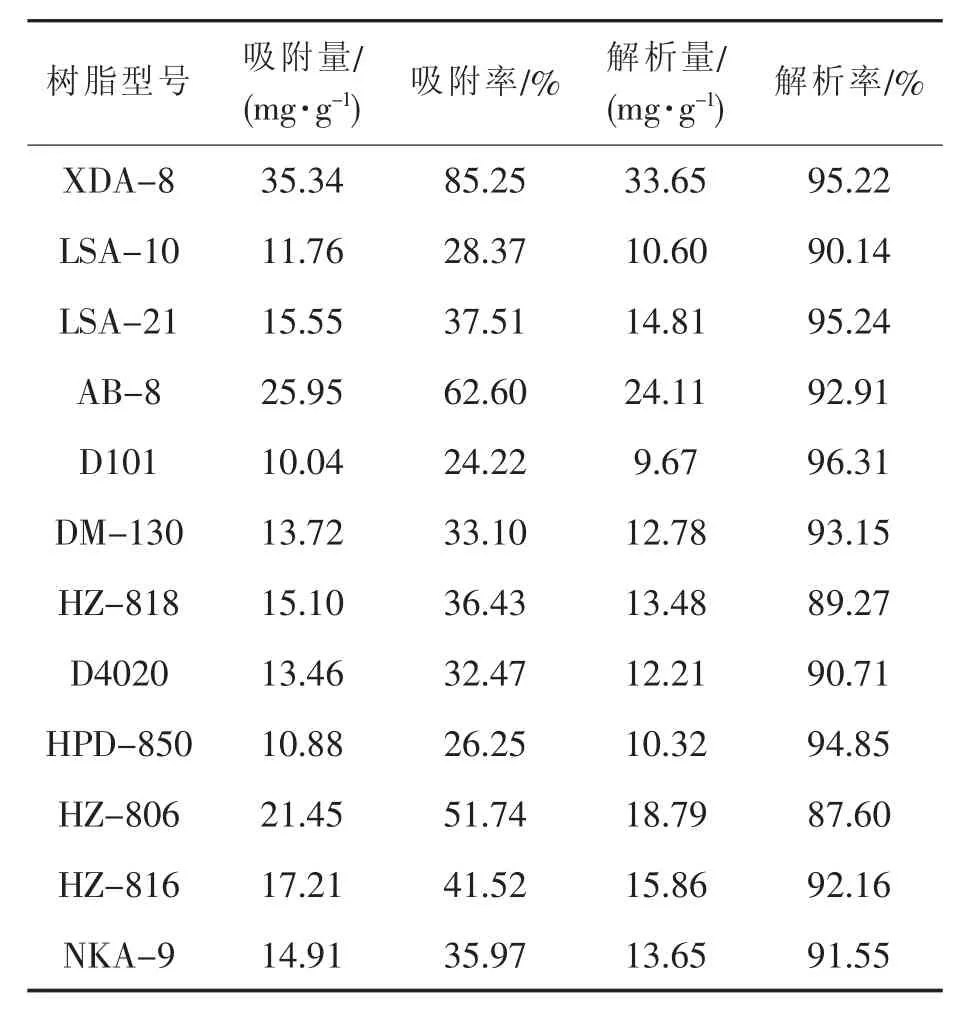
表4 12种大孔树脂对绿原酸的静态吸附和解析性能的比较分析
由表4可知:上述各种大孔树脂对绿原酸都有一定的吸附量,其中XDA-8、AB-8等树脂的吸附率较大,XDA-8的吸附率达85.3%,用70%乙醇对大孔吸附树脂进行解析,XDA-8、LSA-21、D101三种树脂的解析率均达到95%以上,其中XDA-8的解析率达95.2%,评估12种大孔树脂吸附和解析性能,XDA-8综合性能最佳。因此对于绿咖啡豆提取液中的绿原酸纯化工艺而言,大孔树脂XDA-8较为适宜。
2.2.2大孔树脂XDA-8对绿原酸的动态吸附和解析工艺研究
用预处理过的10 g XDA-8树脂,湿法装入16 mm×300mm的玻璃层析柱作为吸附柱,使用前用超纯水冲洗至无醇味,动态上样吸附,乙醇解析纯化绿咖啡豆提取液中的绿原酸,对不同的工艺条件进行优化,选取上柱液浓度(7、8、9、10、11、12 mg/mL)、上柱流速(1、2、3、4 BV/h)、解析用乙醇浓度(10%、20%、30%、40%、50%、60%、70%、80%、90%)、解析用乙醇用量(2、3、4、5、6 BV)、解析乙醇流速(1、2、3、4、5 BV/h)等进行考察,结果如图4和图5所示。优化后得到最佳动态吸附和解析工艺条件为:上柱液浓度为10 mg/mL,上样流速2 BV/h,解析用乙醇浓度为70%,解析用乙醇用量5 BV,解析乙醇流速3 BV/h。
在上述动态吸附和解析纯化绿原酸的最佳工艺条件下,进行了三次重复验证实验,结果显示:XDA-8大孔树脂的吸附量平均达35.5mg/mL,解析率平均可达95.3%,产品含量平均可达70.9%,回收率平均可达85.4%,该工艺重复稳定性好,产品纯度和回收率都较高。
2.3高纯度绿原酸制备
绿咖啡豆提取液通过XDA-8树脂分离纯化后,纯度为70.9%,为了得到高纯度绿原酸,将树脂分离纯化后的绿原酸溶液旋转蒸发浓缩,用于高效液相制备色谱进样,结果如图6。用高效液相色谱检测液相分段收集液,120 min处收集的绿原酸溶液纯度达到95.2%。
3 结论
通过对绿咖啡豆中绿原酸提取条件的单因素和响应面优化实验结果分析,建立绿原酸提取得率回归方程,结果表明提取温度、溶剂pH值、料液化、提取时间这4个因素都对绿原酸提取得率影响显著,R2=0.921 2,模型拟合度好。确定出的最佳提取工艺参数为提取温度79.8℃,pH 2.8,料液比1∶6,提取时间3.0 h。修改试验参数条件下,实测绿原酸提取得率为91.9%,证明优化得实验条件可行。
XDA-8大孔树脂对绿咖啡豆提取液中的绿原酸具有良好的吸附性,能较好地分离纯化绿原酸,最大吸附量平均可达35.5 mg/mL。最佳动态吸附和解析工艺条件为上柱液浓度为10mg/mL,上样流速2 BV/h,解析用乙醇浓度为70%,解析用乙醇用量5 BV,解析乙醇流速3 BV/h,经HPLC检测,绿原酸含量可达70.9%,回收率可达85.4%。XDA-8树脂吸附解析后,通过液相制备色谱即可得纯度为95.2%的绿原酸,冷冻干燥得高纯度绿原酸晶体,确为绿原酸纯品。
综上所述,本文建立一条操作简单、得率较高、绿色环保的绿原酸提取分离纯化工艺流程。
[1]龙文静.咖啡豆中咖啡因与绿原酸的研究进展[J].广西轻工业,2010(1):1-2.
[2]杜延兵,裘爱泳.绿原酸生物活性、资源及其提取纯化[J].现代食品科技,2006,22(2):250-252.
[3]LALLEMAND L A,MCCARTHY JG,MCSWEENEY S,et al. Purification,crystallization and preliminary X-ray diffraction analysis of a hydroxycinnamoyl-CoA shikimate/quinate hydroxycinnamoyltransferase(HCT)from Coffea canephora involved in chlorogenic acid biosynthesis[J].Genetics,2008,178 (4):2315-2326.
[4]KANG Juan,LIU Yuan,XIE Mengxia,et al.Interactions of human serum albumin with chlorogenic acid and ferulic acid[J]. Biochimica et biophysica acta(BBA)-general subjects,2004,1674(2):205-214.
[5]SATO Y,ITAGAKI S,KUROKAWA T,et al.In vitro and in vivo antioxidant properties of chlorogenic acid and caffeic acid [J].International journal of pharmaceutics,2011,403(s 1/2):136-138.
[6]WOOSANG S,DONGGUN L,BAIFW,et al.Antifungal action of chlorogenic acid against pathogenic fungi,mediated by membrane disruption[J].Pure and applied chemistry,2010,82 (1):219-226.
[7]ONG KW,HSU A,TAN B K H.Anti-diabetic and anti-lipidemic effects of chlorogenic acid are mediated by ampk activation[J]. Biochemicalpharmacology,2013,85(9):1341-1351.
[8]AIDILLA M,HODGSON J M,CONSIDINE M J,et al. Supplementation of a high-fat diet with chlorogenic acid is associated with insulin resistance and hepatic lipid accumulation in mice[J].Journal of agricultural and food chemistry,2013,63 (6):4371-4378.
[9]JOKURA H,WATANABE I,UMEDA M,et al.Coffee polyphenol consumption improves postprandial hyperglycemia associated with impaired vascular endothelial function in healthy male adults[J].Nutrition research,2015,35(10):873-881.
[10]薛满,游本刚.正交试验设计比较金银花药材中绿原酸与木犀草苷的水提工艺[J].南京中医药大学学报,2012,28(6):591-593.
[11]单磊,达超超,呼延晓颖,等.金银花中绿原酸提取工艺研究[J].饮料工业,2010,13(4):23-25.
[12]刘佳佳,赵国玲,章晓骅,等.金银花绿原酸酶法提取新工艺研究[J].中成药,2002,24(6):416-418.
[13]杨秀芳,汪洋,马养民.杜仲叶中绿原酸的提取分离及结构鉴定[J].食品研究与开发,2013,34(4):32-34.
[14]赵亚洲,达超超,刘军海.回归正交法优化杜仲叶中绿原酸提取工艺研究[J].化工科技市场,2010,33(11):34-37.
[15]戴瑜,李姣娟,周尽花,等.半纤维素酶法提取杜仲叶绿原酸[J].林业科技开发,2009,23(3):96-99.
[16]卢定强,洪声,王俊,等.多级柱系统吸附分离金银花水提液中绿原酸的研究[J].食品与发酵工业,2009(1):164-168.
[17]ZHANG Bin,YANG Ruiyuan,ZHAO Yan,et al.Separation of chlorogenic acid from honeysuckle crude extracts by macroporous resins[J].Journal of chromatography B,2008,867 (2):253-258.
[18]XIANG Zhinan,ZHAN Yu,NING Zhengxiang.Purification of chlorogenic acid in Flos Loniceraewith system of polar ordered resins[J].Journalof central south university of technology,2007,14(3):357-362.
(责任编辑:朱小惠)
Studies on separation and purification of chlorogenic acid from green coffee beans
ZHANG Youming,ZHANG Yinjun,SHEN Xueliang
(College of Biotechnology and Bioengineering,Zhejiang University of Technology,Hangzhou 310014,China)
The separation and purification processes of chlorogenic acid from green coffee beans were studied.On the basis of single-factor experiments,hot water extraction of chlorogenic acid was optimized by response surfacemethodology.The results showed that the chlorogenic acid yield was significantly affected by the four factors,and the optimum extraction conditions were temperature 79.8℃,solvent pH 2.8,solid/liquid ratio 1∶6 and extraction time 3.0 h.Themaximum extraction yield of chlorogenic acid was 92.0%.The experiments on screening of different resins showed that XDA-8 resin had best efficiency in chlorogenic acid separation and purification. Under the optimized conditions,chlorogenic acid content and recovery reached 70.9%and 85.4%,respectively.Preparative high performance liquid chromatography was used to obtain high purity (95.2%)of chlorogenic acid from green coffee bean extract.The established preparation process of chlorogenic acid had the advantages of simple,efficientand environmentally friendly
chlorogenic acid;green coffee beans;extraction;purification;resin
Q946.81
A
1674-2214(2016)03-0140-07
2016-04-21
张由明(1988—),男,河南开封人,硕士,主要从事天然原料提取纯化及应用方面的研究,E-mail:zyming168 @126.com.通信作者:沈雪亮副教授,E-mail:shenxl_pat@aliyun.com.
