性激素三孢酸在类胡萝卜素生产菌三孢布拉氏霉中的合成代谢研究进展
2016-08-22张晓晖苏思思王文雅袁其朋
张晓晖,苏思思,王文雅,袁其朋,李 强
(1北京化工大学生命科学与技术学院,北京 100029;2清华大学化学工程系,北京 100084)
性激素三孢酸在类胡萝卜素生产菌三孢布拉氏霉中的合成代谢研究进展
张晓晖1,苏思思1,王文雅1,袁其朋1,李强2
(1北京化工大学生命科学与技术学院,北京 100029;2清华大学化学工程系,北京 100084)
类胡萝卜素是重要的精细化学品,三孢布拉氏霉是发酵法生产类胡萝卜素的常用菌种。近年来研究者对影响三孢布拉氏霉类胡萝卜素产量的影响因素做了大量的研究,结果显示三孢酸是最重要的影响因子之一。本文根据国内外研究进展,从发酵法生产类胡萝卜素的研究现状、三孢酸类化合物的结构及其生理功能、三孢酸合成途径研究及三孢酸合成途径中的分子机制等几个方面做了综述报告。
三孢酸;三孢布拉氏霉;类胡萝卜素;毛霉目真菌;β-胡萝卜素
DOI:10.11949/j.issn.0438-1157.20151591
三孢酸是1,1,3-三甲基-2-(3-甲基辛基)环己烷的不饱和氧化衍生物,是二萜类或类胡萝卜素降解时产生的倍半萜类物质,为三孢布拉氏霉、布拉克须霉(Phycomyces blakesleanus)和高大毛霉(Mucor mucedo)等毛霉目真菌的性激素[4],具有诱导菌体分化、刺激孢子形成及调控类胡萝卜素合成等生理功能[5]。三孢布拉氏霉产三孢酸的能力远大于其他毛霉目真菌,因此成为研究三孢酸代谢的模式菌株。在发酵开始或中途加入纯化或未纯化的外源性三孢酸,可以显著提高类胡萝卜素产量[6],作为一种发酵促进剂,三孢酸分离提取和生物合成的研究引起了广泛关注[7]。三孢酸的生物合成是一个十分复杂的过程,涉及到多种代谢产物并且伴随有菌体生理和形态上的变化,其代谢途径的探明对提高类胡萝卜素产量有重要意义。目前三孢酸代谢途径的研究主要集中在国外,国内对这一领域的研究报道相对较少,本文总结分析了近几年的相关研究,着重报道了三孢酸代谢途径的最新研究进展。
1 三孢布拉氏霉发酵产类胡萝卜素的研究概况
1.1产类胡萝卜素的微生物种类
微生物发酵法是生产天然类胡萝卜素的发展方向,目前在这方面研究最多的色素有β-胡萝卜素(β-carotene)、番茄红素(lycopene)和虾青素(astaxanthin)等。可利用的微生物种类包括细菌、藻类、真菌和酵母菌,其中真菌的生产代表菌种是三孢布拉氏霉[8]和布拉克须霉[9],细菌有红螺菌(Rhodospirillum rubrum)[10],酵母有深红酵母(Rhodotorula glutinis)[11],微藻类有杜氏藻类(Dunaliella)[12]。近年来,随着生物技术的发展,一些本身不产色素的微生物,如大肠杆菌(Escherichia coli)[13]和酿酒酵母(Saccharomyces cerevisiae)[14]等,通过基因工程改造后也可用于生产类胡萝卜素。关于产类胡萝卜素的微生物种类及相关色素产量的研究,Chandi等[8]和Barredo[15]的综述中已做了较为详细的归纳和总结,本文不再详述。
用于生产类胡萝卜素的4类微生物(细菌、藻类、真菌和酵母菌)在生产中各有利弊,如在工业生产中的提取色素阶段,酵母菌破壁难度要大于其他3种微生物[16];而杜氏藻类的发酵时间偏长(10 d以上)且在发酵过程中需要严格控制盐度和光照两个条件[12];利用细菌生产类胡萝卜素需要解决遗传稳定性的问题;而三孢布拉氏霉菌的发酵过程相对复杂,需要(+)/(-)菌分别培养然后再混合色素才可以大量积累,但是三孢布拉氏霉具有生长迅速、生物量大、类胡萝卜素产量高(4~5 g·L-1)等明显优势[8],因而可以作为工业菌种且已应用于类胡萝卜素的规模化工业生产中。
1.2影响三孢布拉氏霉类胡萝卜素产量的因素

图1 三孢酸对类胡萝卜素和麦角固醇合成的调控Fig.1 Scheme of regulation of carotenoid and ergosterol synthesis
三孢布拉氏霉是工业上生产类胡萝卜素的主要菌种,自1960年以来,研究者陆续对影响三孢布拉氏霉类胡萝卜素产量的因素开展了广泛研究,在Lampila等[17]和Bhosale[18]的综述中已对这些因素做了较为详细的总结。虽然影响三孢布拉氏霉类胡萝卜素产量的因素众多,但最终可归纳为两大类:环境因素(包括光照、氧气、pH、温度等)和添加物(包括金属盐、三羧酸循环中间产物、抗氧化剂、氧载体、表面活性剂和性激素三孢酸等)[18-23]。研究和实践表明,在优化好的培养基中添加一些化合物对于促进发酵和提高目标产物产量具有事半功倍的效果。迄今研究者还在不断探索和合成新的化合添加物,且发现在众多化合物中,三孢酸对类胡萝卜素产量影响最大(可使类胡萝卜产量增加349%)[19]。目前对三孢酸能大幅刺激类胡萝卜素合成的详细机制尚不十分清楚,Thomas等[24]的研究表明三孢酸可能是通过影响类胡萝卜素代谢途径中的一个或几个酶的合成来发挥作用。Sun等[25-27]利用代谢组、蛋白组和实时定量PCR等技术,综合分析了三孢酸对三孢布拉氏霉菌转录、翻译和代谢网络的影响,发现三孢酸对于霉菌的影响是全面的(对糖酵解、三羧酸循环支路、脂肪酸合成等多种代谢途径均有影响),而非只影响类胡萝卜素合成代谢;在类胡萝卜素合成途径中,三孢酸对hmgR的转录基本没有影响,却增强了ipi、carG、carRA和carB的转录(增强9~33 倍),而isoA和erg9转录水平的变化依赖于三孢酸的添加量(图1),这些结果表明三孢酸可能是通过刺激相关酶基因的转录来调控三孢布拉氏霉类胡萝卜素的合成。
2 三孢酸类化合物(trisporoid)的结构及其功能
β-胡萝卜素裂解产生3个片段化合物:C18、C15和C7化合物[参见图4(a)],其中三孢酸类化合物(trisporoid)属于C18家族,含有18~19个碳原子,包括一个14个碳原子的主碳链[28]。三孢酸及其代谢途径中的所有中间产物总称为三孢酸类化合物,从分子结构来看,三孢酸类化合物中包含有醇类、酮类、酸类及酯类等物质,目前能够分离得到的主要有三孢酮(trisporin)、三孢醇(trisporol)、三孢醇甲酯(methyltrisporate)、三孢酸(trisporic acid)、4-二氢三孢醇甲酯(4-dihydromethyltrisporate)和4-二氢三孢酸(4-dihydrotrisporic acid)等,其中4-二氢三孢酸是一个新分离到的物质,该物质的来源、代谢流向及生理作用均未有研究。这些物质结构相似,遵循图2中的结构通式,当C1、C4位置上的取代基(分别为X1和X4)不同时,物质的种类不同,具体见表1[29]。后来发现,每种物质又有多种衍生物,基于目前分离得到的三孢酸类化合物的分子结构,研究者认为衍生物可分为A、B、C、D、E 5种,目前分离得到的三孢酮的衍生物有B、C两种,三孢醇的有B、C两种,4-二氢三孢醇甲酯的也有B、C两种,三孢醇甲酯的有B、C、E 3种,三孢酸的有A、B、C、D、E 5种,而4-二氢三孢酸只分离到B型衍生物[30-32]。衍生物属于哪种类型由C2、C3和C13位置上的官能团(Y1、Y2和Y3)决定,具体见表2。

表1 R三孢酸类化合物的结构Table 1 Trisporoid structure
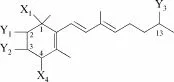
图2 三孢酸类化合物的结构通式Fig.2 General structure of trisporoid

表2 R三孢酸类化合物的衍生物的结构Table 2 Structure of trisporoid derivatives
虽然三孢酸类化合物的结构相似,但功能却不尽相同,生理活性也大小不一。Schachtschabel等[30]研究发现,三孢酸B、C能够诱导高大毛霉(+)/(-)菌产生孢子,三孢醇甲酯和4-二氢三孢醇甲酯只对(-)菌有活性,而三孢酮B、C只对高大毛霉(+)菌起作用。Yamuna等[31]研究了三孢酸类化合物对β-胡萝卜素合成的影响,结果显示影响的大小随着真菌种属、生长阶段的不同而不同,且(-)菌对于三孢酸类化合物的刺激比(+)菌敏感;同时在其研究中还发现,三孢酸B是高大毛霉类胡萝卜素合成的最佳刺激剂,而对三孢布拉氏霉来说最佳刺激剂为4-二氢三孢酮C;三孢酮B、三孢酮C和D'orenone对高大毛霉及三孢布拉氏霉β-胡萝卜素的合成的影响都很小;4-二氢三孢酮C和4-二氢三孢醇甲酯C只对三孢布拉氏霉(-)菌类胡萝卜素的合成有刺激效果,而三孢酸C、三孢醇甲酯B对高大毛霉(-)菌的刺激效果比较大。细胞中三孢酸类化合物的各种衍生物的含量会随着生理状态、环境条件的改变而发生变化,但有一个大致的变化范围,例如在三孢布拉氏霉中C、B、A 3种类型的衍生物含量变化范围分别为55%~87%、12%~39%和16%左右,在真菌中D、E型衍生物的含量通常很少[32]。此外各种衍生物的生理活性大小也不同,一般认为B类衍生物的活性要大于C类衍生物的活性,C类的活性又比A类的大,D、E的活性相对来说最小,这可能与它们在体内的含量多少有一定关系。
3 三孢酸的合成代谢途径
三孢酸首次引起关注是作为一个代谢中间产物,可以极大刺激类胡萝卜素的合成,随后Gooday等[5]发现三孢酸还可以作为性激素诱导孢子形成。由于三孢酸的重要生理作用,研究者对三孢酸的代谢途径进行了长时间的研究,其研究进程大致可以分成两个阶段,第1个阶段(1964~2000年)主要探究了三孢酸的合成机制[(+)/(-)菌协作合成机制]及提出了一个代谢途径框架(图3);第2个阶段(2000年至今)主要是对前一时期提出的代谢框架做了修正和补充(图4),增补了一些新的三孢酸代谢中间产物,如β-apo-12′-carotenal和D'orenone等。
3.1三孢酸的发现及其代谢途径的初步研究
1964年,Prieto等[33]在三孢布拉氏霉的混合培养基中发现了一系列能够刺激β-胡萝卜素合成的酸性化合物,称作β-因子,后来命名为三孢酸。在随后的1~2年相继在其他真菌如布拉克须霉、高大毛霉等的混合培养基中也分离得到该物质[34]。三孢酸只有在(+)/(-)菌混合培养时才可以大量合成,单独培养的(+)/(-)菌几乎不合成三孢酸,因为三孢酸的合成需要(+)/(-)菌协作完成。之所以存在这种机制,是因为三孢酸合成途径中的一些酶是(+)菌或者(-)菌所特有的,因而(+)/(-)菌会各自合成一些特有的前体物质,然后通过物质扩散作用,使得这些特异性前体物在(+)/(-)菌之间得以交换,最终完成三孢酸的合成。
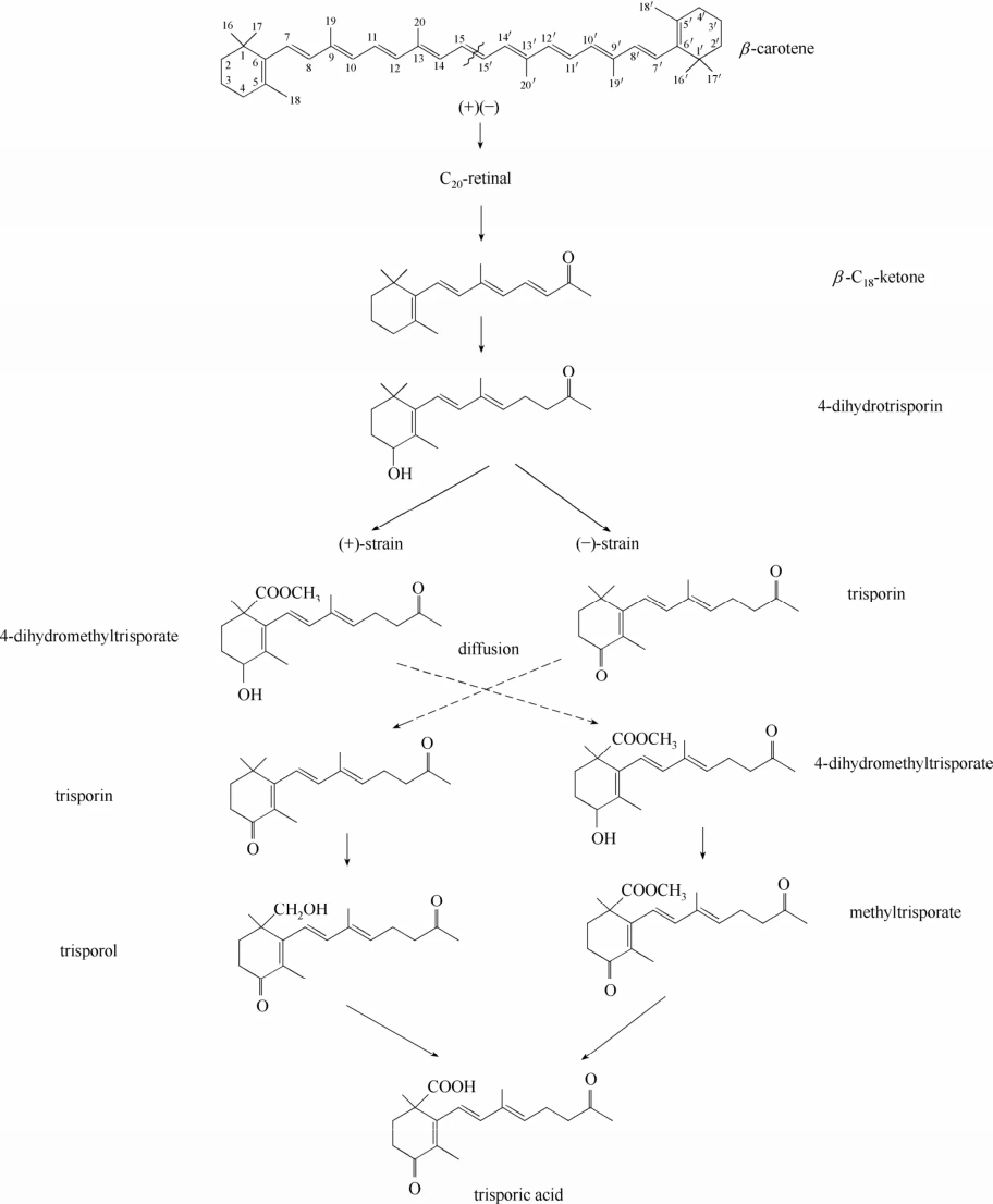
图3 早期的三孢酸合成途径Fig.3 TSA cooperative biosynthetic pathway at early stage
此外,这一时期另一个较大的研究成果就是三孢酸初始前体物质的确定。研究表明三孢酸合成的初始前体物质是β-胡萝卜素,主要有以下3方面证据:第一,放射性同位素(14C)标记实验显示,三孢酸主要来源于β-胡萝卜素;第二,β-胡萝卜素合成的营养缺陷型菌株不能合成三孢酸;第三,混合培养基中添加二苯胺(可以阻断β-胡萝卜素的合成)后,三孢布拉氏霉菌中的三孢酸合成受阻[34]。在证实β-胡萝卜素为三孢酸合成的初始前体物质后,关于β-胡萝卜素的裂解方式也进行了大量研究。这一时期一直认为β-胡萝卜素是在C15-C15′处对称裂解,生成视黄醛(C20-retinal),视黄醛进一步反应生成β-C18-ketone(图3),而后证实这一推测有误[35]。

图4 改进后的三孢酸合成代谢途径Fig.4 Modified cooperative biosynthetic pathway of TSANote: Cooperative biosynthetic pathway illustrates the production of trisporoids. Metabolic pathway in Fig.4(a) could occur in both (+) and (-) mating types while pathway in Fig.4(b) could reflect cooperative biosynthesis which need (+)/(-) mating types exchange intermediate metabolite. Dashed arrows in Fig.4 represent reactions that have not been studied clearly; ①②③④⑤⑥ represent reactions of enzymatic catalysis.
由于只有在(+)/(-)菌混合培养时才可以合成大量的三孢酸,而单独培养的(+)菌或者(-)菌是否也可以合成三孢酸最初研究者不是很清楚。直到1973年,Sutter等[36]证实在无任何(-)菌因素的刺激下,单独培养的(+)菌也可以合成0.1%(指占三孢布拉氏霉(+)/(-)菌混合培养5 d后产生的三孢酸的百分比)的三孢酸,而单独培养的(-)菌几乎不合成三孢酸(< 0.0001%)。但是相对(+)菌,(-)菌对三孢酸的刺激更加敏感,添加三孢酸后(-)菌类胡萝卜素的产量是(+)菌的6倍;此外还发现在(+)/(-)菌混合培养时,如果(-)菌的接种量大,相应的类胡萝卜素产量也高,具体原因尚未研究清楚,可能是因为(-)菌中一些相关的酶的活性更高[3]。
在这一时期,Sutter等[3,34,36]、Austin等[4]对三孢酸代谢途径及其中间产物做了大量的研究,认为三孢酸按照图3的路线合成,包含以下要点:① 三孢酸合成代谢途径的初始物质为β-胡萝卜素,其在C15-C15'处对称裂解生成视黄醛;② 在三孢酸代谢途径中,(+)菌和(-)菌体内都能合成的最后一个物质是4-二氢三孢酮;③ 4-二氢三孢酮下游代谢的进行需要(+)/(-)菌彼此交换特定的中间产物(如三孢酮、4-二氢三孢醇甲酯等),通过(+)/(-)菌协作完成三孢酸的合成。4-二氢三孢醇甲酯只能在(+)菌体内合成,三孢酮只能在(-)菌体内合成。(+)菌合成的4-二氢三孢醇甲酯需扩散到(-)菌体内进而转化成三孢醇甲酯,而(+)菌合成三孢醇的前体是来源于(-)菌的三孢酮[37-38]。
3.2三孢酸代谢途径的完善和发展
前期的研究给出了三孢酸合成代谢途径的基本框架(图3),但是代谢途径中的一些细节问题尚未研究清楚,例如β-胡萝卜素的裂解方式、分离得到的部分化合物在代谢途径中的具体定位等。2000年后,研究者利用同位素标记法、质谱分析法等对三孢酸合成代谢的细节进行了深入研究,补充和完善了已有的合成代谢框架,改进后的合成路线见图4。
2002年,Gessler等[39]通过向β-胡萝卜素的乳浊液(向溶解有β-胡萝卜素的己烷液中滴加Tween-20制得)中添加破碎菌体提取物(从混合培养的三孢布拉氏霉菌菌丝中分离得到),32℃下反应4 h后,对该反应液进行色谱和质谱分析,得到两种β-胡萝卜素代谢产物,分别是异隐黄素(isocryptoxanthine)和D'orenone(图4)。当以视黄醛代替β-胡萝卜素为底物进行该实验时,不能得到相关产物,这表明视黄醛很可能不是三孢酸代谢途径的中间产物。将β-胡萝卜素置于可产生超氧阴离子自由基的黄嘌呤-黄嘌呤氧化酶系统中进行反应,经质谱分析发现β-胡萝卜素更倾向于在分子式的一侧断键而非以往认为的对称裂解,这进一步证明了视黄醛未参与三孢酸代谢。此外,Gessler认为β-胡萝卜素有两种裂解途径(图4):(1)β-胡萝卜素的C4位羟基化形成异隐黄素,异隐黄素进一步不对称裂解生成三孢酸的前体;(2)另一种裂解途径为β-胡萝卜素先裂解生成D'orenone,D'orenone进一步裂解而进入三孢酸代谢途径,后来发现在D'orenone之前还存在中间物质β-apo-12′-carotenal。实验数据显示在菌体内主要进行的是β-胡萝卜素的氧化裂解反应(生成D'orenone的反应),羟基化反应(形成异隐黄素的反应)速率很小[39]。在后来的研究中,相继在(+)/(-)菌混合培养基中分离得到C18、C15和C7片段化合物[图4(a)],因此推测β-胡萝卜素的断键位置可能在C13-C14和C11′-C12′处,其中三孢酸及其合成中间代谢产物全部来源于C18化合物,目前有关C15和C7化合物的生理作用尚不清楚。
2008年,Doreen等[29]用同位素标记法,对三孢酸的合成途径进行了系统的分析,首次证明D'orenone是三孢酸合成的前体物质。Doreen等使用重氢标记三孢酸的前体并分别加入到单独和混合培养的三孢布拉氏霉(+)/(-)菌培养基中,黑暗培养3、6、9、12、24、48 h后,对培养基中的代谢物成分及结构变化进行分析研究。依据实验结果,Doreen对原有的三孢酸合成途径做了以下几方面的修正(图4):(1)β-胡萝卜素裂解后的第一个产物是D'orenone而非视黄醛,而后Yamuna等[31]证明第一个产物是β-apo-12'-carotenal;(2)(+)/(-)菌都能合成的最后一个三孢酸的前体是三孢醇,而非4-二氢三孢酮;(3)三孢醇氧化成三孢醇甲酯的反应只能在(+)菌体内进行,而三孢醇甲酯皂化生成三孢酸的反应在(+)/(-)菌体内都可进行,只是二者的反应速率不同,(-)菌中的反应速率显著高于(+)菌;(4)在(+)/(-)菌的混合培养基内没有发现被重氢标记的4-二氢三孢醇甲酯,因此推测该物质可能没有参与三孢酸的合成代谢;(5)三孢醇甲酯生成三孢酸的反应不可逆;(6)对三孢酮生成三孢醇、三孢醇甲酯生成三孢酸的反应动力学的研究表明,(-)菌中这两步反应的反应速率要明显高于(+)菌。
Yamuna等[31]在高产β-胡萝卜素的大肠杆菌中导入类胡萝卜素氧化酶基因,研究β-胡萝卜素在氧化酶作用下的裂解机制,通过分析大肠杆菌细胞提取物的成分,他们发现了新物质β-apo-12′-carotenal(C25)并证明其为β-胡萝卜素裂解的第一个产物;随后,β-apo-12′-carotenal在C13-C14位置断键,生成D'orenone和一个C7化合物[图4(a)]。目前,对D'orenone生成下一物质的反应机制还不了解,推测有两种可能[图4(a)反应③]:C11-C12位的双键打开,D'orenone生成另一种酮(ketone);或者碳环C4位羟基化形成4-hydroxy-β-C18-ketone,进而转化成4-二氢三孢酮[29,40]。
尽管,Gessler等[39]、Doreen等[29]、Yamuna等[31]的研究丰富和发展了三孢酸的合成代谢途径,但是仍有许多问题没有解决,如4-二氢三孢醇甲酯的来源问题尚不清楚。开始研究者认为4-二氢三孢醇甲酯是(+)菌的一个特异性产物,来源于4-二氢三孢酮(图3)[38]。然而在Doreen的研究中发现,当向培养基中添加重氢标记的三孢酸前体时,代谢产物4-二氢三孢醇甲酯中并不含有放射性标记,此外还发现4-二氢三孢醇甲酯生成三孢酸的速率非常低,这些现象均表明4-二氢三孢醇甲酯几乎不参与三孢酸的合成且可能不是β-胡萝卜素的裂解产物[29]。4-二氢三孢醇甲酯可能由β-胡萝卜素的氧化衍生物异隐黄素降解而来[图4(b)],β-胡萝卜素的非酶催化氧化裂解结果以及超氧阴离子降低β-胡萝卜素氧化酶活性的事实均为以上猜想提供了证据。因此,4-二氢三孢醇甲酯在三孢酸合成中到底起什么作用还需要进一步的探究。
4 三孢酸生物合成途径中相关基因的克隆及其分子调控机制研究进展
近年来,随着研究的深入三孢酸合成代谢途径得到不断的丰富和完善,但是对该过程的分子调控机制的研究却相对滞后,只对三孢酸合成途径中少数几个酶的基因进行了克隆和功能探索。毛霉目真菌具有相似的三孢酸合成途径,除三孢布拉氏霉外,目前对米根霉(Rhizopus oryzae)、高大毛霉和布拉克须霉中三孢酸的合成也有研究,发现相关酶的功能十分相似。目前,克隆得到的酶基因有β-胡萝卜素氧化酶(β-carotene oxygenase)基因tsp3/tsp4、4-二氢三孢酮脱氢酶(4-dihydrotrisporin dehydrogenase)基因tsp2、4-二氢三孢醇甲酯脱氢酶(4-dihydromethyltrisporate dehydrogenase)基因tsp1和AcaA酶基因acaA等,这些酶的基因及功能参见图4(a)和表3。
β-胡萝卜素氧化酶是一个保守酶,其功能在物种间的差异很小,催化β-胡萝卜素在C11'-C12'处断键,生成C25和C15两个片段化合物,其中C25化合物(β-apo-12′-carotenal)进入三孢酸合成途径[图4(a)]。最早发现的β-胡萝卜素氧化酶来自三孢布拉氏霉菌,被命名为TSP3,但是发现存在多种β-胡萝卜素氧化产物,因此推测应该有多种β-胡萝卜素氧化酶存在[31]。米根霉中β-胡萝卜素氧化酶TSP4的发现,更确认了这种推测[41]。目前对这两种酶的结构、活性、底物特异性以及催化产物的了解还很少,但是对其编码基因tsp3和tsp4的转录及调控有一些研究。Anke等[41]的研究显示,三孢布拉氏霉在三孢酸诱导的最初1 h内,tsp3表达量迅速增加,比对照高出500倍,但1 h后,tsp3基因表达量开始逐渐减少,最终只保持一个低水平的表达。这说明三孢酸的合成过程存在反馈调节机制,初期表现为正向反馈调节,后期则为负反馈调节,目前尚无参与这些过程的调控因子的报道。Sun等[26]研究发现,当向三孢布拉氏霉(+)/(-)菌混合培养基中添加三孢酸时,tsp4的转录水平几乎不发生改变,而tsp3的转录水平明显上升;因此,推测TSP3的作用主要是催化三孢酸前体物质的形成,触发三孢酸合成过程;TSP4主要是在(+)/(-)菌接合的早期发挥作用,可能参与了(+)/(-)菌菌丝的相互识别。
AcaA也是一个氧化酶,催化三孢酸生物合成的第2步反应,使得C25化合物在C13-C14位置断键,生成D'orenone[图4(a)]。Humberto等[40]发现须霉属真菌的79747、77754、64508、76627和58172等5个基因可能是与类胡萝卜素氧化裂解相关的基因,并证明在须霉属真菌中79747号基因编码β-胡萝卜素氧化酶,且将其命名为carS;carS是与三孢布拉氏霉tsp3同源的基因,二者基因功能相似(翻译产物都是β-胡萝卜素氧化酶),只是在不同真菌种属中的命名不同而已;77754号基因的编码产物也是一个氧化酶,在β-胡萝卜素氧化酶之后发挥作用,被称作acaA。将含carS和acaA基因的载体分别导入产β-胡萝卜素的大肠杆菌中来表达CarS和AcaA,发现只有CarS有活性,而AcaA完全没有活性;但将carS和acaA先后放在一个操纵子中且由同一个启动子调控时,发现不仅CarS有活性,AcaA也有活性,由此推测AcaA在CarS之后发挥活性,因此acaA是三孢酸合成代谢途径中的第2个活性基因。分离纯化的酶蛋白AcaA可使类胡萝卜素裂解产物C25、C27及C30等化合物进一步降解,但不能降解C20和C22两个片段化合物,说明C25化合物是AcaA最短的环化底物;同时AcaA不能降解β-胡萝卜素、γ-胡萝卜素及虾青素,这进一步证明了AcaA是三孢酸代谢途径中的第二个酶。运用实时荧光定量PCR研究发现acaA的转录不受(+)/(-)菌混合培养的影响,目前关于AcaA的结构及调控方式均未有太多的研究报道[31]。
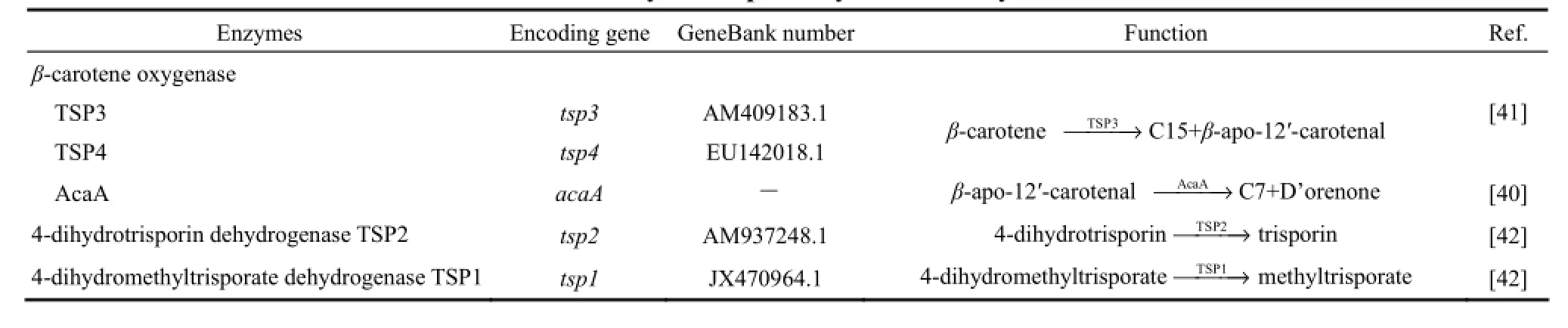
表3 R三孢酸代谢途径中的酶Table 3 Enzymes in pathway of TSA biosynthesis
4-二氢三孢酮脱氢酶由基因tsp2编码,分子杂交结果显示,tsp2是一个单拷贝基因。4-二氢三孢酮脱氢酶是一个短链酶,含有一个NADP+辅因子,催化4-二氢三孢酮C4位的羟基氧化生成三孢酮,在(-)菌体内具有较高的活性。Northern杂交分析显示,tsp2在高大毛霉(+)菌的所有生长阶段都有转录,但是在高大毛霉(-)菌中,在生长后期才开始转录。三孢酸的刺激会增加高大毛霉(-)菌4-二氢三孢酮脱氢酶的活性,但是tsp2的转录水平没有发生变化,由此说明4-二氢三孢酮脱氢酶酶活性的调控方式是翻译后修饰,而非通过调控相应基因的转录来调节酶活性。研究推测4-二氢三孢酮脱氢酶除了在三孢酸代谢中起催化氧化作用外,还有可能在(+)/(-)菌混合培养初期起识别彼此的作用[42-44]。
依赖NADP+的4-二氢三孢醇甲酯脱氢酶是一个醛酮类还原酶,可以催化4-二氢三孢醇甲酯生成三孢醇甲酯。4-二氢三孢醇甲酯脱氢酶的编码基因为tsp1,目前已经克隆并表征了高大毛霉、灰绿犁头霉(Absidia glauca)和三孢布拉氏霉(+)/(-)菌的tsp1基因,后来在布拉克须霉和雅致枝霉(Thamnidium elegans)中也相继发现了该基因的存在[45]。高大毛霉(-)菌中的tsp1基因的编码区长度为2406~3445,内含子的起始位置为2746,碱基数量为74bp;(+)菌的tsp1基因除了131和639位的胸腺嘧啶变为胞嘧啶、546位胞嘧啶变成胸腺嘧啶外,其余部分与(-)菌的tsp1基因序列高度一致,(+)/(-)菌的tsp1基因表达产物的一级结构完全相同。tsp1的转录和翻译均不受三孢酸的影响,但是三孢酸对4-二氢三孢醇甲酯脱氢酶的活性影响较大,在没有三孢酸刺激的情况下,高大毛霉(+)/(-)菌中的4-二氢三孢醇甲酯脱氢酶几乎没有活性;其中(-)菌在添加三孢酸初期,4-二氢三孢醇甲酯脱氢酶仍几乎无活性,80 min后才开始表现出高的活性,这一现象说明4-二氢三孢醇甲酯脱氢酶活性受到一些未知机制的调控[42,45]。
4-二氢三孢酮脱氢酶和4-二氢三孢醇甲酯脱氢酶都是依赖NADP+的脱氢酶,但它们的一级结构和空间构象有很大差异,二者的底物特异性都很低;4-二氢三孢醇甲酯脱氢酶含有一个TIM-桶装结构(TIM-barrel),4-二氢三孢酮脱氢酶含有一个罗斯曼折叠结构(Rossman fold);二者的相同之处是活性中心均含有酪氨酸和赖氨酸残基[42]。
在毛霉目真菌中,除了三孢酸合成途径中的基因外,一些与三孢酸合成及调控相关的基因也被分离出来,如性别决定基因(sexM/sexP)[46]、光诱导基因(crgA)[47]及尿嘧啶合成酶基因(pyrG)[48]等,这些基因对进一步了解三孢酸合成代谢的分子机制有重要意义。其中性别决定基因sexM/sexP与三孢酸合成的调控有密切联系,sexM/sexP控制着毛霉目真菌的有性生殖,该基因含有一段编码HMG-转录因子的DNA序列,序列右侧为一个RNA解旋酶基因,左侧为一个磷酸丙糖转运蛋白基因[46]。该基因在(+)菌中被命名为sexP,在(-)菌中被命名为sexM,二者均为单拷贝基因。当布拉克须霉(+)/(-)菌混合培养时,发现sexM/sexP的转录水平均大幅增加,推测可能是因为受到了三孢酸类化合物的刺激,但是具体作用机制还不清楚。对高大毛霉的研究发现,三孢酸类化合物对sexP的调控作用要比sexM小得多。目前已表征了高大毛霉中sexM/sexP的结构[49],sexP和sexM的基因产物SexP和SexM的生理作用可能是诱导接合菌的性别分化。研究发现SexM蛋白一级结构的101~106(QQRRKY)位处是一段细胞核定位序列,这使得SexM蛋白不需要其他转运系统就可以直接进入到细胞核中,但目前对于SexP在细胞中的定位还不了解。
5 存在问题与展望
发酵法生产类胡萝卜素符合营养健康的消费理念,具有广阔的商业前景。但目前在扩大生产上仍然面临着诸多问题,其中最严峻的就是生产菌种产量低。近年来,通过培养基优化、发酵工艺参数优化、发酵工程技术的运用,使菌种的产量有了极大的提高,但仍不能满足工业化的需求。随着生物技术的发展,基因工程越来越多地运用到了育种技术中,使得菌种得到进一步优化。三孢布拉氏霉菌具有生长迅速、生物量大、类胡萝卜素产量高(4~5 g·L-1)等明显优势,成为进入规模化工业生产类胡萝卜素的主要微生物;但由于三孢布拉氏霉菌类胡萝卜素合成途径复杂、遗传转化困难,目前对其基因功能、代谢调控、遗传转化方法的研究还较少,有待于深入研究。
三孢酸是影响三孢布拉氏霉类胡萝卜素产量的一个重要影响因素,其生物合成途径还有许多待完善的地方,如代谢途径中的许多基因还没有找到、一些中间代谢物质还没有被发现、一些酶的性质和结构还有待深入研究。迄今,三孢酸代谢途径中仅仅鉴定出了4种酶,这主要是由于丝状真菌的基因组结构较为复杂,利用传统技术克隆基因步骤烦琐、工作强度大、存在一定的技术难度。随着全基因组测序技术的快速发展,依据全基因组的序列信息克隆基因大大降低了基因克隆的难度和工作量。近期,美国JGI(Jointed Genome Institute)公布了布拉克须霉全基因组的序列分析结果[50],利用布拉克须霉的基因组数据可以对比克隆三孢布拉氏霉菌中的同源基因,布拉克须霉的全基因组序列分析信息为三孢布拉氏霉菌中三孢酸合成代谢及其调控机制的研究提供了有利条件。
三孢酸合成代谢的研究有利于更好地调控三孢布拉氏霉菌的发酵,从而提高目标产物的产量。此外三孢酸调控类胡萝卜素合成机制的阐明,对提高微生物发酵生产类胡萝卜素及其他萜烯类化合物的产量有重要意义。但是目前关于三孢酸对类胡萝卜素合成的具体调控机理尚不清楚,Sun等[25-27]认为三孢酸是通过刺激类胡萝卜素合成途径中相关酶基因的转录来调控类胡萝卜素的合成;Thomas等[24]认为三孢酸是通过影响类胡萝卜素代谢途径中的相关酶的合成来发挥调控作用,但具体作用位点是哪几个酶还未研究清楚。
References
[1] BERNARDO D R, DANIEL W B, MARIA A Z C. Technological aspects of β-carotene production [J]. Food and Bioprocess Technology, 2011, 4: 693-701.
[2] KAMLA M, JAYANTI T, SNEH G. Microbial pigments: a review [J]. International Journal of Microbial Resource Technology, 2012, 1(4):361-366.
[3] SUTTER R P, RAFELSON M E. Separation of β-factor synthesis from stimulated β-carotene synthesis in mated cultures of Blakeslea trispora [J]. Journal of Bacteriology, 1968, 95(2): 426-432.
[4] AUSTIN D G, BU'LOCK J D, WINSTANLEY D J. Trisporic acid biosynthesis and carotenogenesis in Blakesleea trispora [J]. Biochemical Journal, 1969, 113(3): 34.
[5] GOODAY G W, CARLILE M J. The discovery of fungal sex hormones(Ⅲ): Trisporic acid and its precursors [J]. Mycologist, 1997,11(3): 126-130.
[6] 徐军伟, 徐芳, 袁其朋. 三孢酸结构类似物对发酵生产番茄红素的影响 [J]. 北京化工大学学报, 2007, 34(2):134-137. XU J W, XU F, YUAN Q P. Effect of abscisic acid related compounds on lycopene production by Blakeslea trispora [J]. Journal of Beijing University of Chemical Technology, 2007, 34(2): 134-137.
[7] 师艳秋, 辛秀兰, 袁其朋. 发酵促进剂在三孢布拉霉生产番茄红素中的应用 [J]. 食品与发酵工业, 2012, 38(1):133-136. SHI Y Q, XIN X L, YUAN Q P. The fermentation accelerant on lycopene production by Blakeslea trispora [J]. Food and Fermentation Industries, 2012, 38(1): 133-136.
[8] CHANDI G K, GILL B S. Production and characterization of microbial carotenoids as an alternative to synthetic colors: a review[J]. International Journal of Food Properties, 2011, 14(3): 503-513.
[9] BINA J M, LUIS M S. New mutants of Phycomyces blakesleeanus for β-carotene production [J]. Applied and Environmental Microbiology, 1997, 63(9): 3657-3661.
[10] WANG G S, HARTMUT G, KHALED A A, et al. High-level production of the industrial product lycopene by the photosynthetic bacterium Rhodospirillum rubrum [J]. Applied and Environmental Microbiology, 2012, 78(20): 7205-7215.
[11] HERNÁNDEZ-ALMANZA A, MONTAÑEZ-SÁENZ J, MARTÍNEZÁVILA C, et al. Carotenoid production by Rhodotorula glutinis YB-252 in solid-state fermentation [J]. Food Bioscience, 2014, 7:31-36.
[12] BEN-AMOTZ A. New mode of Dunaliella biotechnology: two-phase growth for β-carotene production [J]. Journal of Applied Phycology,1995, 7(1): 65-68.
[13] SUN T, MIAO L T, LI Q Y, et al. Production of lycopene by metabolically-engineered Escherichia coli [J]. Biotechnology Letters,2014, 36(7): 1515-1522.
[14] XIE W P, YE L D, LV X M, et al. Sequential control of biosynthetic pathways for balanced utilization of metabolic intermediates in Saccharomyces cerevisiae [J]. Metabolic Engineering, 2015, 28: 8-18.
[15] BARREDO J L. Microbial carotenoids from bacteria and microalgae[J]. Methods in Molecular Biology, 2012, 892: 133-141.
[16] 张闯, 张玉苍, 何连芳. 不同微生物生产类胡萝卜素的研究现状[J]. 食品研究与开发, 2011, 32(2): 180-183. ZHANG C, ZHANG Y C, HE L F. Comparative study on microbial production of carotenoids [J]. Food Research and Development, 2011,32(2): 180-183.
[17] LAMPILA L E, WALLEN S E, BULLERMAN L B. A review of factors affecting biosynthesis of carotenoids by the order Mucorales[J]. Mycopathologia, 1985, 90: 65-80.
[18] BHOSALE P. Environmental and cultural stimulants in the production of carotenoids from microorganisms [J]. Applied Microbiology and Biotechnology, 2004, 63(4): 351-361.
[19] SATYA D, MODI V V, JANI U K. Chemical regulators of carotenogenesis by Blakeslea trispora [J]. Phytochemistry, 1980,19(5): 795-798.
[20] KONSTADINA N, TRIANTAFYLLOS R. Oxidative stress response and morphological change of Blakeslea trispora induced by butylated hydroxytoluene during carotene production [J]. Applied Biochemistry and Biotechnology, 2010, 160: 2415-2423.
[21] XU F, YUAN Q P, ZHU Y. Improved production of lycopene and β-carotene by Blakeslea trispora with oxygen-vectors [J]. Process Biochemistry, 2007, 42: 289-293.
[22] SEON-WON K, WEON-TAEK S, YOUNG-HOON P. Enhanced production of β-carotene from Blakeslea trispora with Span 20 [J]. Biotechnology Letters, 1997, 19(6): 561-562.
[23] GOVIND N S, AMIN A R, MODI V V. Stimulation of carotenogenesis in Blakeslea trispora by cupric ions [J]. Phytochemistry, 1982, 21(5): 1043-1044.
[24] THOMAS D M, HARRIS R C, KIRK J T O, et al. Studies on carotenogenesis in Blakeslea trispora (Ⅱ): The mode of action oftrisporic acid [J]. Phytochemistry, 1967, 6(3): 361-366.
[25] SUN J, LI H, YUAN Q P. Metabolic regulation of trisporic acid on Blakeslea trispora revealed by a GC-MS-based metabolomic approach [J]. PLoS ONE, 2012, 7(9): 443-452.
[26] SUN J, LI H, SUN X X, et al. Trisporic acid stimulates gene transcription of terpenoid biosynthesis in Blakeslea trispora [J]. Process Biochemistry, 2012, 47(12): 1889-1893.
[27] SUN J, SUN X X, TANG P W, et al. Molecular cloning and functional expression of two key carotene synthetic genes derived from Blakeslea trispora into E. coli for increased β-carotene production [J]. Biotechnology Letters, 2012, 34(11): 2077-2082.
[28] BARRERO A F, MAR H M, PILAR A, et al. A minor dihydropyran apocarotenoid from mated cultures of Blakeslea trispora [J]. Molecules, 2012, 17(11):12553-12559.
[29] DOREEN S, ANJA D, KLAUS-DIETER M, et al. Cooperative biosynthesis of trisporoids by the (+) and (-) mating types of the zygomycete Blakeslea trispora [J]. ChemBioChem, 2008, 9(18):3004-3012.
[30] SCHACHTSCHABEL D, SCHIMEK C, WÖSTEMEYER J, et al. Biological activity of trisporoids and trisporoid analogues in Mucor mucedo (-) [J]. Phytochemistry, 2005, 66(11): 1358-1365.
[31] YAMUNA S, KERSTIN K, WILHELM B, et al. Early and late trisporoids differentially regulate β-carotene production and gene transcript levels in the Mucoralean fungi Blakeslea trispora and Mucor mucedo [J]. Applied and Environmental Microbiology, 2013,79(23): 7466-7475.
[32] VERESHCHAGINA O A, TERESHINA V M. Trisporoids and carotenogenesis in Blakeslea trispora [J]. Microbiology, 2014, 83(5):438-449.
[33] PRIETO A, SPALLA C, BIANCHI M. Biosynthesis of β-carotene by strains of Choanephoraceae [J]. Chemistry and Industry, 1964, 13:551-551.
[34] SUTTER R P. Trisponic acid synthesis in Blakeslea trispora [J]. Science, 1970, 168(3939): 1590-1592.
[35] BU'LOCK J D, JONES B E, TAYLOR D, et al. Sex hormones in Mucorales. The incorporation of C20and C18precursors into trisporic acids [J]. Journal of General Microbiology, 1974, 80(1): 301-306.
[36] SUTTER R P, CAPAGE D A, HARRISON T L. Trisporic acid biosynthesis in separate plus and minus cultures of Blakeslea trispora:identification by Mucor assay of two mating-type-specific components [J]. Journal of Bacteriology, 1973, 114(3): 1074-1082.
[37] BU'LOCK J D, JONES B E, WINSKILL N. The apocarotenoid system of sex hormones and prohormones in Mucorales [J]. Pure and Applied Chemistry, 1976, 47: 191-202.
[38] SCHACHTSCHABEL D, BOLAND W. Efficient generation of a trisporoid library by combination of synthesis and biotransformation[J]. The Journal of Organic Chemistry, 2007, 72(4): 1366-1372.
[39] GESSLER N N, SOKOLOV A V, BELOZERSKAYA T A. Initial stages of trisporic acid synthesis in Blakeslea trispora [J]. Applied Biochemistry and Microbiology, 2002, 38(6): 536-543.
[40] HUMBERTO R M, CERDÁ-OLMEDO E, AL-BABILI S. Cleavage oxygenases for the biosynthesis of trisporoids and other apocarotenoids in Phycomyces [J]. Molecular Microbiology, 2011, 82(1): 199-208.
[41] ANKE B, MAREIKE R, KORNELIA S, et al.Cleavage of β-carotene as the first step in sexual hormone synthesis in zygomycetes is mediated by a trisporic acid regulated β-carotene oxygenase [J]. Fungal Genetics and Biology, 2007, 44: 1096-1108.
[42] ELLENBERGER S, SCHUSTER S, WÖSTEMEYER J. Correlation between sequence, structure and function for trisporoid processing proteins in the model zygomycete Mucor mucedo [J]. Journal of Theoretical Biology, 2013, 320: 66-75.
[43] SCHIMEK C, WÖSTEMEYER J. Carotene derivatives in sexual communication of zygomycete fungi [J]. Phytochemistry, 2009, 70:1867-1875.
[44] JANA W, OLAF S, ANKE B, et al. 4-Dihydrotrisporindehydrogenase, an enzyme of the sex hormone pathway of Mucor mucedo: purification, cloning of the corresponding gene, and developmental expression [J]. Eukaryotic Cell, 2009, 8(1): 88-95.
[45] CHRISTINE S, ANNETT P, KORNELIA S, et al. 4-Dihydromethyltrisporate dehydrogenase, an enzyme of sex hormone pathway in Mucor mucedo, is constitutively transcribed but its activity is differently regulated in (+) and (-) mating types [J]. Fungal Genetics and Biology, 2005, 42: 804-812.
[46] JANA W, ANKE B, MELANIE K, et al. The mating-related loci sexM and sexP of the zygomycetous fungus Mucor mucedo and their transcriptional regulation by trisporoid pheromones [J]. Microbiology,2012, 158: 1016-1023.
[47] QUILES-ROSILLO M D, RUIZ-VÁZQUEZ R M, VICTORIANO G,et al. Light induction of the carotenoid biosynthesis pathway in Blakeslea trispora [J]. Fungal Genetics and Biology, 2005, 42(2):141-153.
[48] QUILES-ROSILLO M D, RUIZ-VÁZQUEZ R M, VICTORIANO G,et al. Cloning, characterization and heterologous expression of the Blakeslea trispora gene encoding orotidine-5′-monophosphate decarboxylase [J]. FEMS Microbiology Letters, 2003, 222(2): 229-236.
[49] ALEXANDER I, FELICIA J W, ANNA F, et al. Identification of the sex genes in an early diverged fungus [J]. Nature, 2008,451:193-196.
[50] http://genome.jgi.doe.gov/.
Advances in sexual hormone trisporic acid biosynthesis in carotenoids producing Blakeslea trispora
ZHANG Xiaohui1, SU Sisi1, WANG Wenya1, YUAN Qipeng1, LI Qiang2
(1College of Life Science and Technology, Beijing University of Chemical Technology, Beijing 100029, China;2Department of Chemical Engineering, Tsinghua University, Beijing 100084, China)
Given that carotenoids are important fine chemicals, the Blakeslea trispora is receiving increasing attention since its higher industrial production of carotenoids. Numerous factors could affect the carotenoids production in Blakeslea trispora, among which the trisporic acid is one of the uttermost importance. In the present paper, the advances of biosynthesis of trisporic acid were reviewed, including summary of carotenoids production by fermentation, structure and biological function of trisporoids, biosynthetic pathway of trisporic acid and molecular biology of trisporic acid biosynthesis.
trisporic acid; Blakeslea trispora; carotenoids; Mucorales fungi; β-carotene
引 言
类胡萝卜素(carotenoids)是一种天然着色剂,具有增强免疫力、清除自由基、抗氧化等功能,被广泛应用于食品、化妆品和医药行业[1]。生产类胡萝卜素的方法有化学合成法、分离提取法和微生物发酵法,随着消费者对营养、天然产品的需求,微生物源类胡萝卜素逐渐受到广大消费者青睐[2]。自然界中,能合成类胡萝卜素的微生物种类很多,目前国内外生产类胡萝卜素最常用的菌种是三孢布拉氏霉(Blakeslea trispora)。三孢布拉氏霉属于毛曲霉目、藻状菌纲,是一种雌雄异体、具有(+)/(-)菌性别之分的丝状真菌。单独培养的三孢布拉氏霉(+)/(-)菌只能合成少量的类胡萝卜素,混合培养时其类胡萝卜素产量可提高10~15倍[3],因为混合培养时可以生成一种促进类胡萝卜素合成的刺激因子——三孢酸(trisporic acid,TSA)。
date: 2015-10-20.
WANG Wenya, wangwy@mail.buct.edu.cn;YUAN Qipeng, Yuanqp@mail.buct.edu.cn
supported by the National Natural Science Foundation of China (21176018, 21576153) and the National High Technology Research and Development Program of China (2012AA02A701, 2015AA021001).
Q 81
A
0438—1157(2016)05—1654—11
2015-10-20收到初稿,2015-12-13收到修改稿。
联系人:王文雅,袁其朋。第一作者:张晓晖(1989—),女,硕士研究生。
国家自然科学基金项目(21176018,21576153);国家高技术研究发展计划项目(2012AA02A701,2015AA021001)。
