卵巢上皮性交界性肿瘤44例临床分析
2016-08-15黄向华张明乐豆贝贝张暄琳
张 琳,黄向华,张明乐,豆贝贝,张暄琳
(河北医科大学第二医院妇科,河北 石家庄 050000)
·临床研究·
卵巢上皮性交界性肿瘤44例临床分析
张琳,黄向华*,张明乐,豆贝贝,张暄琳
(河北医科大学第二医院妇科,河北 石家庄 050000)
[关键词]卵巢肿瘤;诊断;治疗;预后
doi:10.3969/j.issn.1007-3205.2016.05.029
卵巢上皮性交界性肿瘤(borderline ovarian tumor,BOT)又称低度恶性卵巢肿瘤,占卵巢上皮性肿瘤的10%~20%,是一种独立的病理类型。BOT病理特点是上皮细胞具有一定的核分裂象及异型性,但缺乏破坏性间质浸润,生物学行为介于卵巢良性肿瘤与恶性浸润性肿瘤之间,总体预后良好。BOT发病年龄比上皮性卵巢癌低10~15岁,目前对其治疗仍有争议。本研究回顾性分析44例有完整病历资料的BOT,现报告如下。
1 资料与方法
1.1一般资料选择2005年3月—2015年4月我院收治的44例有完整病历资料的BOT患者,均住院行手术治疗并经病理证实。44例患者年龄18~72岁,中位年龄39.8岁。组织学类型及年龄分布:卵巢交界性浆液性肿瘤(serous borderline ovarian tumor,S-BOT)25例(57%),年龄18~67岁,中位年龄39.8岁;卵巢交界性黏液性肿瘤(mucinous borderline ovarian tumor,M-BOT)17例(39%),年龄18~72岁,中位年龄39.9岁;卵巢交界性混合型肿瘤2例(4%),年龄36~58岁,中位年龄41.0岁。3例合并妊娠,8例未育。临床症状:21例为触及腹部包块、腹胀、下腹不适、腹痛;23例无自觉症状,于查体发现卵巢肿瘤。
1.2辅助检查
1.2.1超声检查44例患者术前均行超声检查,均提示盆腔包块。
1.2.2血清肿瘤标志物检测44例患者术前均行CA125、CA199检查。血CA125高于正常21例,其中S-BOT 12例(37.5~1 236.6 U/mL),M-BOT 8例(42.7~1 036 U/mL),混合型BOT 1例(1 256.3 U/mL)。血CA199高于正常9例,其中S-BOT 1例(90.4 U/mL), M-BOT 7例(76.4~2 053 U/mL),混合型BOT 1例(54 U/mL)。4例患者血CA125和CA199均高于正常,其中S-BOT 1例,M-BOT 2例,混合型BOT 1例。
1.2.3腹腔积液病理合并腹腔积液者9例,其中7例术中取样送病理,结果找到瘤细胞4例,可疑瘤细胞1例,未找到瘤细胞2例。
1.3病理结果与手术-病理分期26例术中行快速冰冻病理检查,其中21例确诊为BOT,5例诊断为良性肿瘤。石蜡病理:S-BOT 25例,M-BOT 17例,混合型BOT 2例。15例行全面分期手术,手术-病理分期为Ⅰ期10例,Ⅲ期5例,见表1。
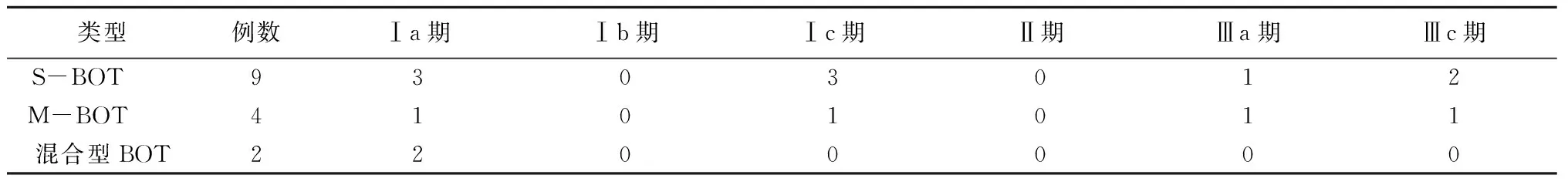
表1 手术-病理分期情况 (例数)
1.4手术方式及术后化疗情况44例患者中15例行全面分期手术(根治性手术):全子宫+双附件+阑尾+大网膜切除术,其中4例同时行盆腔淋巴结清扫术。术后8例术后给予1~6个疗程化疗:2例行多西他赛+奥沙利铂(TP)方案化疗,6例行环磷酰胺+卡铂(CC)方案化疗。
20例行保留生育功能的手术(保守性手术):开腹或腹腔镜下附件切除术或卵巢囊肿剥除术,其中1例行卵巢肿瘤剥除术+大网膜+阑尾切除术,术后给予TP方案化疗5个疗程;3例合并妊娠,其中1例孕35+1周患者因病情变化同时行子宫下段剖宫产术。
其余9例未行全面分期手术情况:2例行全子宫+患侧附件切除术;7例行全子宫+双附件切除术。
44例患者中5例患者为初次手术后接受二次补充手术(其中2例为再分期手术),2例为S-BOT,3例为M-BOT,术后病理证实均无期别上升。
2 结 果
患者定期在门诊行妇科三合诊、血清肿瘤标志物、B超等检查。44例患者中29例患者获得随访,随访时间3~70个月。其中行全面分期手术者19例:Ⅰ期 16例(均未复发);Ⅲ期 3例(2例未复发,定期复查;1例Ⅲc期患者术后肿瘤复发,死于该病)。行保守性手术者8例:均未复发,其中2例合并妊娠者已正常顺娩;2例术前未育患者现已成功妊娠并正常分娩。行其他术式者2例:未复发,定期复查。
3 讨 论
3.1BOT的临床特点及诊断BOT主要发病人群为生育期妇女,发病年龄较卵巢癌早10年,但其预后较好,5年生存率可达80%以上,但仍有10%~15%进展成浸润癌[1]。BOT无特征性的临床表现,多数为查体时发现,应强调常规查体的重要性。辅助检查如超声、CT、磁共振成像(magnetic resonance imaging,MRI)等对于BOT的诊断有一定的提示意义。血肿瘤标志物对于BOT的诊断不具有特异性,但CA125升高显著对S-BOT诊断有重要意义,CA199与癌胚抗原(carcino-embryonic antigen,CEA)升高显著对于M-BOT诊断有重要意义[2]。此外,有研究表明,对于直径≥5 cm的卵巢肿瘤,CA125联合MRI检查区分交界性肿瘤与良性肿瘤的敏感性与特异性均高于单独MRI检查[3]。
3.2手术方式手术是BOT最重要的治疗方式。BOT很少能够在术前进行诊断,术中冰冻病理对BOT诊断的敏感性和特异性很高,但仍有一定的假阴性率或假阳性率,Song等[4]在研究中其假阴性率或假阳性率分别为30.5%和5.1% 。BOT初次手术的范围与浸润性卵巢癌基本一致,移除所有肉眼可见的病灶并进行全面分期手术。虽然有研究显示分期手术不能改善BOT患者的预后[5],但美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南推荐所有患者行全面分期手术并行手术-病理分期,以确定肿瘤累及范围。有学者在回顾性研究143例BOT复发因素时发现,15% S-BOT和28.6%混合型BOT患者复发,M-BOT患者仅4%复发,故建议S-BOT和混合型BOT患者接受全面分期手术[6]。
淋巴结活组织检查并不包括在标准手术方式中,因为有文献报道在高期别BOT手术中即使有淋巴结转移也不影响其复发率和生存率[5]。对S-BOT患者同时行淋巴结切除,行腹主动脉旁及盆腔淋巴结活组织检查[7]。M-BOT患者淋巴结转移很少,故在Ⅱ、Ⅲ期M-BOT手术中可不行淋巴结切除术,对复发率和生存率均无影响[5]。
尽管专家推荐全面的分期手术,但是由于个人意愿或术中未诊断BOT,仍有很多女性在初次手术时并未接受全面分期手术,这些女性是否需要接受再次手术?Snider等[8]对27例未行全面分期的Ⅰ期BOT患者进行再分期手术,术后13例S-BOT患者中有4例期别上升,12例M-BOT患者中无期别上升,1例混合型BOT患者期别上升,1例子宫内膜样BOT患者无期别上升。单侧M-BOT在再次分期手术中发生期别上升的概率比较低,但如果在卵巢外发现病灶应进行全面分期手术和阑尾切除术。M-BOT合并腹膜播散约有50%的概率播散到阑尾或同时累及单侧或双侧卵巢[9]。S-BOT患者进行二次手术是必要的,约20%Ⅰ期S-BOT患者有淋巴结转移,在高期别的病例中淋巴结转移率更高[10]。因此,有学者认为对于初次手术未行全面分期的患者行再分期手术是必要的[11],当然再分期手术也应遵循个体化原则。本研究中有5例患者接受了二次手术,其中2例在初次手术中发现肿瘤破裂,但这5例患者二次手术后病理证实均无期别上升。
BOT确诊的中位年龄是40岁,约有将近1/3的患者年龄低于40岁,因此保留生育功能的手术成为研究的热点。多项研究认为,对Ⅰ期无浸润性种植的BOT患者采用开腹单侧输卵管+卵巢切除术是安全可行的;对于高期别BOT患者,在通过详细的知情同意并且有严密随访条件可以考虑行保留生育功能手术[12-13]。Maltaris等[14]进行的一项Meta分析结果显示,1 483例BOT患者,其中656例(44.2%)接受了保守性手术,196例患者怀孕,111例患者复发,仅1例(0.15%)患者死于该疾病。有学者对155例接受保留生育功能手术与143例接受根治性手术的BOT患者进行了回顾性研究,发现2组复发率差异无统计学意义,保留生育功能组尽管复发率较高,但是均能在接受二次手术后得以控制[15]。本研究中20例患者接受了保留生育功能手术,8例获得随访,无复发,并发妊娠者成功分娩,计划妊娠者成功妊娠2例。
保守性手术后复发的早期发现对于二次手术十分重要,而对于有生育要求的女性再次行保守性手术是可以考虑的,前提是应充分向患者告知复发的风险,并且患者能够进行严密随访和接受再次手术[16]。如果复发后诊断为浸润性种植,保守手术是不适合的。对于任何复发后的二次手术,全面根治手术是非常关键,若不能得到满意的根治性手术,生存率会较低。
3.3术后辅助治疗上皮性卵巢癌患者术后辅以化疗,对缓解症状、提高生活质量、延长生存期有重要作用已不容置疑。但对于BOT患者,术后是否辅助治疗却存在争议。目前国内外尚无研究表明术后化疗可以改善患者预后、降低复发率、提高生存率,故主张Ⅰ期患者不需要任何术后辅助治疗。Morice等[17]对伴有浸润性腹膜种植的患者术后可辅助化疗,以减少复发。因此,我们认为对晚期(Ⅲ期以上)、肿瘤巨大并种植广泛,肿瘤有外生乳头及浸润生长倾向,病理提示有复发的高危因素如浸润种植、DNA多倍体及多核异型等,腹腔积液,血清CA125明显升高的患者行辅助化疗可能利大于弊。
3.4预后及随访BOT具有恶性程度低、复发晚、生存率高、预后好的特点。研究表明复发性BOT的5、10年生存率分别为90%和80%,而未复发患者的5、10年生存率分别为98.9%和94.4%,平均复发年龄为(2.0±1.7)年[18]。因此,BOT患者需要长期随访。随访的内容应包括体格检查(包括盆腔检查)、影像学检查等,以及血清肿瘤标志物CA125、CA199、CEA等检查。前2年应每2~4个月随访1次,此后每3~6个月随访1次,共3年;5年后每年随访1次,终身随访。
[参考文献]
[1]Tropé CG,Kaern J,Davidson B. Borderline ovarian tumours[J]. Best Pract Res Clin Obstet Gynaecol,2012,26(3):325-336.
[2]Ayhan A,Guven S,Guven ES,et al. Is there a correlation between tumor marker panel and tumor size and histopathology in well staged patients with borderline ovarian tumors?[J]. Acta Obstet Gynecol Scand,2007,86(4):484-490.
[3]Park SY,Oh YT,Jung DC. Differentiation between borderline and benign ovarian tumors:combined analysis of MRI with tumor markers for large cystic masses(≥5 cm)[J]. Acta Radiol,2015 [Epub ahead of print].
[4]Song T,Choi CH,Kim HJ,et al. Accuracy of frozen section diagnosis of borderline ovarian tumors[J].Gynecol Oncol,2011,122(1):127-131.
[5]Camatte S,Morice P,Thoury A,et al. Impact of surgical staging in patients with macroscopic “stage I” ovarian borderline tumours:analysis of a continuous series of 101 cases[J]. Eur J Cancer,2004,40(12):1842-1849.
[6]Black JD,Altwerger GH,Ratner E,et al. Management of borderline ovarian tumors based on patient and tumor characteristics[J]. Gynecol Obstet Invest,2015 [Epub ahead of print].
[7]Djordjevic B,Malpiea A. Lymph node involvement in ovarian serous tumors of low malignant potential:a clinicopathoiogic study of thirty-six cases[J]. Am J Surg Pathol,2010,34(3):1-9.
[8]Snider DD,Stuart GC,Nation JG,et al. Evaluation of surgical staging in stage I low malignant potential ovarian tumors[J]. Gynecol Oncol,1991,40(2):129-132.
[9]Ronnett BM,Kurman RJ,Zahn CM,et al. Pseudomyxoma peritonei in women:a clinicopathologic analysis of 30 cases with emphasis on site of origin,prognosis,and relationship to ovarian mucinous tumors of low malignant potential[J]. Hum Pathol,1995,26(5):509-524.
[10]Leake JF,Rader JS,Woodruff JD,et al. Retroperitoneal lymphatic involvement with epithelial ovarian tumors of low malignant potential[J]. Gynecol Oncol,1991,42(2):124-130.
[11]Cadron I,Leunen K,Van Gorp T,et al. Management of borderline ovarian neoplasms[J]. J Clin Oncol,2007,25(20):2928-2937.
[12]Fortin A,Morice P,Thoury A,et al. Impact of infertility drugs after treatment of borderline ovarian tumors:results of a retrospective multicenter study[J]. Fertil Steril,2007,87(3):591-596.
[13]Vandenput I,Amant F,Vergote I. Peritoneal recurrences might be less common in advanced stage serous borderline ovarian tumors that were treated by laparotomy[J]. Gynecol Oncol,2005,98(3):523-525.
[14]Maltaris T,Boehm D,Dittrich R,et al. Reproduction beyond cancer:a message of hope for young women[J]. Gynecol Oncol,2006,103(3):1109-1121.
[15]Song T,Choi CH,Park HS,et al. Fertility-sparing surgery for borderline ovarian tumors:oncologic safety and reproductive outcomes[J].Int J Gynecol Cancer,2011,21(4):640-646.
[16]Cadron I,Amant F,Van Gorp T,et al. The management of borderline tumours of the ovary[J]. Curr Opin Oncol,2006,18(5):488-493.
[17]Morice P,Canmtte S,Bey A,et al.Prognostic factors for patients with advanced stage serous borderline turnouts of the ovary[J]. Ann Oncol,2003,14(4):592-598.
[18]Lenhard MS,Mitterer S,Kümper C,et al. Long-term follow-up after ovarian borderline tumor:relapse and survival in a large patient cohort[J]. Eur J Obstet Gynecol Reprod Biol,2009,145(2):189-194.
(本文编辑:赵丽洁)
[收稿日期]2015-08-07;[修回日期]2015-08-31
[作者简介]张琳(1981-),女,江西新余人,河北医科大学第二医院主治医师,医学硕士,从事妇产科疾病诊治研究。 *通讯作者。E-mail:huangxh2003@163.com
[中图分类号]R737.31
[文献标志码]B
[文章编号]1007-3205(2016)05-0602-04
