替考拉宁的药动学影响因素及治疗药物监测研究进展Δ
2016-08-15李朋梅陈文倩王晓雪张相林
李朋梅,陈文倩,王晓雪,张相林
(中日友好医院药学部,北京 100029)
·本期特稿·
替考拉宁的药动学影响因素及治疗药物监测研究进展Δ
李朋梅*,陈文倩,王晓雪,张相林#
(中日友好医院药学部,北京100029)


图1 替考拉宁的分子结构
1 替考拉宁的药理作用机制
替考拉宁的作用机制与万古霉素和其他糖肽类抗菌药物相似,与细菌接触后很快进入细胞膜内与胞壁黏肽合成的前体UDP-N-乙酰壁氨酸所接5肽的最后2个氨基酸形成的二肽相连接,在末端以D-丙氨酸-D-丙氨酸的顺序形成复合物,使胞壁黏肽所必需的基本结构双糖十肽不能按要求运送至胞壁合成部位,阻碍转糖基反应,抑制黏肽形成,从而抑制细胞壁的合成。同时,这种复合物堆积在细胞膜内,对细胞膜的正常合成也起着阻碍作用,间断影响细胞膜的形成,使细胞壁和细胞膜的完整性遭到破坏,致使细菌死亡。由于替考拉宁独特的作用机制,很少出现耐药菌株,对青霉素类及头孢菌素类、大环内酯类、四环素、氯霉素、氨基糖苷类和利福平耐药的革兰阳性菌仍对替考拉宁敏感。
2 替考拉宁的药动学特点
替考拉宁口服不吸收,可以肌内注射和静脉给药。其在人体血浆中呈双相分布,在人体内的蛋白结合率为90%~95%,组织穿透力强,尤其在肺泡上皮细胞衬液中含量高达48%~332%,静脉给药仅2%~3%代谢,大部分以原形药经肾脏排出。由于替考拉宁的蛋白结合率高、半衰期(t1/2)较长(30~180 h),肾功能不全不影响其在血液中的分布,但严重影响其清除率,导致t1/2延长。1项在中国持续性不卧床腹膜透析患者中的试验结果显示,替考拉宁的药-时曲线下面积(AUC0~72 h)为(921.51±147.22) mg·h/L,t1/2为(76.89±21.06) h,清除率(CLT)为(0.45±0.02) L/h。
3 影响替考拉宁药动学的因素
3.1人口学特征
3.1.1新生儿及儿童:新生儿和儿童对药物的体内处置过程与成人有显著差异。在新生儿和儿童中,为了达到有效治疗浓度,提高替考拉宁基于体质量的给药剂量是非常必要的。在早产儿中,给予15 mg/kg的负荷剂量和8 mg/kg的维持剂量可有效提高达到谷浓度(Cmin)为15 mg/L的比例。对于儿童,清除率高于成人35 ml/(h·kg),给予8 mg/kg的负荷剂量和6 mg/kg的维持剂量可以达到10 mg/L的有效Cmin[1]。
3.1.2肾功能正常的成年和老年患者:肾功能正常的成年和老年患者,替考拉宁的药动学参数符合三室模型,初始相、第二相和终末相的t1/2分别为35 min、10 h和87 h。重度感染时可先给予替考拉宁首剂负荷量400 mg静脉注射,然后给予静脉或肌内注射200 mg,按每24 h给药1次的维持剂量,可使大多数患者达到最低有效血清浓度。Uhart等[2]考察了老年患者替考拉宁药动学的个体间和个体内差异,老年人由于肾功能的个体化差异很大,药动学参数的变异系数达125%~694%,故需要进行替考拉宁的血药浓度监测。
3.2病生理状态
3.2.1肾功能不全:肾损害患者、正常对照组患者分别于0、12、24 h静脉注射替考拉宁6 mg/kg,给药24 h后平均血药浓度分别为17.5、13.5 mg/L,给药48 h后平均血药浓度分别为8.8、4.1 mg/L。另一项研究结果显示,对于肌酐清除率为13~25 ml/min的患者,给予替考拉宁3 mg/kg,其t1/2延长至280~667 h。Federico等的研究结果显示,对202例重症感染患者进行治疗药物监测(therapeutic drug monitoring,TDM)协助调整给药方案,其中106例肾功能正常(肌酐清除率>60 ml/min)、41例存在轻度肾功能不全(肌酐清除率为40~60 ml/min)、55例存在重度肾功能不全(肌酐清除率为40 ml/min),替考拉宁每日给药量分别为(7.23±3.08)、(4.53±3.09)、(3.61±1.93)mg/kg。在治疗的第2、3、4日,患者平均Cmin分别为4.98、7.64、9.40 mg/L,仅3.2%的患者在第2日的Cmin>10 mg/L,而第7、11、15日,达标率分别升至70%、90%、95%,由此可见,当头2 d的负荷给药结束后,需要根据患者TDM结果和肌酐清除率调整维持量。对于大多数患者来说,至少在治疗开始4 d后Cmin才能>10 mg/L,且起始的负荷给药方式对于早期达到有效治疗浓度亦有帮助(P=0.001),因此,当肾功能不全患者在使用替考拉宁时,应常规给予负荷量6 mg/kg、每12 h给药1次,再24 h给予1剂达到稳态,此后根据患者肌酐清除率和TDM结果调整维持量。治疗期间,4例患者出现肾功能损伤,其中3例联合应用阿米卡星等肾毒性药物,因此难以将这3例定为替考拉宁的不良反应;而另外1例患者的肾功能损伤是在使用替考拉宁3周后出现的,考虑和药物不良反应密切相关。
3.2.2血液净化:替考拉宁很难透过腹膜。Guay等研究结果显示,对于5例未发生感染的持续不卧床腹膜透析患者,静脉注射替考拉宁6 mg/kg时,平均血药峰浓度(Cmax)为(56.50±7.5) mg/L,腹透液平均药物浓度为(1.10±0.16) mg/L,t1/2为(266.4±51.9) h,全身清除率为(0.040±0.004)m/(kg·min),平均腹膜清除率为(0.007±0.001) ml/(kg·min);而腹腔注射替考拉宁6 mg/kg时,平均Cmax为(8.0±0.6) mg/L,腹透液平均药物浓度(196.9±29.7) mg/L。Stamatiadis等进一步研究发现,仅3.16%的药物经腹膜排泄。血液透析患者替考拉宁的清除率与超滤率密切相关,当超滤率为15.6 L/24 h时,治疗24 h后,400 mg替考拉宁有32%被清除;而超滤率降至6.2 L/24 h时,仅9.5%被清除。连续血液滤过透析患者可以通过高通量半透膜清除部分替考拉宁。Yagasaki等进一步研究发现,接受连续血液滤过透析的患者给予替考拉宁400 mg/d,t1/2为(78.6± 12.6) h,CLT为(11.3 ± 9.1) ml/min。因此,建议对于连续血液透析患者可以适当减少替考拉宁给药剂量,并延长给药间隔。Hillaire-Buys等发现,对于使用聚砜膜滤器的连续性动静脉血液滤过患者,当替考拉宁给药方案与Choufane相同时,经动脉端采集血样,替考拉宁平均血药浓度在第0.5 h(即静脉滴注结束时)和第24 h分别为(45.6±15.1)和(2.6±1.0) mg/L,治疗24 h后,11例患者中,有7例废液中的替考拉宁量不足总给药量的1%,3例为1.8%~3.8%,1例为7%。提示血液滤过仅能清除少量替考拉宁,对于此类患者,建议根据其肌酐清除率调整给药剂量,对于轻度和重度肾功能不全的患者,可以在治疗头3 d按照常规剂量给予替考拉宁,此后每日可分别给予常规剂量的1/2或1/3,或者每隔2~3 d按常规剂量给药1次[3]。
3.3低蛋白血症患者
重症感染患者独特的病生理状态改变了抗菌药物在其体内的处置。低蛋白血症对替考拉宁药动、药效学的影响较大,替考拉宁的蛋白结合率达90%以上,蛋白结合率下降5.0%可使游离型药物浓度增加2~5倍,游离药物浓度的增加又会引起药物清除率的改变。Roberts等[4]报道替考拉宁在重症监护病房患者体内的清除率增加了36%。非重症感染患者合并低蛋白血症时是否也存在同样的现象?Brink等[5]考察了慢性骨髓炎合并低蛋白血症的患者(血清白蛋白<35 g/L),结果显示,游离替考拉宁的清除率显著高于总的替考拉宁的清除率[38.6(IQR=29.9~47.8)L/h vs.7.0(IQR=6.8~9.8)L/h];多元线性回归分析结果显示,低蛋白血症是游离药物浓度的显著影响因素,因此建议应监测低蛋白血症患者的游离药物浓度。
4 TDM
监测替考拉宁血药浓度的必要性已被越来越多的研究所证实,尤其是高龄老年患者、重症患者等特殊人群,其病理生理的改变等因素导致药物分布与清除发生变化,进而影响血药浓度及治疗效果,需对此类患者进行TDM。替考拉宁的药动学监测指标有体内药物暴露量(AUC0~24 h)、游离谷浓度(fCmin)、Cmin。但到目前为止,研究比较充分的仍然是Cmin。Hagihara等[6]报道替考拉宁AUC0~24 h达800 mg·h/L,抗菌治疗有效率超过60%。Zhao等提出在儿童中AUC0~24 h的有效值需要达到750 mg·h/L。Roberts等[7]研究结果显示,替考拉宁fCmin在重症感染患者中的差异达到了45倍,虽然fCmin的有效范围目前尚没有确定,但这是非常有价值的药动学监测指标。目前国外比较公认的替考拉宁治疗窗为:血药浓度<10 mg/L未达到有效治疗Cmin,非复杂感染的有效Cmin为≥10 mg/L,严重感染、深部复杂感染包括菌血症、心内膜炎、骨髓炎的有效Cmin为20~60 mg/L,中毒Cmin上限为≥60 mg/L[8]。2013年中国医师协会呼吸医师分会发布的《替考拉宁临床应用剂量中国专家共识》中提到Cmin>10 mg/L适用于绝大多数严重感染,对于感染性心内膜炎和骨或假体感染则Cmin应达到15~20 mg/L。国内外对于替考拉宁Cmin的有效范围尚没有一致结论,国内普遍采用较低的治疗窗。近年来,国外对替考拉宁Cmin水平与不良反应发生的相关性进行了进一步研究。Matthews等[8]回顾分析了替考拉宁不同维持剂量方案对严重感染患者血液Cmin水平的影响,共纳入549例门诊抗菌治疗患者,结果显示,替考拉宁600 mg、1日1次(前2剂负荷剂量每12 h给药1次)给药方案的患者更容易达到20~60 mg/L的Cmin水平,且未增加药品不良反应发生率。
4.1常用监测方法
替考拉宁常规监测方法主要是荧光偏振免疫分析法(fluorescence polarization immunoassay,FPIA)、均相免疫比浊定量微球系统(quantitative microsphere system technology,QMS)、高效液相色谱-紫外检测法(high performance liquid chromatography-ultraviolet,HPLC-UV)、液相色谱-串联质谱联用法(liquid chromatography tandem mass spectrometry,LC/MS/MS)[9-10]。这些测定方法在灵敏度和专属性方面会有一些差异。FPIA方便快捷,普及程度较高,但试剂成本高,专属性差。HPLC-UV的前处理复杂,分析时间长,在某些情况下不能满足分析的专属性和灵敏度要求。LC/MS/MS目前是体内药物分析的主要技术手段,是大多数体内药物浓度检测的金标准。Mueller等[11]报道LC/MS/MS与QMS法测定替考拉宁浓度的转换关系为LC/MS/MS=0.856×QMS-1.16 mg/L(r2=0.73)。同时,分析了LC/MS/MS法测定结果较FPIA和QMS法低的可能原因有:(1)免疫方法存在结构类似物的交叉反应;(2)在低浓度区域,免疫方法的测定精密度较差。Fung等[12]报道LC/MS/MS与FPIA法测定替考拉宁浓度的转换关系为LC/MS/MS=0.531×FPIA+4.7866 mg/L(r2=0.86)。Dailly等[13]报道FPIA与QMS法一致性较好,转换关系为QMS=1.031 9×FPIA-2.851 8 mg/L(r2=0.924 6)。部分TDM相关研究的报道汇总见表1。
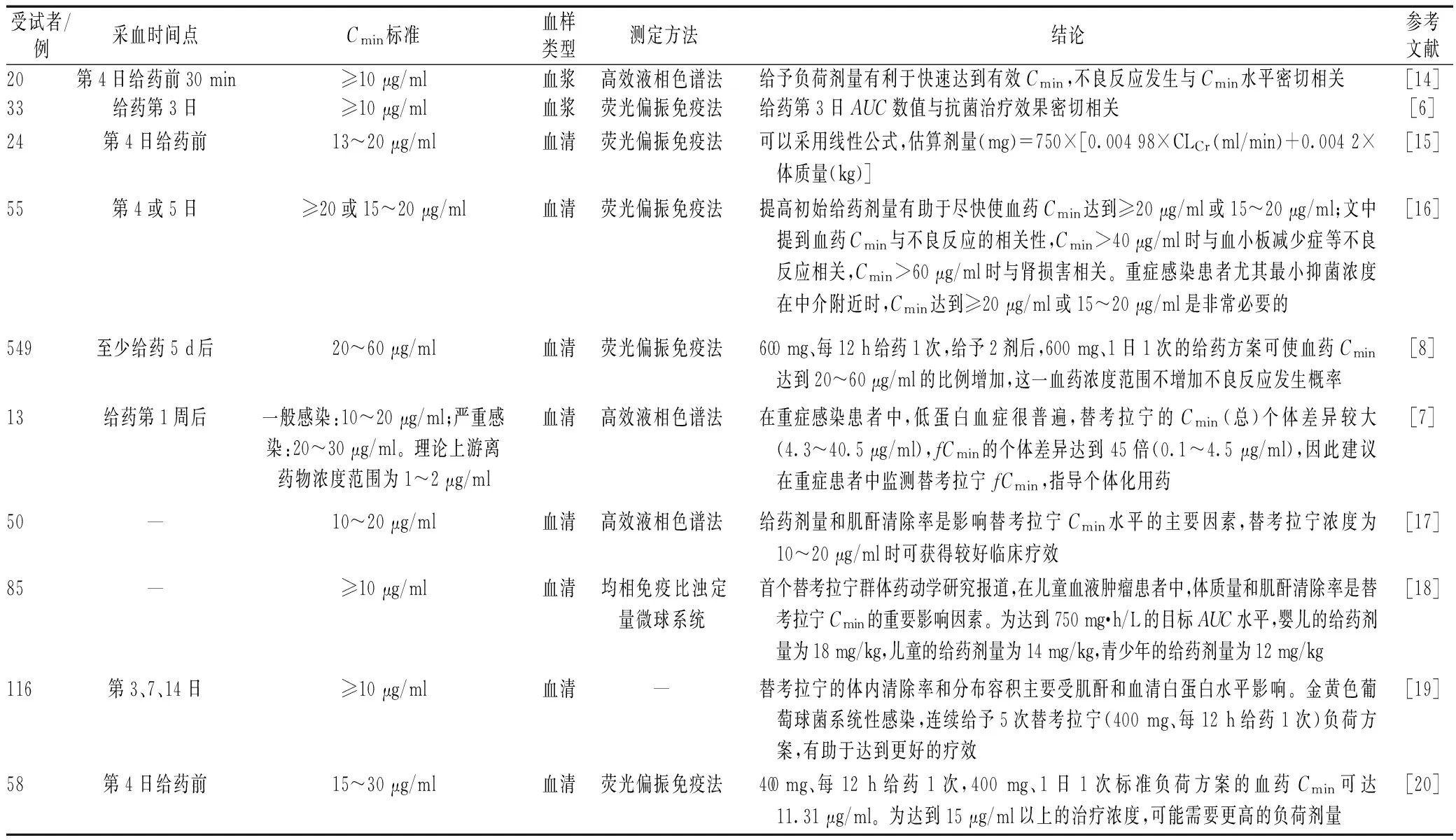
表1 替考拉宁TDM相关研究
注:“—”表示无相关数据
4.2血样采集保存
替考拉宁的t1/2长,达稳态时间久。目前的报道采血时间一般在第4日给药前,标准尚不统一(见表1),主要与初始负荷给药剂量相关。研究结果显示,血清或血浆样品在室温(25 ℃)保存12 h,-20 ℃保存15 d,反复冻融3次,替考拉宁可保持稳定[21]。
4.3群体药动学
替考拉宁的群体药动学研究报道较少。Zhao等[18]首次报道了替考拉宁在儿童血液肿瘤患者中的群体药动学研究,结果显示,体质量和肌酐清除率是显著影响替考拉宁在体内清除率的因素,并通过模拟得到了公式(1):CL=0.491×(体质量/27.1)0.75×(CLCr/179)0.606,公式(2):优化日剂量i(mg/d)=目标AUC0~24 h×CLi。其中CLCr为肌酐清除率,单位为ml/min,体质量单位为kg。通过公式(1)、(2)可以估算出为达到目标AUC0~24 h所需的初始日剂量。Ramos-Martín等[22]报道了替考拉宁的儿童群体药动学参数:CL为0.023 L/(h·kg),表观分布容积为4.183 L。
综上所述,替考拉宁是继万古霉素后研制的治疗革兰阳性球菌的糖肽类抗菌药物,目前仍与万古霉素共同作为确诊或疑似的院内威胁患者生命的耐多药革兰阳性球菌感染的有力武器。提高疗效、降低耐药率要求必须对替考拉宁实行个体化给药。目前,国外对替考拉宁药动学及TDM的研究较多,但其TDM在国内尚未全面普及。本文通过查阅大量国内外文献,将替考拉宁的药动学影响因素及TDM相关研究进行了汇总,对于替考拉宁个体化给药方案的制订有一定的指导作用。替考拉宁的相关监测指南尚未出台,统一监测方法和治疗窗也是未来需要努力的方向。
[1]胡萨萨,董亚琳.替考拉宁在不同人群中的药动学及给药方案分析[J].西北药学杂志,2009,24(3):232-234.
[2]Uhart M,Leroy B,Michaud A,et al.Inter-individual and intra-individual pharmacokinetic variability during teicoplanin therapy in geriatric patients[J].Med Mal Infect,2013,43(7):295-298.
[3]李昊,田刚,王雪.肾功能不全患者替考拉宁药物浓度监测的研究进展[J].中国抗生素杂志,2010,35(11):815-819.
[4]Roberts JA,Pea F,Lipman J.The clinical relevance of plasma protein binding changes[J].Clin Pharmacokinet,2013,52(1):1-8.
[5]Brink AJ,Richards GA,Lautenbach EE,et al.Albumin concentration significantly impacts on free teicoplanin plasma concentrations in non-critically ill patients with chronic bone sepsis[J].Int J Antimicrob Agents,2015,45(6):647-651.
[6]Hagihara M,Umemura T,Kimura M,et al.Exploration of optimal teicoplanin dosage based on pharmacokinetic parameters for the treatment of intensive care unit patients infected withwith methic-illin-resistant Staphylococcus aureus[J].J Infect Chemother,2012,18(1):10-16.
[7]Roberts JA,Stove V,De Waele JJ,et al.Variability in protein binding of teicoplanin and achievement of therapeutic drug monitoring targets in critically ill patients: lessons from the DALI Study[J].Int J Antimicrob Agents,2014,43(5):423-430.
[8]Matthews PC,Chue AL,Wyllie D,et al.Increased teicoplanin doses are associated with improved serum levels but not drug toxicity[J].J Infect,2014,68(1):43-49.
[9]Begou O,Kontou A,Raikos N,et al.An ultra-high pressure liquid chromatography-tandem mass spectrometry method for the quantifi-cation of teicoplanin in plasma of neonates[J].J Chromatogr B Analyt Technol Biomed Life Sci,2016,pii:S1570-0232(16)30049-6.
[10]Tsai IL,Sun HY,Chen GY,et al.Simultaneous quantification of anti-microbial agents for multidrug-resistant bacterial infections in human plasma by ultra-high-pressure liquid chromatography-tandem mass spectrometry[J].Talanta,2013,116:593-603.
[11]Mueller DM,von Eckardstein A,Saleh L.Quantification of teicoplanin in plasma by LC-MS with online sample clean-up and comparison with QMS assay[J].Clin Chem Lab Med,2014,52(6):879-887.
[12]Fung FH,Tang JC,Hopkins JP,et al.Measurement of teicoplanin by liquid chromatography-tandem mass spectro-metry: development of a novel method[J].Ann Clin Biochem,2012,49(Pt 5):475-481.
[13]Dailly E,Fraissinet F,Deslandes G,et al.Evaluation of the QMS©Teicoplanin Immunoassay(Thermo Fisher Scientific) on Cobas©8000 System(Roche Diagnostics) and comparison to fluorescence polarization immunoassay for the determination of teicoplanin concentrations in human plasma[J].J Clin Lab Anal,2013,27(2):96-98.
[14]李昊,王雪,董海燕,等.ICU患者替考拉宁给药方式及药物浓度监测的临床意义探讨[J].中国临床药理学与治疗学,2011,16(5):538-544.
[15]Kanazawa N,Matsumoto K,Ikawa K,et al.An initial dosing method for teicoplanin based on the area under the serum concentration time curve required for MRSA eradication[J].J Infect Chemother,2011,17(2):297-300.
[16]Seki M,Yabuno K,Miyawaki K,et al.Loading regimen required to rapidly achieve therapeutic trough plasma concentration of teicoplanin and evaluation of clinical features[J].Clin Pharmacol,2012,4:71-75.
[17]Wang T,Li N,Hu S,et al.Factors on trough teicoplanin levels, associations between levels, efficacy and safety in patients with gram-positive infections[J].Int J Clin Pharmacol Ther,2015,53(5):356-362.
[18]Zhao W,Zhang D,Storme T,et al.Population pharmacokinetics and dosing optimization of teicoplanin in children with malignant haema-tological disease[J].Br J Clin Pharmacol,2015,80(5):1197-1207.
[19]Ogawa R,Kobayashi S,Sasaki Y,et al.Population pharmacokinetic and pharmacodynamic analyses of teicoplanin in Japanese patients with systemic MRSA infection[J].Int J Clin Pharmacol Ther,2013,51(5):357-366.
[20]Yamada T,Nonaka T,Yano T,et al.Simplified dosing regimens of teicoplanin for patient groups stratified by renal function and weight using Monte Carlo simulation[J].Int J Antimicrob Agents,2012,40(4):344-348.
[21]胡萨萨,庞成森,董海燕,等.危重症感染患者血清中替考拉宁浓度测定[J].中国医院药学杂志,2011,31(9):753-755.
[22]Ramos-Martín V,Paulus S,Siner S,et al.Population pharmacokinetics of teicoplanin in children[J].Antimicrob Agents Chemother,2014,58(11):6920-6927.
2016-06-09)
国家自然科学基金青年项目(No.81302843);中日友好医院院级课题(No.2014-4-QN-31)
主任药师,副教授,硕士生导师。研究方向:个体化给药与临床药理学。E-mail:zryhyyzxl@126.com
R969.1
A
1672-2124(2016)07-0865-04
10.14009/j.issn.1672-2124.2016.07.001
*副主任药师,硕士。研究方向:药动学与治疗药物监测。E-mail:lipengmei@yeah.net
