一株紫菜腐霉的鉴定及其对条斑紫菜的致病性❋
2016-08-13李淑芬莫照兰孔凡娜茅云翔
李淑芬, 莫照兰, 孔凡娜, 朱 明, 茅云翔
(1.中国海洋大学海洋生命学院遗传与育种实验室,山东 青岛 266003; 2.中国水产科学研究院黄海水产研究所,农业部海洋渔业可持续发展重点实验室,山东 青岛 266071; 3.江苏连云港龙源生物科技有限公司,江苏 连云港 222000)
一株紫菜腐霉的鉴定及其对条斑紫菜的致病性❋
李淑芬1, 莫照兰2❋❋, 孔凡娜1, 朱明3, 茅云翔1
(1.中国海洋大学海洋生命学院遗传与育种实验室,山东 青岛 266003; 2.中国水产科学研究院黄海水产研究所,农业部海洋渔业可持续发展重点实验室,山东 青岛 266071; 3.江苏连云港龙源生物科技有限公司,江苏 连云港 222000)
摘要:NBRC33253为日本NITE生物资源中心的保藏菌株,分离自患赤腐病的紫菜。为鉴定其特征及致病性,对NBRC33253进行形态学观察和分子鉴定,检测温度和盐度对其生长的影响,并在不同温度、盐度、感染浓度下检测NBRC33253对条斑紫菜的致病性。研究显示:NBRC33253具有腐霉属的典型特征:在半海水玉米粉固体培养基表面和培养基内生长良好,菌丝发达、有横隔,可形成丝状孢子囊、球形藏卵器、凹形雄器。ITS序列分析证实其为紫菜腐霉(Pythrium porphyrae)。生长实验发现,该菌在温度16~36℃、盐度10~40范围内生长良好,其最适生长温度为28℃、最适生长盐度为20。人工感染实验显示,该菌可引起条斑紫菜的赤腐病病征,在较高温度(18~23℃)、较低盐度(24~29)、较高病原浓度(0.1~1.0mg/mL)下最容易发生赤腐病。研究结果表明,NBRC33253可引起条斑紫菜腐霉病。本研究为进一步了解紫菜腐霉的致病机理和抗病紫菜品系的筛选提供了材料。
关键词:紫菜腐霉;鉴定;条斑紫菜;致病性;赤腐病
引用格式:李淑芬, 莫照兰, 孔凡娜, 等.一株紫菜腐霉的鉴定及其对条斑紫菜的致病性[J].中国海洋大学学报(自然科学版), 2016, 46(7): 27-34.
LI Shu-Fen, MO Zhao-Lan, KONG Fan-Na, et al. Identification of aPythriumporphyraestrain causing the red rot disease ofPorphyrayezoensis[J].Periodical of Ocean University of China, 2016, 46(7): 27-34.
中国紫菜养殖产量居世界第一位,2014年中国渔业年鉴资料显示,2013年条斑紫菜(Pyropiayezoensis)和坛紫菜(Porphyrahaitanensis)产量11.23万t(干品),产值超过20亿元人民币。多年来紫菜病害时常发生,导致紫菜质量下降甚至绝产,造成严重的经济损失。紫菜的丝状体和叶状体阶段均有多种疾病发生,常见的紫菜丝状体病害有泥红病、绿变病、鲨皮病等[1];叶状体常见的病害有赤腐病、拟油壶病、绿斑病、缩曲症、癌肿病等[2]。赤腐病是危害条斑紫菜养殖最严重一种疾病,该病最早于1947年在日本发现[3],在1970年证实病原为紫菜腐霉(Pythiumporphyrae)[4],之后在韩国、美国和中国相继发现该病[5]。1996年在中国江苏条斑紫菜养殖海区首次报道赤腐病[6],最近在福建坛紫菜也发现了该病[7]。国内学者对相关病原的侵染过程和发病条件进行了研究[6-8],但目前尚无有效的方法预防赤腐病的发生。筛选抗病紫菜品系被认为是抵抗赤腐病的一种有效的方法。本实验室正开展紫菜赤腐病流行病学调查,拟对不同地方来源的病原株开展生理、致病性、遗传等方面的研究。NBRC33253为日本NITE生物资源中心的保藏菌株,分离自患赤腐病的紫菜,但其鉴定特征和致病性尚不明确。本研究对NBRC33253进行了形态和分子鉴定、生长特性及致病性研究,旨在为深入了解紫菜腐霉致病机理、制定疾病防治措施、培育抗病紫菜品系提供病原真菌研究材料。
1 材料和方法
1.1 藻株和菌株
条斑紫菜PY4-7株(来源于中国海洋大学海洋生命学院遗传与育种实验室)培养于PES[9],培养条件为:温度15℃,盐度28~29,光照强度62.5μmol/(m2·s),光暗周期12L∶12D,充气培养,每3天换一次培养基,生长和形态无异常的紫菜用于后续实验。NBRC33253(购自于日本生物资源库)的固体培养用半海水玉米粉琼脂培养基(CMM)[3],22℃;液体培养用谷氨酸钠液体培养基[8],20℃ 100r/min摇床。
1.2 NBRC33253的形态观察
NBRC33253在CMM培养10d后,用打孔器(口径8mm)在菌落边缘扣取1块含有菌丝的培养基转接至新的CMM进行培养,每天肉眼观察NBRC33253的生长情况,并在光学显微镜(Olympus CX31,日本)下观察菌丝的形态。
1.3 ITS序列扩增和系统发育学分析
收集NBRC33253菌丝用于基因组DNA提取[9],作为模板用于PCR扩增ITS序列,按照文献[11]提供的引物和方法进行PCR扩增。所得PCR产物送上海华大进行测序,测序结果在GenBank中进行BLAST同源性比对,从GenBank获取其他相关菌的ITS序列。采用ClustalW软件进行多序列比对,应用Mega5.3软件采用邻接法(Neighbor-joining)构建系统发育树,模型为Kimura 2-paramete,并以自展法(Bootstrap)进行各分支的置信度检验,共循环1000次[7]。
1.4 温度和盐度对NBRC33253生长的影响
NBRC33253在CMM固体培养基上生长5d后,收集菌丝体用灭菌海水冲洗3次,用灭菌吸水纸吸干后称湿重,将1mg的菌丝转接到200mL谷氨酸钠液体培养基(pH=7.5)。进行温度实验时,设置温度范围为4~36℃,盐度为18;进行盐度实验时,设置盐度范围为5~50,培养温度为20℃。每个实验组设置3个平行。培养7d后收集菌丝,测量每个实验组的菌丝体重量。用SPSS16.0对各温度水平间和各盐度水平间进行显著性差异分析,两水平间的P<0.05为显著性差异。
1.5 人工感染实验及组织病理观察
NBRC33253在谷氨酸钠液体培养基(pH=7.5)培养7d,收集菌丝称重置于装有200mL灭菌海水的锥形瓶中,制成终浓度为1.0mg/mL的菌丝体悬液。在每个含有菌丝体悬液的锥形瓶中放入5张健康条斑紫菜成体,每张长度10~12cm、宽度3~4cm;设置无添加菌丝的实验组为对照组。每组实验设置3个重复。所有实验组置于光照培养箱中培养,培养温度15℃,每天肉眼观察紫菜发病情况,切取患病部位叶片进行常规制片,在光学显微镜下进行组织病理观察,同时取患病叶片进行病原的分离培养、形态观察、ITS序列分析,以验证分离菌株是否为NBRC33253。
1.6 环境因子对感染效果的影响
在实验室条件下研究不同温度、盐度、感染浓度(NBRC33253菌丝重量)对感染程度的影响,实验体系同1.5,温度设8、13、18和23℃,盐度设24、29、34和39,感染浓度为1.0、0.5、0.1和0.01mg/L。进行不同温度实验时,设置盐度为28,腐霉浓度为0.5mg/mL;进行不同盐度实验时,设置温度为15℃,腐霉浓度为0.5mg/mL;进行不同浓度实验时,设置温度为15℃,盐度为28。每个处理组均设置不加腐霉菌丝的实验组为对照,各个处理组和对照组设置3个平行。实验期间,每天观察紫菜发病情况,以肉眼可观察到红色斑点为疾病发生时间,一周后用叶面积仪(Yaxin-124,北京雅欣仪科有限公司)计算紫菜页片病斑面积占总紫菜叶片面积的百分比。
2 结果
2.1 NBRC33253的生长及形态特征
NBRC33253在CMM固体培养基上表现为菌丝衍生到培养基内生长,在整个培养期内呈乳白色。培养前期的菌落形状平滑,培养至5d左右,有的菌落出现放射型或兼平滑型和放射型(见图1A,平滑型);培养至10d左右,菌落在培养基内布满整个培养皿,培养基表面有数量极少的隆起的菌丝。
在显微镜下观察,菌丝在培养基表面无特定形态,分枝发达。培养前期的菌丝无色、无隔,培养7d左右菌丝出现横隔有隔并呈淡黄色(见图1B)。无性生殖期间,可观察到在菌丝体的顶端或中间产生长筒状的游动孢子囊(见图1C),孢子囊伸长形成排孢管,顶端膨大成近球形的泡囊,孢子囊原生质进入包囊内形成多个游动孢子,泡囊破裂后释放出游动孢子。有性生殖期间,有些菌丝中间或顶端出现球形的藏卵器,内有球形的卵孢子(见图1D),有些菌丝一端产生凹形的雄器呈,扣在藏卵器一侧(见图1E)。
2.2 NBRC33253的ITS系统发育学分析
NBRC33253的ITS序列全长为870bp,BLAST结果显示该序列与紫菜腐霉P.porphyrae的相似度为99%~100%,在系统发育树与紫菜腐霉聚为一支,自举值为99%(见图2)。这个结果表明NBRC33253为紫菜腐霉。
2.3人工感染实验及组织病理的观察
以浓度为1.0mg/mL的紫菜腐霉菌丝体感染紫菜,2天后可肉眼观察到藻体不定位置出现锈红色斑点;随时间延长,病斑逐渐增大,由针尖大小增加至直径2cm以上,颜色逐渐变为黄褐色或淡黄色(见图3B),边缘稍带红色;随着病程发展,大小不同的病斑连接成片形成腐烂的孔洞,叶片呈现绿色(见图3C),最后导致腐烂组织流失,出现病症到紫菜叶片腐烂流失的时间为5~7d。实验期间,对照组藻体没有出现上述病变(见图3A)。
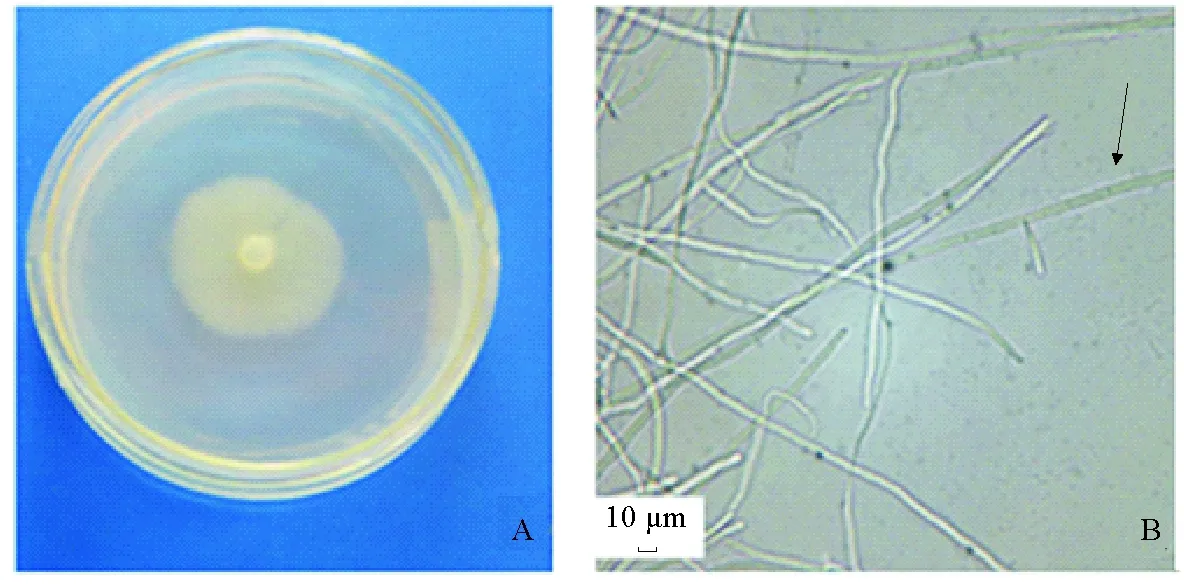

(A 菌落形态Colony morphology;B 菌丝Hyphae;C 游动孢子囊,示泡囊(箭头1)和排孢管(箭头2)Zoosporangium, presenting hyphae swelling (arrow 1) and spore excretion tube ( arrow 2);D 卵孢子(箭头)Oospores (arrow);E 藏卵器(箭头1)和雄器(箭头2)Archegonium (arrow 1) and antheridium (arrow 2).)
图1光学显微镜观察NBRC33253形态
Fig.1Morphology of NBRC33253 observed under light microscopy
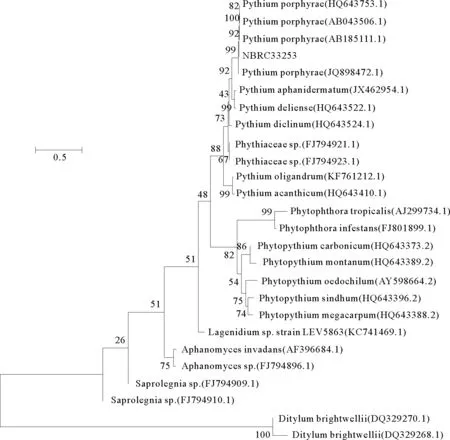
图2 基于ITS基因序列构建的N-J系统进化树

(A对照组紫菜The controlP.yezoensisthalli without infection ofP.porphyrae;B感染腐霉后的紫菜,叶片呈黄褐色TheP.yezoensisthalli infected withP.porphyrae, presenting yellow color;C感染腐霉后的紫菜,叶片呈黄绿色TheP.yezoensisthalli infected withP.porphyrae, presenting green color.)
图3感染紫菜腐霉后发生赤腐病的条斑紫菜
Fig.3Red rot symptom ofP.yoenzosisinfected withP.porphyrae
在低倍镜下,发现紫菜病斑区细胞收缩、颜色变淡,与周围正常细胞有明显的区别(见图4C)。高倍镜下,病斑处的紫菜细胞被菌丝体贯穿,萎缩均质化(见图4D),在一些被菌丝体穿透的细胞发现有桃红色藻红素流出(见图4E);在病灶处还发现了孢子囊和藏卵器(见图4F)。对照组紫菜细胞没有发现病理变化(见图4A、4B)。从患病叶片分离到形态一致的纯菌落,随机挑取部分菌落进行显微观察和ITS序列分析,显示它们的显微特征和ITS序列与NBRC33253一致。上述结果表明NBRC33253可以感染条斑紫菜引起赤腐病。
2.4 温度和盐度对紫菜腐霉生长的影响
表1数据显示,紫菜腐霉菌丝体在16~36℃的温度范围内生长良好,较高温度适合菌丝体生长,温度为28℃时,菌丝体的生长量最重。各温度组间的菌丝体重量均呈现显著性差异(P<0.05),表明温度对NBRC33253菌丝体的生长有着重要的作用。
紫菜腐霉在10~40的盐度内生长良好,较低盐度适合菌丝的生长,盐度为20时,菌丝体重量最大。各盐度间的菌丝体重量均呈现显著性差异(P<0.05),表明盐度对紫菜腐霉菌丝体的生长有着重要的作用(见表2)。

(A对照紫菜(放大10倍)The controlP.yezoensisthalli without infection ofP.porphyrae(10 times magnification);B 对照紫菜(放大100倍) The controlP.yezoensisthalli without infection ofP.porphyrae(100 times magnification);C 紫菜病斑区颜色变淡(放大10倍)The diseased spot ofP.yezoensisbecame lighter in color(10 times magnification);D紫菜细胞收缩,被菌丝体贯穿(箭头处)(放大100倍) The infected algae cells became shrank and penetrated by fugal hyphae(100 times magnification); E 藻红色素流出(箭头处)(放大100倍) The phycoerythrobilin(arrow) discharged from the infected algae cells(100 times magnification); F 紫菜病斑区发现紫菜腐霉的藏卵器(箭头1)和雄器(箭头2)(放大100倍) The archegonium (arrow 1) and the antheridium (arrow 2) ofP.porphyraewere observed at the infected region ofP.yezoensis(100 times magnification).)
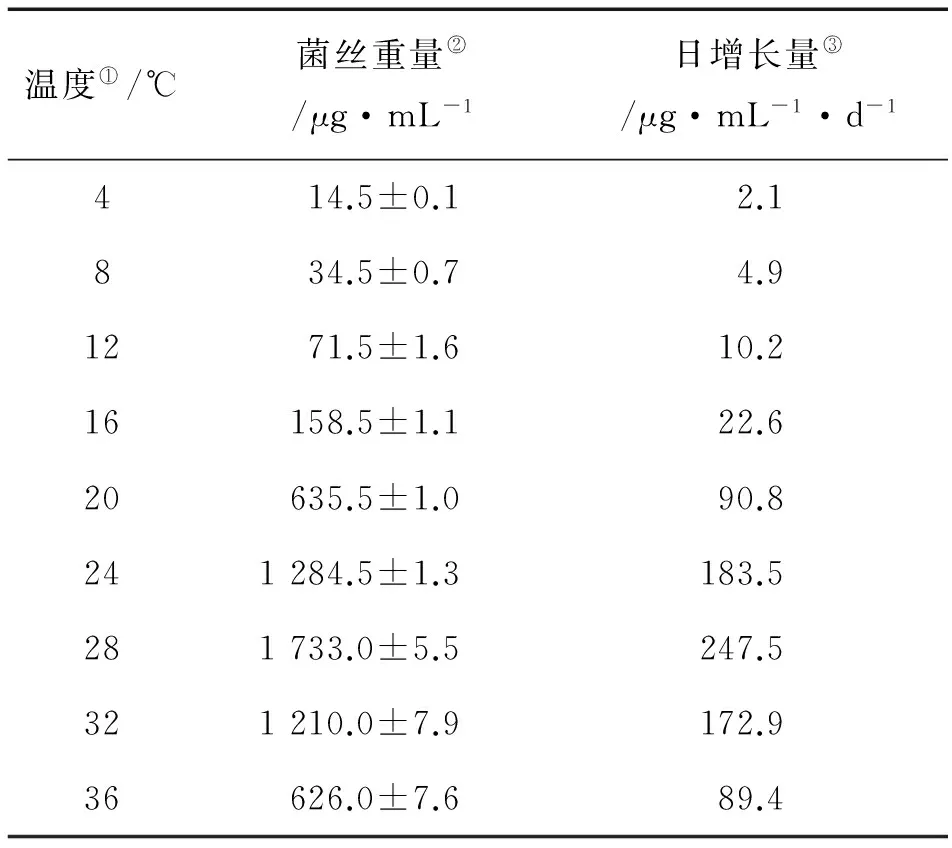
图4 紫菜腐霉感染条斑紫菜叶状体的组织病理变化
Note: ①Temperature; ②Hyphae weight; ③Daily growth weight
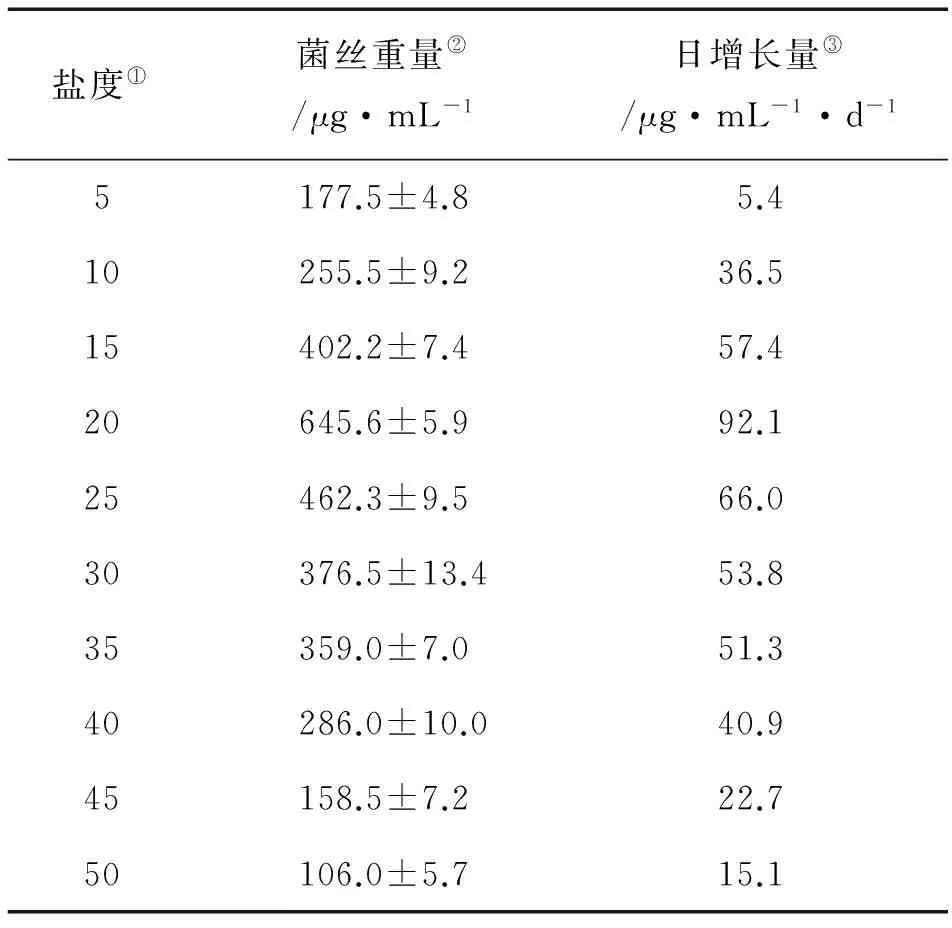
表2 盐度对紫菜腐霉菌生长的影响
Note: ①Salinity; ②Hyphae weight; ③Daily growth weight
2.5 环境因子对紫菜腐霉感染效果的影响
在不同的养殖温度下,18℃组最早(1天)出现针尖大小的红色斑点,其次分别为23℃组(2天)和13℃组(4天),而8℃组在实验期间(7天)没有观察到病症出现(见表3)。随着病程发展,温度愈高,病斑出现面积愈大,在第7天时,病斑面积分别为98.7%(23℃)、87.7%(18℃)、12.0%(13℃),各实验组之间均有显著性的差异(P<0.01)(见图5A)。因此,较高温度(18~23℃)容易发生赤腐病。
如表3所示,盐度愈低,出现病症的时间愈早,各盐度条件下出现病症的时间分别:24盐度组1天、29盐度组2天、34盐度组4天、39盐度组5天。随着病程发展,盐度愈低,病斑出现面积愈大,在第7天时,病斑面积分别为100%(24盐度组)、80.3%(29盐度组)、25.2%(34盐度组)、11.6%(39盐度组),各实验组之间均有显著性差异(P<0.01)(见图5B)。因此,低盐度(24~29)条件容易发生赤腐病。
如表3所示,腐霉感染浓度愈高,出现病症时间愈早,各感染浓度条件下出现病症的时间分别为1.0mg/mL组(2天)、0.5mg/mL组(3天)、0.1mg/mL组(3天)、0.01mg/mL组(4天)。随着病程发展,感染浓度愈高,病斑出现面积愈大,在第7天时,病斑面积分别为100%(1.0mg/mL组)、94.3%(0.5mg/mL组)、87.3%(0.1mg/mL组)、12.9%(0.01mg/mL组),各实验组之间均有显著性差异(P<0.01)(见图5C)。因此,水体中存在较高浓度的腐霉(0.1~1.0mg/mL)容易发生赤腐病。
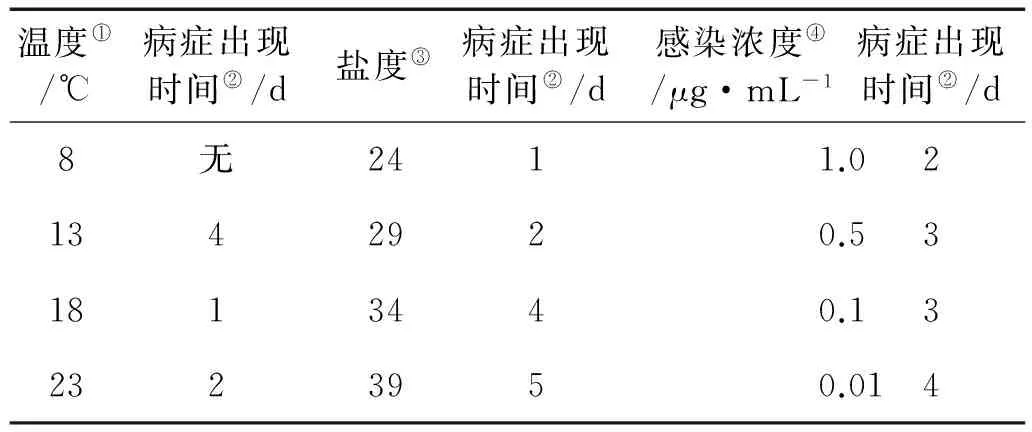
表3 腐霉感染条斑紫菜后出现病症时间
Note:①Temperature; ②Time of occurrence of disease; ③Salinity;④Infection dose
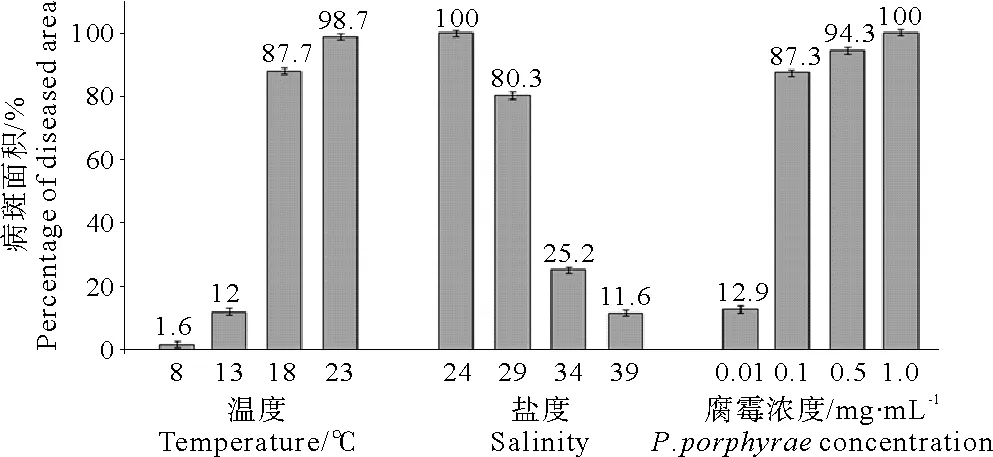
图5 不同养殖条件下条斑紫菜发生赤腐病病斑的面积
3 讨论
腐霉菌在全世界分布,多数在土壤和水生环境中营腐生生活,有超过80种为陆地植物病原,引起各种植物根腐和幼苗猝倒,一些还可引起人和动物疾病[11-13]。日本、韩国、美国和中国的学者相继报道紫菜腐霉可引起养殖和野生紫菜赤腐病[3-4,6-8,14-17]。Park等发现从日本和韩国不同地区患病紫菜分离的紫菜腐霉存在形态和生理特征的差别[18],这些差别说明不同地理腐霉菌株可能存在遗传和致病性的差异。中国学者分别从坛紫菜和条斑紫菜中分离到紫菜腐霉株[6,7],它们与其他地区分离得到的菌株是否存在遗传和致病性的差异,目前尚未有这方面的研究报道。本实验室在开展紫菜赤腐病病原分离、鉴定等流行病学调查的同时,对日本患赤腐病紫菜的一株分离菌株进行鉴定和致病性的检测,旨在进一步比较研究不同来源紫菜腐霉菌株的遗传、表型特征和鉴别特征,为研究腐霉致病机理、建立外来病风险评估以及疾病防控措施提供依据。本实验室研究人员严格遵守国家进境动物源性生物材料及制品检验检疫管理规定、《病原微生物实验室生物安全管理条例》和《兽医实验室生物安全管理规范》,保证实验过程安全使用和存放该菌株,严禁进行海上实验。
多数腐霉菌的形态特征不稳定,难于用来区分形态特征和生物学特征相近但亲缘关系较远的种。基于核糖体DNA转录内间隔区ITS序列的分子特征成为腐霉菌分类和鉴别的重要手段。本研究首先观察了NBRC33253的形态特征。结果显示该菌具有腐霉属的基本特征,产生丝状孢子囊、球形藏卵器、凹形雄器,这些结果与文茜等从条斑紫菜分离得到紫菜腐霉的特征一致[14]。该菌的ITS序列分析结果显示它与其他紫菜腐霉菌的亲缘关系最近。感染实验结果表明紫菜腐霉可以引起条斑紫菜赤腐病,病斑处细胞被菌丝穿透,导致细胞色素等内容物流出而导致紫菜细胞的死亡,最终引起紫菜组织溃烂,这些症状与丁怀宇等的描述一致[8]。
根据文献报道,每年的11月中旬到12月下旬,以及2—3月期间,当海水温度连续几天超过18℃,是赤腐病易发期。紫菜养殖海区的盐度一般在25~33,如果连续降雨引起海水盐度下降,也会增加赤腐病发生的机会[6]。本研究观测了温度、盐度、腐霉浓度对赤腐病发生效果的影响,结果显示较低盐度(24~29)、较高水温(18~23℃)、较高腐霉浓度(0.5~1.0mg/mL)有利于赤腐病发生。条斑紫菜可在0.5~20℃生长,最适合生长温度为16~18℃[20]。有研究发现,在23℃培养的条斑紫菜叶状体生长缓慢,培养8天时叶片皱缩、加厚、表面不平整,培养30天时叶片死亡变白腐烂[21]。本研究观测到在23℃进行感染,感染浓度较高的紫菜藻体在7天内发生90%以上的病烂,其原因可能是高温和病原感染两者综合作用的结果。同时,本研究还发现,腐霉在较高温度(16~36℃)、较低盐度(10~40)条件下生长良好。因此,当紫菜养殖海区温度在16~20℃、盐度低于25时,适合紫菜腐霉生长,养殖区腐霉数量增加,是发生赤腐病的根本原因。在此期间,减少紫菜栽培筏架设置密度以增加水体交换,可以稀释病原数量和提高水体盐度,对降低病原感染有帮助。
目前主要通过加强养殖过程中管理和调控环境因子来减轻紫菜病害的发生,筛选和培育抗病紫菜品系也是一种应对病害的有效途径,是本实验室着力发展的方向。本研究结果为进一步研究紫菜腐霉与宿主的相互作用提供了基础,有利于抗病紫菜品系的筛选和培育。
参考文献:
[1]Yarish C, Pereira R. Mass Production of Marine Macroalgae [M]. Jørgensen S E, Fath B D. Ecological Engineering. England: Elsevier, Oxford, 2008, 3: 2236-2247.
[2]贲秀林. 条斑紫菜丝状体培育的病害及防治[J]. 水产养殖, 2007, 28(1): 43-44.
Ben Xiu Lin. Diseases and control ofPorphyrahaitanensisconchocelis culture[J]. J Aquacul, 2007, 28(1): 43-44.
[3]Arasaki S. Studies on the rot ofPorphyrateneraby aPythium[J]. Bull Jpn Soc Sci Fish, 1947, 13(3): 74-90.
[4]Takahashi M. Identification of genusPythium[J]. Plant Prot, 1970, 24(8): 339-346.
[5]Gachon C M M, Sime-Ngando T, Strittmatter M, et al. Algal diseases: Spotlight on a black box[J]. Trends in Plant Science, 2010, 15(11): 1360-1385.
[6]Ma J H. A preliminary study on the red rot disease ofPorphyrayezoensisUeda[J]. J Shanghai Fish Univ, 1996, 5(1): 1-7.
[7]刘一萌, 马家海, 文茜. 福建坛紫菜赤腐病的病程及病原鉴定[J]. 福建农林大学学报(自然科学版), 2013, 42(1): 18-42.
Liu Yi Meng, MA Jia Hai, Wen Qian. Infection process and pathogen identification of red rot disease inPorphyrahaitanensisfrom Fujian[J]. J Fujian Agri Forest Univ (Natural Science Edition), 2013, 42(1): 18-42.
[8]Ding H, Ma J. Simultaneous infection by red rot and chytrid diseases inPorphyrayezoensisUeda[J]. J Appl Phycol, 2005, 17(1): 51-56.
[9]Niu C, Kebede H, Auld D L, et al. A safe inexpensive method to isolate high quality plant and fungal DNA in an open laboratory environment[J]. African Journal of Biotechnology, 2008, 7(16): 2818-2822.
[10]Deng J X, Paul N C. Molecular characterization, morphology and pathogenicity ofAlternariapanaxfrom araliaceous plants in Korea[J]. Mycol Progress, 2013, 12: 383-396.
[11]袁高庆, 赖传雅. 广西南宁地区腐霉的研究[J]. 中国生态农业学报, 2004, 12(3): 149-152.
Yuan Gao Qing, Lai Chuan Ya. Studies on the new and dominant species of genusPythiumin Nanning Region of Guangxi [J]. Chinese J Eco-Agricul, 2004, 12(3): 149-152.
[12]Yu T F.Pythium, damping-off of cucumber [J]. Agric Sin, 1934, 1: 91-106.
[13]楼兵干, 张炳欣. 基于rDNA ITS序列探讨部分腐霉种的系统发育与其形态特征[J]. 菌物学报, 2005, 24(2): 207-220.
Lou Bing Gan, Zhang Bing Xin. Phylogenetic relationships and its morphological characteristics among some phythium species inferred from sequence analysis of rDNA ITS[J]. Mycosystema, 2005, 24(2): 207-220.
[14]文茜, 马家海. 紫菜腐霉菌生长及繁育基础研究[J]. 江苏农业科学, 2012, 40(7): 201-204.
Wen Qian, Ma Jia Hai. Basic study on the growth and propagation ofPythriumporphyrae[J]. Jiangshu Agricul Sci, 2012, 40(7): 201-204.
[15]Saito S, Sasaki M. Studies on red rot disease ofPorphyra[M]∥ Japanese Society of Fisheries Science . The disease of cultivatedPorphyra. Tokyo, Japan: Koseisha Koseikaku, 1973: 59-69.
[16]Fujita Y, Zenitani B. Studies on pathogenicPythiumof laver red rot in Ariake sea farm-I general mycological characteristic[J]. Bulletin of the Japanese Society of Scientific Fisheries, 1976, 42: 1183-1188.
[17]Kerwin J L, Johnson L M, Whisler H C, et al. Infection and morphogenesis ofPythiummarinumin species ofPorphyraand other red algae [J]. Can J Bot, 1992, 70: 1017-1024
[18]Park C S, Sakaguchi K, Kakinuma M, et al. Comparison of the morphological and physiological features of the red rot disease fungusPythiumsp. isolated fromPorphyrayezoensisfrom Korea and Japan [J]. Fisheries Science, 2000, 66(2): 261-269.
[19]Kawamura Y, Yamashita Y, Kito H. Growth ofPorphyrayezoensisf. narawaensis on culture nets in the noni farm and its environmental Conditions [J]. Suisanzoshoku, 1991, 39(3): 273-278.
[20]吕峰, 王小红, 陆德祥, 等. 高温胁迫对条斑紫菜突变系圆盘体生长的影响[J]. 江苏农业科学, 2012, 40(3): 214-219.
Lv Feng, Wang Xiao Hong, Lu De Xiang, et al. Effects of high temperature on the growth ofPorphyrayezoensismutant [J]. Jiangshu Agricul Sci, 2012, 40(3): 214-219.
责任编辑朱宝象
基金项目:❋ 国家高技术研究发展计划项目(2012AA10A406, 2012AA10A401, 2012AA100815);国家自然科学基金项目(31372517);山东省自主创新项目(2013CXC80202)资助
收稿日期:2015-04-09;
修订日期:2015-12-25
作者简介:李淑芬(1987-),女,硕士生。E-mail: lishufen888@126.com ❋❋通讯作者:E-mail:mozl@ysfri.ac.cn
中图法分类号:Q939.95
文献标志码:A
文章编号:1672-5174(2016)07-027-08
DOI:10.16441/j.cnki.hdxb.20150121
Identification of aPythriumporphyraeStrain Causing the Red Rot Disease ofPorphyrayezoensis
LI Shu-Fen1, MO Zhao-Lan2, KONG Fan-Na1, ZHU Ming3, MAO Yun-Xiang1
(1.Laboratory of Marine Genetics and Breeding, College of Marine Life Sciences, Ocean University of China, Qingdao 266003, China; 2.Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China; 3.Longyuan Biotchnology Copmany Ltd., Lianyungang 222000, China)
Abstract:Pyropia is an economically important cultured species in East Asia. Farmed Pyropia is easy to be infected by various pathogens. It is necessary to get a comprehensive understanding of the pathogenecity mechanism of pathogens for diseases prevention. Pythrium porphyrae is a fungus that is able to cause the red rot disease of Porphyra. A strain NBRC33253 was isolated from farmed Porphyra and deposited in NITE Biological Resource Center in Japan, but its taxonomic status and the pathogenecity are not avai-lable. To get a better understanding of the physiology and pathogenecity of NBRC33253, we performed this study to identify the fungal strain with combined methods of morphology and molecular biology, to exam its growth under different culture conditions (temperature and salinity), and finally to determine its pathogenecity on P. yezoensis by artificial infection experiments. The result of morphological examination showed that the NBRC33253 grew well on CMS medium, producing transverse mycelia, zoosporangium, archegonium and antheridium, which are the typical characteristics of genus Pythium. Phylogenetic analysis based on the internal transcribed spacer (ITS) region revealed that the NBRC33253 was clustered with Pythrium porphyrae, being 99% ITS sequence similar with those of Pythrium porphyrae strains deposited in GenBank. Consequently, NBRC33253 was identified as Pythrium porphyrae. The result of growth experiment showed that the NBRC33253 grew well at temperatures ranging from 16 to 36℃ and salinities ranging from 10 to 40 with the optimum growth temperature of 28℃ and the optimum growth salinity of 20. In artificial infection experiments on P. yezoensis blade, NBRC33253 was able to cause small (<0.5mm in diameter), round, red lesion on the thalli at 48 h post infection, which gradually developed into irregular light yellow lesions (>20 mm) surrounded by a pink margin and finally caused necrosis of entire thallus in 5~7 days post infection. Histopathological examination of the infected laver showed that the NBRC33253 mycelia were able to invaded the thalli tissue, causing the laver cells collapsed and died. Further studies found that P. yezoensis was prone to ret rot disease after infection with NBRC33253 at higher temperature (18~23℃), lower salinities (24~29) and higher concentration of fungi (0.1~1.0mg/mL). These findings will provide a fungal material for further comparative study on the genetic and pathogenesis of P. pythrim from various origins, which will help to prevent the red rot disease of P. yezoensis.
Key words:Pythrium porphyrae; identification; Pyropia yezoensis; pathogenecity; red rot disease
Supported by National High Technology Research and Development Program (2012AA10A406, 2012AA10A401, 2012AA100815); National Natural Sciences Foundation of China (31372517); Special Independent Innovation of Shandong Province (2013CXC80202)
