6株高产油微拟球藻的中试培养评价研究❋
2016-08-13朱葆华石红萍孙发强韩吉昌杨官品潘克厚
朱葆华,石红萍,孙发强,韩吉昌,杨官品,潘克厚,3❋❋
(中国海洋大学 1.海水养殖教育部重点实验室,2.海洋生命学院,3.青岛海洋科学与技术国家实验室,海洋渔业科学与食物产出过程功能实验室,山东 青岛 266003)
6株高产油微拟球藻的中试培养评价研究❋
朱葆华1,石红萍1,孙发强1,韩吉昌1,杨官品2,潘克厚1,3❋❋
(中国海洋大学 1.海水养殖教育部重点实验室,2.海洋生命学院,3.青岛海洋科学与技术国家实验室,海洋渔业科学与食物产出过程功能实验室,山东 青岛 266003)
摘要:用50 L密闭式吊袋光生物反应器,采用连续培养模式,对6株微拟球藻(Nannochloropsis oceanica)进行产油性能的中试筛选。从藻种的比生长速率、总脂含量、油脂产率,甘油三酯(TAG)含量和脂肪酸组成等方面评价藻种的产油性能。经过10d的连续培养,筛选到2株生长速率快、油脂产率高的优良能源微藻藻株:3-25和75B1,它们的总脂含量分别达到细胞干重的33.49%和29.36%;油脂产率分别为10.04和8.07mg·(L·d)-1;它们的C16与C18之和分别占到了总脂肪酸含量的72.71%和68.05%,且以饱和脂肪酸C16∶0及单不饱和脂肪酸C16∶1为主,适合生物柴油的生产。尽管藻株4-38的油脂产率较低,但其甘油三酯含量较高,C16和C18之和高达76.32%,其脂肪酸组成也非常适合生物柴油的生产。研究结果表明,3-25、75B1和4-38这3株微拟球藻有望作为生产生物柴油的候选藻株。
关键词:生物柴油; 微拟球藻; 连续培养; 中试规模
引用格式:朱葆华,石红萍,孙发强,等. 6株高产油微拟球藻的中试培养评价研究[J].中国海洋大学学报(自然科学版),2016, 46(7): 15-20.
ZHU Bao-Hua , SHI Hong-Ping, SUN Fa-Qiang,et al. Evaluation of sixN.oceanicastrains with high oil productivity in pilot scale [J].Periodical of Ocean University of China, 2016, 46(7): 15-20.
石化燃料的过度开采和使用导致能源危机加剧,寻找一种新型、可持续的绿色清洁能源已成为当今社会关注的焦点。生物柴油作为一种可再生、绿色环保的清洁能源已成为世界各国能源研究的热点。
生产生物柴油的油脂大多来自植物油脂,在所有的油料作物中,微藻相对于传统的油料作物具有明显的优势,已成为第三代生物柴油生产的理想原料[1-2]。到目前为止,微藻生物柴油尽管已经有几十年的研究历史[3],但实现商业化生产还需要进行很大的努力,而微藻大规模培养高昂的成本是主要的瓶颈之一[4-6]。因此,生长速率快、抗逆性强、油脂产率高的优良能源微藻藻种的筛选成为提高生物柴油产量、降低生产成本的重要突破点之一。
微拟球藻(Nannochloropsis.sp)属大眼藻纲、微拟球藻属,是一类球形或近似球形的单细胞真核生物,其细胞小(通常2~4μm),形态简单,具有很高的光合作用效率、生物量和总脂含量;它的脂肪酸组成主要以C16,C18和C20为主[7],是生产生物柴油的理想原料,被公认为最具潜力进行商业化生产生物柴油的藻种之一[8]。
本研究采用一种封闭、连续培养方式的吊袋式反应器对6株诱变海洋微拟球藻(Nanochloropsisoceanica)进行中试培养,通过分析总脂含量、油脂产率、中性脂以及脂肪酸组成对它们进行筛选评价,为进一步进行大规模培养并获得可规模化培养的优良能源微藻藻株提供科学依据。
1 材料与方法
1.1 藻种
6株微拟球藻(Nanochloropsisoceanica)来自中国海洋大学水产学院应用微藻生物学实验室,KA2以精喹禾灵(Quizalofop-p-ethyl)作为筛选压筛选获得[9],4-5、4-38、3-25、3-26、75B1通过甲基磺酸乙酯(Ethyl-methylsulfone, EMS)诱变,再通过平板涂布获得单克隆藻株,在实验室内证明这些藻株具有较大的比生长速率和较高的油脂产率。
1.2 微藻培养
中试培养筛选验证在青岛市中国海洋大学鳌山卫实验基地进行,中试培养时间为2014年10月8—17日,采用50 L的吊袋式反应器进行,工作原理如图1所示:
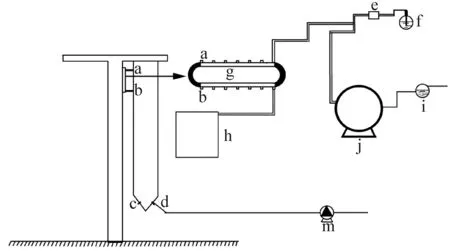
(a:消毒海水和营养盐注入口 Disinfection water and nutrient sprue;b:藻液流出口 Algal flow export;;c:通气入口 Air inlet; d:藻液接种口和取样口 Fluid of algal inoculation and sampling; e:蠕动泵 Peristaltic pump; f:培养基 Culture medium; g:营养液加入和藻液排出通道 Nutrient solution to join and algal liquid discharge channels; h:藻液收集缸 Algae fluid collection cylinder; i:砂滤器 Sand filter;j:海水高温灭菌设备 Water high temperature sterilization equipment; m:鼓风机 Air blower.)
图1吊袋式反应器简图
Fig.1Diagram of reactor with punching bag
通过加料口(a)每天将10 L新鲜培养液24h持续不断的以恒定流速注入到反应器中,新鲜培养液由培养基(f)和经过灭菌的海水按一定比例混合而成,海水先经沙滤装置(i)过滤后再经海水高温灭菌装置(j)灭菌才进入到反应器内。反应器上端还有另一出口(b),当培养的藻液液面达到(b)口时,每天有10 L藻液进入藻液收集缸(h)。反应器下端有通气孔(c)和取样孔兼接种口(d),通气孔处装有气体流量调节器,调节进入到反应器中的气体流量(气体流量为1000mL/min),通入反应器的气体经紫外线杀菌后由鼓风机(m)提供。培养体系为一个密闭系统,保证培养过程始终处于无污染的状态。
反应器吊袋为透明强力聚乙烯薄膜,具有耐高压和韧度强等优点,接种时控制藻种密度为1.7×107cell/mL、体积10L。培养条件,温度(24±3)℃,光强(20~131)μmol·m-2·s-1全光照培养(白天为自然光,晚上采用人工光源),每株微拟球藻设置3个平行。培养过程中,每天定时测定培养液的pH。
培养10d后,每个平行取2000mL 藻液,7000r/min、5min离心(Ependorf , Germany)收集,沉淀用50mL蒸馏水重悬洗盐2次(离心条件同上),通过真空冷冻干燥得到藻粉(称重获得生物量干重),用于总脂、脂肪酸分析。
1.3 比生长速率测定
比生长速率通过公式u=(lnx2-lnx1)/(t2-t1)进行计算[10]。式中:u为比生长速率(d-1);x1和x2分别为开始和结束时反应器中总细胞数量;t1和t2分别为培养开始和结束的时间。
1.4 总脂含量和油脂产率
总脂测量参考Bligh and Dyer[11]的方法,称取50mg藻粉于干燥试管中,依次加入2mL 氯仿(CHCl3)和1mL 甲醇(CH3OH),震荡15min,5000r/min 离心10min,将提取液转到新试管;重复上述操作,合并2次提取液,加入0.9%生理盐水1.2mL,振荡,静置15min,吸取提取液中的氯仿层于预先称重的新试管中,水浴锅蒸干氯仿层称重,计算总脂含量。
油脂产率计算公式:P=1 000C·B/D。式中:P表示每升藻液每天积累油脂的含量(mg·L-1·d-1);C是藻细胞积累的油脂含量占藻粉干重的百分比(% of DW);B表示微藻培养过程中的干重(g/L),D表示培养时间(d)[12]。
1.5 甘油三酯(TAG)分析
甘油三酯分析采用薄层层析法[13-14]进行。上样量为3μL,展层剂为正己烷∶乙醚∶甲酸体积比为70∶30∶1(v/ v/ v)。展层后将层析板置于通风橱内吹干, 然后置于含有碘颗粒的烧杯中,37℃恒温显色5~10min,三酰甘油标准品为美国Sigma 产品(Glyceryl trioleate T7140-500MG)。
1.6 脂肪酸组成分析
脂肪酸组成采用气相色谱法[15]。称取15mg 藻粉至干燥试管中,加入 2mol/L的氢氧化钾-甲醇(KOH-CH3OH)溶液2mL,充分混匀, 75℃水浴30min , 冷却至室温后加入3mol/L 盐酸-甲醇(HCl-CH3OH)溶液2mL,振荡1min,75℃水浴30min ,冷却至室温,加入正己烷(C6H14)0.1mL及少量蒸馏水促进分层, 充分振荡, 离心后取正己烷层,上样1μL进行气相色谱分析。
气相分析采用外标法,进样量1μL,脂肪酸标准品为Sigma 公司产品(Supelco 37, USA)。仪器型号为HP 5890II,氢火焰离子化检测器,毛细管柱型号为007-CW。程序升温: 150℃保持1min,以15℃/min 升至200 ℃,再以2℃/min 升至250℃;汽化室温度270℃;检测器温度270℃;载气为高纯氮气,流速1.5mL/min。
1.7 数据分析
采用软件Spss 20(美国IBM公司)进行单因素方差分析(LSD,Duncan),并进行多重比较,显著性水平为P<0.05;采用Microsoft office 2007的Excel绘图。
2 结果与分析
2.1 比生长速率和生物量
培养过程中6株藻一直以平均0.2d-1的比生长速率迅速生长。藻株3-26的比生长速率为0.18d-1显著小于其他5株(P<0.05),4-38、3-25和75B1的比生长速率均为0.19d-1,3-5和KA2的比生长速率达到0.21d-1是6株藻中最大的(见表1)。
6株藻收获时的生物量如表1所示,生物量分别为241、234、239、192、217和224mg/L,3-26的生物量显著低于其他5个藻株(P<0.05),其他5株藻之间生物量差异不显著(P>0.05),6株藻的生长趋势与生物量的增加趋势基本一致。
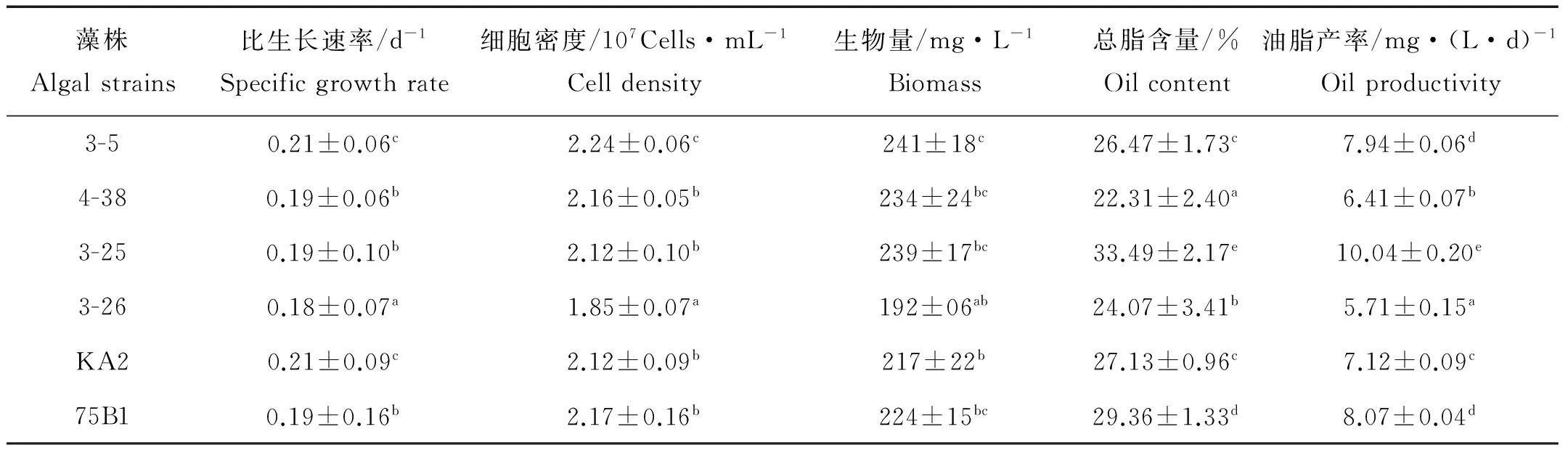
表1 6株微拟球藻的比生长速率、细胞密度、生物量、总脂含量和油脂产率
注:a、b、c、d、e分别表示方差分析差异程度,同一列中有相同字母的组之间差异不显著(P>0.05)。
Note:Values in the same row with the same supersxripts are not significantly different(P>0.05).
2.2 总脂和油脂产率
总脂含量和油脂产率是衡量一株藻产油能力的重要指标。由表1可以看出,6株藻收获时的总脂含量和油脂产率,藻株3-25的总脂含量和油脂产率分别达到33.49%和10.04mg·(L·d)-1,显著高于其他5个藻株,是6株藻中最高的;75B1的总脂含量和油脂产率仅次于3-25,显著高于其他4个藻株;4-38的总脂含量在6株藻中最低,其油脂产率仅高于3-26。
2.3 甘油三酯(TAG)分析
6株微拟球藻总脂中的甘油三酯(TAG)通过薄层层析法进行分析。由图2可以看出,藻株4-38的甘油三酯(TAG)含量最高,75B1次之,3-5含量最少,而其他3株藻(3-25、3-26和KA2)的含量相当。
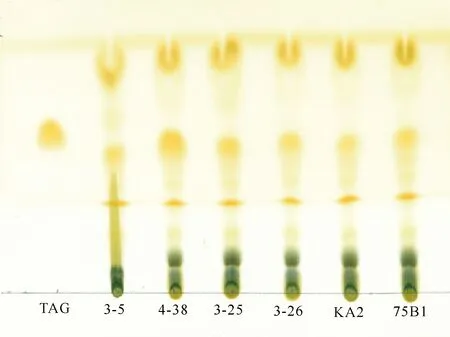
图2 6株微拟球藻的薄层层析图谱
2.4 6株微拟球藻脂肪酸分析结果
由表2可以看出,6株藻的主要脂肪酸组成为C16、C18和C20,其中C16 (C16∶0 和C16∶1)占到了总脂肪酸的56%以上,C16和C18之和占到了总脂肪酸含量的65.92%以上。藻株4-38的C16和C18之和高达76.32%,其次为藻株3-25,达到了72.18%;3-26、KA2和75B1三株藻的C16和C18之和没有显著差异,但75B1的C20∶5(EPA)含量最高,占总脂肪酸含量的22.39%。
3 讨论
本实验采用连续培养模式,相比批次培养模式具有如下优点:结果可靠、可重复性强,生长速率和生物量可通过改变稀释比例进行调节控制,并且可长期维持在较高水平[16]。连续式培养模式以一定的流速连续向培养系统内添加新鲜培养液,同时以相同的流速从培养体系中放出藻液,藻细胞的生长速度、代谢水平处于相对恒定的状态,能够稳定、快速培养微藻产生相应的代谢产物[17-18]。
微藻细胞的油脂积累主要在指数生长期末期,生长速率越快,油脂积累越缓慢。在连续培养模式下,由于藻细胞始终处于指数生长状态,油脂积累与实验室理性状态(6株藻的总脂含量在30.3%~34.6 %之间)相比有一定差距,所研究的6个藻株总脂含量仍达到了22.31%~33.49%(见表1),相信通过改变培养模式,比如开放跑道池大规模培养,由于光照和温度等条件的改变,最重要的是,在跑道池中培养,藻细胞可在一定时间内达到指数生长末期,它们的总脂含量一定会有所升高的。
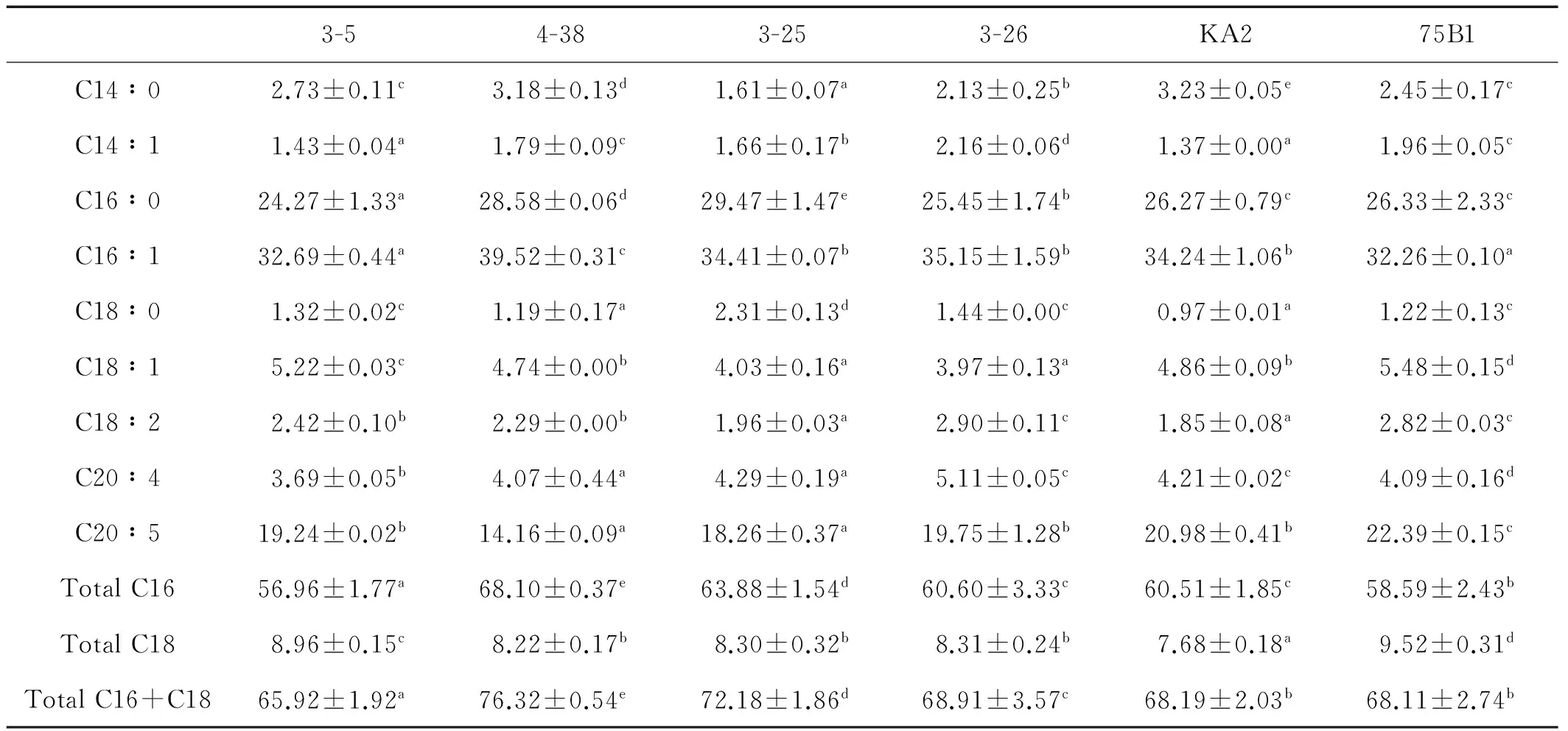
表2 6株诱变微拟球藻的脂肪酸组成(占总脂肪酸的百分比)
注:a、b、c、d、e表示方差分析差异程度,同一行中有相同字母的组之间差异不显著(P>0.05)。
Note:Values in the same row with the same superscrpts are not significantly different(P>0.05).
油脂产率是微藻培养过程中油脂产生数量的量度,用单位时间单位体积产生油脂的多少表示。由表1可以看出,藻株3-25的油脂产率为10.04mg·(L·d)-1,显著高于其他5个藻株,其次为75B1,但这与实验室通过柱状反应器所得数据(藻株3-25的油脂产率为16.63mg·(L·d)-1相比仍有较大差距。一方面藻细胞始终处于指数生长状态,不利于油脂积累,藻液不断流出也不利于生物量的增加;另一方面,本实验中,尽管晚上采用人工光源,一定程度上减少了呼吸作用对生物量的消耗,但白天采用自然光源,相对光照强度较低(20~131μmol·m-2·s-1),仍是导致油脂产率较低的主要原因[19]。另外,氮限制、高盐胁迫等[20-21]有利于油脂积累,在后续大规模培养过程中,可考虑在指数生长末期对藻细胞进行一定的胁迫,从而提高油脂产率[22-23]。
生物柴油是脂肪酸烷基酯的混合物,主要以甘油三酯(TAG)为底物通过酯交换反应(Transesterification)生成[24]。用于生产生物柴油的优良藻株,不仅要有高的油脂产率,具有较高的中性脂含量(主要是甘油三酯,TAG)和适宜的脂肪酸组成也尤为重要。由图2可以看出,藻株4-38的TAG含量最高,其次为75B1,3-5含量最少,而其他3株藻(3-25、3-26和KA2)的含量相当。
微藻的脂肪酸组成是衡量生物柴油质量的一个重要指标[25],对生物柴油的燃烧性能产生重要影响[26]。另外,生物柴油的浊点仅由饱和脂肪酸的数量决定[27],而低温流动性则取决于不饱和脂肪酸。C16与C18含量之和(占总脂肪酸的百分含量)已经被用来评价生物柴油的产率[28]。由表2可以看出,6株藻的C16与C18之和占到了总脂肪酸含量的65.92%以上,藻株4-38则高达76.32%,且主要以饱和脂肪酸(C16∶0) 与单不饱和脂肪酸(C16∶1)为主,其脂肪酸组成非常适合生物柴油的生产[29-30]。
结合油脂产率、中性脂和脂肪酸组成分析,3-25、75B1具有较好的生产生物柴油的潜力,
虽然4-38的油脂产率较低,但由于较高的甘油三酯含量以及优良的、适合生产生物柴油的脂肪酸组成,有望在后续规模化培养中通过改变培养条件大幅提高其油脂产率。另外,75B1的C20∶5(EPA)含量最高,占总脂肪酸含量的22.39%,还可以作为生产EPA的优良藻株。
致谢:本实验在青岛即墨中国海洋大学鳌山卫基地完成,对赫勇老师在实验初期给予的大力帮助表示衷心感谢。
参考文献:
[1]Hu Q, Sommerfeld M, Jarvis E, et al. Microalgal triacylglycerols as feedstocks for biofuel production: Perspectives and advances [J]. Plant, 2008, 54: 621-639.
[2]Huang G H, Chen F, Wei D, et al. Biodiesel production by microalgal biotechnology [J]. Applied Energy, 2010, 87(1): 38-46.
[3]Wijffels R H, Barbosa M J. An outlook on microalgal biofuels [J]. Science, 2010, 329: 796-799.
[4]Chisti Y. Biodiesel from microalgae [J]. Biotechnol, 2007, 25(3): 294-306.
[5]Li Y G, Xu L, Huang Y M, et al. Microalgal biodiesel in China:Opportunities and challenges [J]. Applied Energy, 2011, 88:3432-3437.
[6]Sing S F, Isdepsky A, Borowitzka M A, et al. Production of biofuels from microalgae [J]. Mitig Adapt Strateg Glob Change, 2013, 18: 47-72.
[7]李秀波, 徐旭东, 孔任秋,等.五种微绿球藻产油和产多不饱和脂肪酸的研究 [J].水生生物学报, 2010, 34(5): 893-897.
Li X B, Xu X D, Kong R Q, et al. Studies on the production of oil and polyunsaturated fatty acids in five species ofNannochloropsis[J]. Acta Hydrobiologica Sinica, 2010, 34(5):893-897.
[8]Rodolfi L, Chini Zittelli G, Bassi N, et al. Microalgae for oil: strain selection, induction of lipid synthesis and outdoor mass cultivation in a low-cost photobioreactor [J].Biotechnology and Bioengineering, 2009, 102(1): 100-112
[9]曲晓梅, 宓文义, 朱葆华, 等.精喹禾灵筛选高脂微藻的有效性研究 [J].中国海洋大学学报(自然科学版), 2013, 43(6): 25-28
Qu X M, Mi W Y, Zhu B H, et al. Applicability of herbicide quizalofop-p-ethyl to the screening of lipid richNannochloropsisoceanic[J]. Periodical of Ocean University of China, 2013,43(6):25-28.
[10]Zhu B H, Sun F Q, Yang M, et al. Large-scale biodiesel production using flue gas from coal-fired powerplants withNannochloropsismicroalgal biomass in open raceway ponds [J].Bioresource Technology, 2014,174: 53-59.
[11]Bligh E G, Dyer W G. A rapid method of total lipid extraction and purification [J]. Canadian Journal of Biochemistry and Physiology, 1959, 37(8): 911-917.
[12]Liu A Y, Chen W, Zheng L L, et al. Identification of high-lipid producers for biodiesel production from forty-three green algal isolates in China [J]. Materials International, 2011, 21: 269-276.
[13]Reiser S, Somerville C. Isolation of mutants ofAcinetobactercalcoaceticusdeficient in wax ester synthesis and complementation of one mutation with a gene encoding a fatty acyl-coenzyme A reductase [J]. Journal Bacteriology, 1997, 179(9): 2969-2975.
[14]Yu E T, Zendejas F J, Lane P D, et al. Triacylglycerol accumulation and profiling in the model diatomsThalassiosirapseudonanaandPhaeodactylumtricornutum(Baccilariophyceae) during starvation [J]. Journal Applied Phycology, 2009, 21(6): 669-681
[15]Lepage G, Roy C C. Improved recovery of fatty acid through direct transecsterification without prior extraction purification [J]. J Lipid Res, 1984, 25(12): 1391-1396.
[16]Williams J A. Keys to bioreactor selection [J]. Chemical Engineering Progress, 2002, 98(3): 34-41.
[17]蒋礼玲, 张亚杰, 李潇萍, 等. 微藻培养模式研究进展 [J]. 可再生能源, 2010, 28(1): 56-62.
Jiang L L, Zhang Y J, Li X P, et al.Research developments in cultivation modes in microalgae [J]. Renewable Energy, 2010, 28(1): 56-62.
[18]Marsot P, Pelletier E, St-Louis R. Effects of triphenyltin chloride on growth of the marine microalgaPavlovalutheriin continuous culture [J]. Bull Environ Contam Toxicol Bulle tin of Environmental Contamination and Toxicology, 1995, 54(3): 389-395.
[19]Sforza E, Bertucco A, Morosinotto T, et al. Photobioreactors for microalgal growth and oil production withNannochloropsissalina, from lab-scale experiments to large-scale design [J]. Chemical Engineering Research and Design, 2012, 90: 1151-1158.
[20]Courcchesne N M, Prisien A , Wang B, et al. Enhancement of lipid production using biochemical, genetic and transcription factor engineering approaches [J]. Journal of Biotechnology, 2009, 141: 31-41.
[21]Meng X, Yang J, Xu X, et al. Biodiesel production from oleaginous microorganisms [J]. Renewable Energy, 2009, 34(1): 1-5.
[22]Gouveia L, Oliveira A C. Microalgae as a raw material for biofuels production [J]. Journal of Industrial Microbiology and Biotechnology, 2009, 36(2): 269-274.
[23]Hsieh C H, Wu W T. Cultivation of microalgae for oil production with a cultivation strategy of urea limitation [J]. Bioresource Technology, 2009, 100(17): 3921-3926.
[24]Mata T M, Martins A A, Caetano N S. Microalgae for biodiesel production and other applications:A review [J]. Renewable and Sustainable Energy Reviews, 2010, 14(1): 217-232.
[25]Ji M K, Abou-Shanab R A I, Kim S H, et al. Cultivation of microalgae species in tertiary municipal wastewater supplemented with CO2 for nutrient removal and biomass production [J]. Ecological Engineering, 2013, 58: 142-148.
[26]Knothe G. Dependence of biodiesel fuel properties on the structure of fatty acid alkyl esters [J]. Fuel Processing Technology, 2005, 86: 1059-1070.
[27]Imahara H, Minami E, Saka S. Thermodynamic study on cloud point of biodiesel with its fatty acid composition [J]. Fuel, 2006, 85: 1666-1670.
[28]Tang D, Han W, Li P, et al. CO2biofixation and fatty acid composition ofScenedesmusobliquusandChlorellapyrenoidosain response to different CO2levels [J]. Bioresour Technol, 2011, 102: 3071-3076.
[29]Francisco E, Neves D, Lopes E, et al. Microalgae as feedstock for biodiesel production:carbon dioxide sequestration, lipid production and biofuel quality [J]. Journal of Chemical Technology and Biotechnology, 2009, 85: 395-403.
[30]Pal D, Khozin-Goldberg I , Cohen Z, et al. The effect of light, salinity, and nitrogen availability on lipid production byNannochloropsissp. [J]. Appl Microbiol Biotechnol, 2011, 90(4): 1429-1441.
责任编辑朱宝象
基金项目:❋ 国家重点基础研究发展计划项目(2011CB200901;2011CB200904);国家自然科学基金项目(31372518)资助
收稿日期:2015-04-08 ;
修订日期:2015-05-29
作者简介:朱葆华(1971-),男,副教授,主要从事微藻生理、生化与分子生物学方面的研究。E-mail:zhubaohua@ouc.edu.cn ❋❋通讯作者:E-mail:qdkhpan@126.com
中图法分类号:Q948.12
文献标志码:A
文章编号:1672-5174(2016)07-015-06
DOI:10.16441/j.cnki.hdxb.20150136
Evaluation of SixN.oceanicaStrains with High Oil Productivity in Pilot Scale
ZHU Bao-Hua1, SHI Hong-Ping1, SUN Fa-Qiang1, HAN Ji-Chang1,YANG Guan-Pin2, PAN Ke-Hou1,3
(Ocean University of China, 1. The Key Laboratory of Mariculture, Ministry of Education; 2. College of Marine Life Sciences; 3.Laboratory for Marine Fisheries and Aquaculture, Qingdao National Laboratory for Marine Science and Technology,Qingdao 266003, China)
Abstract:Renewable energy as microalgal biodiesel has raised broad interest; it is characterized by higher lipid productivity per ground area than oleaginous agricultural crops and does not compete for arable land or bio-diversifies natural landscapes. Unfortunately, a great deal of developments must occur before such product reaches the marketplace. One of the key bottlenecks is the high cost of microalgal cultivation. For the successful commercialization of microalgae-based fuels, it is crucial to minimize culture cost and breed oil-rich microalgae. Therefore, it is imperative that the strain selected for large-scale cultivation produces the appropriate lipids suitable for biodiesel production in pilot scale. Selection criteria should be based on a number of factors including growth rate, lipid quantity and quality, strong adaptability to the change in environment and determination of preferred nutrients and nutrient uptake rate. Nannochloropsis have proved to be suitable as raw materials for commercial production due to their high biomass and oil content. In this study, six Nannochloropsis oceanica strains were screened for their oil productivity by continuous cultivation mode in pilot scale with 50 L inclosed punching bag - light bioreactors. Oil-producing characteri-stics were evaluated from several aspects such as specific growth rate, content of total lipids, oil productivity, triglyceride content and fatty acid composition. Two excellent strains (3-25 and 75B1) with rapid growth and high oil productivity were obtained by continuous cultivation for ten days. The content of total lipids and oil productivity of the two strains were 33.49% and 29.36%, and 10.04mg·L-1·d-1and 8.07mg·L-1·d-1, respectively. The C16 and C18 series contents of the two algal strains accounted for 72.71% to 68.05%, respectively, and were found to consist largely of the saturated fatty acid (SAFA) palmitic acid (C16∶0) and the monounsaturated fatty acid (MUFA) palmitoleic acid (C16∶1), which are ideal for biodiesel production. Strain 4-38 performed better than the other five; it contained higher amount of triacylglycerols and fatty acids (the C16 and C18 series contents reach up to 76.32%), which are used for biodiesel production. Our results showed that three strains among six are perspective to be used for biodiesel production, which will provide scientific basis for further cultivation and obtain excellent strains suitable for large scale culture to produce biodiesel.
Key words:biodiesel production; Nannochloropsis oceanica; continuous cultivation mode; pilot scale production
Supported by Major State Basic Research Development Program of China(2011CB200901;2011CB200904); National Natural Science Foundation of China(31372518)
