冠心止痛胶囊对动脉粥样硬化大鼠血Ca2+、主动脉Ca2+及C反应蛋白的影响*
2016-08-12王晓丽周红艳李开言张雪侠
王晓丽,孙 为,周红艳,张 薇,李开言,张雪侠
(河南省中医药研究院中药药理实验室,河南 郑州 450004)
冠心止痛胶囊对动脉粥样硬化大鼠血Ca2+、主动脉Ca2+及C反应蛋白的影响*
王晓丽,孙为,周红艳,张薇,李开言,张雪侠
(河南省中医药研究院中药药理实验室,河南 郑州 450004)
目的:探讨冠心止痛胶囊对动脉粥样硬化大鼠血Ca2+、主动脉Ca2+和C反应蛋白(c-reactive protein,CRP)的影响。方法:用改良的高脂饲料饲养、维生素D3注射和卵清白蛋白免疫损伤复合法复制大鼠动脉粥样硬化(atherosclerosis,AS)模型,观察大鼠的体质量和摄食量,于实验第63天和91天测定血清Ca2+含量,于实验第91天采用火焰法测定主动脉组织Ca2+含量,并采用透射比浊法测定血清CRP含量。结果:①模型对照组和各药物组的大鼠体质量、摄食量下降。②与正常对照组对比,模型对照组血清Ca2+和主动脉Ca2+含量升高,差别有统计学意义(P<0.05或P<0.01);与模型对照组对比,冠心止痛胶囊大、小剂量组主动脉Ca2+含量降低,差别有统计学意义(P<0.05或P<0.01),血清Ca2+变化无统计学意义(P>0.05)。③与正常对照组对比,模型对照组CRP含量升高,差别有统计学意义(P<0.05);与模型对照组对比,冠心止痛胶囊大、小剂量组CRP水平有下降的趋势,但差别无统计学意义(P>0.05)。结论:冠心止痛胶囊可降低AS大鼠的主动脉Ca2+含量,抑制血管钙化,有助于延缓动脉粥样硬化的发展。
冠心止痛胶囊/药效学;动脉粥样硬化模型;动物;大鼠;Ca2+; C反应蛋白
冠心病是目前威胁人类健康的心血管疾病之一[1],其病理生理机制主要是动脉粥样硬化(atherosclerosis,AS)所致冠状动脉管腔狭窄或阻塞引起的心肌缺血、坏死。AS病变常累及大、中肌性动脉,动脉壁上脂类沉积,伴随纤维组织增生和钙质沉积,使动脉弹性降低、管腔变窄,最终造成组织器官缺血、坏死。AS发病机制尚未明确,脂质浸润学说、炎症反应学说、氧化应激学说等在AS发生、发展过程中相互关联和补充。冠心止痛胶囊是河南省中医药研究院研制的纯中药复方制剂,具有宽胸理气、化痰活瘀、通络止痛之效。笔者前期研究[2]表明:冠心止痛胶囊可降低AS大鼠的血脂水平,抑制炎性细胞因子的分泌或释放,保护AS大鼠。本文观察了其对AS大鼠血清Ca2+、主动脉Ca2+和C反应蛋白(c-reactive protein,CRP)的影响,以进一步探讨冠心止痛胶囊的作用机制。
1 材料与方法
1.1动物
SPF级雄性SD大鼠,体质量(80±20) g,购自河南省实验动物中心,合格证号:SCXK(豫)2005-0001。
1.2药品、试剂与仪器
冠心止痛胶囊,由河南省中医药研究院附属医院制剂室提供,批号20130301,由瓜蒌、半夏、红花、赤芍、川芎、紫苏梗、山楂、甘草等中药组成,0.5 g/粒(含原生药2.66 g);阿托伐他汀钙片,北京嘉林药业股份有限公司产品,批号130351;丙硫氧嘧啶片,上海朝晖药业有限公司提供,批号1210F09;维生素D3注射液,上海通用药业股份有限公司提供,批号121004。胆固醇,中国医药集团上海化学试剂公司提供,批号F20120803;胆酸钠,上海华硕精细化学品有限公司提供,批号F20080827;卵清白蛋白(批号326A053)、弗氏完全佐剂(批号107K8618)、弗氏不完全佐剂(批号068K8761),均为美国Sigma公司产品;Ca标准溶液,国家标准样品,GSB 04-1720-2004,由国家有色金属及电子材料分析测试中心提供;Ca2+测定试剂盒,中生北控生物科技股份有限公司提供,批号120548;CRP测定试剂盒,上海科华生物工程股份有限公司提供,批号 1309096。TDL-5型离心机,上海安亭科学仪器厂产品;7600-010型全自动生化分析仪,日本日立公司产品;contrAA®700型原子吸收仪,德国耶拿分析仪器股份公司产品。
1.3模型的建立
采用改良的高脂饲料饲养、维生素D3注射和卵清白蛋白免疫损伤复合法复制大鼠AS模型[3]。
1.4分组与给药
将AS大鼠随机分为模型对照组、阿托伐他汀钙片组 [5 μg/(g·d)]、冠心止痛胶囊大剂量组[3 g/(kg·d)] 和小剂量组[1.5 g/(kg·d)],另设正常对照组,每组10只。药物组灌胃相应药物,正常对照组和模型对照组给予等容积生理盐水(10 μL/g·d),1 d 1次,连续13周。正常对照组大鼠给予正常颗粒饲料,不给予维生素D3和AE。
1.5检测指标
1.5.1一般情况
每天观察大鼠活动、进食、排泄等一般状况,第一次实验前(第0天)称量各组大鼠体质量,于实验第7天、21天、35天、49天、63天、77天、91天称量大鼠体质量、并记录大鼠的摄食量。
1.5.2血清与主动脉组织Ca2+含量
实验第63天,眼球取血,采用全自动生化仪测血Ca2+含量。实验第91天,以水合氯醛麻醉大鼠,腹主动脉取血,离心取血清,测定血Ca2+含量;并摘取大鼠胸主动脉,称量质量,用硫酸、硝酸、过氧化氢硝解48 h,赶酸后过滤,加入基改剂(质量分数 5 g/L的氯化钾和 5 g/L 氯化镧),并配制Ca2+标准品,采用火焰法测主动脉Ca2+含量,波长422.672 8 nm。
1.5.3血清CRP含量测定
实验第91天,大鼠腹主动脉取血,取血清,采用免疫透射比浊法检测各组大鼠的CRP水平,操作严格按照试剂盒说明书进行。
1.6统计学方法
2 结 果
2.1各组大鼠一般情况、体质量和摄食量对比
正常对照组大鼠精神状态良好,活动灵活,行为、体征未发现异常,大鼠体质量随时间延长逐步增加。模型对照组部分大鼠出现活动减少、竖毛、身体蜷曲等体征;同期体质量增幅低于正常对照组,自实验第21天开始大鼠体质量低于正常对照组,差别有统计学意义(P<0.01);摄食量自第21天开始显著减少,与正常对照组同期对比,差别有统计学意义(P<0.01)。冠心止痛胶囊小剂量组体质量和摄食量与模型对照组对比,差别无统计学意义(P>0.05)。冠心止痛胶囊大剂量组大鼠第91天体质量低于模型对照组(P<0.05),之前体质量与模型对照组对比,差别无统计学意义(P>0.05); 第77天、第91天摄食量较模型对照组降低,差别有统计学意义(P<0.05),其余时间点的摄食量与模型对照组对比差别无统计学意义(P>0.05)。阿托伐他汀钙片组自第21天开始体质量较模型对照组降低,差别有统计学意义(P<0.01);第35天、第63天摄食量较模型组升高(P<0.05或P<0.01)。结果见表1,2。


组 别剂量/(g·kg-1)第0天第7天第21天第35天正常对照组—135.90±17.70183.10±24.90282.00±37.90359.50±42.70模型对照组—133.60±18.10188.30±18.90240.50±29.50**244.30±36.00**阿托伐他汀钙片组5×10-3130.90±16.40170.00±22.60194.90±19.90##199.90±20.10##冠心止痛胶囊大剂量组3.0140.90±16.50191.10±19.90229.30±30.30228.40±41.00冠心止痛胶囊小剂量组1.5142.30±13.50197.20±16.00246.90±19.90260.00±21.60


组 别剂量/(g·kg-1)第49天第63天第77天第91天正常对照组—405.30±36.50456.00±39.60479.40±47.20514.30±50.50模型对照组—281.30±58.90**273.60±46.00**276.30±42.00**280.20±40.10**阿托伐他汀钙片组5×10-3221.50±26.30##221.10±25.40##223.90±27.80##226.30±30.80##冠心止痛胶囊大剂量组3.0237.20±58.40232.70±62.40276.30±42.00240.10±49.10#冠心止痛胶囊小剂量组1.5282.20±36.50281.90±32.70278.00±37.60267.00±40.50
注:与正常对照组对比, **P<0.01;与模型对照组对比 #P<0.05,##P<0.01。


组 别剂量/(g·kg-1)第7天第21天第35天第49天正常对照组—62.76±2.4350.97±1.8344.24±3.5031.69±2.07模型对照组—64.46±2.3636.98±10.67**29.59±6.36**30.25±5.77阿托伐他汀钙片组5×10-367.20±5.7040.45±6.1839.34±4.93##36.04±3.65冠心止痛胶囊大剂量组3.064.18±4.2033.01±9.9331.76±3.1823.19±3.42冠心止痛胶囊小剂量组1.564.25±3.5632.94±9.0533.28±4.9326.73±4.68


组 别剂量/(g·kg-1)第63天第77天第91天正常对照组—31.69±3.1132.28±1.9730.45±4.09模型对照组—26.09±4.91**24.88±3.16**21.45±3.93**阿托伐他汀钙片组5×10-329.74±3.27#23.85±2.9923.93±35.53冠心止痛胶囊大剂量组3.024.84±5.9120.33±2.46##17.68±1.97##冠心止痛胶囊小剂量组1.523.23±4.1323.12±3.9820.89±3.17
注:与正常对照组对比,**P<0.01;与模型对照组对比,#P<0.05, ##P<0.01。
2.2各组大鼠血清和主动脉Ca2+含量对比
实验第63天,模型对照组血清Ca2+含量较正常对照组差别有统计学意义(P<0.01);阿托伐他汀钙片组、冠心止痛胶囊大、小剂量组血清Ca2+含量与模型对照组对比差别均无统计学意义(P>0.05)。第91天,模型对照组血清Ca2+含量继续升高,与正常对照组对比差别有统计学意义(P<0.05);阿托伐他汀钙片组、冠心止痛胶囊大、小剂量组血清Ca2+含量与模型对照组对比差别均无统计学意义(P>0.05);3个药物组主动脉Ca2+含量较模型对照组降低,差别有统计学意义(P<0.05或P<0.01)。冠心止痛大、小剂量组血清和主动脉Ca2+含量与阿托伐他汀钙片组对比,差别无统计学意义(P>0.05)。

表3 各组大鼠血清和主动脉Ca2+含量对比 ±s
注:与正常对照组对比,*P<0.05,**P<0.01;与模型对照组对比,#P<0.05, ##P<0.01。
2.3各组大鼠血清CRP含量对比
与正常对照组对比,模型对照组CRP含量增高,差别有统计学意义(P<0.05);3个药物组的CRP水平与模型对照组对比差别无统计学意义(P>0.05)。
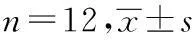

组 别剂量/(g·kg-1)CRP/(mg·L-1)正常对照组—0.87±0.17模型对照组—1.08±0.27*阿托伐他汀钙片组5×10-30.96±0.16冠心止痛胶囊大剂量组3.00.94±0.23冠心止痛胶囊小剂量组1.50.98±0.19
注:与正常对照组对比,*P<0.05。
3 讨 论
AS的病理生理机制众多,早期认为脂质沉积是主要原因,降脂药能有效降低心脑血管疾病的发病率,但不能完全阻止心脑血管疾病的发生、发展。脂质沉积学说并不能完全阐释心脑血管疾病发生,除此之外还有诸多原因。
炎症是促进冠心病发生、发展的重要因素,动脉粥样硬化的形成也是炎症进程。越来越多的研究发现:外周血 CRP与冠心病密切相关,参与了AS发生、发展过程的各个环节[4-6]。CRP 可激活经典的补体途径,介导吞噬作用,调节炎症,是感染和组织炎症非特异但敏感的标志物,前瞻性研究表明健康人CRP 可直接作用于血管内皮促进早期AS 的形成[7]。急性脑梗死患者颈动脉粥样硬化组的CRP、IL-6水平显著高于健康人,不稳定斑块组的CRP、IL-6水平显著高于稳定斑块组、无斑块组和健康人。因此,急性脑梗死患者AS斑块性质和CRP水平密切相关[8]。CRP 能够反映动脉粥样硬化斑块的成分,预测斑块破裂的可能性,是心血管疾病的独立预测因子[9-10],对于防治心脑血管疾病可能有重要意义。
本研究发现模型对照组的CRP水平有所增高,冠心止痛胶囊和阿托伐他汀钙片具有降低AS大鼠CRP水平的趋势,但较模型对照组差别无统计学意义,此可能与我们实验周期短有关,也可能是检测条件和方法较局限,本次实验结果的数值较低,而低浓度样品检测结果的变异较大。若将超敏C-反应蛋白作为检测指标可能会更好地表明冠心止痛胶囊对CRP的影响。
血管钙化是AS的典型临床病理表现,血管壁钙、磷过量的异常沉积,可造成斑块破裂和血栓形成[14]。动脉壁的钙盐沉积致使血管钙化,与斑块的不稳定性紧密相关,因此钙代谢异常也是AS发生、发展的重要因素[15]。大剂量的维生素D3增加了机体对钙的吸收,激活破骨细胞的活性,导致血钙增高、血管壁上钙盐沉积[16]。本研究采用高脂饮食联合维生素D3的方案复制AS模型,模型对照组的血管内Ca2+含量显著增加,冠心止痛胶囊可显著降低血管Ca2+含量,药效与阿托伐他汀钙片相当。表明:本研究成功复制了AS大鼠模型,冠心止痛胶囊可能具有抑制血管的钙盐沉积的作用。
中医药在治疗冠心病、AS等心血管疾病方面已积累了丰富的经验,可通过多途径、多靶点干预疾病的发生、发展进程。结合前期对冠心止痛胶囊的研究,笔者发现:冠心止痛胶囊除了可调节脂质代谢、抑制炎症因子的分泌或释放、改善动脉的病理变化外,还具有抑制血管内钙盐等作用,提示冠心止痛胶囊对AS和冠心病的预后、转归具有十分重要的临床意义。
[1]陈伟伟,高润霖,刘力生,等.中国心血管病报告2013 概要[J].中国循环杂志, 2014,30(7):487-491.
[2]黄霞,王守富,刘慧霞,等.冠心止痛胶囊对动脉粥样硬化模型大鼠的影响[J].中国实验方剂学杂志,2016,22(1):153-157.
[3]王军, 高传玉.心血管疾病动物模型[M].郑州: 郑州大学出版社, 2014:266-270.
[4]CAGNIN S, BISCUOLAM M, PATUZZO C, et al. Reconstruction and functional analysis of altered molecular pathways in human atherosclerotic arteries [J]. BMC Genomics, 2009,10:13.
[5]PRAJAPATI J, JAIN S, VIRPARIYA K, et al.Novel atherosclerotic risk factors and angiographic profile of young Gujarati patients with acute coronary syndrome[J].J Assoc Physicians India, 2014, 62(7):584-588.
[6]CHENG JM, OEMRAWSINGH RM, GARCIA-GARCIA HM, et al.Relation of C-reactive protein to coronary plaque characteristics on grayscale, radiofrequency intravascular ultrasound, and cardiovascular outcome in patients with acute coronary syndrome or stable angina pectoris (from the ATHEROREMO-IVUS study)[J]. Am J Cardiol, 2014,114(10):1497-1503.
[7]MORTENSEN RF.C-reactive protein, infammation and innate immunity [J] .Immunol Ros, 2001, 24(2):163-176.
[8]曾庆范, 卢红.急性脑梗死患者颈动脉粥样硬化斑块与IL-6及CRP的关系[J] .中国实用神经疾病杂志, 2016,19(7):17-19.
[9]张晓慧, 李光韬, 张卓莉.C 反应蛋白与超敏C 反应蛋白的检测及其临床意义[J] .中华临床免疫和变态反应杂志,2011,5(1):74-79.
[10]高锦雄, 彭海军, 严炳存, 等.C 反应蛋白与冠心病患者动脉硬化的相关性研究[J] .现代医院, 2013,13(5):13-17.
[14]ZOUHAIR A,HERIBERT S. Genetics of atherosclerosis and vascular calcification go hand-in-hand[J] .Atherosclerosis, 2013,228(2):325-326.
[15]庄瑞娟, 金卫东, 施海燕, 等.奥美沙坦酯对大鼠主动脉粥样斑块和血管钙化的干预作用[J].南通大学学报(医学版), 2015,35(1):17-20.
[16] EHARA S, KOBAYASHI Y, YOSHIYAMA M, et al.Spotty calcification typifies the culprit plaque in patients with acute myocardial infarction: an intravascular ultrasound study[J].Circulation, 2004, 110(22):3424-3429.
(编辑陶珠)
2016-05-13;修回日期:2016-05-18
1001-6910(2016)07-0062-04
R541.4
B
10.3969/j.issn.1001-6910.2016.07.30
国家中医药管理局重点学科建设项目(国中医药发[2009]30号);河南省中医药研究院中医心病学重点学科基础研究课题(1304482);河南省中医临床学科领军人才计划(2013-10)
·实验研究·
