HPLC-荧光检测法测定人血大黄酸的药代动力学和相对生物利用度
2016-08-09岳阳市二人民医院药剂科岳阳414000
李 伟(岳阳市二人民医院药剂科 岳阳 414000)
HPLC-荧光检测法测定人血大黄酸的药代动力学和相对生物利用度
李伟(岳阳市二人民医院药剂科岳阳414000)
目的:建立健康志愿者血浆中大黄酸的HPLC-荧光检测法,并研究大黄酸的药代动力学和人体相对生物利用度。方法:血浆样品用盐酸沉淀后离心,乙酸乙酯萃取上清液,以水(含1%醋酸)-甲醇-乙腈(60∶15∶25,v/v)为流动相,在Kromasil C18柱(250mm× 4.6mm,5μm)上分离,流速1.0mL·min-1。20名健康志愿者以随机双交叉实验方法,单剂量口服大黄酸胶囊受试制剂和参比制剂100mg,进行药代动力学分析和生物等效性判定。结果:大黄酸在0.05~5.0μg·mL-1的范围内线性关系良好,回归方程为A=2.991c+ 0.0011,r=0.9999。定量下限为0.05μg·mL-1。单剂量口服受试制剂和参比制剂的Tmax分别为(4.03±0.7)h和(4.07±0.6)h;Cmax分别为(16.2±3.1)μg·mL-1和(15.8±2.9)μg·mL-1;t1/2分别为(5.25±1.15)h和(5.36±1.19)h;MRT0-t分别为(7.21±0.78)h和(7.13±0.81)h;AUC0-t分别为(162.6±36.1)μg·mL-1和(157.8±38.7)μg·mL-1;AUC0-∞分别为(164.9±38.5)μg·mL-1和(159.4±39.2)μg·mL-1。结论:采用梯形法计算AUC0-t,单剂量口服大黄酸胶囊后,体内相对生物利用度为(105.6±13.1)%。经方差分析和双单侧t检验表明在人体内两种制剂具有生物等效性。
大黄酸胶囊 药代动力学 生物利用度
大黄酸(Rhein)广泛分布于蓼科植物大黄、何首乌、虎杖中,是大黄游离蒽醌衍生物,具有广泛的药理活性,因其能有效防治II型糖尿病肾病,引起学者广泛关注[1]。研究发现,大黄酸具有减轻肾小球硬化、肾脏肥大,改善胰岛素敏感性、降低血脂水平的作用[2]。基于明显的药理作用,大黄酸在人体内的药代动力学研究具有重要意义。本实验参考国内外相关研究,对20名志愿者口服大黄酸参比制剂和受试制剂后的药代动力学进行了研究,评价其生物利用度,为该药的临床实验提供参考。
1仪器与试药
1.1仪器:日本岛津高效液相色谱仪(SPD-M20A检测器,LC-20AT型泵),CTO-10A柱温箱,RF-10AXL荧光检测器(日本岛津);高速离心机、SPD1010离心浓缩装置(美国Thermo);80-2离心沉淀器(盛威实验仪器厂);mini-Q Gradient AIO超纯水器(Millipore公司);KQ-50B型超声波清洗器(上海昨非实验室设备有限公司)。
1.2药品与试剂:受试制剂:大黄酸胶囊(50mg·粒-1;批号:20120415;南京军区南京总医院);参比试剂:大黄酸片剂(50mg·粒-1;批号:20111109;中国药科大学);大黄酸标准对照品(中国药品生物制品检定所);1,8二羟基蒽醌(中国药品生物制品检定所);甲醇(色谱纯,阿尔法试剂公司);乙腈(色谱纯,Merck公司);醋酸、盐酸、乙酸乙酯均为分析纯;水为双蒸水;空白血浆由兖矿集团有限公司总医院提供。
2溶液的配制
2.1大黄酸对照品溶液:精密称取大黄酸标准品10.0mg,置100mL容量瓶中,加入甲醇摇匀,配制成100mg·L-1的储备液,4℃冰箱保存。使用时,用甲醇稀释至所需浓度。
2.2内标溶液:精密称取1,8二羟基蒽醌10.0mg,置100mL容量瓶中,用甲醇溶解摇匀,配制成100mg·L-1的储备液,4℃冰箱保存。储备液用甲醇稀释,配制成50.0μg·L-1的内标溶液备用。
3给药方案与样品采集
试验经兖矿集团有限公司总医院伦理委员会批准,选择20名健康男性志愿受试者,年龄22~27岁,体重55~75kg,在实验前于兖矿集团有限公司总医院接受全面体检,体检合格后签署知情同意书并纳入实验。
20名受试者随机分为两组,每组10人,采用双周期随机交叉试验设计。试验前禁食10h,早晨空腹口服大黄酸胶囊或大黄酸片剂 100mg,温开水送服,于服药前(0h)和服药后0.5,1.0,2.0,3.0,4.0,5.0,6.0,8.0,12.0,24.0h由肘静脉抽血5mL,离心分取血浆,-20℃冰箱保存。
4色谱条件
色谱柱:Kromasil C18(250mm×4.6mm,5μm);流动相:水(含1%醋酸)-甲醇-乙腈(60∶15∶25);流速:1.0mL·min-1;激发波长:440nm;发射波长:520nm;柱温:35℃;进样量:15μL。
5血浆样品处理
取血浆样品0.5mL,加入内标1,8二羟基蒽醌(50mg·L-1)50μL涡旋混匀,加入30μL盐酸(2mol·L-1),涡旋5min,加入1mL乙酸乙酯萃取,涡旋10min,离心10min(8000r·min-1),取乙酸乙酯相N2流吹干后,加入50μL甲醇溶解,进样15μL。
6专属性
采用内标法进行测定,大黄酸与血浆中杂质完全分离,内源性物质基本不干扰测定,本实验条件下测得的色谱图见图1。大黄酸的保留时间8.62min,内标在11.78min,两者完全分离,峰形良好,空白血浆中杂质峰不干扰测定,本方法专属性较高。
7标准曲线与线性范围
精密吸取空白血浆0.5mL,加入对照品储备液,涡旋振荡5min,用空白血浆稀释成含大黄酸0.05,0.10,0.20,0.50,1.0,2.0,5.0μg·mL-1的血浆样品,按照“5”中血浆样品处理操作并测定,记录色谱图,以大黄酸峰面积(A)与血药浓度(C)进行线性回归。得线性回归方程:A=2.991c+0.0011 r=0.9999
大黄酸在0.05~5.0μg·mL-1的范围内线性关系良好。定量下限为0.05μg·mL-1。
8准确度与精密度
去空白血浆0.5mL,按照“7”的方法配制10.0,100.0,500.0μg·L-1的质量控制样品,每一浓度进行5样本分析,同一天内测定5次,连续测定3d,记录大黄酸峰面积,按回归方程计算浓度,求得准确度与日内、日间精密度,结果见表1。

表1方法的准确度与精密度(n=5)
9方法的提取回收率
配制浓度为10.0,100.0,500.0μg·L-1的对照品血浆,按“7”项操作,测定峰面积A1;另外配制10.0,100.0,500.0μg·L-1的对照品溶液,进样测定峰面积A2。每一浓度进行5样本分析,以A1与A2之比计算提取回收率。内标物1,8二羟基蒽醌(1000.0μg· L-1)提取回收率实验方法相同(表2)。

表2提取回收率(n=5)
10方法稳定性
用空白血浆配制10.0,100.0,500.0μg·mL-1的对照品血浆,分别置于室温放置12h、-20℃冷冻-解循环2次、-20℃冰箱保存20d,药物稳定性良好(表3)。
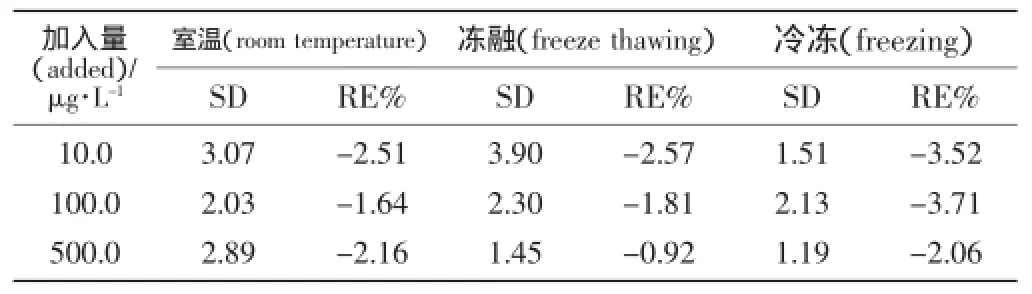
表3样品稳定性考察(n=3)
11 口服大黄酸药-时曲线
两组受试者服用受试制剂100mg后平均血药浓度/时间曲线(图2)。
12药代动力学参数
20名男性健康志愿者单剂量交叉口服大黄酸胶囊受试制剂和参比制剂。经DAS(Drug And Statistics,version 2.0)程序处理,采用非房室模型计算药代动力学参数,结果见表4。
13单剂量口服大黄酸胶囊的相对生物利用度
两组受试者交叉服用两种制剂的平均生物利用度为(105.6±13.1)%,方差分析结果表明受试制剂和参比制剂的Cmax和AUC0-24之间没有显著差异(P>0.05),90%置信区间受试试剂在参比试剂99.6%~112.4%之间,证明两种制剂具有生物等效性。
14讨论
14.1 20名健康志愿者服用大黄酸胶囊100mg后,根据平均血药浓度曲线,药代动力学参数与文献报道基本一致[3]。由实验结果可知,大黄酸胶囊口服给药3~4h达到最大血药浓度。方差分析显示,大黄酸参比制剂和受试制剂Cmax、AUC0-t值和AUC0-∞值存在明显个体差异,临床用药时需考虑个体化用药。实验过程,无不良反应发生。
14.2专属性实验发现,大黄酸在光照、酸、碱、热条件下相对稳定。对大黄酸胶囊的色谱峰进行PDA检测,主峰纯度较好,未发现杂质峰。
14.3生物样品中大黄酸的检测常用HPLC-UV法、放射性标记法、HPLC-MS法和固相萃取法等,HPLC-UV法检测过程易被血浆样品杂质干扰,灵敏度不高,误差较大;放射性标记法需要价格昂贵的特殊设备,对仪器要求高,难以推广;大黄酸临床样品浓度高,质谱检测残留较大,HPLC-MS法难以定量测定人体内的大黄酸;固相萃取法成本高,操作烦琐,不利于进行大批量新药研究。本文建立了对人血浆(0.5mL)中大黄酸浓度的HPLCFLD方法,该方法灵敏度高,杂质干扰少。大黄酸对治疗糖尿病和肾病具有一定效果,该检测方法符合生物样品检测要求,为大黄酸的临床研究提供了稳定可靠且操作方便的检测手段。
[1]张锦雯,王广基,孙建国,等.HPLC-荧光检测法测定大鼠血浆中大黄酸的浓度及其药代动力学[J].中国天然药物,2005,3(4):238.
[2]刘志红,郑敬民,吴义超,等.糖尿病肾病小鼠肾脏基因表达谱及大黄酸对其影响[J].肾脏病与透析肾移植杂志,2002,11:201.
[3]万萍,孙建国,郝刚,等.大黄酸的HPLC-荧光检测及其在人体药代动力学中的应用[J].中国药科大学学报,2013,44(1):73.
R927.2
A
1672-8351(2016)08-0007-03
