紫苏PfPDAT基因单核苷酸多态性分析
2016-08-04李璐赵静梁倩孔存翠王计平
李璐,赵静,梁倩,孔存翠,王计平
(山西农业大学 农学院,山西 太谷 030801)
紫苏PfPDAT基因单核苷酸多态性分析
李璐,赵静,梁倩,孔存翠,王计平*
(山西农业大学 农学院,山西 太谷 030801)
摘要:[目的] 磷脂:二酰甘油脂酰转移酶(PDAT)是植物油脂合成最后一步酰基化反应的关键酶之一,研究紫苏PfPDAT基因单核苷酸多态性,旨在分析该基因多态性与紫苏种子油脂含量之间的关系。[方法] 以脂肪酸含量不同的7个紫苏品种为试材,通过直接测序法分析PfPDAT基因cDNA全长序列的单核苷酸多态性及其与油脂含量的关系。[结果]在所测总长度为14 679 bp的核苷酸序列中,共检测到9个SNP 和2个InDel,单核苷酸多态性频率分别为1/1 631 bp和1/7 340 bp,其中编码区含2个SNP,非编码区为7个。编码区和非编码区发生SNP的频率分别为1/5 439 bp和1/543 bp。根据PfPDAT 基因序列多态性将供试紫苏材料分为不同的单倍型,单倍型H1和H2中都包含有油脂含量较高和含量较低的材料。[结论]PfPDAT基因的单倍型分类与紫苏油脂含量之间没有显著相关性,同时也反映了植物种子油脂合成的复杂性。
关键词:紫苏; 种子油脂; PfPDAT; 单核苷酸多态性
紫苏(Perilla frutescens)作为一种药食同用的新型油料作物,越来越引起人们的关注[1]。紫苏籽油富含α-亚麻酸,是人体必需脂肪酸,但是不能直接在人体内合成,只能通过食物供给[2],因此,开发基于植物源的α-亚麻酸营养保健产品具有十分重要的意义。目前,有关紫苏α-亚麻酸生物合成积累及调控机制的研究很少。磷脂:二酰甘油脂酰转移酶(PDAT)是植物油脂合成最后一步酰基化反应的关键酶之一,PDAT途径最初是在酿酒酵母中发现的,Oelkers等[3]发现PDAT在酵母中参与对数期TAG的合成。该途径利用磷脂作为脂酰基供体,二酰甘油(DAG)作为脂酰基受体,在该酶的催化作用下,将磷脂酰胆碱(phosphatidylcholine,PC)的sn-2位的酞基链转移到DAG上,形成溶血卵磷脂和三酰甘油TAG[4~6]。Dahlqvist等[7]利用蓖麻微粒体制备物可以将2-[14C]蓖麻油酰-DAG作为底物形成TAG,证明在发育的蓖麻微粒体制备物中具有PDAT活性,对蓖麻油酸具有高特异性。PDAT被认为与特殊FA(fattyacid,FA,主要以脂酰-CoA的方式存在)在TAG中的积累有关。蓖麻是一种特殊FA植物,在种子中可积累80 %~90 % 的羟基化FA-蓖麻油酸。在蓖麻种子发育过程中可检测到较高的蓖麻油酸的PDAT酶活性,在转化蓖麻油酸合成基因RcFAH12的拟南芥中过表达RcPDAT可使得种子积累的蓖麻油酸由17 %提高到25%[8]。单核苷酸多态性(singlenucleotidepolymorphism,SNP)主要是指在基因组水平上由单个核苷酸的变异所导致的DNA序列多态性,分布在基因编码区的SNP又称为cSNP位于外显子内,cSNP可引起表达蛋白的多态性,非同义替换将会导致蛋白质结构及功能的改变[9]。本试验以种子油脂含量不同的紫苏品种为试验材料,利用直接测序法研究紫苏PfPDAT基因的单核苷酸多态性(SNP),分析PfPDAT基因多态性与紫苏种子油脂含量及α-亚麻酸含量之间的关系,为紫苏种子油脂品质的遗传改良提供基础。
1材料与方法
1.1试验材料
本研究以晋苏1号、中北、白苏、Y-2、Y-4、Y-7、Y-早为试材, 具体情况如表1。

表1 试验材料
1.2试验方法
1.2.1紫苏RNA的提取及cDNA的合成
利用TRNzol总RNA提取试剂盒(天根生化科技有限公司)提取7个紫苏品种开花后10d的种子RNA,反转录为cDNA,用于PCR扩增。
1.2.2引物设计
利用PrimerPremier5.0软件对克隆得到的紫苏PfPDAT全长cDNA序列设计2对能够进行全长cDNA扩增的叠套引物,分别命名为:F1/R1和F2/R2(见表2)。
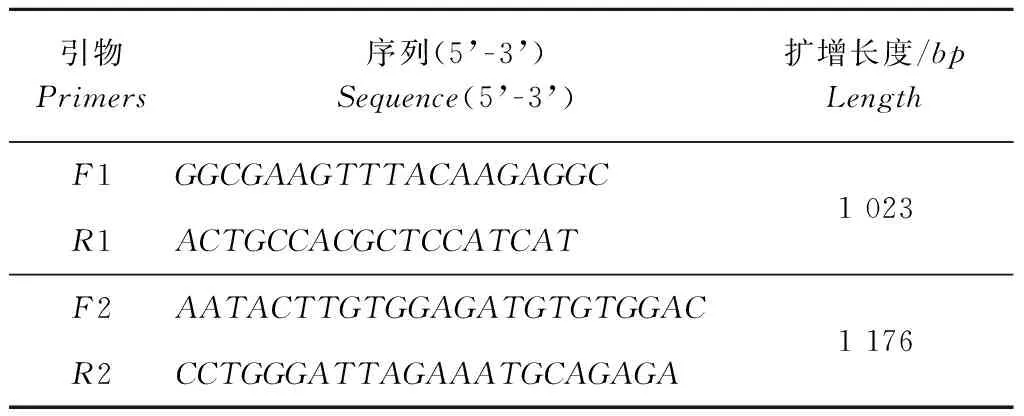
表2 引物序列
1.2.3PCR扩增和测序
PCR扩增体系:模板cDNA2μL,引物1μL,10×TaqBuffer2μL,dNTPMixture(2.5mol·L-1) 1.6μL,DNAPolymerase0.5μL,ddH2O12.9μL,共20μL。反应条件为:94 ℃ 3min→(94 ℃ 30s→60 ℃ 30s→30 ℃ 2min)×循环30次→72 ℃ 5min→4 ℃保存 。
将能够扩增出特异性强的单一条带的PCR产物送至北京金诺锐杰基因科技有限公司进行双向测序,每份材料至少检测6个克隆。
1.2.4SNP位点鉴定
利用Chromas1.81 软件将测序峰图较好的序列用于cSNP分析。当|低峰值|/|主峰值|≥0.3 时,认为是杂合位点,反之则为模糊位点,无法进行判断。
1.2.5SNP位点检测
测序结果利用DNAStarSeqMan软件进行质量评估和组装拼接,用DNAStarMegalign软件对不同材料的序列进行多序列联配(ClustalW),用DnaSP5.0 和PHYLIP软件包对不同品种的序列进行单核苷酸多态性及单倍型分析。
2结果与分析
2.1紫苏PfPDAT基因PCR扩增
如图1-1A和1-1B,7个品种所扩增出的PCR产物与预期的分子量相一致,引物特异性较强,无非特异性扩增条带,浓度高,能够满足PCR产物测序,随后标记样品进行双向测序。

图1-1A F1/R1引物PCR扩增产物电泳分析Fig.1-1A Electrophoresis of amplified PCR product of F1/R1 primer
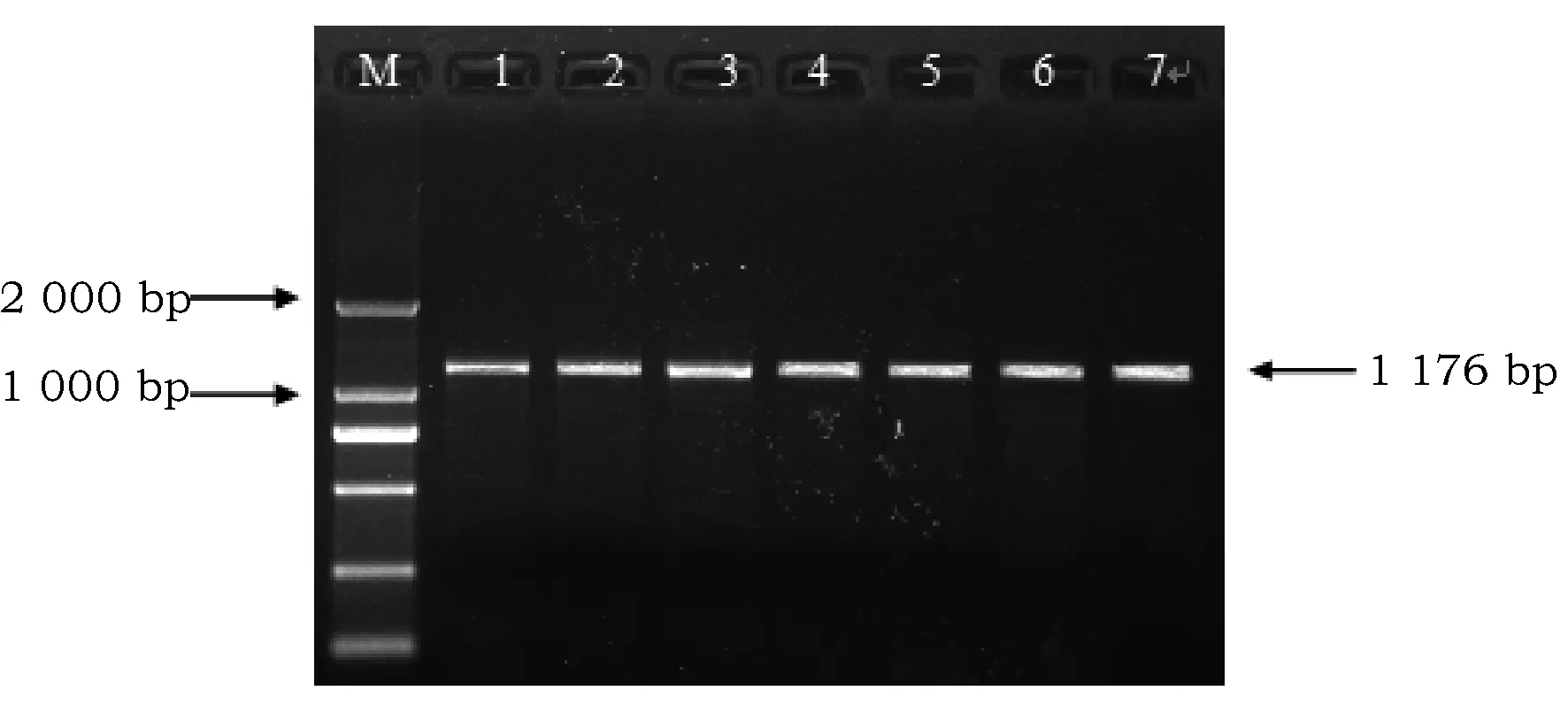
图1-1B F2/R2引物PCR扩增产物电泳分析Fig.1-1B Electrophoresis of amplified PCR product of F2/R2 primer 注: M:DL2000 marker;1~7分别为紫苏品种晋苏1号、白苏、中北、Y-2、Y-4、Y-7、Y-早。Note: M:DL2000 marker; 1~7 respectively perilla varieties Jin Su 1, Bai Su, Zhong Bei, Y-2, Y-4, Y-7, Y-Zao.
2.2SNP位点鉴定
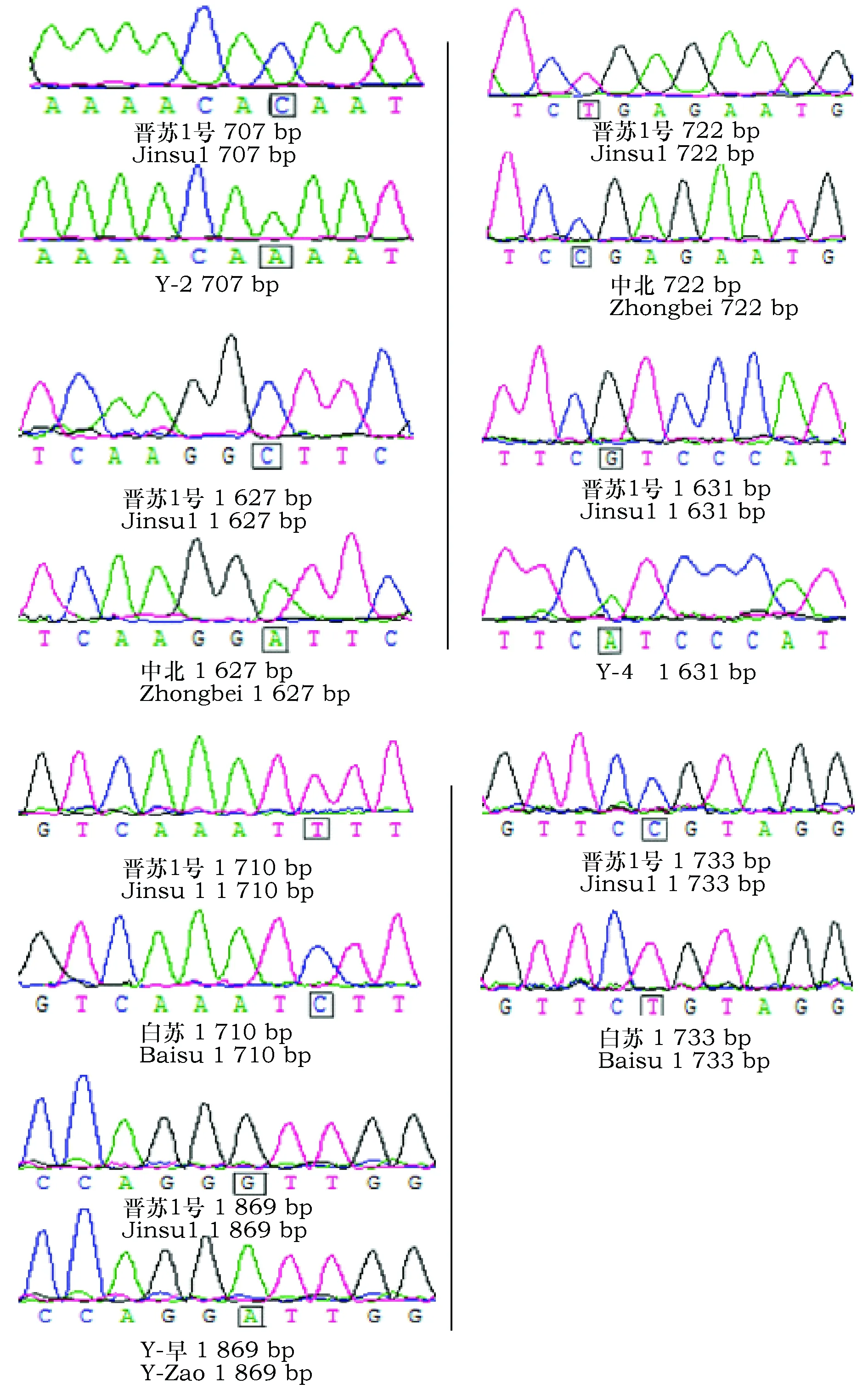
图2 PfPDAT基因多态位点测序图Fig.2 The sequencing map for polymorphism locus of PfPDAT
测序结果进行比对分析发现,在总长度14 679bp核苷酸序列中共有9个SNP位点和2个InDel,SNP位点检测如图2所示,位点清晰且为单一峰,具有较高的可信度。以晋苏1号作为参照,9个SNP位点中有2个位点位于编码区,分别为Y-2的707bp位点处碱基C转换为A,中北722bp位点处碱基T转换为C。剩余的7个位点和2个InDel都位于非编码区,中北1 627bp位点处碱基C转换为A;Y-4 1 631bp位点处碱基G转换为A;白苏1 710bp位点处碱基T转换为C;白苏/中北/Y-7的1 733bp同一位点处发生突变(中北、Y-7基因多态位点测序图同白苏1 733bp故略图),均由C转换为T;Y-早1 869bp位点处碱基G转换为A。
2.3紫苏PfPDAT基因的单核苷酸多态性分析
2.3.1紫苏PfPDAT基因序列多态性分析
对7份材料进行单核苷酸多态性分析,结果如表3所示:总长度为14 679bp核苷酸序列中共发现9个SNP位点和2个InDel,多态性频率分别为1/1 631bp和1/7 340bp,其中编码区有2个SNP位点,非编码区有7个,SNP在编码区和非编码区中出现的频率分别为1/5 439bp和1/543bp,SNP在非编码区的变异频率约为编码区的10倍,且9个SNP都属于碱基转换突变。2个InDel出现在非编码区,发生频率为1/1 901bp,分别在野生型品种Y-2和栽培型品种中北中检测到。

表3 PfPDAT基因序列核苷酸变异
核苷酸多样性(π)的大小代表该基因的遗传变异程度。PfPDAT基因在序列总长中π值为0.00127,其中编码区为0.000 37,非编码区为0.003 16,非编码区π值大于编码区,因此非编码区的遗传变异程度较大。
2.3.2紫苏PfPDAT基因编码区多态性位点分析
对7份供试材料PfPDAT基因编码区碱基序列和所翻译的氨基酸序列进行检测分析,在Y-2和中北2个品种中各发现了1个SNP位点,其中中北722bp位点为同义突变,同义变异对编码蛋白质的氨基酸组成没有变化,因此对基因的功能和表型没有影响。
位于Y-2第707bp位点的变异为非同义突变,碱基由C转换为A,氨基酸由组氨酸变为谷氨酰胺,由于突变位点不在该基因PLN02733superfamily功能域之内,因此可能不会影响蛋白质的合成和基因的表达。
2.3.3紫苏PfPDAT基因编码区多态性分析
对7份供试材料PfPDAT基因编码区内由核苷酸多样性引起的同义与非同义突变进行分析,结果表明(见表4):同义突变大于非同义突变。Ka(非同义突变平均数)与Ks(同义突变平均数)之比表示基因的选择效应及选择方向,当Ka/Ks>1时,基因进行正向选择,快速进化基因;Ka/Ks=1时,为中性变异,群体不发生改变;Ka/Ks<1时,进行负向选择影响,为相对保守基因[10]。PfPDAT基因Ka与Ks之比为0.3,该基因属于负向选择,核苷酸序列相对保守。

表4 PfPDAT编码区单核苷酸多样性
2.4紫苏PfPDAT基因单倍型分析
对7份供试材料进行聚类分析和单倍型分析,结果如图3所示。该基因序列在不同品种间差异较小,4份野生型品种为一分支,剩余3份栽培型品种为另一分支,遗传关系较近,遗传系数达0.99。单倍型分析显示,7份材料可分为2个单倍型,单倍型H1包含Y-2、Y-4、Y-7、Y-早共4个野生型品种,其中品种Y-2总脂肪酸含量较高,但品种Y-4、Y-7、Y-早总脂肪酸含量较低;单倍型H2包括晋苏1号、白苏和中北3个栽培型品种,其中晋苏1号总脂肪酸含量较高,白苏和中北总脂肪酸含量较低。本研究供试材料较少,因此不能很好地解释油脂含量与单倍型分类之间的相关性,同时也表明植物种子油脂合成的复杂性。
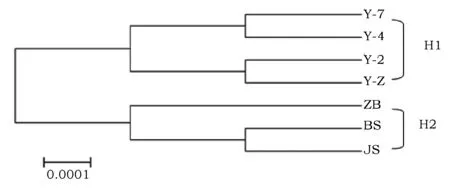
图3 7份紫苏材料的聚类分析Fig.3 Cluster analysis of 7 Perilla frutescens genotypes 注:不同品种紫苏名称分别为:BS:白苏;ZB:中北;JS1:晋苏1号;Y-2:Y-2;Y-7:Y-7;Y-4:Y-4;Y-Z:Y-早Note: Different varieties of Perilla frutescens names: BS:BaiSu; ZB:ZhongBei; JS1:JinSu 1; Y-2:Y-2; Y-7:Y-7; Y-4:Y-4; Y-Z:Y-Zao
3结论与讨论
在生物进化过程中,SNP的出现是自然和人工共同选择的结果[11~14],当个体中的SNP随着时间的延长得以保留时,SNP的发生会在一定程度上加快个体的进化速度[15]。作为继RFLP、AFLP、SSR之后第四代分子标记的SNP具有很大的发展潜力,广泛应用于生物、农学、医学等众多领域,在分子育种和遗传学等方面发挥着巨大的作用,大量研究表明SNP与遗传表型具有直接联系,李密杰等[16]研究表明SNP标记将成为研究人类及动植物遗传变异和进化的重要方法。本研究通过对7份供试紫苏材料PfPDAT基因全长cDNA进行单核苷酸多态性分析,在总长度为14 679bp核苷酸序列中共发现9个SNP位点和2个InDel,二者多态性频率分别为1/1 631bp和1/7 340bp,均低于棉花R2R3-MYB转录因子0.94/100bp[17]、葡萄MYBA转录因子1/33bp[18]、向日葵基因组编码区1/63bp[19]、及水稻基因组编码区3/1 000bp[20]的发生频率,因此推测cSNP的发生频率可能与生物种类、基因功能和表达等有一定的相关性。对该基因进行蛋白质功能预测和氨基酸多态性分析结果表明:在材料Y-2的第707位点上的SNP变异导致氨基酸发生变化,但由于这一位点不在氨基酸序列第2~143位的PLN02733superfamily功能域之内,因此可能不会对紫苏种子油α-亚麻酸含量及蛋白质的合成和表达产生影响。
植物种子积累储存TAG是一个非常复杂的生理生化过程,研究表明,PDAT基因表达与植物种子油含量和油脂成分都有一定的限制作用[21]。前期研究结果表明本文所用的7个紫苏品种在种子发育的过程中脂肪酸的组成成分及含量均具有明显的差异[22],但在对PfPDAT基因进行单倍型分析时发现:7个供试材料可以分为两个单倍型,单倍型H1和H2中均包含总脂肪酸含量较高和总脂肪酸含量较低的品种,由于本研究所选紫苏材料较少,因此不能很好地解释PfPDAT基因单倍型分类与油脂含量之间的相关性,同时也进一步说明了植物中油脂合成的复杂性。
参考文献
[1]张燕平,王维华,董贵玲,等.紫苏中天然抗氧化物质的提取及增效作用的研究[J].西部粮油科技.2000,25(2):36-39.
[2]曲永洵.谈谈油脂的保健功能[J].中国油脂,2000,25(5):39-40.
[3]OelkersP,CromleyD,PadamseeM,etal.TheDGATGeneDeterminesaSecondTriglycerideSyntheticPathwayinYeast[J].JBiolChem,2002,277:8877-8881.
[4]BASFPlantScienceGmbH,Expressionofphospholipid:diacylglycerineacyltran-sferase(pdat)fortheproductionofplantstoragelipidswithpolyunsaturatedfattyacids[P].DE,WO/2003/083100,2007-9-12.
[5]ZhangM,FanJ,TaylorDC.DAGT1andPDAT1acyltransferaseshaveoverlappingfunctionsinArabidopsistriacylglycerolbiosynthesisandareessentialfornormalpollenandseeddevelopment[J].PlantCell,2009,21:3885-3901.
[6]BaudS,BoutlnJP,MiquelM,etal.AnintegratedoverviewofseeddevelopmentinArabidopsisthalianaecotypeWS[J].PlantPhysiolBiochem, 2002,40(2):151-160.
[7]DahlqvistA,StahU,LenmanM,etal.Phospholipid:diacylglycerolacyltransferase:anenzymethatcatalyzestheacyl-CoA-independentformationoftriacylglycerolinyeastandplants[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica.2000,97(12):6487-6492.
[8]KimHU,LeeKR,GoYS,etal.Endoplasmicreticulum-locatedPDAT1-2fromcastorbeanenhaceshydroxyfattyacidaccumulationintransgenicplants[J].Plant&cellphysiology,2011,52:983-993.
[9]曾朝阳,熊炜,周艳宏,等. 高密度全基因组单核苷酸多态芯片研究进展及其在肿瘤研究中的应用[J]. 癌症,2006,25(11):1454-1458.
[10]NielsenR.Molecularsignaturesofnaturalselection[J].AnnualReviewofGenetics,2005,39:197-218.
[11]NicolaiM,PisaniC,BoucherJ,etal.DiscoveryofalargesetofSNPandSSRgeneticmarkersbyhigh-throughputsequencingofpaper[J].GeneticsandMolecularResearch,2012,11(3);2295-2300.
[12]SchmidKJ,Ramos-OnsinsS,Ringys-BecksteinH,etal.AmultilocussequencesurveyinArabidopsisthalianarevealsagenome-widedeparturefromaneutralmodelofDNAsequencepolymorphism[J].Genetics,2005,169(3):1601-1615.
[13]GanalMW,AltmannT,RoderMS.SNPidentifitionincropplants[J].Curr.Opin.PlantBiol.,2009,12(2):211-217
[14]WrightSI,FoxeJP,WilsonLD.TestingforeffectsofrecombinationrateonnucleotidediversityinnaturalpopulationsofArabidopsislyrata[J].Genetics,2006,174(3):1492-1303.
[15]ChangeD,GasicK,CrowhurstRN,etalDevelopmentofasetofSNPmakerspresentinexpressiongenesoftheapple[J].Genomics,2008,92(5):353-358.
[16]李密杰. 山羊LHX4和POU1F1基因遗传分析及其与经济性状的关联[D].杨凌:西北农林科技大学,2009.
[17]AnC,SahaS,JenkinsJN,etal.CottonR2R3-MYBtranscriptionfactorsSNPidentification.phylogenomiccharacterization,chromosomelocalizationandlinkagemapping[J].TheoreticalandAppliedGenetics,2008,116:1015-1026.
[18]RiahiL,ZoghlamiN,Fournier-LevelA,etal.CharacterizationofsinglenucleotidepolymorphisminTunisiangrapevinegenomeandtheirpotentialforpopulationgeneticsandevolutionarystudies[J].GenetResourCrop,2013,60(3):1139-1151.
[19]KolkmanJM,BerryST,LeonAJ,etal.Singlenucleotidepolymorphismsandlinkagedisequilibriuminsunflower[J].Genetics,2007,177(1):457-468.
[20]YuJ,HuSN,WangJ,etal.ADraftsequenceofthericegenome[J].Science,2002,296(5565):79-92.
[21]XuJ,CarlssonAS,FrancisT,etal.TriacylglycerolsynthesisbyPDAT1intheabsenceofDGAT1activityisdependentonreacylationofLPCbyLPCAT2[J].BMCPlantBiol,2012,12: 4.
[22]张玲慧. 紫苏种子油脂代谢及限速酶DGAT1基因的表达分析[D].太谷:山西农业大学,2014.
(编辑:武英耀)
收稿日期:2016-03-22 修回日期:2016-04-23
作者简介:李璐(1992-),女(汉),山西灵石人,在读硕士,研究方向:紫苏油脂代谢机理 *通讯作者:王计平,副教授,博士,硕士生导师。Tel: 13633544366;E-mail:sxndwjp@163.com
基金项目:国家自然科学基金(31201266)
中图分类号:S565.8
文献标识码:A
文章编号:1671-8151(2016)08-0551-06
SinglenucleotidepolymorphismsanalysisofPfPDATGeneinPerilla frutescens
LiLu,ZhaoJing,LiangQian,KongCuncui,WangJiping*
(College of Agriculture, Shanxi Agricultural University, Taigu 030801, China)
Abstract:[Objective] Phospholipid: diacylglycerol acyltransferase (PDAT) is one of the key enzymes that can catalyze the final acylation of triacylglycerol (TAG). The objective of the present study was to detect single nucleotide polymorphisms (SNP) of PfPDAT and determine the relationship between SNP and seed fatty acid content. [Methods] Seven perilla varieties with different fatty acid content were used as the plant materials. The single nucleotide polymorphism of the full-length cDNA sequence of PfPDAT gene was analyzed by sequencing. [Results] Eleven nucleotide mutations were identified, including 9 SNP and 2 InDel in a total of 14679 bp nucleotide acid sequence. The frequencies of SNP and InDel were 1/1 631 and 1 /543, respectively. Among them, 2 SNP loci were in the coding region and 7 SNP in non-coding region. The SNP frequencies were 1/5439 bp and 1/543 bp respectively. The tested seven accessions could be classified as two haplotypes. Haplotype H1 and H2 comprised higher oil content materials and low oil content materials, synchronously. [Conclusion] The results of research showed that there was no significant correlation between haplotype classification of PfPDAT gene and perilla seed oil content, meanwhile it also showed that plant seed oil synthesis was very complicated.
Key words:Perilla frutescens; Seed oil; PfPDAT; Single nucleotide polymorphisms
