外源激素对紫马铃薯试管苗快繁的影响
2016-08-04冯璐王玉国温银元高佳佳刘圆贺美琳
冯璐,王玉国,温银元,高佳佳,刘圆,贺美琳
(山西农业大学 农学院,山西 太谷 030801)
外源激素对紫马铃薯试管苗快繁的影响
冯璐,王玉国*,温银元,高佳佳,刘圆,贺美琳
(山西农业大学 农学院,山西 太谷 030801)
摘要:[目的]为研究不同外源激素及其配比对紫马铃薯试管苗生长的影响。[方法]以紫马铃薯的无菌试管苗为试验材料,在添加不同浓度的生长素(IBA、NAA、2,4-D)和细胞分裂素(TDZ、6-BA、ZT)的MS培养基上培养,观察并分析各项生长指标。[结果]IBA、NAA两种生长素对根系生长的影响较大,IBA 1.0 mg·L-1时有利于紫马铃薯试管苗根的生长,对根系作用效果明显,NAA浓度在0.5 mg·L-1以上时不利于根系生长;2,4-D 0.5~2.0 mg·L-1时试管苗株高增加、茎纤细、根系极不发达,产生乳白色、块状愈伤组织。0.5 mg·L-1的TDZ或ZT可促进不定芽产生,利于芽增殖;单独使用6-BA时,无不定芽产生,也不利于试管苗生长。[结论]紫马铃薯试管苗生长的最适培养基成分:MS+IBA 1.0 mg·L-1+6-BA 1.0 mg·L-1、MS+NAA 0.5 mg·L-1+6-BA 0.2~0.5 mg·L-1。
关键词:紫马铃薯;试管苗;植物激素;快繁
马铃薯(Solanum tuberosumL.)为茄科(Solanaceae)茄属(Solanum),一年生双子叶草本植物,可作一年生或一年两季栽培[1],目前已成为继玉米、水稻和小麦之后的世界第四大粮食作物。紫色马铃薯原产于南美洲玻利维亚,不仅具有营养丰富、易于消化吸收、适应性强等特点,还含有普通品种所没有的天然花青素,具有一定的药理保健作用,同时作为天然着色剂应用于现代食品工业[2,3]。在中国,随着马铃薯主粮化的推进,马铃薯种植范围广、产业发展迅速,已经成为我国调整种植结构、解决粮食安全的重要部分[4]。然而,中国马铃薯的单产水平不到欧美等发达国家的一半,其主要原因在于马铃薯是无性繁殖作物,其繁殖过程中病毒逐代积累而危害马铃薯产量和品质[5]。因此,目前利用植物组织培养技术,培育出优质的新品种马铃薯种苗、种薯是解决该问题的根本方法。
近年来,对马铃薯种苗茎尖脱毒、微型种薯诱导等方面的研究已有很大的进展,但在微型种薯繁育及种质保存等研究及应用中仍存在大量的问题[6],脱毒种薯繁种数量少、质量差、增产效果有限,试管苗保存中出现叶片小、徒长、茎细弱、分枝减少等现象。脱毒种薯的产量、品质依赖于品种及试管苗质量,因此,选择培育优质品种及提高试管苗质量成为生产优质马铃薯试管苗和微型种薯的重要环节[7]。本试验选择优质的紫马铃薯,研究不同外源激素对新品种试管苗生长的影响,建立激素的最佳配比,为进一步优化继代培养基配方,提高紫马铃薯试管苗质量,进而增强种薯品质提供参考。
1材料与方法
1.1材料
材料:以紫马铃薯具有腋芽的节间或幼嫩茎段为外植体。
试剂:MS基本培养基;蔗糖;琼脂; 吲哚丁酸IBA、α-萘乙酸NAA、2,4-二氯苯氧乙酸2,4-D;噻二唑苯基脲TDZ、6-苄基腺嘌呤6-BA、玉米素ZT;
将上述激素配置成1.0g·L-1的溶液,存放于4 ℃冰箱中备用。
1.2无菌试管苗的获得
取紫马铃薯的幼嫩茎段,利用肥皂水冲洗20min,然后在超净工作台上进行外植体消毒;用无菌水涮洗2次,将幼嫩茎段转入无菌瓶中,用75%酒精浸30s,用无菌水冲洗3~4次,利用3%NaClO消毒10min,再用无菌水冲洗5~6次,处理过程中轻轻晃动无菌瓶;消毒完成,待用。
将已消毒的外植体接入MS基本培养基,最终获得无菌苗。选择经过5次继代培养的同一无性系组培苗为试验材料。
1.3接种与培养
选择同一无性系试管苗的中间部位,切成长度约0.5cm含一个腋芽的茎段。将切成的茎段接种于各处理培养基中,每瓶约8个外植体,每个处理6瓶,重复3次。
培养条件为温度(25±2) ℃,光照强度2 000~3 000Lx,光照时间14h·d-1,相对湿度70%~80%,定期观察其生长情况。
1.4试验设计
1.4.1单因子生长素
试验共设计4种处理:①MS+IBA(0.5、1.0、1.5、2.0mg·L-1);②MS+NAA(0.5、1.0、1.5、2.0mg·L-1);③MS+2,4-D(0.5、1.0、1.5、2.0mg·L-1);④MS为对照。观察不同浓度生长素对紫马铃薯试管苗的影响,35d后,测量并记录株高、茎粗、生根数,观察试管苗素质等。
1.4.2单因子细胞分裂素
试验共设计4种处理:①MS+TDZ(0.5、1.0、1.5、2.0mg·L-1);②MS+ZT(0.5、1.0、1.5、2.0mg·L-1);③MS+6-BA(0.5、1.0、1.5、2.0mg·L-1);④MS为对照。观察不同浓度细胞分裂素对紫马铃薯试管苗的影响,30d后,记录苗芽长及芽增殖数等。
1.4.3生长素与细胞分裂素配比
根据单因子激素的试验结果,选择最佳的生长素IBA、NAA的浓度与不同浓度的6-BA配比,试验设计为2种:①MS+IBA(1.0mg·L-1)+6-BA(0、0.2、0.5、1.0、1.5、2.0mg·L-1);②MS+NAA(0.5mg·L-1)+6-BA(0、0.2、0.5、1.0、1.5mg·L-1)。观察不同外源激素配比对紫马铃薯试管苗的影响,35d后测量并记录株高、茎粗、生根数及生根率等。
以上培养基均为固体培养基,含3%蔗糖,0.5%琼脂,pH值6.0。
1.5试管苗生长指标测定
试验用尺子、游标卡尺等工具,测量株高、茎粗、根长、根粗、芽长等;
鲜重、干重:取出材料,用电子天平称鲜重;经105 ℃下杀青 15min后,于80 ℃条件下烘干至衡重, 再称干重;
增殖倍数=(增殖总芽数-接种数)/接种数,试验记录不定芽数;
生根率=生根苗数/接种数×100%。
1.6数据统计
试验数据在MicrosoftExcel及DPS7.5统计软件中处理,各浓度处理间进行多重比较用Duncan法分析。
2结果与分析
2.1生长素对紫马铃薯试管苗的影响
2.1.1IBA对紫马铃薯试管苗生长的影响
从表1中看出,随着IBA浓度的增高,紫马铃薯试管苗的根条数增加、根变短增粗,同时其株高、茎粗也有一定变化。与对照相比,加入IBA0.5mg·L-1的培养基中,紫马铃薯试管苗的根长减少6.67cm、直径增加0.16mm、根条数增加1.33条。IBA0.5~1.0mg·L-1的试管苗根健壮、苗增高、茎稍粗,可提高试管苗的质量,有利于移栽成活。随着IBA浓度的升高,试管苗的鲜重、干重等与对照相比均增加,IBA1.0mg·L-1时影响最大,平均鲜重、干重分别增加0.41g、0.024g。IBA1.0~2.0mg·L-1时试管苗质量表现为处理间无显著差异。同时观察发现,在IBA2.0mg·L-1时试管苗基部膨大,周围有少量愈伤组织产生,呈乳白色,根正常生长。综合考虑,添加一定浓度的IBA,有利于紫马铃薯试管苗根的生长,IBA1.0mg·L-1时处理效果最好,对根部作用效果明显。
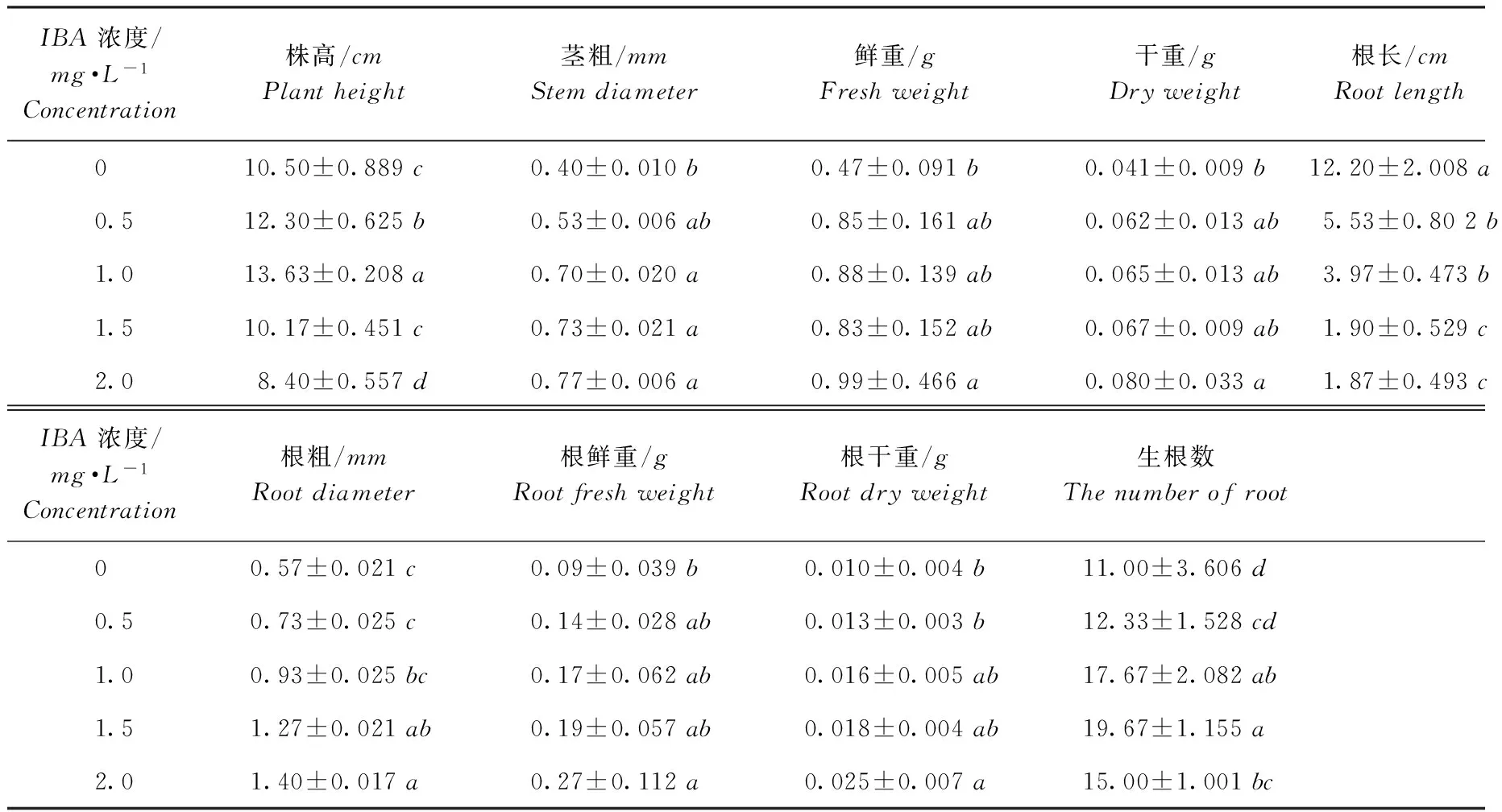
表1 IBA对紫马铃薯试管苗生长的影响
注:数据以“平均数±标准差”的形式表示,同列数字旁不同小写字母表示差异显著(p<0.05)。下同
Note:Thedataisexpressedintheformof“mean+standarddeviation”,andthedifferencebetweenthedifferentsmalllettersinthesamecolumnissignificant(p<0.05).Thesameasfollows
2.1.2NAA对试管苗生长的影响
植物激素NAA对紫马铃薯试管苗的根部作用较大,影响根条数、根长、根粗等,但与IBA不完全相同。由表2可知,随着NAA浓度的增加根条数分别减少0.33、1.34、4.66、5.67条;根分别缩短7.33cm、10.47cm、11.00cm、11.1cm;同时根增粗,直径分别增加0.83mm、1.10mm、1.13mm、1.10mm。NAA浓度在 1.5~2.0mg·L-1时,处理间无显著差异。通过观察发现,NAA0.5mg·L-1时,试管苗基部稍膨大,有少量愈伤存在,根正常生长(图1a);在1.0~2.0mg·L-1,随NAA浓度的升高基部膨大程度增大,周围有明显的愈伤组织,呈乳白色,严重影响根生长,1.5~2.0mg·L-1时长出透明的不正常根(图1b、1c)。结果表明,NAA浓度大于0.5mg·L-1时不利于紫马铃薯试管苗生长,当浓度为1.5~2.0mg·L-1时紫马铃薯苗愈伤化更加严重。
2.1.32,4-D对试管苗的影响
将茎段接种到含2,4-D0.5mg·L-1的培养基中,茎段形态学下端5d左右开始膨大,有根产生,地上部开始生长;20d左右基部愈伤明显呈乳白色、块状、紧致,植株地上部分枝少,根短,有透明的不正常根产生;30d左右,试管苗平均株高12.5cm,根长0.8~1.0cm,基部愈伤乳白(图2a)。当加入2,4-D1.0~2.0mg·L-1时,7d左右茎段形态学下端接触培养基的部位膨大并产生乳白带紫斑点、块状、紧密的愈伤组织;光照20d左右成乳白色,且愈伤组织面积逐渐扩大,同时植株细长;30d左右愈伤组织大小稳定,乳白色、致密,其地上部分生长,茎纤细、无分枝、无根产生,尤其2,4-D浓度增加到 1.5~2.0mg·L-1时非常明显(图2b、2c);之后,愈伤开始褐化;45d左右发现部分愈伤周围有新的淡绿色愈伤产生(图2d、2e)。表明浓度为0.5~2.0mg·L-1的2,4-D使试管苗株高增加,茎部纤细、根系极不发达,基部产生块状愈伤,尤其2,4-D1.5~2.0mg·L-1时表现明显。
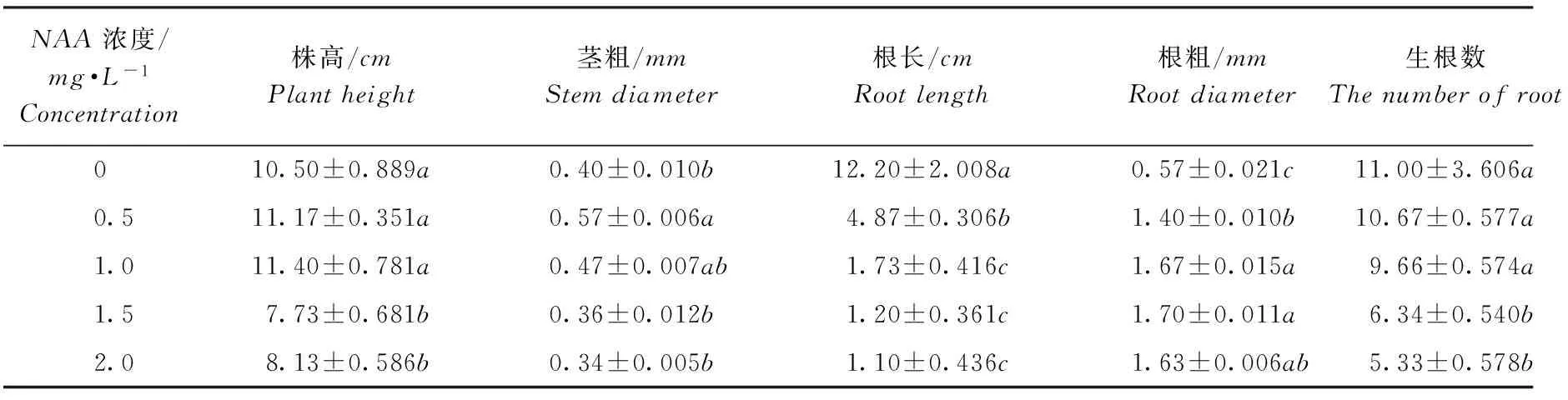
表2 NAA对紫马铃薯试管苗生长的影响

图1 不同浓度的NAA对紫马铃薯试管苗的影响Fig.1 Effects of different concentration of NAA on the test tube seedling of purple potato 注: a. MS+ NAA 0.5 mg·L-1、 b. MS+ NAA 1.5 mg·L-1、 c. MS+NAA 2.0 mg·L-1,培养基中培养30 d 观察Note: Figure 1 of a.b.c are expressed that the plantlets are cultured in MS with NAA 0.5 mg·L-1, 1.5 mg·L-1, 2.0 mg·L-1 and observed after 30 days
2.2细胞分裂素对紫马铃薯试管苗的影响
2.2.1TDZ、ZT对试管苗的影响
从表3中看出,对照培养基无不定芽产生;添加不同浓度的TDZ对试管苗不定芽增殖及芽长影响不同,TDZ1.5mg·L-1的芽长高于其他TDZ浓度处理的,但增殖倍数不高,仅1.04倍,TDZ0.5mg·L-1时处理效果明显,增殖倍数高达7.13倍;不同浓度的ZT间相比,处理间差异显著,0.5mg·L-1时芽长最短,平均2.01cm,但增殖倍数最高达5.63倍,ZT2.0mg·L-1时无不定芽产生。在基本培养基不变时,随着TDZ、ZT浓度的升高,不定芽增殖数逐渐降低、芽长增加,且TDZ优于ZT。通过观察发现,加入TDZ或ZT1.5~2.0mg·L-1时紫马铃薯试管苗与对照相比,叶片数减少、叶片稍大、茎增粗;TDZ0.5~1.0mg·L-1和ZT0.5~1.5mg·L-1的茎段基部(接触培养基部位)均有膨大呈深绿色。结果表明,培养基中添加0.5mg·L-1的TDZ或ZT均有利于芽增殖,促进扩繁,同时高浓度的TDZ或ZT可优化继代培养基配方。
2.2.26-BA对试管苗生长的影响
细胞分裂素6-BA对紫马铃薯试管苗的影响与TDZ、ZT不同,6-BA0.5~2.0mg·L-1无不定芽产生,无芽增殖。随着6-BA浓度的增加,试管苗的叶片展开变大,但植株矮弱、不生根、分枝少。表4中,除对照外,不同浓度的6-BA处理间无显著差异,单独使用6-BA造成试管苗矮弱、不生根,不利于其生长。

图2 不同浓度的2,4-D对紫马铃薯试管苗的影响Fig.2 Effects of different concentration of 2,4-D on the test tube seedling of purple potato 注:试管苗分别在a. MS+2,4-D 0.5 mg·L-1、 b. MS+2,4-D 1.5 mg·L-1、 c. MS+2,4-D 2.0 mg·L-1,培养基中培养30 d 观察; d. MS+2,4-D 1.5 mg·L-1、e. MS+2,4-D 2.0 mg·L-1 培养45 d观察Note: Figure 2. a, b, c are expressed that the plantlets are cultured in MS with 2,4-D 0.5 mg·L-1, 1.5 mg·L-1, 2.0 mg·L-1 and observed after 30 days; Figure 2 of d. e are expressed that the plantlets are cultured in MS with 2,4-D 1.5 mg·L-1, 2.0 mg·L-1 and observed after 45 days
Table3EffectsofTDZandZTontheproliferationandbudlengthofpurplepotato
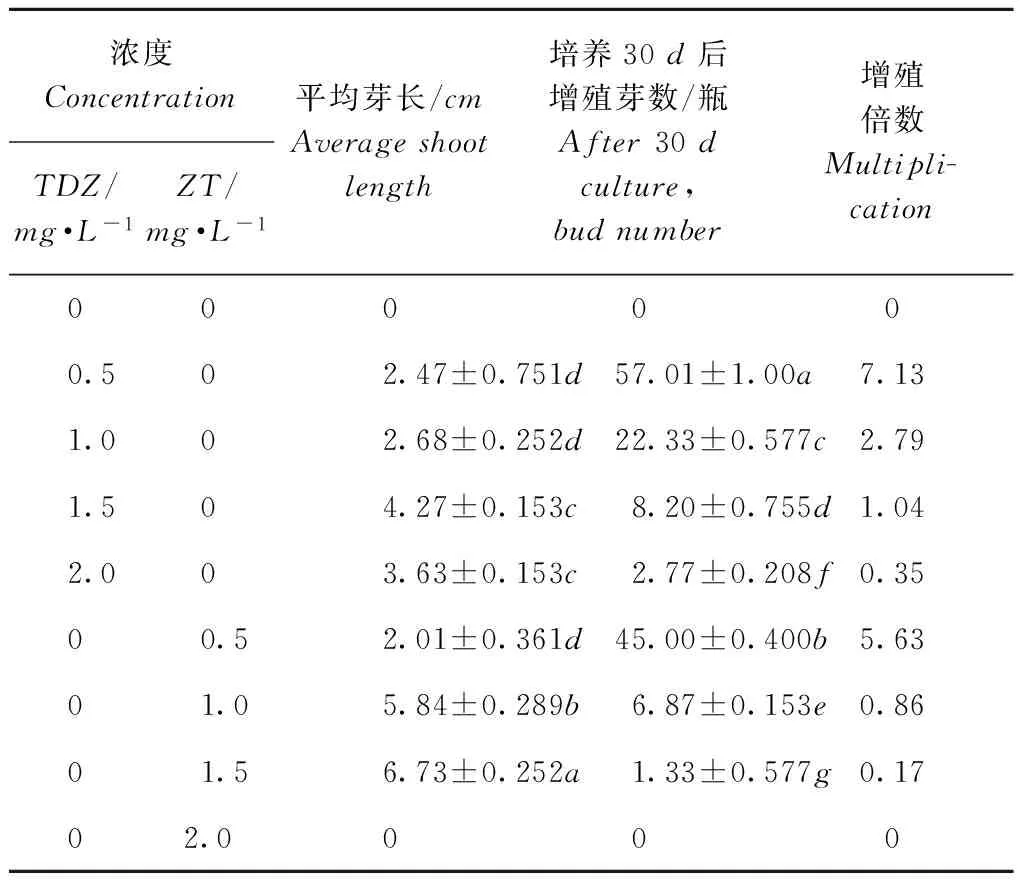
浓度ConcentrationTDZ/mg·L-1ZT/mg·L-1平均芽长/cmAverageshootlength培养30d后增殖芽数/瓶After30dculture,budnumber增殖倍数Multipli-cation000000.502.47±0.751d57.01±1.00a7.131.002.68±0.252d22.33±0.577c2.791.504.27±0.153c8.20±0.755d1.042.003.63±0.153c2.77±0.208f0.3500.52.01±0.361d45.00±0.400b5.6301.05.84±0.289b6.87±0.153e0.8601.56.73±0.252a1.33±0.577g0.1702.0000
注:数据以“平均数±标准差”的形式表示,同列数字旁不同小写字母表示差异显著(p<0.05)。表中为培养30d后平均每瓶增殖芽数。
Note:Thedataisexpressedintheformof“mean+standarddeviation”,andthedifferencebetweenthedifferentsmalllettersinthesamecolumnissignificant(p<0.05),thesamebelow。Thetableforthecultureof30daveragebudnumberperbottle.
2.3不同生长素与6-BA配比对紫马铃薯试管苗的影响
由表5可知,对照MS+IBA1.0mg·L-1时,紫马铃薯试管苗平均根条数17条、生根率100%与表1试验结果基本相符;培养基MS+IBA(1.0mg·L-1)+ 6-BA(0.2~2.0mg·L-1),随6-BA浓度的增加,试管苗的株高、根条数、生根率均降低。其中,添加6-BA2.0mg·L-1效果明显,生根率下降87.50%,单株根条数减少高达16.33条,几乎无根产生。观察发现,MS+IBA(1.0mg·L-1)+6-BA(1.0~2.0mg·L-1)与对照相比,试管苗叶片伸展、叶片多而大,植株稍矮、根粗壮,基部膨大呈深绿色。综合考虑,当MS+IBA(1.0mg·L-1)+6-BA(1.0mg·L-1)时植株长势良好,茎粗、叶片伸展、叶片多而大,为试管苗生长的最适组合。
表6中对照MS+NAA0.5mg·L-1平均株高9.90cm、单株根条数12.33条、生根率100%;与对照相比,MS+NAA(0.5mg·L-1)+6-BA(0.2~1.0mg·L-1)随着6-BA浓度的增加,株高逐渐降低、根条数减少、生根率下降。通过观察发现,加入6-BA0.2~0.5mg·L-1的培养基中紫马铃薯试管苗植株叶片展开、叶片变大,平均株高降低、根条数减少、根粗壮;在6-BA0.2~1.0mg·L-1时试管苗基部膨大明显呈深绿色。表明培养基MS+NAA(0.5mg·L-1)+6-BA(0.2~0.5mg·L-1)有利于紫马铃薯试管苗的生长,比单独添加NAA效果好。
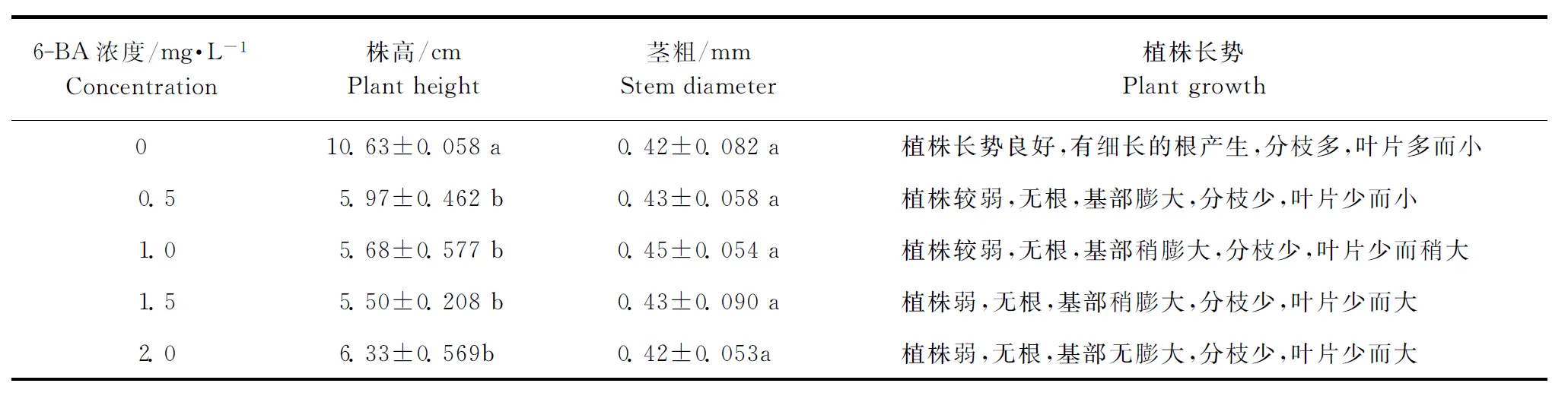
表4 6-BA对紫马铃薯试管苗生长的影响

表5 不同浓度6-BA与IBA配比对紫马铃薯试管苗生长的影响

表6 不同浓度6-BA与NAA配比对紫马铃薯试管苗生长的影响
综上所述,MS+IBA(1.0mg·L-1)+6-BA(1.0mg·L-1)、MS+NAA(0.5mg·L-1)+6-BA(0.2~0.5mg·L-1),降低紫马铃薯试管苗的株高、根条数、生根率,促进叶片展开,使试管苗叶片多而大,有利于其生长。
3讨论与结论
植物激素(内源激素)作为重要的生理活性物质,对于调节植物体各种生长发育过程和环境应答具有十分重要的意义[8]。在植物离体培养过程中起着至关重要的作用,尤其是生长素和细胞分裂素,采用适当激素配比可提高接种外植体快繁系数。不同作物类型、品种、外植体离体培养中对激素组成的要求不同[9~11],本试验利用优质紫马铃薯,研究不同浓度的生长素、细胞分裂素及其配比对新品种马铃薯试管苗生长的影响。
生长素IBA、NAA、2,4-D对紫马铃薯试管苗的作用效果各不相同。周珊等[12]在研究紫心马铃薯品种黑美人的组织培养过程中,发现NAA在0~0.6mg·L-1范围内,较适宜的生根培养基为MS+NAA0.4mg·L-1;金建钧等[13]通过添加单一激素NAA0~0.2mg·L-1培养荷兰薯与川薯3号两个品种,在NAA0.2mg·L-1时根条数量生长速度高达0.75cm·d-1,对根部作用明显;鲍红春等[14]对马铃薯品种陇薯5号进行了茎段的离体再生培养,观察发现诱导试管苗生根的最佳培养基为MS+IBA0.5mg·L-1。本试验结果表明:IBA、NAA均有利于试管苗根的生长,但IBA优于NAA。IBA1.0mg·L-1时效果明显,试管苗株高增加1.33cm、根条数增加6.67条、根粗增加0.36mm,此结论与鲍红春等[14]的试验结果不完全相同,可能由于不同品种间存在差异,对外源激素IBA的敏感度不同;添加NAA的浓度高于0.5mg·L-1时,不利于根的生长,该结果与前人的研究基本相一致。在MS培养基中加入2,4-D试管苗茎纤细、根系极不发达,基部产生愈伤;分别添加2,4-D、NAA1.0~2.0mg·L-1时均有利于产生愈伤组织,2,4-D的作用效果明显,通常将2,4-D、NAA与适量6-BA配比诱导愈伤产生[15~16]。
对于细胞分裂素TDZ、ZT对马铃薯试管苗生长的影响研究比较少,使用ZT通常与NAA、IAA、6-BA等配比[17~18],单一外源激素TDZ、ZT对试管苗的作用很少有报道。蒲秀琴[18]对青海省主栽的青薯2号、青薯9号、费乌瑞它等3个马铃薯品种进行愈伤诱导,结果发现MS+2mg·L-1ZT+1mg·L-1IAA对3个品种的愈伤诱导作用强。杨春[18]以晋薯7号马铃薯为材料,诱导茎尖不定芽分化时MS+6-BA2.0mg·L-1+ZT2.0mg·L-1+NAA0.5mg·L-1+GA35.0mg·L-1的培养基效果明显。本试验表明,单一外源激素TDZ或ZT0.5mg·L-1均有利于紫马铃薯芽增殖,增殖倍数达7.13和5.63倍,同时可促进愈伤形成,利用TDZ或ZT的这种作用可优化其继代增殖培养、愈伤组织诱导的培养基配方。金建钧等[14]的研究中6-BA0~1.5mg·L-1时,随着6-BA浓度增加,根条数与株高呈下降趋势,高浓度的6-BA对试管苗生长有一定的抑制作用,6-BA浓度小于0.1mg·L-1为宜。在本试验中发现单独使用6-BA0.5~2.0mg·L-1并未促进芽增殖,而是使试管苗不生根、分枝少、苗矮弱,此现象与金建钧等[14]试验结论一致。
选择不同生长素IBA、NAA分别与6-BA配比的试验中,随着6-BA浓度的增加,生根率降低,同时,紫马铃薯组培苗的单株根条数也显著减少,与单独使用IBA、NAA相比不利于根的生长;但添加一定浓度的6-BA可促进试管苗叶片展开,叶片增大,有利于试管苗的生长。结果表明当培养基为MS+IBA1.0mg·L-1+6-BA1.0mg·L-1、MS+NAA0.5mg·L-1+6-BA0.2~0.5mg·L-1时有利于紫马铃薯试管苗的生长。
综上,不同浓度的外源激素对紫马铃薯试管苗的作用不同,同一类激素对其作用也不尽相同。因此,研究不同外源激素对紫马铃薯试管苗生长的影响显得尤为重要,这为选择激素的最佳配比条件,进一步优化继代培养基配方,进而提高马铃薯试管苗质量,促进种薯生产提供依据。
参考文献
[1]谢从华.马铃薯产业的现状与发展[J].华中农业大学学报(社会科学版), 2012(1): 1-4.
[2]陈洁, 白林, 吕亚娟,等. 绿色食品添加剂——紫马铃薯花色素提取工艺[J]. 低碳世界, 2014(9):187-188.
[3]周芳芳. 紫色马铃薯“紫云1号”离体培养及试管薯诱导的研究[D]. 南宁:广西大学, 2014.
[4]中国作物学会马铃薯专业委员会. 马铃薯产业与现代可持续农业[EB/OL]. 2015-08-03[2016-01-20].www.chinapotato.org.
[5]李灿辉,杨文洪.马铃薯无病毒种薯生产体系[J]. 云南农业科技,2000(3):38-42.
[6]王拴福. 山西马铃薯脱毒种薯生产应用现状与推广[J]. 中国种业, 2014(4):72-73.
[7]张新永, 白磊, 郭华春. 植物生长调节剂对马铃薯组培苗的影响[J]. 云南农业科技, 2013(2):8-10.
[8]许智宏, 李家洋. 中国植物激素研究:过去、现在和未来[J]. 植物学通报, 2006, 23(5):433-442.
[9]黄科, 唐婧, 刘自震,等. 生长素和细胞分裂素对桑树离体繁育的影响[J]. 西南大学学报(自然科学版), 2015(3):28-34.
[10]叶晓青, 佘建明, 邓衍明,等. 不同类型细胞分裂素对扇蕨不定芽诱导和植株再生的影响[J]. 江苏农业学报, 2012, 28(1):172-175.
[11]韦如萍, 胡德活, 郑会全,等. 植物激素对杉木组培苗增殖和生根的影响[J]. 广东林业科技, 2013, 29(4):11-17.
[12]周珊, 农艳丰, 段维兴,等. 紫心马铃薯品种黑美人组织培养技术(英文)[J]. 南方农业学报, 2014, 45(4):527-531.
[13]金建钧, 刘志文. 植物激素对马铃薯试管苗的影响及微型薯高效形成条件分析[J]. 作物杂志, 2011(2):20-24.
[14]鲍红春, 李小雷, 王建平,等. 马铃薯品种陇薯5号茎段再生体系的建立[J]. 内蒙古农业科技, 2014(2):31-32.
[15]李云, 卢其能, 赵昶灵. 影响马铃薯再生体系建立的主要因素[J]. 安徽农业科学, 2010, 38(28):15487-15489.
[16]李娟, 程智慧, 张国裕. 四个马铃薯品种幼茎段再生技术的研究[J]. 西北农林科技大学学报(自然科学版), 2006, 34(3):122-126.
[17]蒲秀琴. 3种青海省主栽马铃薯外植体的组织培养和植株再生[J]. 江苏农业科学, 2014(4):52-54.
[18]杨春. 生长素和细胞分裂素在马铃薯愈伤组织分化中的作用[J]. 山西农业科学, 2008, 36(7):40-42.
(编辑:邢国芳)
收稿日期:2016-04-08 修回日期:2016-05-11
作者简介:冯璐(1993-),女(汉),山西运城人,硕士研究生,研究方向:植物生理与分子生物学 *通讯作者:王玉国,教授,博士生导师。Tel:13835462639;E-mail: tgwygn@126.com
基金项目:山西省农业技术推广示范项目(SNJTGSFXD201301)
中图分类号:S532
文献标识码:A
文章编号:1671-8151(2016)08-0544-07
Effectsofexogenoushormonesonrapidpropagationofpurplepotatoplantletsin vitro
FengLu,WangYuguo*,WenYinyuan,GaoJiajia,LiuYuan,HeMeilin
(College of Agriculture, Shanxi Agricultural University, Taigu 030801, China)
Abstract:[Objective]In order to research the effects of different exogenous hormones and their ratio on the growth of purple potato test tube seedling. [Methods]The new varieties purple potato of sterile test tube seedling was cultured on MS medium with different concentrations of auxins (IBA, NAA, 2,4-D) , cytokines (TDZ, 6-BA, ZT) . [Results] The two kinds of auxin IBA and NAA had effects on the root growth. When the concentration of IBA was 1.0 mg·mL-1, the growth of purple potato root in vitro was significantly better than the other treatments. It was not beneficial to the root growth when the concentration of NAA was more than 0.5 mg·mL-1. Adding 2,4-D 0.5 to 2.0mg·mL-1to MS medium made the height of the plant increased, stem became slender, root became extremely developed, and produced milk white, massive callus. 0.5 mg·mL-1TDZ or ZT could promote adventitious bud formation and was beneficial to bud proliferation. When 6-BA was used exclusively, there was no adventitious bud and it's also unfavorable for the growth of test tube seedlings. [Conclusion]In conclusion,the best optimal medium for growth was MS+IBA 1.0 mg·L-1+6-BA 1.0 mg·L-1and MS+NAA 0.5 mg·L-1+6-BA 0.2 to 0.5 mg·L-1.
Key words:Purple potato; Test tube seedling; Plant hormone; Rapid propagation
