SSR结合SRAP标记分析油菜菌核病抗性资源遗传多样性
2016-07-28张晓娟
张晓娟,张 羽,赵 辉
(1.陕西理工学院生物科学与工程学院,陕西汉中 723000;2.陕西理工学院体育学院,陕西汉中 723001)
SSR结合SRAP标记分析油菜菌核病抗性资源遗传多样性
张晓娟1,张 羽1,赵 辉2
(1.陕西理工学院生物科学与工程学院,陕西汉中 723000;2.陕西理工学院体育学院,陕西汉中 723001)
为了更准确、有效地揭示油菜资源遗传多样性,探索SSR和SRAP 2种分子标记在油菜菌核病抗性资源遗传多样性分析中的应用,采用40对SSR核心引物及陕西理工学院生物学院分子与遗传实验室筛选出的40对多态性高、条带清晰的SRAP引物,对陕西省汉中市农科所经过连续3年牙签茎秆接种试验结合多年的田间抗性表现筛选出的43份菌核病抗性较好的油菜材料进行遗传多样性分析,并对2种分子标记揭示的多态性条带数、多态性信息含量(PIC)进行比较。结果表明:2种标记共检测出634个条带,SRAP标记检测的多态性条带数(335)较SSR(287)高,而SSR引物的平均多态性信息含量(PIC)值较SRAP引物高,分别是0.76和0.69。在遗传相似系数0.67处,43份油菜材料被分为Ⅲ类,白菜型油菜(丰油10号白菜型选系)可较好地与甘蓝型油菜区分。主成分分析(Principal component analysis,PCA)、群体结构分析与聚类分析结果相似,说明SSR与SRAP标记结合能准确有效的反映油菜材料的亲缘关系。供试43份油菜材料遗传相似系数分布在0.65~0.81,表明遗传相似性较高,亲缘关系较近。因此,应进一步加强抗源筛选及引进,对现有材料进行遗传改良,拓宽其遗传背景,从而为抗菌核病油菜品种选育奠定基础。
SSR;SRAP;油菜;菌核病;遗传多样性
油菜是我国及世界重要的油料作物之一。油菜菌核病是由真菌核盘菌(Sclerotinia sclerotiorum(Lib.)de Bary)侵染引起的一种严重危害油菜产量和品质的广谱性病害[1]。抗菌核病油菜育种是油菜育种的重要目标。抗源筛选对抗病育种非常重要,为油菜抗菌核病杂交育种提供优异的亲本资源[2]。研究表明,甘蓝型油菜菌核病抗性较白菜型油菜好[3]。因此,从甘蓝型油菜中筛选菌核病抗性资源,分析其遗传多样性,明确材料间的亲缘关系,掌握材料的遗传背景,对油菜抗病遗传育种具有重要意义。
分子标记是根据DNA分子多态性开发的遗传标记,能真实反映不同个体的遗传差异,是进行遗传多样性分析、基因定位与克隆、遗传进化、指纹图谱构建、遗传育种等研究的有力工具[4]。SSR(Simp le sequence repeat),也称微卫星DNA,是分布于真核生物基因组中的简单重复序列,通常以2~6个碱基形成的核心序列为单位多次串联重复,由于重复次数不同导致不同个体的多态性[5]。SSR标记为共显性标记,特异性及重复性好,是较理想的分子标记。SRAP(Sequence-related amplified polymorphism)即相关序列扩增多态性标记,是针对不同个体启动子、内含子及间隔区的长度多态性开发设计的分子标记,对基因的开放阅读框(ORF)进行扩增[6]。SRAP标记属半随机标记,其特点是多态性高,重复性好[7],适合于植物的形态差异及起源进化分析。目前,SSR、SRAP标记均已广泛应用于油菜研究中[8-9]。Annisa等[10]通过SSR标记结合细胞学及形态学研究将164份来自不同国家(地区)的白菜型油菜材料分为三大类。Sun等[11]利用634对SRAP引物构建了甘蓝型油菜高密度遗传图谱,大小为1 604.8 cM,包括19个连锁群。文雁成等[12]利用SRAP标记分析了我国不同选育时期的130份甘蓝型油菜材料的遗传多样性及遗传基础。陈伦林等[13]利用SSR和SRAP分子标记研究了国内外19份甘蓝型油菜遗传多样性的差异,分析了不同品种遗传距离及其与选育年代的关系。
目前,尚未见SSR与SRAP标记结合研究油菜菌核病抗性资源遗传多样性的报道。本研究将这2种分子标记结合,对汉中市农科所经过持续3年牙签茎秆接种试验及材料田间抗性监测筛选出的43份菌核病抗性较好的油菜材料进行遗传多样性分析,旨在明确抗菌核病油菜育种亲本材料间的亲缘关系,为抗菌核病油菜杂交育种提供较为合理的亲本选配,为改良现有油菜,丰富材料遗传背景提供依据,同时,为分子标记辅助抗菌核病油菜育种奠定了基础。
1 材料和方法
1.1 试验材料
43份油菜菌核病抗性材料由汉中市农业科学研究所提供,材料种植于农科所试验田。供试材料基本信息见表1。

表1 供试油菜材料编号及材料名称Tab.1 M aterial num ber and nam e
1.2 试验方法
1.2.1 CTAB法提取油菜基因组DNA 取供试油菜材料幼叶,液氮研磨至粉末状,采用CTAB法提取基因组DNA[14],0.8%的琼脂糖凝胶检测。
1.2.2 引物筛选、PCR扩增 利用8份系谱清楚具代表性的油菜材料筛选多态性好、条带清晰的SRAP引物。40对核心SSR引物参考文献[15]。SSR引物序列来自网址http://brassica.bbsrc.ac. uk/。PCR反应总体系15μL。2×Taq Master Mix 7.5μL,10μmol/L的正反引物各1μL,DNA模板1μL,ddH2O补足体系,PCR扩增采用复性变温法,扩增程序:94.0℃预变性5 m in;94.0℃变性1 min,35.0℃退火1 m in,72.0℃延伸1 m in,10个循环;94.0℃变性30 s,50.0℃退火30 s,72.0℃延伸1 m in,35个循环;72.0℃延伸10 m in,4.0℃保存。
1.2.3 聚丙烯酰胺凝胶电泳及染色 采用8%的非变性聚丙烯酰胺凝胶电泳分离扩增产物。电泳结束后将凝胶剥下,将一角切去少许以标记方向,置于摇床上染色约8 min,回收染色液,蒸馏水漂洗10 s,加入显色液,摇床上显色至有清晰条带,照相。
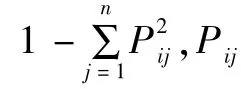
2 结果与分析
2.1 SSR和SRAP引物的扩增条带数及多态性信息含量(PIC)
利用40对SSR核心引物及筛选出的40对多态性好的SRAP引物(SRAP组合及序列见表2)在43份供试油菜材料中共检测出634个条带,其中多态性条带622个,多态性条带比率98.11%。SRAP引物检测的条带数(343)及多态性条带数(335)较SSR引物高(分别是291和287)。
SSR引物的PIC值平均为0.76,较SRAP(0.69)高。每个SSR位点的PIC值为0.53~0.98,每个SRAP位点的PIC值为0.31~0.99。根据Botstein等[17]提出的当PIC>0.5时,该基因座为高度多态基因座,0.25<PIC<0.5时为中度多态基因座,PIC<0.25时为低度多态基因座。表明本试验的SSR及SRAP引物多态性丰富。

表2 SRAP引物组合及序列Tab.2 SRAP prim er pairs and sequence
2.2 材料间遗传相似系数分析
SSR标记结合SRAP标记分析的供试43份油菜材料间遗传相似系数为0.65~0.81,平均值为0.70。材料丰油10号白菜型选系与HL1203选系遗传相似系数最小(0.65),材料杂0982选系与秦优198选系遗传相似系数最大(0.81)。
2.3 SSR和SRAP标记的聚类分析
SSR和SRAP标记构建的遗传相似系数和聚类图如图1所示,在相似系数0.67处分为三类。第Ⅰ类包括SY13AB和中双11/荣油801 2个材料。第Ⅱ类包括中双10号选系、中双11号选系-1、秦优168选系、秦优2177选系、驰杂油1号选系等39个材料。第Ⅲ类有2个选系材料:杂26选系和丰油10号白菜型选系。在该聚类图中,来源于同一材料扬油6号的编号为3、4的材料聚在一起;亲缘关系较近的材料如秦优7号/1135-4与陕油8号/秦优7号,中双11号选系-1与汉3B,中油杂2号与希望98,秦优7号/恢702、秦优7号/1135-4、陕油8号/秦优7号及701//秦优7号/1009-1聚在一起。此外,供试材料中唯一的白菜型油菜(丰油10号白菜型选系)可与其他材料(甘蓝型油菜)区分开。说明SSR结合SRAP标记能准确反映油菜材料亲缘关系及类型。
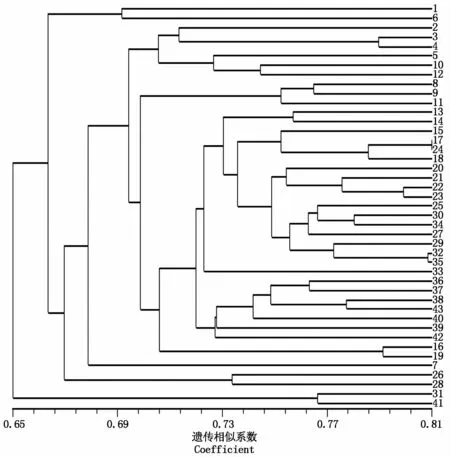
图1 SSR结合SRAP分子标记构建的43份油菜材料的聚类图Fig.1 Cluster dendrogram of 43 rapeseed m aterials constructed by SSR and SRAP m olecular m arker
2.4 SRAP和SSR标记的主成分分析

图2 SSR结合SRAP标记构建的前2个主要主成分坐标图Fig.2 Bip lot of the first two m ajor p rincipal com ponents extracted from SSR and SRAP data
主成分分析(PCA)结果与聚类分析结果相似。中双11/荣油801在聚类分析中归为第Ⅰ类,在PCA图中也与其他材料区分开。聚类中在第Ⅱ类且距离较近的材料陕油8号/秦优7号选系与701//秦优7号/1009-1、中双11号选系-2与天禾油1201选系、SWU10V01选系与H29J24选系在PCA图中也归在一起。材料杂26选系与丰油10号白菜型选系均在聚类分析的第Ⅲ类,在PCA图中也划在一起。同一材料扬油6号选系-1不同编号的3号和4号样品在PCA图中聚在一起。第一主成分和第二主成分分别占总变异的6.44%和6.11%(图2)。
2.5 SSR和SRAP标记的群体结构分析
当K=3时,Ln P(D)值最大。43份油菜材料被分为3组(图3),第Ⅰ组包括聚类分析中第Ⅰ类的SY13AB、中双11/荣油801及聚类中与第Ⅰ类相距较近的宁油16号选系、编号3、4的扬油6号选系-1等10个材料。第Ⅱ组29个材料在聚类图中也归为第Ⅱ类。第Ⅲ组包括聚类中第Ⅲ类的杂26选系、丰油10号白菜型选系及与第Ⅲ类相距较近的驰杂油1号选系、312A/HSTC//SZ 4个材料。综上所述,Structure分析结果同样与聚类分析结果具有较好的一致性。
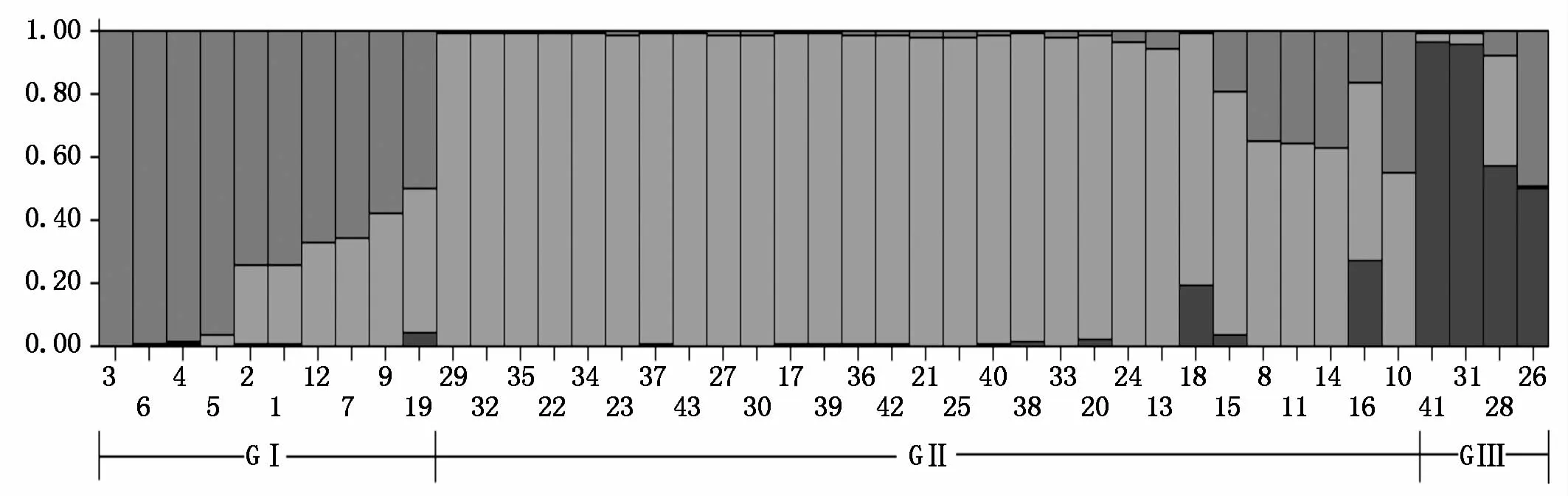
图3 SSR结合SRAP标记构建的43份油菜材料的群体结构分析图(K=3)Fig.3 Popu lation structure of the 43 accessions by SSR and SRAP m olecu lar m arker(K=3)
3 讨论与结论
抗菌核病育种被认为是防治油菜菌核病既经济、有效又环保的措施。万华方等[18]以菌核病抗性突出的野生型甘蓝C01材料为亲本,通过人工合成甘蓝型油菜途径,合成了抗性高于中双9号的甘蓝型油菜。筛选高抗品种作为杂交亲本是提高油菜菌核病抗性的有效手段。目前,已筛选到一些抗(耐)病性较好的甘蓝型油菜材料[19]。分析抗性资源的遗传多样性对抗病遗传育种中的杂交亲本选配具有较好的理论参考价值。
不同分子标记反映的是DNA不同区域的多态性,检测范围不同。SSR标记检测的是均匀分布在基因组的简单重复序列的多态性,SRAP标记针对的是开放阅读框(ORF)。本研究将这2种标记结合能更全面的检测不同个体基因组的多态性,充分反映材料间的遗传差异,从而较为准确地揭示研究材料间的亲缘关系。为了更快速有效地反映材料的遗传多态性,研究利用40对SSR核心引物及从120对引物组合中筛选出的40对SRAP引物进行扩增。同时,本研究综合运用了聚类分析、主成分分析及群体结构分析法研究供试油菜材料遗传多样性。分析结果表明,PCA与群体结构分析结果同聚类分析结果具有较好的一致性,都是亲缘关系较近的材料聚在一起,进一步验证了聚类分析的准确性,反映了SSR结合SRAP标记能真实客观的反映材料遗传背景。
此外,通过对比2种标记构建的聚类图及SSR与SRAP单独构建的聚类图得出,SRAP标记更接近于2种标记共同分析的聚类结果。同时,SRAP标记能较好地将白菜型油菜与甘蓝型油菜区分,而SSR标记则不能,反映SRAP标记较SSR标记更适合于区分不同类型的油菜材料,这可能与SRAP标记多态性高有关,研究与谭祖猛等[20]研究结果一致。本研究中SRAP引物的PIC值较SSR低,这是由于SRAP引物只是从120对引物中筛选而得,而SSR引物为核心引物,核心引物较一般引物具有更丰富的多态性,因此,应进一步筛选SRAP引物,建立一套油菜中的SRAP核心引物,应用于油菜种质资源遗传多样性分析效果将更好。
2种分子标记分析结果显示,供试43份油菜材料遗传相似系数分布在0.65~0.81,说明供试材料的亲缘关系较近,遗传背景较为狭窄,需加强油菜菌核病抗性资源筛选,丰富抗菌核病油菜育种中的亲本资源;不断引入优良的种质资源,拓宽现有油菜遗传背景。根据本研究聚类分析结果,在进行抗菌核病油菜材料改良中,建议选择遗传相似系数较远的材料如杂双6号选系、丰油10号白菜型选系与中双11/荣油801、HL1203选系、沪油16号选系、中双11号选系-1等材料进行遗传改良。
致谢:感谢陕西省教育厅项目(14JK1152)资助,感谢汉中市农科所提供试验材料,感谢西北农林科技大学胡胜武教授对本文提出宝贵修改意见。
[1] 李 慧,文 李,刘 凯,等.油菜抗菌核病机制研究进展[J].作物研究,2015,29(1):84-90.
[2] 刘正立,刘春林.甘蓝型油菜抗菌核病研究进展[J].中国农学通报,2015,31(15):114-123.
[3] 梅家琴.甘蓝与甘蓝型油菜C亚基因组遗传关系调查及甘蓝抗菌核病QTL定位[D].重庆:西南大学,2011:110-124.
[4] 黄龙花,吴清平,杨小兵.基于特定引物PCR的DNA分子标记技术研究进展[J].生物技术通报,2011,26(2):61.
[5] 张征锋,肖本泽.基于生物信息学与生物技术开发植物分子标记的研究进展[J].分子植物育种,2009,7(1):130-136.
[6] Li G,Quiros C F.Sequence-related amplified polymorphism(SRAP),a new marker system based on a simp le PCR reaction:its application tomapping and gene tagging in Brassica[J].Theoretical and Applied Genetics,2001,103(2/3):455-461.
[7] Ferriol M,Pic B,Nuez F.Genetic diversity of a germplasm collection of Cucurbita pepo using SRAP and AFLPmarkers[J].Theoretical and Applied Genetics,2003,107(2):271-282.
[8] LiWei,Jiang Wei,Zhao Huixian,et al.Genetic diversity of rapeseed accessions from different geographic locations revealed by expressed sequence Tag-Simple sequence repeat and random amplified polymorphic DNA markers[J].Crop Science,2012,52(1):201-210.
[9] 李小白,张明龙,崔海瑞.油菜EST-SSR标记的建立[J].分子细胞生物学报,2007,40(2):137-144.
[10] Annisa,Chen S,Cowling W A.Global genetic diversity in oilseed Brassica rapa[J].Crop&Pasture Science,2013,64:993-1007.
[11] Sun Zudong,Wang Z,Tu Jinxing,et al.An ultradense genetic recombination map for Brassica napus,consisting of 13551 SRAP markers[J].Theoretical and Applied Genetics,2007,114(8):1305-1317.
[12] 文雁成,王汉中,沈金雄,等.用SRAP标记分析中国甘蓝型油菜品种的遗传多样性和遗传基础[J].中国农业科学,2006,39(2):246-256.
[13] 陈伦林,邹小云,李书宇,等.SSR和SRAP标记揭示甘蓝型油菜遗传多样性的差异分析[J].分子植物育种,2008,6(3):511-516.
[14] Doyle J J,Doyle J L.Isolation of plant DNA from fresh tissue[J].Focus,1990,12:13-15.
[15] 李海渤,杨 军,吕泽文,等.甘蓝型油菜SSR核心引物研究[J].中国油料作物学报,2010,32(3):329-336.
[16] Pritchard JK,Stephens M,Donnelly P.Inference of population structure using multilocus genotype data[J].Genetics,2000,155:945-959.
[17] Botstein D,White R L,Skolnick M,et al,Construction of a genetic linkage map in man using re striction fragment length polymorphisms[J].Am J Hum Genet,1980,32:314-331.
[18] 万华方.高抗菌核病野生甘蓝C01抗性机理及其应用[D].重庆:西南大学,2013:19-24.
[19] 姜伟丽.油菜抗菌核病品种的筛选和抗性机理分析[D].南京:南京农业大学,2008:10-14.
[20] 谭祖猛,李云昌,胡 琼,等.SSR和SRAP标记研究油菜杂交种骨干亲本的遗传多样性[J].农业生物技术学报,2009,17(5):882-890.
Genetic Diversity of Sclerotinia sclerotiorum Resistant Brassica napus Based on SSR and SRAP
ZHANG Xiaojuan1,ZHANG Yu1,ZHAO Hui2
(1.School of Biological Science and Engineering,Shaanxi University of Technology,Hanzhong 723000,China;2.Department of Physical Education,Shaanxi University of Technology,Hanzhong 723001,China)
In order to disclose the genetic diversity of Brassica napus accurately,exp lore the application of two molecular markers(SSR and SRAP)in genetic diversity analysis in Sclerotinia sclerotiorum resistant Brassica napus,forty core SSR primers and forty selected SRAP primers with high polymorphism and clear bands from molecular and genetic laboratory in department of Biological of Shaanxi University of Technology were used to analyze 43 Sclerotinia sclerotiorum resistant rapeseed materials identified with stem inoculation method by Hanzhong Institute of Agricultural Sciences.The polymorphism bands and PIC value revealed by the two markers were analyzed.The results showed that,634 polymorphism bands were detected by two markers,the polymorphism bands detected by SRAP(335)was higher than SSR(287),but the average PIC value of SSR primer was higher than SRAP primer,thatwas 0.76 and 0.69 respectively.The 43 rapeseed accessions were divided into three clusters at the coefficient cut off value 0.67.The principal component analysis(PCA)and the population structure analysis resultswere similar to the result of cluster analysis,showed that combination of SSR and SRAP marker could reflect the relationship of rapeseed accurately.Genetic similarity coefficient of the 43 rapeseed samples distributed mainly between 0.65 and 0.81,disp layed that the tested rapeseed materials had a near relationship and a relatively high genetic sim ilarity. Thus,it′s of great importance to introduce and enhance the selection of Sclerotinia sclerotiorum resistant lines to broaden the genetic background of current ones for further Sclerotinia sclerotiorum resistance breeding.
SSR;SRAP;Brassica napus;Sclerotinia sclerotiorum;Genetic diversity
S565.03 文献标识码:A 文章编号:1000-7091(2016)03-0169-06
10.7668/hbnxb.2016.03.025
2016-03-20
陕西省教育厅项目(14JK1152)
张晓娟(1980-),女,陕西咸阳人,讲师,在读博士,主要从事油菜分子遗传学研究。
