EMS诱变亚麻荠获得2S贮藏蛋白缺失突变体
2016-07-28苑丽霞郝敬云薛金爱李润植
苑丽霞,郝敬云,赵 奎,薛金爱,李润植
(1.晋中学院生物科学与技术学院,山西晋中 030600;2.山西农业大学分子农业与生物能源研究所,山西太谷 030801)
EMS诱变亚麻荠获得2S贮藏蛋白缺失突变体
苑丽霞1,2,郝敬云2,赵 奎2,薛金爱2,李润植2
(1.晋中学院生物科学与技术学院,山西晋中 030600;2.山西农业大学分子农业与生物能源研究所,山西太谷 030801)
亚麻荠种子富含大量不饱和脂肪酸和贮藏蛋白。为了获得广泛的育种材料,创建优异的新种质,采用EMS(甲基磺酸乙酯)对亚麻荠种子进行诱变处理。通过EMS不同处理时间(0,8,12,16 h)和不同处理浓度(0,0.2%,0.4%,0.6%,0.8%,1.0%,1.2%)条件下诱变亚麻荠种子,建立了EMS诱变亚麻荠种子的优化体系,以0.8%(V/V)EMS处理成熟种子12 h效果最佳,筛选获得一个亚麻荠2SP1突变体。与野生型相比,该突变体种子贮藏蛋白成分中缺失了2S清蛋白,但是亚麻荠种子含油量和蛋白含量、株型和种子萌发等农艺性状未发生显著变化。这种特殊的亚麻荠2SP1突变体可作为研究种子贮藏蛋白合成机理及培育高营养品质亚麻荠新品种的优异种质资源,也可用于进行相关功能基因组学等的研究。
亚麻荠;2S清蛋白;EMS;突变体(2SP1)
亚麻荠(Camelina sativa L.Crantz)是一种在北美及欧洲地区广泛种植的十字花科油料作物,因其具有“低耗、高抗和环保”等优良的生物学特性和农艺性状[1-2],种植区域日益扩大。亚麻荠生育期短(80~100 d),株高平均92.4 cm,千粒质量平均1.25 g,种子含油量高(34%~45%),我国近年来也开展了亚麻荠的引种、育种及推广种植。亚麻荠种子独特的不饱和脂肪酸组成,以及高水平的ω-3脂肪酸和低含量的芥子油苷,赋予亚麻荠油重要的食品营养价值和工业利用价值[3-5]。此外,亚麻荠种子也含有占种子干质量约30%的贮藏蛋白质[6],其是人类食品及动物饲料蛋白质的重要来源。
植物种子在发育成熟过程中会合成积累大量贮藏蛋白,并以蛋白体的形式存在,为种子萌发提供重要的营养物质,其也是人类植物蛋白的重要来源[7-8]。Osborne根据溶解度不同将种子贮藏蛋白分为4类:溶于水或稀盐缓冲液的清蛋白(Album in),溶于稀盐溶液的球蛋白(Globulin),常溶于70%~80%乙醇的醇溶蛋白(Prolamin)和溶于稀酸、稀碱溶液的谷蛋白(Glutelin)[9]。其中,沉降系数是2S的清蛋白(2S album in/napin)含有动物胰蛋白酶抑制剂、α-淀粉酶抑制剂及过敏原等多种具有生理活性的多肽,这类蛋白能降低人体胃肠道对植物蛋白的吸收利用,影响食用植物蛋白的营养价值,并可引起特殊人群尤其是儿童的过敏反应;而且,在工艺上这类蛋白也会影响植物蛋白的乳化与凝胶性能[10]。2S清蛋白并不是均一组分,而是由一些在分子量、电荷性质、氨基酸组成及沉降行为等方面比较接近的2个亚基(L亚基和S亚基)所组成。亚麻荠种子贮藏蛋白主要为清蛋白和球蛋白[11]。其中,2S清蛋白的存在影响了亚麻荠种子贮藏蛋白的食品营养价值。
在创育作物种质资源的诸多技术中,EMS(甲基磺酸乙酯)诱变是一种简便有效的方法[12],EMS作用往往是诱发点突变,不易对染色体造成畸变,稳定性好;产生的突变体丰富多样,而且显性突变体比例高;无需遗传转化,即可快速获得一些具有优良性状的突变体。EMS诱变已被广泛应用于大豆、油菜等油料作物品质育种[13-15]。有关亚麻荠种子品质改良的EMS诱变鲜见报道。
笔者在优化亚麻荠EMS诱变技术基础上,采用EMS溶液诱变处理亚麻荠种子,创建亚麻荠突变体,通过筛选鉴定获得亚麻荠种子2S贮藏蛋白缺失突变体2SP1。该突变体种子油脂和蛋白含量及其他重要农艺性状均较优良,可作为优异种质材料应用于亚麻荠高附加值品质育种和相关功能基因组学等研究。
1 材料和方法
1.1 试验材料
选用亚麻荠种质材料SC-N16品种为EMS诱变起始材料,由山西农业大学作物遗传育种重点实验室系统选育。
1.2 EM S诱变亚麻荠体系的优化
EMS诱变流程:选取饱满无破损的亚麻荠种子,经蒸馏水预浸8 h(20℃左右)后,用吸水纸吸去表面水分。再将种子样品分别浸入用0.1 mmol/L磷酸缓冲液(pH值7.0)稀释的不同浓度EMS诱变液中(0.2%,0.4%,0.6%,0.8%,1.0%,1.2%),在各种EMS诱变液中浸泡时间分别是8,12,16 h,对照种子样品用清水浸泡。EMS处理后加入一定量的2%NaS2O3溶液以终止反应,在整个诱变过程中所有接触过EMS的器皿用10%NaS2O3溶液浸泡过夜,再用清水冲洗干净。将处理好的种子置于培养皿中观察统计发芽率。萌发7 d后移栽于装有湿润营养土的育苗盘中,放于温室进行培养,调查统计成苗率。成苗后再移栽于田间,按常规方法管理[16],定时浇水并记录幼苗成长情况。
通过EMS试验剂量以及处理时间等参数统计分析结果,确定亚麻荠EMS半致死浓度(LC50)和优化的亚麻荠EMS诱变方法。
1.3 EM S诱变亚麻荠种子萌发性状的测试和诱变材料的种植
本试验用优化的EMS诱变体系共处理5 000余粒亚麻荠种子,将EMS诱变的亚麻荠种子以及未诱变处理的亚麻荠种子,用0.1%的KMnO4消毒15 min,再用蒸馏水洗干净,晾干后摆放到平铺有3层滤纸的培养皿中(所用培养皿及滤纸要提前高压蒸气灭菌)。每皿50粒,加灭菌蒸馏水至种子湿润为宜。设6次重复,在(25±1)℃和自然光照条件下培养。每天定时观察,种子的胚芽出现则认为萌发,种子萌发的第3天测其发芽势,第7天测其发芽率。连续7 d观察并记录其发芽情况,直至蒸馏水处理的对照种子发芽率不再变化为止。

当代诱变材料(M1)成苗后移栽于田间,成熟后分单株收获。二代材料(M2)按M1单株播种穗行,按株系收获突变体,三代材料(M3)按M2突变株系种植,在田间生长期间对突变性状的稳定性、分离状况等进行观察。
1.4 蛋白质样品的制备
取EMS诱变株收获的成熟种子样品100 mg,放入1.5 m L的离心管中。用研棒研碎后,加入200 μL蛋白提取缓冲液(100 mmol/L Tris-HCl,0.5%(m/V)SDS,2%(V/V)β-巯基乙醇,5 mmol/L ED-TA,pH值8.0),充分振荡混匀样品和提取液[17]。将离心管放入90℃的热水浴中浸提3 m in后,在转速为5 000 r/min的离心机上离心5 min,吸取上清液待用或-20℃保存。以未进行EMS处理的野生型种子样品作为对照。
1.5 SDS-PAGE电泳分离
采用不连续分离缓冲系统进行分析,Acr在分离胶中的浓度为8.47%(m/V),在浓缩胶中为3.80%(m/V)。将配置好的凝胶置于电泳槽中,加入电泳缓冲液(0.025 mol/L Tris-HCl,0.192 mol/L甘氨酸,0.5%(m/V)SDS,pH值8.3),蛋白样品20μL与上样缓冲液混匀后,加入到凹形点样孔底部,电泳(20~30 mA)10~15 h。电泳完毕后,将凝胶在染色液(40%(V/V)甲醇,10%(V/V)冰醋酸,0.1%考马斯亮蓝R250)内染色过夜,然后再将凝胶在脱色液(40%(V/V)甲醇,10%(V/V)冰醋酸)内脱色2~3 h至背景清晰[18-19]。背景脱色后的凝胶用凝胶成像系统观察和照相,用相应软件(BandScan V6.0)分析染色凝胶中种子蛋白主要组分的相对含量。
1.6 种子总油脂和蛋白质含量的测定
亚麻荠种子含油量(%,干质量)用近红外反射光谱种子成分分析仪(Perten DA7200 NIR seed analyzer)测定。大量样品测定前,系统标准曲线用一组已知含油量亚麻荠品种标样(经多种化学分析方法验证)进行校正。
总蛋白质含量测定是利用LECO CHNS-932分析仪,取100粒干燥的亚麻荠种子,通过N元素分析检测蛋白质含量,以N含量乘以6.25得到总蛋白质含量。
1.7 数据分析
各样品生物学重复6次,每个样品测试3次,计算平均值±标准误。所有数据均采用SAS软件进行统计分析,差异显著性用t检验。
2 结果与分析
2.1 亚麻荠EM S诱变体系的优化
观察分析EMS处理材料的种子萌发性状变化是评估EMS诱变效果及确定EMS处理相应参数的重要依据。将不同浓度EMS及其不同处理时间的亚麻荠材料种子种植于大田,观察记载和统计各EMS处理材料的种子发芽率和成苗率,其结果如图1所示。由图1可知,与未处理的对照材料(CK)相比,EMS处理对亚麻荠种子萌发性状有较大影响,总的趋势表现为随着EMS浓度升高和处理时间增加,种子发芽率和成苗率逐渐下降。
其中,低浓度(0.2%)和短时间EMS(8 h)处理对亚麻荠种子的影响不大,EMS处理的种子发芽率和成苗率与对照相比差异不显著;高浓度(1.2%)和长时间(16 h)EMS处理对亚麻荠种子的损伤较大,产生致死突变,当EMS浓度为1.2%时,3个不同处理时间均导致种子萌发特性全部丧失。统计分析表明,不同浓度(0.4%以上1.0%以下)相同时间EMS处理,不同时间相同浓度(0.4%以上1.0%以下)EMS处理,所观察的种子萌发性状与对照相比差异显著(P<0.05)。
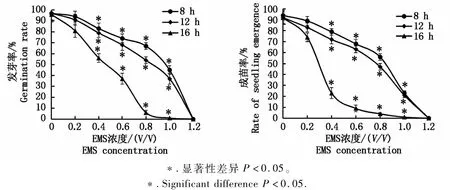
图1 EM S处理亚麻荠差异种子萌发性状的统计分析Fig.1 Statistical analysis on seed germ ination of EM S-induced C.sativa m aterials
经EMS处理的种子出苗缓慢,较野生型对照推迟3~5 d。部分种子萌发后,子叶迅速变黄和死亡导致成苗率降低。亚麻荠种子经1.0%EMS处理8 h和0.4%EMS处理16 h,虽然具有较高发芽率(45%和56%),但成苗率均低(23%)。这是因为萌发后存活下来的一部分幼苗,有的在后期转变为黄化苗和白化苗而凋亡,有的幼苗叶片严重皱缩和卷曲,影响到幼苗的正常光合作用,最终凋谢死亡。应用统计软件SPSS回归分析的probit模型计算半致死浓度LC50。分析结果显示,EMS诱变亚麻荠的半致死浓度为0.8%,处理时间12 h诱变效果较好。
2.2 亚麻荠种子2S清蛋白缺失突变体的筛选
5 000余粒EMS诱变处理的亚麻荠种子播种后共获得成活可育植株573株,其中,呈现叶型、株高、生育期、结实率等可见形态变异的共556株,其余17株的形态和生育期未发生明显变化。对未发生明显形态变异的17株进行特别处理和分析,探讨EMS诱变处理是否对它们也有影响,收获的种子进行种子成分分析、贮藏蛋白鉴定。提取样品蛋白,经SDS-PAGE电泳分离和蛋白成分测定,筛选到1种2S清蛋白缺失突变体(图2),命名为2SP1。种子贮藏蛋白成分检测显示,野生型亚麻荠种子2S蛋白含量占总贮藏蛋白的36%,收获的M2和M3种子2S蛋白积累甚微(<0.1%),几乎检测不到。显然,亚麻荠2SP1突变体的种子2S贮藏蛋白缺失性状遗传稳定。
2.3 亚麻荠2SP1突变体的株高和生育期分析
连续对2SP1亚麻荠突变体及后代(M1、M2、M3)株高和生育期检测表明,与野生型相比,这些性状有差异,但未达统计学显著水平(P>0.05)(表1)。2SP1突变体(M3)苗期株高(11.3 cm)较野生型苗期株高(10.5 cm)略高,成熟期株高(85.6 cm)较野生型成熟期株高(87.2 cm)略低;2SP1突变体(M3)单株所结角果数(248个)较野生型角果数(231个)稍多;从播种到开花期的天数野生型和突变体均为34 d左右。全生育期2SP1突变体(M3)比野生型平均早3 d左右。

图2 EM S诱变的亚麻荠2SP1突变体与野生型的种子贮藏蛋白电泳谱Fig.2 E lectrophoresis p rofiles of seed storage p rotein for w ild-type and EM S-induced 2SP1 m utant C.sativa

表1 亚麻荠2SP1突变体与野生型株高及生育期的比较Tab.1 The com parison of p lant heigh t and period of du ration between 2SP1 m utant and w ild-type C.sativa
2.4 亚麻荠2SP1突变体的种子形态特征分析
亚麻荠2SP1突变体成熟种子呈棕褐色,形状为卵圆形。M3种子百粒质量(115 mg)和种子长度(2.5 mm)略大于野生型种子的百粒质量(113 mg)和长度(2.4 mm);然而,2SP1突变体M3种子的宽度(1.3 mm)则略低于野生型种子的宽度(1.4 mm)。统计学分析显示,这些种子形态学性状在突变体和野生型间差异不显著(P>0.05)(表2、图3)。
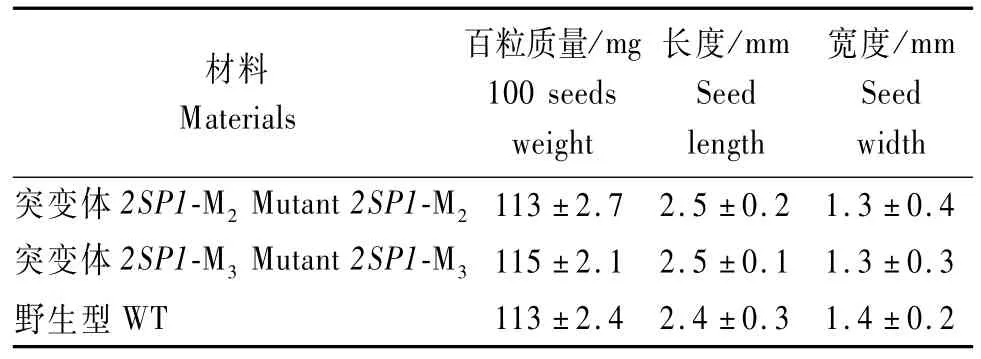
表2 亚麻荠2SP1突变体与野生型种子形态的比较Tab.2 The seed m orphology com parison betw een 2SP1 m utant and w ild-type C.sativa

图3 亚麻荠2SP1突变体(M 3)和野生型种子形态Fig.3 Seed m orphology of 2SP1 m utant(M 3)and w ild-type C.sativa
2.5 亚麻荠2SP1突变体种子的油脂与蛋白含量分析
为检测亚麻荠2SP1突变体种子缺失2S蛋白是否引起亚麻荠种子油脂和蛋白质合成积累发生明显变化,测试了亚麻荠2SP1突变体M2、M3种子含油量和蛋白含量(表3)。由表3可知,与野生型(WT)种子蛋白含量(28.3%)相比,2SP1突变体M3种子的蛋白含量(平均27.6%)没有显著变化,尽管53个 M3突变株系中9株蛋白含量有轻微上升(0.3%~1.1%)。亚麻荠突变体M3种子的含油量由野生型(WT)种子39.7%的含油量提高到40.5%,但差异不显著。说明该突变体缺失2S蛋白并未显著影响到亚麻荠种子总贮藏蛋白和总油脂的积累。97.29%,比野生型95.73%的发芽率提高了1.56个百分点;然而,2SP1突变体M3的发芽势为81.64%,比野生型82.37%的发芽势降低了0.73个百分点,但这2个性状在突变体和野生型间均无显著差异(P>0.05);亚麻荠2SP1突变体M3种子与野生型种子在穴盘苗床播种(图4-B)和大田条件下播种(图4-C),出苗及幼苗发育等性状亦未出现明显差异。

表3 亚麻荠2SP1突变体与野生型种子的油脂和蛋白含量的比较Tab.3 The com parison of seed oil and p rotein contents between 2SP1 m utant and w ild-type C.sativa%
2.6 亚麻荠2SP1突变体种子的萌发和出苗特征分析
室内种子萌发试验和大田播种试验显示(表4、图4-A),亚麻荠2SP1突变体M3种子发芽率为

表4 亚麻荠2SP1突变体与野生型种子的萌发特征比较Tab.4 The com parison of seed germ ination features between 2SP1 m utant and w ild-type C.sativa%

图4 亚麻荠2SP1突变体(M 3)和野生型种子的萌发和出苗特征Fig.4 Featu res of seed germ ination and seed ling em ergence for 2SP1 m utant(M 3)and w ild-type C.sativa
3 讨论与结论
应用EMS处理植物种子是一种有效的植物诱变方法,可导致各植物组织或器官发生丰富多彩的表型突变[20-21]。EMS诱变不仅突变频率高,而且多为点突变、易稳定,尽管诱变方向不确定[22-23]。EMS诱变已广泛应用于模式植物拟南芥、番茄等蔬菜植物[24]、水稻等禾谷类粮食作物[25]和油菜等油料作物[26-27]突变体创育及突变体库的构建,并在植物种质创新和功能基因组学研究中发挥了重要作用。适宜的EMS诱变处理浓度和处理时间是提高诱变效率的关键,这与植物种类及处理材料密切相关。通常检测处理材料的发芽率和成苗率来确定EMS处理浓度和处理时间[28],尽管叶色、叶形、株型、生育期和育性等性状也可作为参考指标[29]。本试验通过对EMS不同处理浓度和不同处理时间的诱变材料发芽率和成苗率进行比较以及统计分析,结果确定0.8%EMS浓度、处理种子12 h为亚麻荠种子EMS有效诱变的优化组合。这为进一步创建亚麻荠这一新型重要油料作物高通量突变体库提供了借鉴。
植物种子在发育成熟过程中通常合成积累大量贮藏蛋白,以蛋白体形式存在于细胞中。种子贮藏蛋白不仅为种子萌发提供所需蛋白质和氨基酸,亦是人类饮食蛋白质营养的重要来源[30-31]。然而,一些种子贮藏蛋白理化性质影响其用作食品加工的效值。2S贮藏蛋白在食品加工工艺上主要影响植物蛋白的发泡、凝胶及乳化性能,2S蛋白组分具有很强的亲水性和耐热性[10],这可能与其富含Met及Cys等含硫氨基酸有关。Met及Cys可在蛋白亚基间及亚基内形成多个二硫键,二硫键的存在是蛋白质具有耐热性的主要原因[32]。更重要的是,2S蛋白也是油料作物种子贮藏蛋白中的一类能引起部分人群(特别是儿童)饮食过敏的蛋白,过敏蛋白的存在严重限制了种子贮藏蛋白的食品营养应用价值。已检测的油菜、大豆、花生和向日葵等普通油料作物种质资源均含有2S蛋白,约占种子贮藏蛋白的15%~35%[9,33-34]。还有研究发现,一些亚麻荠种质资源2S蛋白含量高达种子贮藏蛋白的39%[2]。本试验所用亚麻荠材料2S蛋白含量为种子贮藏蛋白的36%。通过EMS诱变该基因型亚麻荠种子,筛选获得了2S贮藏蛋白缺失突变体2SP1。该突变体种子蛋白和油脂含量、种子大小和萌发特性以及生育期等其他农艺性状与野生型无明显差异。进一步分子检测显示,亚麻荠编码2S蛋白的基因在该突变体中几乎没有表达,这可能是由该基因位点上游启动子区一些关键碱基发生突变所致,仍有待进一步鉴定。与其他一些植物种子贮藏蛋白相关研究报道类似[35],本研究中,2S蛋白缺失并未引起总蛋白含量明显降低,这可能是由该突变体调控光合产物用于合成蛋白质、油脂和碳水化合物等贮藏物代谢分配机制没有发生改变所致。用于蛋白质合成的代谢物总量不变的情况下,减少某种贮藏蛋白合成所节省的代谢物就可能用于其他贮藏蛋白的合成,进而使总蛋白积累量未发生明显改变。另外,EMS处理油料作物种子,常诱变产生一些油脂成分发生变化的突变体。例如,用EMS处理甘蓝型油菜,张宏军等[26]研究获得4株高油酸突变体。黄永娟等[36]从EMS处理甘蓝型油菜8 441份种子材料中,筛选出5份高油酸材料。本试验未从EMS诱变的亚麻荠突变体中筛选到油脂成分改变的突变体材料,将进一步加大EMS处理群体,以期筛选到亚麻荠种子油脂成分改变的优异突变体。总之,本试验获得亚麻荠种子贮藏蛋白2S缺失突变体,可为亚麻荠品种改良和种子贮藏蛋白合成积累分子机制的研究创建了优异的新种质,亦可直接应用于亚麻荠商业化种植和生产加工,因过敏性蛋白的缺失扩大了食用人群,提高了食品营养价值,从而提高亚麻荠种子产品的附加值。
本试验结果表明,EMS能有效诱变亚麻荠获得丰富的突变体,以0.8%(V/V)EMS处理成熟种子12 h效果最佳。经筛选鉴定获得了亚麻荠种子2S贮藏蛋白缺失突变体2SP1,与野生型相比,该突变体种子油脂和蛋白含量及其他重要农艺性状未出现不良表型,可作为优异种质材料应用于亚麻荠品质育种、高附加值产品加工和相关功能基因组学等研究。
[1] Kagale S,Koh C,Nixon J,et al.The emerging biofuel crop Camelina sativa retains a highly undifferentiated hexaploid genomestructure[J].Nature Communications,2014,5:3706.
[2] Vollmann J,Eynck C.Camelina as a sustainable oilseed crop:Contributions of plant breeding and genetic engineering[J].Biotechnology Journal,2015,10(4,SI):525-535.
[3] 苑丽霞,毛 雪,杨致荣,等.新型工业油料作物亚麻荠油脂代谢工程[J].生物技术通报,2015,31(6):28-36.
[4] 苑丽霞,毛 雪,高昌勇,等.种子特异表达二酰甘油酰基转移酶基因(VgDGAT1)提高亚麻荠种子油脂积累[J].植物生理学报,2015,51(5):668-678.
[5] 苑丽霞,郝敬云,周广航,等.新型能源作物亚麻荠及种子油脂合成调控研究进展[J].山西农业科学,2015,43(5):634-638,642.
[6] Davis P B,Menalled F D,Peterson R K D,et al.Refinement of weed risk assessments for biofuels using Camelina sativa as amodel species[J].Journal of Applied Ecology,2011,48(4):989-997.
[7] Kumamaru T,Ogawa M,Satoh H,et al.Protein body biogenesis in cereal endosperms[M]//Olsen O A.Plant Cell Monogr Berlin,Heidelberg:Springer-Verlag,2007:141-158.
[8] 韦存虚,张 军,周卫东,等.小麦胚乳发育过程中贮藏蛋白的积累和蛋白体的形成[J].麦类作物学报,2009,29(1):73-78.
[9] 阎其涛,李建粤,米 东,等.重要谷类种子贮藏蛋白的特性及改良研究[J].西北植物学报,2004,24(4):754-759.
[10] 杨晓泉,张水华,黎 茵,等.花生2S蛋白的提取分离及部分性质研究[J].华南理工大学学报:自然科学版,1998,26(4):2-6.
[11] Li N,Qi G,Sun X S,et al.Adhesion properties of camelina protein fractions isolated with different methods[J].Industrial Crops&Products,2015,69:263-272.
[12] 张凤启,黄永娟,杨甜甜,等.EMS诱变甘蓝型油菜M_2代群体的表型突变研究[J].植物遗传资源学报,2010,11(6):760-765.
[13] Wang F,Travins J,Delabarre B,et al.Targeted inhibition ofmutant IDH2 in leukemia cells induces cellular differentiation[J].Science,2013,340(6132):622-626.
[14] An C,Beard WA,Chen D,et al.Understanding the lossof-function in a trip le m issense mutant of DNA polymeraseβfound in prostate cancer[J].Alimentary Pharmacology&Therapeutics,2013,43(4):1131-1140.
[15] 曲高平,孙妍妍,庞红喜,等.甘蓝型油菜EMS突变体库构建及抗除草剂突变体筛选[J].中国油料作物学报,2014,36(1):25-31.
[16] 邓曙东,张青文.亚麻荠种植和利用的研究现状[J].植物学通报,2004,21(3):376-382.
[17] 王显生,麻 浩,向世鹏,等.不同SDS-PAGE分离胶浓度条件下大豆贮藏蛋白亚基的分辨效果[J].中国油料作物学报,2004,26(2):75-80.
[18] 张金锐,刘 勇,林 刚,等.SDS-PAGE分析转基因小麦与主栽小麦杂交后代的高分子量麦谷蛋白亚基[J].生物技术通讯,2006,17(3):341-344.
[19] 张晓科,魏益民,谢惠民,等.HMW-GS的SDS-PAGE图谱在小麦品质评价中的应用[J].西北植物学报,2004,24(5):787-792.
[20] Hartwig B,Velikkakam JG,Konrad K,et al.Fast isogenic mapping-by-sequencing of EMS-induced mutant bulks[J].Plant Physiology,2012,160(2):591-600.
[21] Shi L,Katavic V,Yu Y,et al.Arabidopsis glabra2 mutant seeds deficient in mucilage biosynthesis produce more oil[J].Plant Journal for Cell&Molecular Biology,2012,69(1):37-46.
[22] Gu L P,Jones A D,Last R L.Broad connections in the Arabidopsis seed metabolic network revealed by metabolite profiling of an amino acid catabolism mutant[J]. Plant Journal for Cell&Molecular Biology,2010,61(4):579-590.
[23] Pislariu CI,Udvardi MK.A Medicago truncatula tobacco retrotransposon insertion mutant collection with defects in nodule development and symbiotic nitrogen fixation.Plant Physiol[J].Plant Physiology,2012,159(4):1686-1699.
[24] Menda N,Semel Y,Peled D.In silico screening of a saturated mutation library of tomato[J].The Plant Journal,2004,38(5):861-872.
[25] 赵天祥,孔秀英,周荣华,等.EMS诱变六倍体小麦偃展4110的形态突变体鉴定与分析[J].中国农业科学,2009,42(3):755-764.
[26] 张宏军,肖 钢,谭太龙,等.EMS处理甘蓝型油菜(Brassica napus)获得高油酸材料[J].中国农业科学,2008,41(12):4016-4022.
[27] 刘 鹏,李旭新,张春兰,等.蓖麻EMS处理条件分析及突变体分子标记检测[J].华北农学报,2015,30(4):47-50.
[28] 王军伟,蒋彩虹,宋志美,等.甲基磺酸乙酯对烤烟种子发芽率的处理效应[J].中国烟草科学,2011,32(3):17-20,27.
[29] 张晓勤,薛大伟,周伟辉,等.用甲基磺酸乙酯(EMS)诱变的大麦浙农大3号突变体的筛选和鉴定[J].浙江大学学报:农业与生命科学版,2011,37(2):169-174.
[30] Nguyen H T,Silva JE,Podicheti R,et al.Camelina seed transcriptome:a tool for meal and oil improvement and translational research[J].Plant Biotechnology Journal,2013,11(6):759-769.
[31] Singh R,Bollina V,Higgins E E.Single-nucleotide polymorphism identification and genotyping in Camelina sativa[J].Molecular Breeding,2015,35(1):1-13.
[32] Puumalainen T J,Poikonen S,Kotovuori A N.2S albumins,aremajor allergens in oilseed rape and turnip rape[J].Journal of A llergy and Clinical Immunology,2006,117(2):426-432.
[33] 朱宗河,郑文寅,张学昆.甘蓝型油菜种子贮藏蛋白遗传距离与杂种优势关系研究[J].中国油料作物学报,2009,31(4):413-420.
[34] Puumalainen T J,Puustinen A,Poikonen S.Proteomic identification of allergenic proteins,napin and cruciferin,from cold-pressed rapeseed oils[J].Food Chemistry,2015,175:381-385.
[35] 曲 龙,卢夏茹,李阳生,等.水稻辐射诱变突变体的种子蛋白质成分分析[J].核农学报,2015,29(2):209-214.
[36] 黄永娟,张凤启,杨甜甜,等.EMS诱变甘蓝型油菜获得高油酸突变体[J].分子植物育种,2011,9(5):611-616.
An EMS-induced M utant w ith 2S Protein Deficiency in Seed Storage Proteins of Camelina sativa
YUAN Lixia1,2,HAO Jingyun2,ZHAO Kui2,XUE Jinai2,LIRunzhi2
(1.College of Biological Science and Technology,Jinzhong University,Jinzhong 030600,China;2.Institute of Molecular Agriculture and Bioenergy,Shanxi Agricultural University,Taigu 030801,China)
Camelina sativa is an important oilseed crop,whose seeds is full of high content of unsaturated fatty acids and contain lots of storage proteins.In order to obtain extensive breeding material and establish superior new germp lasm,camelina seeds were treated by EMS(ethyl methane sulphonate).In this study,Camelina sativa seeds were treated for mutation by EMS(ethylmethane sulphonate).The treatments were conducted with different EMS concentrations(0,0.2%,0.4%,0.6%,0.8%,1.0%,1.2%)and various treating times(0,8,12,16 h).An optim izationalmutagenesis system by EMS was developed for Camelina sativa seeds.One mutant showing 2S album in deficiency in seed proteins was obtained,and designated as 2SP1.Except for this feature,the mutant exhibited no significant difference from the wild-type camelina for other agronomic traits including seed oil and protein contents,p lantmorphology and seed germ ination.This specialmutant of 2SP1 could be used as a new excellent germplasm for investigating the mechanism of seed storage protein biosynthesis and accumulation,for breeding new Camelina sativa varieties with high nutrition quanlity,and also for further functional genom ics research.
Camelina sativa;2S albumin/napin;EMS;Mutant(2SP1)
Q78 文献标识码:A 文章编号:1000-7091(2016)03-0011-07
10.7668/hbnxb.2016.03.002
2016-03-01
国家自然科学基金项目(30971806;31201266;31401430;31501323);国家“948”项目(2014-Z39);山西省煤基重点科技攻关项目(FT-2014-01);山西省高校科技创新项目(2016171);山西省高校大学生创新创业项目(2016413)
苑丽霞(1979-),女,山西武乡人,副教授,在读博士,主要从事分子遗传与基因工程研究。
李润植(1959-),男,山西芮城人,教授,博士,博士生导师,主要从事分子遗传与基因工程研究。
