普通小麦春化处理过程中wcor14a基因的表达分析
2016-07-28张宝娜张鹏钰王同朝
张宝娜,张鹏钰,王同朝,王 翔,尹 钧,卫 丽
(1.河南农业大学农学院,河南郑州 450002;2.河南农业大学国家小麦工程技术研究中心,河南郑州 450002)
普通小麦春化处理过程中wcor14a基因的表达分析
张宝娜1,张鹏钰1,王同朝1,王 翔2,尹 钧2,卫 丽2
(1.河南农业大学农学院,河南郑州 450002;2.河南农业大学国家小麦工程技术研究中心,河南郑州 450002)
为进一步完善普通小麦春化特性理论基础,从不同春化特性小麦品种RNA-Seq结果中筛选得到一个春化诱导上调表达的EST序列Unigene3230,经NCBI比对与小麦wcor14a基因序列一致。为进一步明确该基因在春化过程中的功能,利用荧光定量PCR分析了wcor14a基因在非生物胁迫下的表达特性,结果显示,wcor14a基因能够响应低温、ABA、干旱等非生物胁迫。对wcor14a基因在不同春化发育特性小麦品种中的表达分析表明,该基因在不同发育特性小麦品种中的表达总体表现为春性>半冬性>冬性>强冬性,而且表达时间表现为冬性和强冬性早于春性和半冬性。
小麦;非生物胁迫;春化;表达分析
小麦是河南省主要夏粮作物,总产占全国的1/4,因而河南省小麦生产对我国粮食安全起了重要的作用。小麦的发育特性决定了其种植区域[1]。近年来,人们通过对拟南芥等植物开花调控机制的研究,提出了4种重要的开花途径即自主开花途径、光周期促进途径、春化途径和赤霉素(GA)途径[2]。日照长短和温度对植物的开花时间有着强烈的影响,而植物就是通过春化途径和光周期途径来分别感知和应答温度和光照的外界环境刺激[3-5]。我国麦区分布较广,除春麦区外,冬麦区小麦品种发育特性的差异主要表现在对春化条件的要求有所不同[6-7]。春性小麦和冬性小麦在满足春化发育条件后都表现出长日促进发育的特性[8],导致很多优良品种只能在特定的区域内种植,造成品种利用的局限性。因此,如何改变小麦品种发育特性,扩大品种利用范围、提高品种利用效率是当前亟须解决的重大科技问题。
小麦春化发育特性是由多基因调控的复杂生理过程[9]。尹均课题组先后扩增和比对了普通小麦春化基因VRN-A1,VRN-B1、VRN-D1和VRN-A2、VRN-B2、VRN-D2的DNA和cDNA的序列差异,并进一步明确了目前黄淮地区推广品种VRN1和VRN2的基因组成[10-12]。就目前普通小麦春化基因研究结果看,只能区分出春性、冬性品种,但不能区分春性与强春、冬性和强冬性品种之间的基因型差异。因而需要挖掘新的春化相关基因与分子标记,进一步揭示春化作用的调控机制。
转录组学是一个快速和直接研究基因本身的方法[13]。基于新一代高通量测序技术的转录组测序能够在单核苷酸水平对任意物种的整体转录活动进行检测[14-16]。为进一步探索普通小麦春化基因对小麦发育的调控,明确不同发育特性小麦春化基因的基因型,尹均课题组通过I llumina HiSeq 2000测序平台,对春性品种辽春10号、冬性品种京841春化和未春化处理的转录本进行测序,并对转录组及表达谱进行生物信息学分析,从中筛选出1个EST序列Unigene3230,经比对分析该序列与小麦wcor14a基因序列一致。小麦wcor14基因是禾谷类植物中最典型的冷调节基因[17],能够响应低温、强光照,该基因编码的蛋白WCOR14属于LEA蛋白(Late embryo genesis abundant proteins,LEA proteins)的第Ⅱ亚类家族成员[18],是小麦细胞叶绿体中的冷应答蛋白。目前有关wcor14a基因只限于冷胁迫方面的研究,而春化处理过程中的表达鲜见报道。为此,本研究分析了wcor14a基因在不同春化发育特性的小麦春化过程中的表达特性,并分析了该基因在低温、ABA、PEG、高盐等非生物胁迫下的表达模式,以期深入探讨wcor14a基因在小麦春化阶段的功能,为进一步完善小麦的春化机制提供理论依据。
1 材料和方法
1.1 试验材料及处理
供试材料辽春10(LC10,春性)、豫麦49-198(Y49-198,半冬性)、京841(J841,冬性)和肥麦(FM,强冬性),均由国家小麦工程技术研究中心提供。挑取各品种大小均匀的种子,消毒后于25℃浸泡12 h,放置在25℃的培养箱萌动后,各品种取适量移至培养皿放入4℃春化箱进行低温处理,分别于处理0,7,14,21,28,35,42,49 d取小麦叶片,经液氮处理存放于-80℃冰箱备用。
非生物胁迫处理方法:取适量萌动的J841种子,移入光照培养箱(25℃,16 h光照/8 h黑暗,光照强度350μmol/(m2·s))进行培养,材料长至2叶1心时,分别进行ABA(100μmol/L)、PEG 6000(20%)、NaCl(100μmol/L)和冷(4℃)处理。分别剪取上述处理后0,3,6,9,12,24,36,72 h的叶片,迅速用液氮冷冻后保存于-80℃冰箱备用,每次取样时间尽可能缩短以避免基因节律表达对表达分析结果的影响。
试验所用大肠杆菌菌株(E.coli)DH5α、pMD19-T载体、反转录试剂盒均由TaKaRa(大连)试剂公司提供;所用引物自行设计及测序工作由英潍捷基贸易有限公司进行。
1.2 DNA、总RNA的提取及cDNA第1链的合成
取上述冷冻保存的小麦叶片材料,采用改良的CTAB法[19]提取小麦叶片基因组DNA,260/280 nm吸光值测定DNA浓度和纯度,调整质量浓度至100 ng/μL,用于目的基因的克隆。采用TRIzol(TaKaRa)试剂提取材料的总RNA。提取完成后用0.8%琼脂糖凝胶电泳检测总RNA的完整性;用便携式紫外分光光度计测定其在260/280 nm吸光值确定其纯度及浓度,测定其OD260、OD280值。1μg总RNA用于cDNA第1链的合成。
1.3 不同发育特性小麦品种wcor14a基因序列分析
根据Unigene 3230 cDNA的序列设计引物(Unigene3230F1:5′-ACTACTGACTCAGCTCCTCCACC-3′;Unigene3230R1:5′-CAGCCTATTCTAGCAACTTTTC G-3′),以不同发育特性小麦品种cDNA和J841 DNA为模板进行PCR扩增并测序,反应体系均为20μL,包括:5 U/μL La Taq聚合酶0.2μL、10×LA PCR BufferⅡ2μL、10 mmoL/L的dNTP m ixture、10μmol/L引物各1μL和模板100μg,用ddH2O补齐至20μL。PCR反应条件为95℃预变性3 m in;95℃变性30 s,55℃退火30 s,72℃延伸1 m in,35个循环;72℃后延伸10 m in。连接转化DH5α,经菌液PCR检测后送往公司测序,利用DNAMan软件对测序结果进行比对分析。
1.4 荧光定量qRT-PCR
根据引物设计原则设计Real-time PCR引物,前引物:F2:5′-TGGGATGCCACCAAAGACG-3′,后引物R2:5′-CGCCAACTGAATAACTGATACGC-3′。以小麦看家基因β-Actin的cDNA序列设计特异引物βactin F:5′-TTTGAAGAGTCGGTGAAGGG-3′和β-actin R:5′-TTTCATACAGCAGGCAAGCA-3′。Real-time PCR反应体系为20μL:2×SYBR Prem ix Ex Taq TMⅡ10μL、cDNA模板2μL、Real-time PCR Primers(10μmoL/L)1.6μL,加ddH2O至20μL。反应条件为:95℃30 s;95℃5 s,60℃30 s,40个循环,在60℃反应步骤时收集荧光信号,每个样品设置3个重复以校正PCR模板的拷贝数。根据扩增曲线确定每个基因相应的Ct值,以β-actin为内参对照,结果计算采用相对定量方法,相对量采用2-ΔΔCt方法计算,每个反应设置3次重复。
2 结果与分析
2.1 不同发育特性小麦品种wcor14a基因序列分析
为验证转录组测序得到的Unigene3230拼接序列的正确性,以该序列5′、3′端设计特异性引物,以J841 cDNA为模板,采用RT-PCR扩增得到与预期大小相符的特异片段,测序结果表明与Unigene3230拼接序列一致(图1)。J841基因组Unigene3230序列与其cDNA序列比对发现,该基因DNA为774 bp,cDNA为677 bp,开放阅读框为423 bp,编码140个氨基酸,5′端UTR 42 bp,3′端UTR 212 bp,基因组序列中有1个97 bp的内含子。测序结果经NCBI(http://www.ncbi.nlm.nih.gov/)比对,与小麦wcor14a基因(GB:AF207545.1)序列一致。
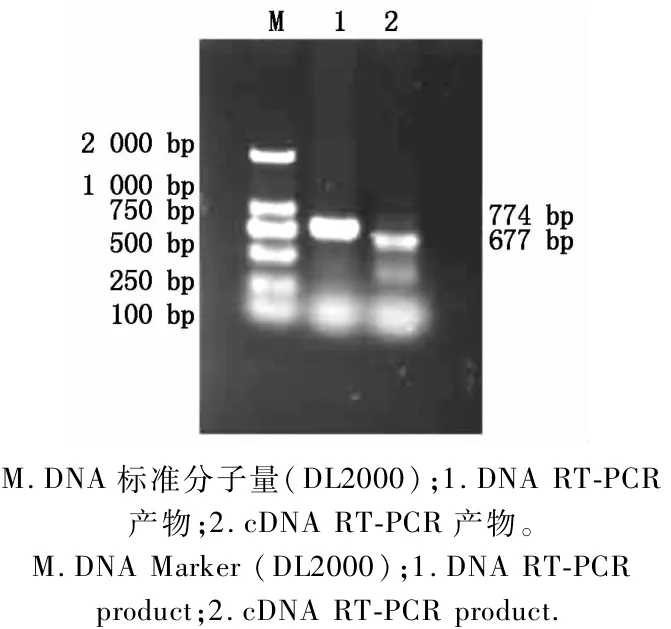
图1 Unigene3230基因DAN及cDNA的RT-PCR扩增Fig.1 RT-PCR am p lification of unigene3230 from DNA and cDNA level in w heat

图2 不同发育特性小麦品种wcor14a基因序列比对Fig.2 Sequences alignm ent of wcor14a gene in wheat varieties w ith d ifferent developm ental characteristics
以不同发育特性小麦品种cDNA为模板进行PCR扩增,测序结果表明,该基因在不同发育特性小麦品种中序列高度保守(图2)。
2.2 非生物胁迫下小麦wcor14a基因的表达特性分析
由图3可知,在ABA胁迫处理下,小麦wcor14a基因的表达量迅速上升,处理3 h时表达量是对照的4.7倍,之后呈下降趋势;6 h之后表达量均低于对照,处理6~72 h,对照表达量分别是ABA胁迫处理的2.7,3.6,10.1,7.0,10.6,5.4倍。由此可知,小麦wcor14a基因在ABA胁迫下呈负调控。高盐处理下,0~6 h小麦wcor14a基因的表达与对照相差不大,9 h后随着高盐胁迫处理时间的延长,9,12,24,36,72 h表达量分别是对照组的62.8%,11.5%,8.6%,38.2%,25.8%,说明随着高盐胁迫时间的延长,小麦wcor14a基因表达受到抑制。在PEG处理下,小麦wcor14a基因的表达量0~6 h与对照相差不大,处理9,12 h对照表达量分别是PEG处理的1.95,0.65倍,处理24 h时小麦wcor14a基因的表达急剧下降,处理24,36,72 h对照表达量分别是PEG处理的5.3,5.7,1.7倍。由此可知,随着PEG胁迫处理时间的延长,小麦wcor14a的表达受PEG胁迫抑制。低温处理下,小麦wcor14a基因的表达呈逐渐上升的趋势,处理12 h后随低温胁迫处理时间的延长表达量降低。低温胁迫处理36~72 h时,小麦wcor14a的表达量急剧降低,但相对表达量仍然是对照的56.9倍。由此可知,小麦wcor14a基因能够响应低温胁迫。
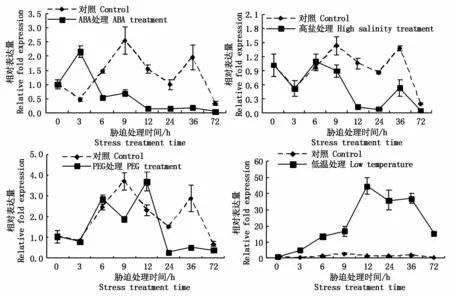
图3 不同非生物胁迫下小麦wcor14a基因的表达Fig.3 Exp ression patterns of w cor14a gene under d ifferen t abiotic stress
2.3 小麦wcor14a基因在不同春化发育特性小麦品种中的表达特性分析
wcor14a基因在不同发育特性小麦品种春化处理过程中的表达如图4所示。春化处理过程中,wcor14a基因在春性品种LC10中的表达呈上升趋势,春化处理第28天达到最大值,随后表达水平下降。而半冬性品种YM49-198在春化处理第35天达到最大值。在冬性品种J841和强冬性品种肥麦中,最大值出现在第21天,随后下降。春性品种LC10号只在第28天出现一个峰值,其余3个冬性品种整体上基本呈先波动上升后下降的趋势。wcor14a基因在4个小麦品种中的表达量最大值总体表现为春性>半冬性>冬性>强冬性。春性小麦辽春10号和半冬小麦豫麦49-198分别在第28,35天wcor14a基因表达量达到最大值,而在冬性京841和强冬性品种肥麦中,wcor14a基因在第21天表达量达到最大值,wcor14a基因在不同春化特性小麦品种中的表达时间上,表现为冬性和强冬性早于春性和半冬性。
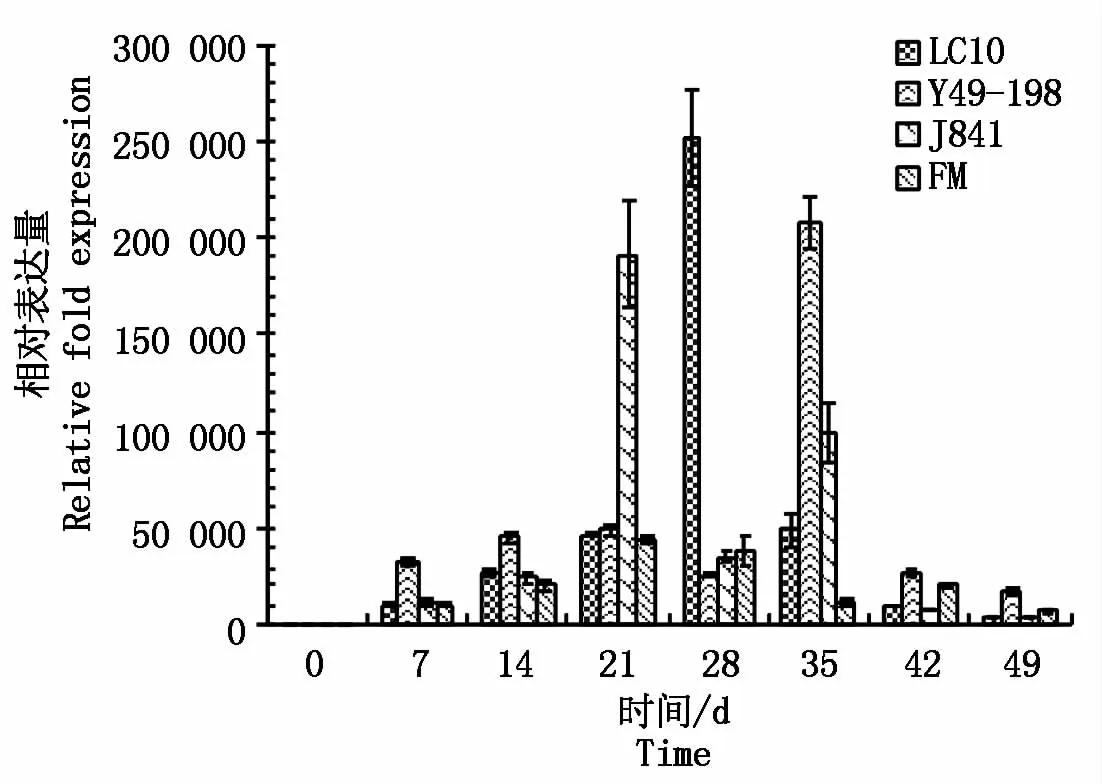
图4 w cor14a基因在不同发育特性小麦品种的表达Fig.4 Exp ression of wcor4a gene in wheat varieties w ith d ifferent developm ental characteristics under vernalization treatm ent
3 结论与讨论
春化阶段是小麦生长发育进程中一个重要阶段,冬小麦必须经过春化处理才能正常开花结实。小麦在长期的自然进化过程中,形成了较为完整的适应低温环境的机制。在低温环境下,小麦由最初感受低温区域通过各种复杂的信号途径,将低温信号逐级传递来调控下游基因的表达,最终引起细胞产生低温响应及生理生化的改变,使小麦适应低温环境[3]。春化作用与冷驯化都需要经过一定时间的低温处理,但两者对低温和处理时间要求却不相同[3,20-21]。研究表明,小麦wcor14a基因编码COR蛋白(Cold-regulated proteins),该类蛋白是禾谷类中典型的冷调节蛋白[17],能够响应低温、强光照,是小麦细胞叶绿体中的冷应答蛋白。研究表明,该家族蛋白与植物的逆境胁迫有关[12]。本试验中,小麦wcor14a在低温胁迫下表达量上升,在低温胁迫过程中,表达量明显高于对照,与前人研究结果一致,进一步验证了该基因对低温的敏感性。
本研究结果表明,小麦wcor14a基因在不同春化发育特性小麦品种春化处理过程中的表达均呈抛物线状,春性小麦、半冬性小麦分别在春化处理第28,35天wcor14a基因的表达达到最大值,然后呈现下降趋势,而在冬性和强冬性小麦春化处理过程中,均于第21天达到最大值,但总体来说,wcor14a基因在春性、半冬性品种中的表达量高于冬性和强冬性品种,与VRN1在春性和冬性小麦品种中的表达趋势相似。小麦春化发育受多基因的调控,其中VRN1是春化作用的关键基因[22-23],小麦中还有耐冷(Freezing tolerance,Fr)的QTL位点,如Fr1、Fr2等,Fr1和VRN1是紧密连锁的,Fr1/VRN1在小麦低温胁迫或春化过程中起重要作用[17]。有研究表明,在低温胁迫处理下,Fr1/VRN1调控CBF/DREB1的表达,CBF是小麦种参与冷驯化的转录因子,可以进而促进COR基因的表达[21,24],进一步阐明了在低温胁迫处理下,COR基因的表达受多因子的调控,是多基因网络调控的结果[25]。
[1] 赵广才.中国小麦种植区划研究(二)[J].麦类作物学报,2010,30(6):1140-1147.
[2] Boss P K,Bastow R M,Mylne J S,et al.Multiple pathways in the decision to flower:enabling,promoting,and resetting[J].The Plant Cell,2004,16(Suppl):S18-S31.
[3] Sung S,Amasino R M.Molecular genetic studies of the memory of winter[J].Journal of Experimental Botany,2006,57(13):3369-3377.
[4] 高曼霞.我国小麦春化基因和光周期基因鉴定[D].郑州:河南农业大学,2014.
[5] Díaz A,Zikhali M,Turner A S,et al.Copy number variation affecting the Photoperiod-B1 and Vernalization-A1 genes is associated with altered flowering time in wheat(Triticum aestivum)[J].PLoS One,2012,7(3):e33234.
[6] 张志红,张晓科,孙道杰,等.春化和光周期基因在陕西小麦品种中的分布[J].麦类作物学报,2009,29(3):401-408.
[7] 赵广才.中国小麦种植区域的生态特点[J].麦类作物学报,2010,30(4):684-686.
[8] 苗果园,张云亭,侯跃生,等.光温互作对不同生态型小麦品种发育效应的研究.Ⅱ温光对品种苗穗期作用力及回归分析[J].作物学报,1994,120(2):136-143.
[9] 曹 霞,王 亮,冯 毅,等.新疆小麦品种春化和光周期主要基因的组成分析[J].麦类作物学报,2010,30(4):601-606.
[10] 杨宗渠,尹 钧,周 冉,等.黄淮麦区不同小麦基因型的春化发育特性研究[J].麦类作物学报,2006,26(2):82-85,108.
[11] 袁秀云,李永春,孟凡荣,等.黄淮麦区21个小麦品种中春化基因VRN1的组成分析[J].麦类作物学报,2009,29(5):760-765.
[12] 马丽娟,王 翔,卫 丽,等.不同发育特性小麦品种春化基因VRN2的序列分析[J].麦类作物学报,2012,32(4):603-609.
[13] 岳桂东,高 强,罗龙海,等.高通量测序技术在动植物研究领域中的应用[J].中国科学:生命科学,2012,42(2):107-124.
[14] Zhang JZ,Ai X Y,Sun L M,et al.Transcriptome profile analysis of flowering molecular processes of early flowering trifoliate orange mutant and the wild-type(Poncirus trifoliata(L.)Raf.)bymassively parallel signature sequencing[J].BMC Genomics,2011,12(1):63.
[15] WeiW,Qi X,Wang L,et al.Characterization of the sesame(Sesamum indicum L.)global transcriptome using Illumina paired-end sequencing and development of EST-SSR markers[J].BMC Genom ics,2011,12(1):451.
[16] 祁云霞,刘永斌,荣威恒.转录组研究新技术:RNASeq及其应用[J].遗传,2011,33(11):1191-1202.
[17] Crosatti C,Polverino de Laureto P,Bassi R,et al.The interaction between cold and light controls the expression of the cold-regulated barley gene cor14b and the accumulation of the corresponding protein[J].Plant Physiology,1999,119(2):671-680.
[18] 花 庆,刘小刚,张静雅,等.小麦冷驯化相关基因及抗寒性分子机理研究进展[J].中国农学通报,2012,28(36):8-22.
[19] Murray M G,Thompson W F.Rapid isolation of high molecular weight plant DNA[J].Nucleic Acids Research,1980,8(19):4321-4325.
[20] Kobayashi F,Takumi S,Nakamura C,et al.Regulation of cold-responsive Cor/Lea genes and their transcription factors by the major freezing tolerance locus Fr-1 in wheat[J].Recent research developments in p lant science,2004(2):249-266.
[21] W infield M O,Lu C,W ilson ID,et al.Plant responses to cold:Transcriptome analysis of wheat[J].Plant Biotechnology Journal,2010,8(7):749-771.
[22] 金芬芬,朱灿灿,王 翔,等.调控小麦春化发育特性的相关基因研究进展[J].河南农业科学,2012,41(12):1-6.
[23] Yan L,Loukoianov A,Tranquilli G,et al.Positional cloning of the wheat vernalization gene VRN1[J].Proceedings of the National Academy of Sciences of the United States of America,2003,100(10):6263-6268.
[24] B ga M,Chodaparambil SV,Lim in A E,et al.Identification of quantitative trait loci and associated candidate genes for low-temperature tolerance in cold-hardy winter wheat[J].Functional&Integrative Genomics,2007,7(1):53-68.
[25] 张 晗.棉花CBF调控因子在逆境条件下的表达调控及沙冬青CBF基因的克隆[D].北京:中国农业科学院,2008.
Expression Analysis of wcor14a Gene in Comm on W heat under Vernalization Treatm ent
ZHANG Baona1,ZHANG Pengyu1,WANG Tongchao1,WANG Xiang2,YIN Jun2,WEI Li2
(1.College of Agricultural Science,Henan Agricultural University,Zhengzhou 450002,China;2.National Engineering Research Centre for Wheat,Henan Agricultural University,Zhengzhou 450002,China)
In order to study the theoretical basis of common wheatwith different vernalization characteristics,an EST Unigene3230 was discovered from high-throughput sequencing results from transcripts of wheat varieties with different vernalization characteristics,and its sequence is consistentwith wcor14a gene by sequence alignment from NCBI.In order to explore the functions of wcor14a in the process of vernalization,wcor14a expression patterns were analyzed using fluorescence quantitative RT-PCR under abiotic stress treatments.The result showed that wcor14a gene could response to low temperature,exogenous ABA,and drought stress treatments.What′smore,the expression patterns of wcor14a gene in wheat varieties with different vernalization characteristics were analyzed,and the result revealed that wcor14a gene was expressed in wheat varieties and the relative expression level was spring wheat>semi-winter wheat>winter wheat>strong winter wheat,and the expression time of winter and strong winter wheat was earlier than spring and sem i-winter wheat.
Wheat;Stress;Vernalization;Expression analysis
S512.03;Q78 文献标识码:A 文章编号:1000-7091(2016)03-0163-06
10.7668/hbnxb.2016.03.024
2016-03-20
河南省科技攻关项目(132102110044)
张宝娜(1988-),女,河南杞县人,在读硕士,主要从事小麦生理生态研究。
卫 丽(1966-),女,河南商丘人,研究员,博士,主要从事小麦发育分子调控研究。
