甘肃高山细毛羊和湖羊HIF-2α基因遗传特性与高原低氧适应性分析
2016-07-28党鹏举李少斌王继卿罗玉柱
党鹏举,李少斌,王继卿,刘 秀,洪 魏,胡 江,罗玉柱
(1.甘肃省草食动物生物技术重点实验室,甘肃省牛羊基因改良工程实验室,甘肃农业大学 动物科学技术学院,甘肃兰州 730070;2.浙江赛诺生态农业有限公司,浙江临安 311311)
2.2 SSCP检测结果
甘肃高山细毛羊和湖羊HIF-2α基因遗传特性与高原低氧适应性分析
党鹏举1,李少斌1,王继卿1,刘 秀1,洪 魏2,胡 江1,罗玉柱1
(1.甘肃省草食动物生物技术重点实验室,甘肃省牛羊基因改良工程实验室,甘肃农业大学 动物科学技术学院,甘肃兰州 730070;2.浙江赛诺生态农业有限公司,浙江临安 311311)
为探讨HIF-2α基因核苷酸序列变异与绵羊高原适应的相关性,以540只(甘肃高山细毛羊200只,湖羊340只)绵羊为研究对象,采用PCR-SSCP技术分析HIF-2α基因第11外显子和内含子部分区段在甘肃高山细毛羊和湖羊中单核苷酸多态性(SNPs)。结果显示:HIF-2α基因扩增片段在2个绵羊品种中共检测到4种等位基因(A、B、C和D)和10种基因型(AA、BB、CC、DD、AB、AC、BC、AD、BD和CD),存在6个SNPs位点,其中外显子11检测到5个SNPs位点(G/A、G/C、C/T、T/C、G/A、),内含子11检测到1个SNPs位点(G/A),甘肃高山细毛羊未检测到DD基因型。2个绵羊品种的优势基因型均为AB,基因型频率分别为34.50%和16.47%。HIF-2α基因在2个绵羊品种中具有丰富的多态性,且等位基因频率在品种间存在极显著差异(P<0.01)。推测在高海拔低氧适应过程中,HIF-2α基因的基因型可能受到了选择,随着长期的高海拔低氧环境的选择,有利于低氧适应的基因型在高海拔绵羊品种中受到选择并富集,携带基因型AA、BB和AB的绵羊可能更加适应高海拔低氧环境,而携带基因型CD、BD和DD的绵羊对高海拔低氧环境适应的能力可能较差。
HIF-2α基因;甘肃高山细毛羊;适应性;多态性
低氧诱导因子(Hypoxia-inducible factor,HIFs)是一种氧依赖的转录激活因子,在缺氧调节过程中发挥核心作用,由一个调节表达的亚基(HIF-α)和一个持续表达的亚基(HIF-β)组成[1],同时结合着一个缺氧反应元件(Hypoxia response element,HRE)。它是由Semenza等[2]于1992年发现的,与生物体的生长、发育及一些疾病的发病机理都存在着密切的关系。HIF的活性主要由α亚基决定,而α亚基的稳定性、DNA结合活性和转录又受到严格调控,其中氧诱导的羟化酶作用是最主要的调控途径。低氧时,脯氨酸羟化酶功能丧失,不能使HIF-α亚基羟基化,从而导致HIF-α降解受阻而聚集增多;常氧条件下,脯氨酸羟化酶使HIF-α亚基羟基化,最终导致 HIF-α亚基降解[3]。目前,发现的HIF-α亚基主要有3种:HIF-1α、HIF-2α和HIF-3α[4]。HIF-2α是由Tian等[5]克隆出的HIF家族新成员,与HIF-1α具有48%的结构同源性。Yi等[6]发现HIF-2α是藏族与汉族多种基因频率差别最大的基因,而且相关性分析发现HIF-2α与藏族血红蛋白浓度呈显著负相关,提示该基因参与了藏族的高原适应过程。绵羊的HIF-2α基因位于3号染色体上,有15个外显子,全长44 252 bp,编码843个氨基酸;山羊的HIF-2α基因位于11号染色体上,有15个外显子,全长42 250 bp,编码858个氨基酸。吴晓云[7]分析牦牛HIF-2α基因的SNPs及在组织中的表达,结果表明3个牦牛群体中的3个SNPs位点均处于高度连锁状态,形成5种基因型;HIF-2α基因mRAN在牦牛和高原地区黄牛的7个组织中均有表达,且表达量差异极显著(P<0.01)。
湖羊主要饲养在江苏、浙江两省交界的太湖流域一带,气候湿润,雨量充沛,年平均气温为15~16℃,海拔1 000 m以下。甘肃高山细毛羊属毛肉兼用细毛羊品种,分布在高寒地区。海拔高,干旱少雨,年平均气温为1.9℃,海拔2 400~4 070 m;甘肃高山细毛羊能在高原寒冷、低氧的严酷环境中正常的生长发育。目前对HIF-2α基因的研究主要集中于该基因与人类癌症的相关性,而对绵羊HIF-2α基因的研究报道相对较少。因此,本试验以生活在低海拔的湖羊为对照,甘肃高山细毛羊为研究对象,采用PCR-SSCP方法,研究HIF-2α基因第11外显子和内含子部分区段的SNPs和遗传特征,为分析绵羊HIF-2α基因与高原适应性提供基础理论数据。
1 材料和方法
1.1 试验材料
选取2个绵羊品种的540个样本,分别是湖羊340只,甘肃高山细毛羊200只。颈静脉采血,酸性柠檬酸葡萄糖溶液(ACD)抗凝,-20℃冷冻保存,部分血样滴到FTA卡(Whatman BioScience,M iddlesex,UK)上干燥保存。
1.2 试验方法
1.2.1 基因组DNA的提取 用Zhou等[8]描述的两步法提取绵羊血样基因组DNA,冷冻保存的血样用常规苯酚-氯仿抽提法提取基因组DNA,用于PCR扩增。
1.2.2 引物设计及PCR扩增 参照GenBank中绵羊HIF-2α基因第11外显子和内含子部分区段的核苷酸序列(登录号:NC_019460.1),用DNAMAN软件设计特异引物,预计扩增目的片段约为470 bp。上游引物序列:5′-GAGAGGACTTCCAGCTTAGC-3′,下游引物序列:5′-TCCCCTATGCAGCCCAGC-3′,引物由北京六合华大基因科技股份有限公司合成。
PCR扩增采用20μL的体系:Taq预混酶10μL(北京百泰克生物技术有限公司),上下游引物各0.4μL,模板DNA 1μL(或1.2 mm FTA卡小圆片1个),ddH2O 8.2μL。退火温度为61℃。PCR产物用1%的琼脂糖凝胶电泳检测。
1.2.3 SSCP检测 取2μL的PCR产物加入9μL的变性上样缓冲液(980 m L/L去离子甲酰胺,0.25 g/L溴酚蓝,0.25 g/L二甲苯青,pH值8.0,0.01 mol/L EDTA),98℃变性10 m in,立即冰浴10 m in。用胶联度39∶1、浓度14%的非变性聚丙烯酰胺凝胶,220 V、27℃电泳20 h,根据Byun等[9]描述的方法银染聚丙烯酰氨凝胶,直至条带清晰后对基因型判型,并用干胶仪干燥于A4纸保存。
1.2.4 序列分析与数据统计 将不同基因型样品的PCR产物送生工生物工程(上海)股份有限公司进行测序。纯合子直接测序,杂合子按照Gong等[10]描述的方法切胶测序。利用MEGA 5.0软件进行等位基因核苷酸序列比对及分析,采用Popgene32软件计算等位基因频率、基因型频率、纯合度(Homozygosity,Ho)、杂合度(Heterozygosity,He),有效等位基因数(Effective number of alleles,Ne)和χ2检验,采用PIC软件计算多态性信息含量(Polymorphism information content,PIC)。
2 结果与分析
2.1 PCR扩增结果
分别扩增甘肃高山细毛羊和湖羊HIF-2α基因的第11外显子和内含子部分序列,并用1%的琼脂糖凝胶检测(图1),目的条带清晰无杂带,与预期扩增片段长度相符,可直接用于SSCP分析。

图1 绵羊H IF-2α基因外显子11 PCR产物琼脂糖检测Fig.1 Agarose gel check of the PCR am p licons of H IF-2αgene for the exon 11 in sheep
2.2 SSCP检测结果
甘肃高山细毛羊和湖羊群体HIF-2α基因第11外显子和内含子部分区段的PCR扩增产物SSCP电泳带型见图2。2个绵羊群体540份样品共检测出10种SSCP带型,分别代表4种等位基因:A、B、C、D,形成10种基因型:AA、BB、CC、DD、AB、AC、BC、AD、BD和CD。其中甘肃高山细毛羊未检测出DD基因型。
2.3 H IF-2α基因不同等位基因序列比对

图2 绵羊H IF-2α基因外显子11 PCR-SSCP检测Fig.2 Detection of H IF-2αgene for the exon 11 in sheep by PCR-SSCP

图3 绵羊H IF-2α基因目的片段等位基因核苷酸序列比对Fig.3 Nucleotide sequences alignm ent the aim gene fragm ent of H IF-2αgene in sheep
以GenBank提供的HIF-2α基因序列(NC-019460.1)为模板,用MEGA 5.0软件对扩增区域的各等位基因进行比对(图3)。结果表明,该引物扩增区域等位基因B序列与原序列NC-019460.1相同,等位基因A、D各检测到1个SNPs位点,分别是221位C>T的转换,38位G>A的转换;等位基因C检测到5个SNPs位点,分别是38位G>A的转换,71位G>C的转换,213位T>C的转换,425和450位的G>A的转换。
2.4 H IF-2α基因遗传多态性
2.4.1 基因频率和基因型频率 2个绵羊品种HIF-2α基因第11外显子和内含子扩增区域的基因频率和基因型频率见表1,2。由表1可知,2个绵羊品种中均检测出A、B、C和D 4种等位基因,其中甘肃高山细毛羊的等位基因频率从大到小依次为A(43.5%)、B(41.00%)、C(12.50%)和D(3.00%),湖羊的等位基因频率从大到小依次为B(32.15%)、A(27.59%)、D(23.89%)和C(16.37%);经χ2检验显示,HIF-2α基因第11外显子和内含子扩增片段的基因频率在甘肃高山细毛羊和湖羊间存在明显差异(P=0.001)。由表2可知,甘肃高山细毛羊检测到AA、BB、CC、AB、AC、BC、AD、BD和CD 9种基因型,未检测到DD基因型,而湖羊检测到包括DD基因型在内的10种基因型。2个绵羊品种的优势基因型均为AB,基因型频率分别为34.50%和16.47%。经χ2适应性检验,2个绵羊品种均达到Hardy-Weinberg平衡状态(P>0.05)。

表1 绵羊H IF-2α基因第11外显子的等位基因频率Tab.1 A llele and genotype frequencies of H IF-2αfor the exon 11 in sheep
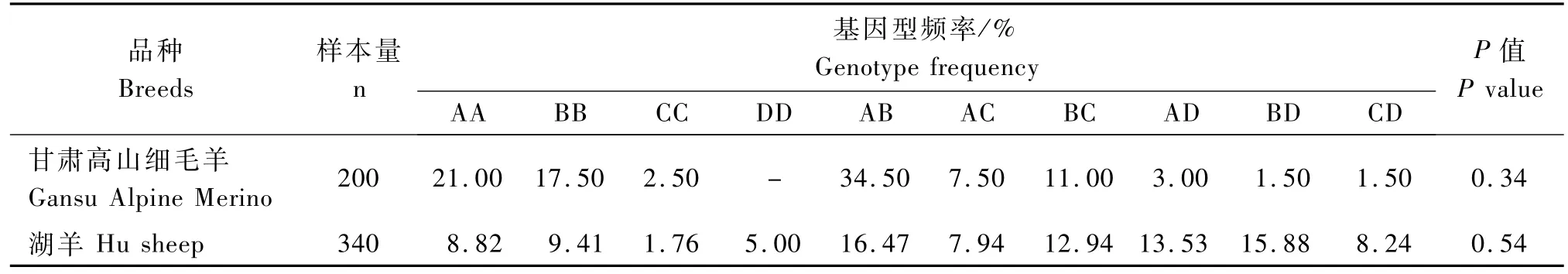
表2 绵羊H IF-2α基因第11外显子的基因型频率Tab.2 Genotype frequencies of H IF-2αfor the exon 11 in sheep
2.4.2 基因的纯合度、杂合度、有效等位基因数和多态性信息含量 遗传纯合度(Ho)、有效等位基因数(Ne)和多态性信息含量(PIC)都是度量群体内遗传变异的参数,群体间不同遗传变异参数体现各群体遗传差别,期望杂合度(He)越高,遗传纯合度(Ho)越低,说明遗传变异越大,对环境有较强的适应能力。甘肃高山细毛羊和湖羊HIF-2α基因第11外显子和内含子扩增区域的遗传参数见表3。由表3知,2个绵羊品种的杂合度(He)分别为0.59和0.75,遗传纯合度(Ho)分别为0.41和0.25,表明遗传多样性丰富,遗传变异程度最高,具有较大的遗传潜力。甘肃高山细毛羊和湖羊的PIC值分别为0.55和0.69,均大于0.5,均属于高度多态,表明这2个绵羊品种遗传变异大,可用于动物遗传育种研究。

表3 不同绵羊品种基因纯合度、杂合度、有效等位基因数和多态性信息含量Tab.3 Ho,He,Ne and PIC of different sheep breeds
3 讨论
HIF-2α是缺氧诱导因子(HIFs)家族的重要成员之一,主要作用的靶基因(如促红细胞生成素(EPO))中都含有缺氧反应原件(HRE),通过识别核心序列5′-TACGTGCT-3′与HRE结合,诱导靶基因的转录,介导细胞对缺氧的应答[11-12]。研究表明HIF-2α基因不仅对EPO有调节作用[13],对血管内皮生长因子(VEGF)的调节作用更强,有较强的转录激活VEGF的能力[14-15]。低氧时,HIF-2α亚基降解受阻而聚集增多,调节低氧组织VEGF的增加,促进血管生成,有利于机体适合低氧环境,保证氧气和营养物质通过血管输送给低氧细胞[16]。Beall等[17]采用全基因组等位基因分化扫描(GWADS)法在世居藏族人(海拔4 200 m)中发现了31个连锁不平衡的HIF-2α位点,这些位点与高原世居藏族人低Hb浓度有关。
单核苷酸多态(SNPs)是指在基因水平上单个核苷酸变异引起的DNA序列多态性,包括碱基替换而不包括碱基插入和缺失[18]。本试验以甘肃高山细毛羊和湖羊2个生活在完全不同生境中的绵羊品种为研究对象,采用PCR-SSCP技术检测HIF-2α基因第11外显子和内含子部分区域在这2个绵羊品种中的遗传多态性,共检测到4种等位基因和10种不同的基因型,有6个SNPs位点(G/A、G/C、C/T、T/C、G/A、G/A),SNPs位点数占分析总碱基数的1.28%,其中第221位C>T的转换引起氨基酸的改变,由苯丙氨酸突变为亮氨酸,其他SNPs位点突变未引起氨基酸的改变,均属于同义突变。根据PIC>0.5高度多态[19]可得:甘肃高山细毛羊和湖羊的PIC值分别为0.55和0.69,均大于0.5,均属于高度多态,说明群体的变异性较大。2个绵羊品种丰富的多态性信息含量(PIC>0.05)和较高的期望杂合度(均大于0.6)表明HIF-2α基因多态性较为分散,即遗传基础比较广泛。
甘肃高山细毛羊和湖羊所生存的环境有一定的差异,甘肃高山细毛羊主要分布在高寒地区,海拔高,干旱少雨,海拔2 400~4 070 m,而湖羊饲养在江苏、浙江两省交界的太湖流域一带,海拔较低[20]。本试验通过对HIF-2α基因在2个绵羊品种中的基因频率进行卡方检验,发现HIF-2α基因扩增区域的基因频率在这2个绵羊品种间具有种间差异,且差异具有统计学意义。结合等位基因和基因型频率的大小,推测在高海拔低氧适应过程中,HIF-2α基因的基因型可能受到了选择,随着长期的高海拔低氧环境的选择,有利于低氧适应的基因型在高海拔绵羊品种中受到选择并富集,如甘肃高山细毛羊基因型AA、BB和AB频率较高,频率之和达73.00%,而湖羊相同基因型频率之和为34.70%;不利于低氧适应的基因型在高海拔绵羊品种中频率下降,如基因型DD、BD和CD,甘肃高山细毛羊未检测到基因型DD,基因型BD和CD的基因型频率均为1.50%,而湖羊基因型DD的基因型频率为5.00%,基因型BD和CD的基因型频率均分别为15.88%和8.24%。由此推测随着海拔的升高,携带基因型AA、BB和AB的绵羊可能更加适应高海拔低氧环境,而携带基因型DD、BD和CD的绵羊对高海拔低氧环境适应的能力可能较差。由于2个绵羊品种均达到Hardy-Weinberg平衡状态,说明所选样本未受到或受到人工选择的影响较小,所以这种现象可能与绵羊所生存的环境有关。Dong等[21]研究HIF-2α基因的第8、9、10和15外显子共14个SNPs位点,发现藏猪与平原猪种间基因型频率差异极显著,且SNP1、SNP7、SNP10和SNP11可能与藏猪适应高海拔环境相关联。Wu等[22]研究表明甘南牦牛和大通牦牛的CD基因型频率显著高于天祝白牦牛(P<0.05);Beall等[17]运用基因芯片技术证实HIF-2α基因内含子的3个SNPs位点基因频率在世居高原藏族与汉族之间有很大差别,以上报道与本试验研究结果一致,都说明高原低氧环境是影响HIF-2α基因等位基因及基因型频率显著差异的重要因素,这种显著差异可能与动物适应生存环境的能力即适应性有关。
[1] Lakkisto P,Kyt V,Forsten H,et al.Heme oxygenase-1 and Carbon monoxide promote neovascularization after myocardial infarction by modulating the expression of HIF-1alpha,SDF-1alpha and VEGF-B[J].European Journal of Pharmacology,2010,635(1/3):156-164.
[2] Semenza G L,Wang G-L.A nuclear factor induced by hypoxia via de novo protein synthesis binds to the human erythropoietin gene enhancer at a site required for transcriptional activation[J].Molecular and Cellular Biology,1992,12(12):5447-5454.
[3] Semenza G L.Hydroxylation of HIF-1:Oxygen sensing at the molecular level[J].Physiology,2004,19(19):176-182.
[4] 何 凌.HIF-1α/HIF-2α在恶性上皮性卵巢肿瘤中的表达及其对耐药机制影响的初步探究[D].长沙:中南大学,2011.
[5] Tian H,Mcknight S L,Russell DW.Endothelial PAS domain protein 1(EPAS1),a transcription factor selectively expressed in endothelial cells[J].Genes&Development,1997,11(1):72-82.
[6] Yi Xin,Liang Yu,Huerta-sanchez Emilia,et al.Sequencing of 50 human exomes reveals adaptation to high altitude[J].Science,2010,329(5987):75-78.
[7] 吴晓云.牦牛EPAS1和VEGF-A基因的克隆、SNPs检测及其表达分析[D].兰州:甘肃农业大学,2012.
[8] Zhou H,Hickford JG,Fang Q.A two-step procedure for extracting genom ic DNA from dried blood spots on filter paper for polymerase chain reaction amplification[J].Analytical Biochem istry,2006,354(1):159-161.
[9] Byun SO,Fang Q,Zhou H,et al.An effective method for silver-staining DNA in large numbers of polyacrylamide gels[J].Analytical Biochemistry,2009,385(1):174-175.
[10] Gong Hua,Zhou Huitong,Hickford J G.Diversity of the glycine/tyrosine-rich keratin-associated protein 6 gene(KAP6)fam ily in sheep[J].Molecular Biology Reports,2011,38(1):31-35.
[11] Tissot van Patot M C,Gassmann M.Hypoxia:adapting to high altitude by mutating EPAS-1,the gene encoding HIF-2a[J].High Altitude Medicine&Biology,2011,12(2):157-167.
[12] Haase V H.Regulation of erythropoiesis by hypoxia-inducible factors[J].Blood Reviews,2013,27(1):41-53.
[13] Mastrogiannaki M,Matak P,Mathieu J R,et al.Hepatic hypoxia-inducible factor-2 down-regulates hepcidin expression in mice through an erythropoietin-mediated increase in erythropoiesis[J].Haematologica,2012,97(6):827-834.
[14] Greer SN,Metcalf JL,Wang Yi,et al.The updated biology of hypoxia-inducible factor[J].The EMBO Journal,2012,31(11):2448-2460.
[15] Compernolle V,Brusselmans K,Acker T,et al.Loss of HIF-2alpha and inhibition of VEGF impair fetal lung maturation,whereas treatment with VEGF prevents fatal respiratory distress in premature mice[J].Nature Medicine,2002,8(7):702-710.
[16] Partovian C,Adnot S,Eddahibi S,et al.Heart and lung VEGF mRNA expression in rats with monocrotaline-or hypoxia-induced pulmonary hypertension[J].The American Journal of Physiology,1998,275(6 Pt 2):H1948-H1956.
[17] Beall C M,Cavalleri G L,Deng Libin,et al.Natural selection on EPAS1(HIF2alpha)associated with low hemoglobin concentration in Tibetan highlanders[J].Proceedings of the National Academy of Sciences of the U-nited States of America,2010,107(25):11459-11464.
[18] 罗怀容,施 鹏,张亚平.单核苷酸多态性的研究技术[J].遗传,2001,23(5):471-476.
[19] Vaiman D,Mercier D,Goudarzi K M,et al.A set of 99 cattle microsatellites:characterization synteny mapping[J].Mammalian Genome,1994,5(5):288-297.
[20] 赵有璋.中国养羊学[M].北京:中国农业出版社,2013:127.
[21] Dong Kunzhe,Kang Ye,Yao Na,et al.Genetic variation of EPAS1 gene in tibetan Pigs and three Low-Altitude pig breeds in China[J].Journal of Integrative Agriculture,2014,13(9):1990-1998.
[22] Wu Xiaoyun,Ding X Z,Chu Min,et al.Novel SNP of EPAS1 gene associated with higher hemoglobin concentration revealed the hypoxia adaptation of yak(Bos grunniens)[J].Journal of Integrative Agriculture,2015,14(4):741-748.
The Analysis of Gansu A lpine M erino and Hu Sheep H IF-2αGene Genetic Characteristics and Adap tability to H igh A ltitude Hypoxia
DANG Pengju1,LIShaobin1,WANG Jiqing1,LIU Xiu1,HONGWei2,HU Jiang1,LUO Yuzhu1
(1.Gansu Key Laboratory of Herbivorous Animal Biotechnology,Gansu Engineering Lab of Genetic Improvement in Runminants,Faculty of Animal Science and Technology,Gansu Agricultural University,Lanzhou 730070,China;2.Zhejiang Sainuo Ecological Agriculture Lim ited Company,Lin′an 311311,China)
To study the relationship between the variations of HIF-2a gene and adaption to plateau in sheep,we detected the 540 sheep including 200 Gansu Alpin Merino and 340 Hu sheep,and used the PCR-SSCP to analyze the SNPs of part of the eleventh exon and intron of HIF-2a gene.The results showed that 6 SNPs corresponding to 4 alleles(A,B,C and D)and 10 kinds of genotypes(AA,BB,CC,DD,AB,AC,BC,AD,BD and CD)were detected in HIF-2a gene in 2 sheep breed.The 5 SNPs existed in the eleventh exon and the one SNPs laid in the eleventh intron and the genotype DD was not detected in Gansu Alpine Merino.The advantaged genotype AB with frequency of 0.345 0 and 0.164 7 was detected in both sheep breed.The HIF-2a gene has abundant polymorphism in 2 sheep breed and the frequency of alleles has significantly difference in two popul ations(P<0.01).As the selecting of environment with p lateau and low oxygen,the HIF-2a gene was selected and clustered in p lateu sheep.The sheep withthe genetype AA,BB and AB can adapt in plateau environmentmore better and the adaptive capacity of other sheep with genetype CD,BD and DD was poor.
HIF-2αgene;Gansu Alpine Merino;Adaptability;Polymorphism
Q78;S826 文献标识码:A 文章编号:1000-7091(2016)03-0088-06
10.7668/hbnxb.2016.03.013
2016-03-11
甘肃省国际科技合作专项(1304WCGA178);甘肃农业大学盛彤笙科技创新基金项目(GSAU-STS-134);甘肃省青年科技基金计划项目(1308RJYA025);甘肃省高等学校科研项目(2015B-052)
党鹏举(1987-),男,甘肃定西人,硕士,主要从事生物技术与动物育种研究。
罗玉柱(1962-),男,甘肃景泰人,教授,博士,博士生导师,主要从事现代生物技术与动物育种应用研究。
