盾叶半夏凝集素基因的克隆及功能分析
2016-07-28杨在君刘玲玲彭正松
杨在君,刘玲玲,2,彭正松
(1.西华师范大学生命科学学院,西南野生动植物资源保护教育部重点实验室,四川南充 637009;2.重庆大学生物工程学院,生物流变科学与技术教育部重点实验室,重庆 400044)
盾叶半夏凝集素基因的克隆及功能分析
杨在君1,刘玲玲1,2,彭正松1
(1.西华师范大学生命科学学院,西南野生动植物资源保护教育部重点实验室,四川南充 637009;2.重庆大学生物工程学院,生物流变科学与技术教育部重点实验室,重庆 400044)
为克隆盾叶半夏凝集素基因,并对其功能进行分析。采用RACE技术从盾叶半夏中克隆得到盾叶半夏凝集素基因的全长cDNA序列,命名为ppl。同时,构建了ppl基因的原核表达载体,并成功实现了33 kDa重组蛋白在E.coli BL21中的表达。纯化后的重组蛋白PPL用于凝血和体外抗癌试验。该基因的全长cDNA序列为1 504 bp,其中开放性阅读框(ORF)813 bp,编码270个氨基酸,具有3个甘露糖结合识别位点。PPL具有凝血活性,这种凝血活性可受甘露糖抑制。PPL对人鼻咽癌细胞(CNE)、人宫颈癌细胞(Hela)及人乳腺癌细胞(Bcap-37)的生长均具有抑制作用,其中对Hela细胞的抑制效果最好。为进一步研究PPL蛋白的功能奠定了理论基础。
盾叶半夏;凝集素;基因克隆;功能分析
盾叶半夏(Pinellia peltata Pei)为天南星科(Araceae)半夏属(Pinellia)多年生草本植物。直径为1.0~2.5 cm近球形的块茎,叶2~3片,叶片盾状着生,与本属其他任何种都不同;叶片呈深绿色,全缘,卵形或长圆形;浆果卵圆形,锐尖;种子球形。产于浙江温州、文成、福建松政等地,为我国所特有[1]草本植物。目前,盾叶半夏在我国分布数量极少,在《濒危植物红皮书》中被列为濒危(E)级,被我国政府确定为国家二级保护野生植物。盾叶半夏的块茎可消肿止痛、散瘀解毒,用于乳痈、肿毒、毒蛇咬伤、跌打损伤等疾病[2]。
凝集素是Stillmark在蓖麻(Ricinus communis L.)籽萃取物中首次发现的,李燕娥等[3]研究表明,植物凝集素含有一个或多个非催化性位点,可与单糖或多糖可逆结合,在植物生长发育的各个阶段,以不同的方式保护植物免受病虫害的侵害,可以抵御细菌、真菌、病毒等病原体的入侵。目前成功的用于植物抗病虫害基因工程的植物凝集素基因主要有半夏凝集素、雪花莲凝集素基因等。半夏凝集素是一类专一结合甘露糖的蛋白质,属于单子叶植物甘露糖凝集素家族,具有显著的抗虫活性[4-5]。同时半夏凝集素能凝集羊、猪、狗、猫、鼠等的血红细胞,而且能和生长旺盛的肝癌细胞结合,并使其凝集,显示出在治疗肝癌上的应用前景[6]。Yao等[7]首次克隆了半夏凝集素基因的cDNA,并将该基因成功转到水稻、玉米、小麦、烟草等植物中,试验结果表明,转基因植株对褐飞虱、二化螟、麦蚜、桃蚜等均具有显著抑制作用[8-11]。掌叶半夏和滴水珠凝集素基因cDNA也相继被成功克隆,并表现出明显的抗虫性[12-14]。西南野生动植物资源保护教育部重点实验室的赵静等[15]利用半夏凝集素的核心保守序列设计引物成功克隆出盾叶半夏的核心序列。
本试验根据赵静等[15]克隆出的盾叶半夏核心序列,利用3′RACE和5′RACE获得了盾叶半夏凝集素ppl的cDNA全长序列,同时分析了ppl基因的特征。并对原核表达出的重组蛋白PPL的凝血活性、单糖抑制活性和体外抗癌活性进行了研究,以期为后续深入研究PPL蛋白的功能提供一定的理论基础。
1 材料和方法
1.1 植物样品
本试验所用盾叶半夏(P.peltata)采自浙江温州雁荡山,现种植于西华师范大学生命科学学院试验田中。选取健康幼嫩的叶片用于RNA提取。
1.2 菌株和载体及试剂
植物总RNA提取试剂盒EZgeneTMPlant Easy Spin RNA Miniprep Kit购自BIOMIGA公司(BIOMIGA,美国圣地亚哥);反转录试剂盒M-MLV Reverse Transcriptase、大肠杆菌DH5α、pMD19-T载体、pET-28a载体、大肠杆菌BL21、质粒提取试剂盒、限制性内切酶Eco RⅠ和Hin dⅢ购自宝生物工程(大连)有限公司(TaKaRa,中国大连);3′RACE试剂盒SMARTerTMRACE cDNA Amplification Kit购自Clontech公司(Clontech,美国加州);5′RACE试剂盒5′RACE System for Rapid Amplification of cDNA Ends,Version 2.0购自Invitrogen公司(Invitrogen,美国加利福尼亚);引物合成和测序由生工生物工程(上海)股份有限公司完成(Sangon Biotech,中国上海);Ni-Agarose His标签蛋白纯化试剂盒购自北京康为世纪生物科技有限公司(CWBIO,中国北京);CCK-8试剂盒购自北京索莱宝科技有限公司(Solarbio,中国北京)。
1.3 RNA提取与cDNA合成
盾叶半夏总RNA的提取采用BIOMIGA公司的EZgeneTMPlant Easy Spin RNA Miniprep Kit植物总RNA提取试剂盒,按试剂盒的说明书提取总RNA,利用Nano-Drop 2000C分光光度计测定RNA的浓度并评估RNA的质量,通过琼脂糖凝胶电泳检测RNA的完整性。按照TaKaRa公司的M-MLV Reverse Transcriptase反转录试剂盒说明书将提取的总RNA反转录成cDNA第一链,-70℃保存备用。
1.4 ppl基因的克隆
根据本试验前期克隆的盾叶半夏凝集素核心保守序列[15],利用Primer Premier 5.0软件设计3′RACE和5′RACE反应所需引物:3′RACE Outer,3′RACE Inter;5′RACE Outer,5′RACE Inter(表1)。3′RACE和5′RACE分别按照Clontech公司的SMARTerTMRACE cDNA Amp lification Kit试剂盒和Invitrogen公司的5′RACE System for Rapid Amp lification of cDNA Ends,Version 2.0试剂盒的说明书操作。扩增产物经回收和纯化后,将目的片段连接到pMD19-T载体上并转化大肠杆菌DH5α,将PCR验证的阳性克隆送生工生物工程(上海)股份有限公司测序。最后,将测序结果进行拼接确定该全长序列的开放阅读框(Open reading frame,ORF)。
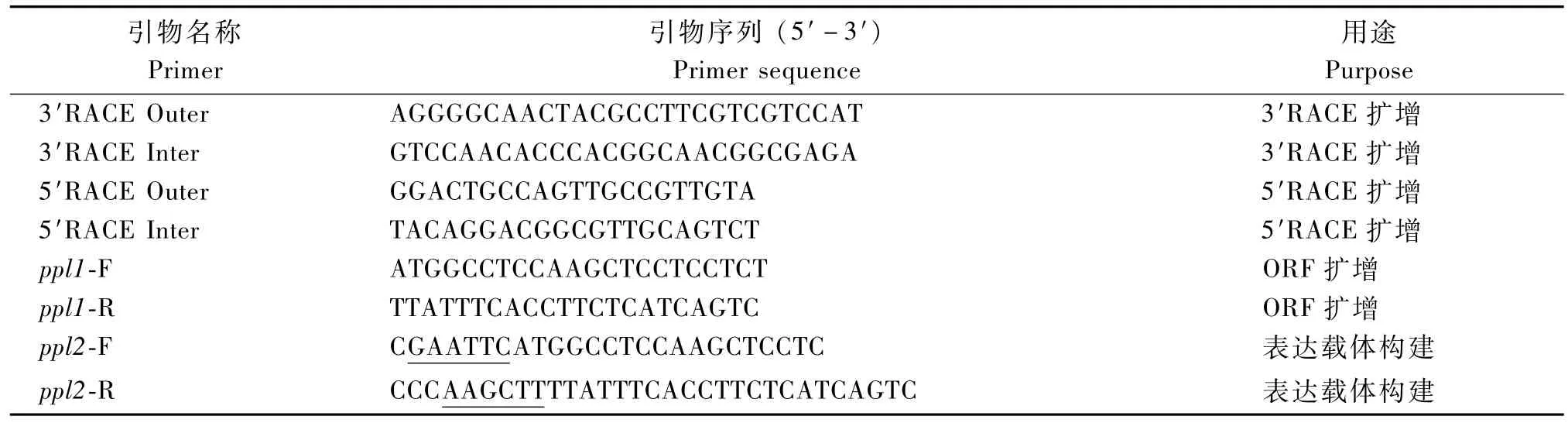
表1 试验所用引物Tab.1 Prim ers used in this study
根据ppl的ORF,设计验证引物ppl1-R和ppl1-F(表1),经PCR扩增,回收纯化后,将目的片段连接到pMD19-T载体上并转化大肠杆菌DH5α,将PCR验证的阳性克隆送生工生物工程(上海)股份有限公司测序。
1.5 pp l基因的生物信息学分析
利用在线工具ORF find(http://www.ncbi. nlm.nih.gov/gorf/gorf.htm l)和ProtParam(http:// web.expasy.org/protparam/)预测ppl的开放性阅读框(ORF)、等电点和分子量。利用DNAMAN 5.0进行不同物种间凝集素同源序列比对,用MEGA 6.0构建系统进化树。
1.6 PPL重组蛋白的原核表达及纯化
根据盾叶半夏的ppl基因序列设计特异性酶切引物ppl2-R和ppl2-F(表1),克隆ppl cDNA序列,将目的片段连接至载体pET-28a,测序验证后转化大肠杆菌BL21。将PCR验证后的重组菌接种于1.5 m L的含Kan+的LB液体培养基中37℃振荡培养过夜;从过夜培养物中取200μL接种到20 m L LB培养液中(含Kan+),振荡培养至吸光度A600= 0.5;加入IPTG,使终浓度为1 mmol/L,培养0~4 h,10 000 r/m in离心3 min,收集菌体;菌体沉淀用PBS悬浮,沸水浴4 m in,使蛋白质变性。取10μL样品用于SDS-PAGE电泳检测。
按照Ni-Agarose His标签蛋白纯化试剂盒(康为世纪)操作手册纯化带(His)6标签的目的蛋白,洗脱的蛋白质溶液再经透析纯化获得纯的PPL蛋白。
1.7 PPL凝血活性及单糖抑制试验
采兔血和鸡血用于本试验,采血后立即加抗凝剂(柠檬酸三钠溶液),颠倒混匀,冷冻离心机在4℃下,2 000 r/m in离心5 m in。血液分层,然后吸掉上层和中间层,留最下层的红细胞。用生理盐水洗涤4~5次。最后,吸取洗涤后的红细胞加入到生理盐水中,配制成2%(V/V)的红细胞悬液。
用双重稀释法检测凝集素凝血活性[16],在96孔板上,先在1~12孔中分别加入25μL生理盐水,再在第1孔中加入25μL PPL溶液(浓度为300 μg/m L,生理盐水稀释),然后取出25μL对2~12孔进行稀释,然后每孔中加入兔血或鸡血球悬浮液25μL,混合均匀,室温下放置1 h后再利用高倍镜(40×)检查红细胞的凝集情况。每次观察设3组平行试验,对试验结果取平均值,能使红细胞凝集的最低有效终浓度即为凝集滴度。
选择以下糖类:葡萄糖、麦芽糖、蔗糖、甘露糖、D-果糖、D-半乳糖用兔血球缓冲液配制成浓度为0.1 mol/L的不同糖溶液,将糖溶液在96孔板上进行倍比稀释,室温静置1 h后,用40倍显微镜观察结果。糖的抑制能力即为抑制凝血作用所需要的最小糖浓度[16]。
1.8 PPL抗癌活性研究
采用CCK-8法检测细胞凋亡率。培养细胞至对数期时,将细胞接种于96孔板中,每孔200μL,细胞浓度为1×105个/m L,然后置于CO2培养箱中培养,待细胞铺满孔底部,则可加入不同浓度的重组PPL。继续培养24 h,加入CCK-8,孵育2 h后,用酶标仪测定450 nm处的吸光值。根据吸光值计算PPL对人鼻咽癌细胞(CNE)、人宫颈癌细胞(Hela)及人乳腺癌细胞(Bcap-37)生长的影响。
2 结果与分析
2.1 ppl基因的克隆及分子特征
采用3′RACE方法经2轮巢式PCR反应,扩增产生的目的条带如图1-A所示,测序长度为519 bp;采用5′RACE方法,扩增出的目的条带如图1-B所示,测序长度为540 bp;将扩增出的3′RACE片段、5′RACE片段和之前西南野生动植物资源保护教育部重点实验室克隆出的核心片段拼接获得ppl的cDNA全长为1 504 bp,利用NCBI在线工具ORF finder确定该基因的ORF为813 bp,编码270个氨基酸,等电点(PI)为7.65,分子量为29.48 kDa,5′-UTR和3′-UTR分别为402,289 bp。以ppl1-R和ppl1-F为引物,PCR扩增产生单一条带(图1-C),测序表明该序列与拼接结果一致,表明已成功获得ppl全长cDNA。
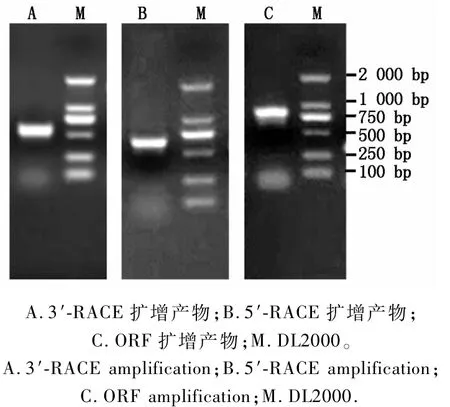
图1 盾叶半夏ppl基因3′-RACE、5′-RACE和ORF序列PCR扩增Fig.1 3′-RACE,5′-RACE and ORF am p lifications of ppl gene in P.peltata
经NCBI数据库中BlastP检索,发现PPL与天南星科多种植物凝集素蛋白的序列相似。其中,PPL与滴水珠(Pinellia cordata N.E.Br)的凝集素PCA相似性最高,为88%,其次为半夏(Pinellia ternata(Thunb.)Breit.)的PTA和掌叶半夏(Pinellia pedatisecta Schott)的PPA等。由此可以断定,试验所得的基因属于凝集素家族基因。用DNAMAN软件将 PPL与同源性较高的滴水珠 PCA(ABK88277)、半夏PTA(AAR27794)和掌叶半夏PPA(AGV40779)的氨基酸序列进行多重比对,发现这些蛋白都具有3个α-D-甘露糖结合识别位点QXDXNXVXY(QDNVY)[17],其中第1个位点和第2个位点的保守程度较高,氨基酸的序列完全一致,第3个位点在不同物种中变化较大(图2)。

图2 PPL蛋白与半夏属其他植物的凝集素蛋白序列比对结果Fig.2 M ultip le sequence alignm ent of PPL w ith lectin protein sequence from other p lants in Pinellia
2.2 PPL的系统进化分析
利用MEGA 6.0软件,采用邻接法(Neigh-bourjoining,NJ)构建PPL与天南星科其他植物凝集素氨基酸序列的系统进化树,这些序列包括:滴水珠PCA(ABK88277)、半夏PTA(AAR27794)、掌叶半夏PPA(AGV40779)、天南星AHA(AAP50524)、海芋AML(ABC69036)、花南星ALA(AAS66304)、东北天南星AAL(ABY91323)、犁头尖TDA(ABM68041)和岩芋RVA(ACH41914)。聚类结果表明:天南星科植物的凝集素可聚为3类(图3),第1类除天南星的凝集素AHA外,其余都是半夏属植物的凝集素,包括:PPA、PCA、PPL和PTA;第2类包括:ALA、AAL、AML和RVA;第3类只包括TDA。盾叶半夏凝集素PPL聚在第一类,与半夏凝集素PTA亲缘关系最近。
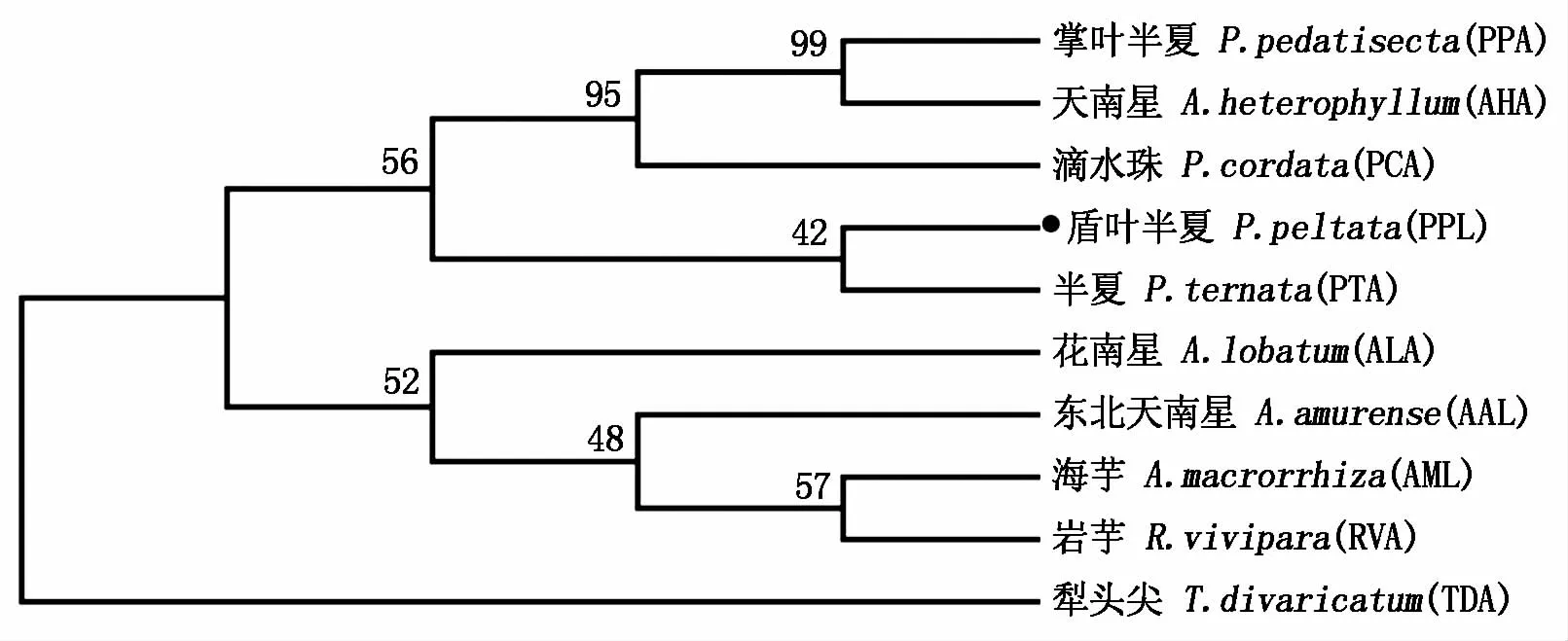
图3 PPL与其他植物凝集素氨基酸序列的进化树分析Fig.3 Phylogenetic tree of PPL and lectin am ino acid sequences from other p lan ts
2.3 PPL重组蛋白的表达及纯化
将ppl基因的重组子转化到表达菌株BL21感受态细胞,IPTG诱导表达后,SDS-PAGE电泳分析发现大肠杆菌表达了33 kDa的蛋白质(包括组氨酸标签),随着诱导时间的推移,蛋白质的表达量增加,3~4 h达到最大值。提取的蛋白质在经过2 mol/L尿素洗脱以后,上柱纯化,纯化洗脱液电泳后可观察到单一目的条带(图4),说明纯化效果较好,可进行下一步试验。

图4 PPL的原核表达及纯化Fig.4 Prokaryotic exp ression and pu rification of PPL
2.4 PPL的凝血活性及单糖抑制试验
凝血活性测定结果表明,PPL对兔血红细胞有凝集活性,而对鸡血红细胞无凝集活性。PPL对兔血红细胞的凝集滴度为54μg/m L。糖抑制试验的结果表明,PPL凝集兔血红细胞的能力能被甘露糖完全抑制,抑制能力为5.4μg/m L。葡萄糖、麦芽糖、蔗糖、D-果糖、D-半乳糖对PPL没有抑制作用。
2.5 PPL抗癌活性
从图5可以看出,PPL对CNE、Hela和Bcap-37细胞的生长均具有抑制作用,且PPL对CNE、Hela及Bcap-37细胞的生长抑制率均具有剂量依赖性。其中对Hela细胞的抑制效果最好,当PPL浓度达到200μg/mL时对Hela细胞的生长抑制率可以达到72.31%。

图5 PPL对CNE、Hela和Bcap-37细胞生长的抑制作用Fig.5 The effect of PPL on the grow th of CNE,Hela and Bcap-37 cells
3 讨论
近年来,植物凝集素在细胞凝集[18]、抗虫[19-22]、抗动物病毒[23]、诱导细胞凋亡和自噬[24]以及抗肿瘤[25]等方面的研究受到越来越多的重视。特别是凝集素在癌症的治疗和诊断中起到了越来越重要的作用。大量研究数据表明,凝集素对细胞间的黏着、靶细胞的识别、细胞定位、癌细胞的有丝分裂、跨膜信号转导、宿主免疫防御、细胞毒性及细胞死亡等均具有重要的调控作用。据王海燕等[26]报道欧洲槲寄生提取物在临床上可作癌症患者化疗佐剂。其中槲寄生凝集素(ML)被认为是最重要的活性成分。刀豆凝集素ConA具有自噬型细胞毒性和免疫调节的双重功能,在小鼠肝癌原位模型中,定期和定量的ConA饲喂,能使肿瘤组织明显萎缩[27]。半夏凝集素PTA能体外凝集恶性肿瘤细胞,诱导癌细胞凋亡[6]。加利福尼亚大学的L ubli等[28]的研究也表明,凝集素可以有效地抑制癌症的早期发展。
本试验成功地从盾叶半夏中克隆出盾叶半夏凝集素基因ppl的全长cDNA序列。该基因全长cDNA为1 504 bp,编码270个氨基酸,等电点(PI)和分子量分别为7.65,29.48 kDa。同源比对发现ppl与半夏属其他物种如滴水珠、掌叶半夏和半夏的凝集素基因cDNA序列具有较高的同源性。聚类分析同样证实盾叶半夏凝集素PPL与半夏凝集素PTA亲缘关系最近。对该基因编码的氨基酸序列进行分析发现,PPL具有3个α-D-甘露糖结合识别位点,其中第1,2位点与半夏属其他物种的凝集素蛋白如:PCA、PTA和PPA的序列完全一致,第3个位点存在一定的变异。已有研究表明,槲寄生凝集素不同亚型MLI和MLIII B之间氨基酸序列不同,对糖结合的特异性也发生了变化[29]。凝集素的抗虫活性与它和糖类可逆性结合能力密切相关。Zhu等[30]通过定点突变技术,使豆科植物的凝集素GASⅡ丧失与糖结合的能力,结果该凝集素丧失了抗虫活性。因此,盾叶半夏ppl基因这种结构上的差异是否是由于物种上的差别引起的,以及这种差别对甘露糖结合效力和抗虫作用的影响如何,还需要利用分子突变等方法进行进一步的试验研究。
通过ppl基因的原核表达和蛋白纯化,获得了重组PPL蛋白,凝血活性结果表明,重组PPL蛋白对兔血红细胞有凝集活性,而对鸡血红细胞无凝集活性。糖抑制试验结果表明,PPL凝集兔血红细胞的能力能被甘露糖完全抑制。因此,PPL是一种甘露糖结合凝集素。PPL体外抗癌活性试验研究结果表明,PPL对CNE、Hela和Bcap-37细胞的生长均具有抑制作用,其中对Hela细胞的抑制效果最好,当PPL浓度达到200μg/m L时对Hela细胞的生长抑制率可以达到72.31%。
本试验通过盾叶半夏凝集素基因的克隆、原核表达和蛋白纯化,获得了半夏凝集素基因ppl的全长cDNA序列和重组PPL蛋白。同时对PPL蛋白的凝血活性和单糖抑制活性及体外抗癌活性进行了研究,为进一步开展盾叶半夏凝集素对癌细胞表面糖抗原表型作用以及对癌细胞侵染转移的影响和甘露糖型凝集素的抗肿瘤研究奠定了理论基础。
[1] 中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1979:200-206.
[2] 蔡世珍,邹忠梅,徐丽珍,等.半夏属药用植物的研究进展[J].国外医学:中医中药分册,2004,26(1):17-24.
[3] 李燕娥,朱 祯,上官小霞,等.棉花转凝集素基因的研究进展[J].中国棉花,2004,31(6):5-6.
[5] Huang D F,Pan Y H,Zhang S X.The discovery of Insecti-Cidal proteinagainst aphids from Pinellia pedatisecta and P.ternate[J].Sci Agn Sin,1997,30(2):94-97.
[6] 秦宏伟.半夏生物技术研究概况[J].特产研究,2007,29(2):75-78.
[7] Yao JH,Sun X F,Tang K X.Molecular cloning of lectin gene from Pinellia ternata[J].Journal of Fudan University,2001,40(4):461-464.
[8] 张红宇,吴先军,唐克轩,等.半夏凝集素基因(pta)导入水稻及其表达的初步研究[J].遗传学报,2003,30(11):1013-1019.
[9] 范媛媛,庞永珍,吴为胜,等.双价抗虫植物表达载体p3300-bt-pta的构建及转基因烟草的初步检测[J].上海交通大学学报:农业科学版,2004,22(1):1-6.
[10] Yang Y Z,Wei M.Increased oriental arm yw Orm and aphidresistance in transgenic wheat stably expressing Bacillus thuringiensis(Bt)endotoxin and Pinellia ternate agglutinin(PTA)[J].Plant Cell Tiss Organ Cult,2008,94:33-44.
[11] Yao J,Pang Y,Qi H,et al.Transgenic tobacco expressing Pinellia ternata agglutinin confers enhanced resistance to aphids[J].Transgenic Research,2003,12(6):715-722.
[12] Lin J,Zhou X,Gao S,et al.cDNA cloning and expression analysis of a mannose-binding lectin from Pinellia pedatisecta[J].Journal of Biosciences,2007,32(2):241-249.
[13] 李晓静,李志宏,王玉芹,等.掌叶半夏研究概况[J].中医药信息,2004,21(1):16-18.
[14] Lin L,Lu J,Zeng H,et al.Molecular cloning and characterization of a mannose-binding lectin gene from Pinellia cordata[J].Molecular Biology Reports,2008,35(4):641-647.
[15] 赵 静,彭正松,杨在君,等.半夏属植物凝集素基因片段克隆与序列分析[J].西华师范大学学报:自然科学版,2011,32(1):7-11,41.
[16] Jiang JF,Han Y,Xing L J,et al.Cloning and expression of a novel cDNA encoding amannose-specific jacalin-related lectin from Oryza sativa[J].Toxicon:Official Journal of the International Society on Toxinology,2006,47(1):133-139.
[17] 张正英.半夏凝集素基因的克隆与氨基酸序列初步分析[J].中草药,2012,43(9):1818-1823.
[18] Lis H,Sharon N.The biochemistry of plant lectins(phytohemagglutinins)[J].Annual Review of Biochemistry,1973,42(0):541-574.
[19] 马员春,马维亮,宋晓华,等.植物凝集素在作物转基因中的利用现状[J].宁夏农林科技,2010(3):60-62.
[20] 梁 峰,刘秀花,刘 茵,等.转菊芋凝集素基因烟草的抗蚜性研究[J].河南农业科学,2004(2):16-19.
[21] 张林水,朱 祯,上官小霞,等.转菊芋凝素基因棉花研究初报[J].山西农业科学,2005,33(4):22-23.
[22] 李明想,柏素花,张玉刚,等.苹果甘露糖结合凝集素基因的克隆及表达分析[J].华北农学报,2013,28(6):36-41.
[23] Xu H L,Li C Y,He X M,et al.Molecularmodeling,docking and dynamics simulations of GNA-related lectins for potential prevention of Influenza virus(H1N1)[J].Journal of Molecular Modeling,2012,18(1):27-37.
[24] Liu B,Cheng Y,Zhang B,et al.Polygonatum cyrtonema lectin induces apoptosis and autophagy in human melanoma A375 cells through a mitochondria-mediated ROS-p38-p53 pathway[J].Cancer Letters,2009,275(1):54-60.
[25] 鲍锦库.植物凝集素的功能[J].生命科学,2011,23(6):533-540.
[26] 王海燕,白晓春,罗深秋.植物凝集素与医学应用[J].生命的化学,2003,23(3):224-226.
[27] Lei H Y,Chang C P.Induction of autophagy by concanavalin A and its app lication in anti-tumor therapy[J].Autophagy,2007,3(4):402-404.
[28] L ubli H,Pearce O M,Schwarz F,et al.Engagement of myelomonocytic siglecs by tumor-associated ligandsmodulates the innate immune response to cancer[J].Proceedings of the National Academy of Sciences of the U-nited States of America,2014,111(39):14211-14216.
[29] Pevzner IB,Agapov I I,Niwa H,et al.Differences in amino acid sequences ofmistletoe lectin I and III B-subunits determining carbohydrate binding specificity[J]. Biochimica et Biophysica acta,2004,1675(1/3):155-164.
[30] Zhu-Salzman K,Shade R E,Koiwa H,et al.Carbohydrate binding and resistance to proteolysis control insecticidal activity of Griffonia simplicifolia lectin II[J].Proceedings of the National Academy of Sciences of the United States of America,1998,95(25):15123-15128.
C loning and Functional Analysis of the Lectin Gene in Pinellia peltata
YANG Zaijun1,LIU Lingling1,2,PENG Zhengsong1
(1.College of Life Science,China West Normal University,Key Laboratory of Southwest China W ildlife Resources Conservation,Ministry of Education,Nanchong 637009,China;2.Bioengineering College,Chongqing University,Key Laboratory of Biorheological Science and Technology,Ministry of Education,Chongqing 400044,China)
To clone a lectin gene from Pinellia peltata and analyze its bioactivity.A lectin gene,designated as ppl,was cloned by using RACE in Pinellia peltata.The open reading frame(ORF)of P.peltata lectin(ppl)was constructed into the pET-28a vector.A recombinant protein about33 kDa in the Escherichia coli BL21 was induced. The purified recombinant protein was used blood coagulation experiment and anticancer experiment in vitro.The full-length cDNA of ppl was1 504 bp,and contained an 813 bp ORF with a deduced amino acid sequence of270 residues.The putative PPL protein contained three mannose binding site.The PPL had clotting activity,and this activity could be inhibited by mannose.The result of anticancer experiment in vitro showed that the PPL could inhibit the growth of nasopharyngeal carcinoma cell(CNE),human cervical carcinoma cell(Hela)and human breast cancer cell(Bcap-37).These results were useful for further determination of the function of P.peltata lectin protein(PPL).
Pinellia peltata;Lectin;Gene cloning;Functional analysis
Q78 文献标识码:A 文章编号:1000-7091(2016)03-0032-06
10.7668/hbnxb.2016.03.005
2016-03-12
西华师范大学博士科研启动项目(11B017)
杨在君(1981-),男,四川南充人,副教授,博士,硕士生导师,主要从事植物资源与分子生物学研究。杨在君、刘玲玲为同等贡献作者。
