应用小室模型再生毛发的实验研究
2016-07-25杨颖杨志岗肖苒
杨颖 杨志岗 肖苒
应用小室模型再生毛发的实验研究
杨颖杨志岗肖苒
【摘要】目的建立毛囊重建小室模型,并应用该模型进行毛发再生实验研究。方法制备小室模型,分离C57BL/6新生小鼠的表皮和真皮细胞,混合后注入小室内。7 d后拆除小室,并观察创口部位的毛发再生情况。30 d后对创口部位皮肤取材,行HE染色,观察其形态结构。结果裸鼠小室植入部位创面愈合并可见毛发再生,新生毛发大体观和镜下观与正常毛发无明显差异,且排列极性、生长密度良好。对部分无毛发再生的创面进行分析,发现模型构建过程中小室植入的位置对毛囊再生具有重要的影响。结论应用小室模型和新生鼠表皮真皮细胞可以成功实现毛发再生,小室模型是一种可用于毛囊再生研究的良好动物模型,且小室的植入位置对该模型的成功与否具有重要影响。
【关键词】毛发再生毛囊重建小室模型
秃发是一种常见的毛发疾病,实现毛发的高效再生是解决该问题的根本途径。建立一个有效稳定的毛发再生模型,对于阐明毛发再生机制和影响因素具有重要意义。小室模型是毛发再生研究中的常用动物模型,并具有毛发结构、密度接近正常毛发的优点[1]。本研究采用小室模型和新生鼠表皮、真皮细胞进行毛发再生实验,并评估小室模型的稳定性。
1 材料与方法
1.1实验动物
新生C57BL/6小鼠15只 (0~2 d),5~6周龄雌性Balb/c裸鼠30只,由北京维通利华公司提供。所
1.2主要试剂
Ⅰ型胶原酶、DNaseⅠ(Sigma,美国);中性蛋白酶(UBIO,美国);胰酶、DMEM(Hyclone,美国);FBS (Gibco,美国)。
1.3模型制备方法
1.3.1分离真皮细胞和表皮细胞
获取15只C57BL/6新生小鼠的皮肤,浸泡于2倍体积的0.25%中性蛋白酶中,4℃消化2 h。分别分离表皮和真皮。真皮组织用0.2%Ⅰ型胶原酶37℃消化1.5 h后再经DNaseⅠ (终浓度为0.1 mg/mL)继续消化30 min,消化完毕后筛网过滤,细胞经离心后重悬计数。表皮组织用0.25%胰酶37℃消化10 min,经中和后筛网过滤,离心并计数。1.3.2小室动物模型制备
将直径约1 cm精油瓶内塞(聚乙烯)倒置,中间钻一小孔,75%乙醇消毒备用;30只裸鼠经腹腔麻醉后,各在背部制备一直径约1 cm的全层皮肤缺损创面,将小室植入,并缝合小室周边皮肤以固定。取1×107个真皮细胞和5×106个表皮细胞,用100 μL DMEM重悬并注入小室内。共制备30个小室模型,术后第7天将小室取出,医用凡士林敷料覆盖创面。
2 结果
2.1新生鼠表皮和真皮细胞的分离和培养
获得足够的表皮细胞和真皮细胞是构建小室模型的基本条件。通过对多个批次和不同数量的新生鼠获得的表皮和真皮细胞进行计数统计,发现新生鼠可获取的表皮细胞数量平均为 (3.158±1.310)×106个,真皮细胞为(13.32±2.831)×106(图1)。细胞经接种培养后,第1天可见表皮细胞和真皮细胞均有不同程度的贴壁,随着培养时间延长贴壁细胞逐渐增多,真皮细胞呈长梭形,符合典型成纤维样细胞特点,表皮细胞呈典型铺路石样,符合典型上皮样细胞特点(图1)。
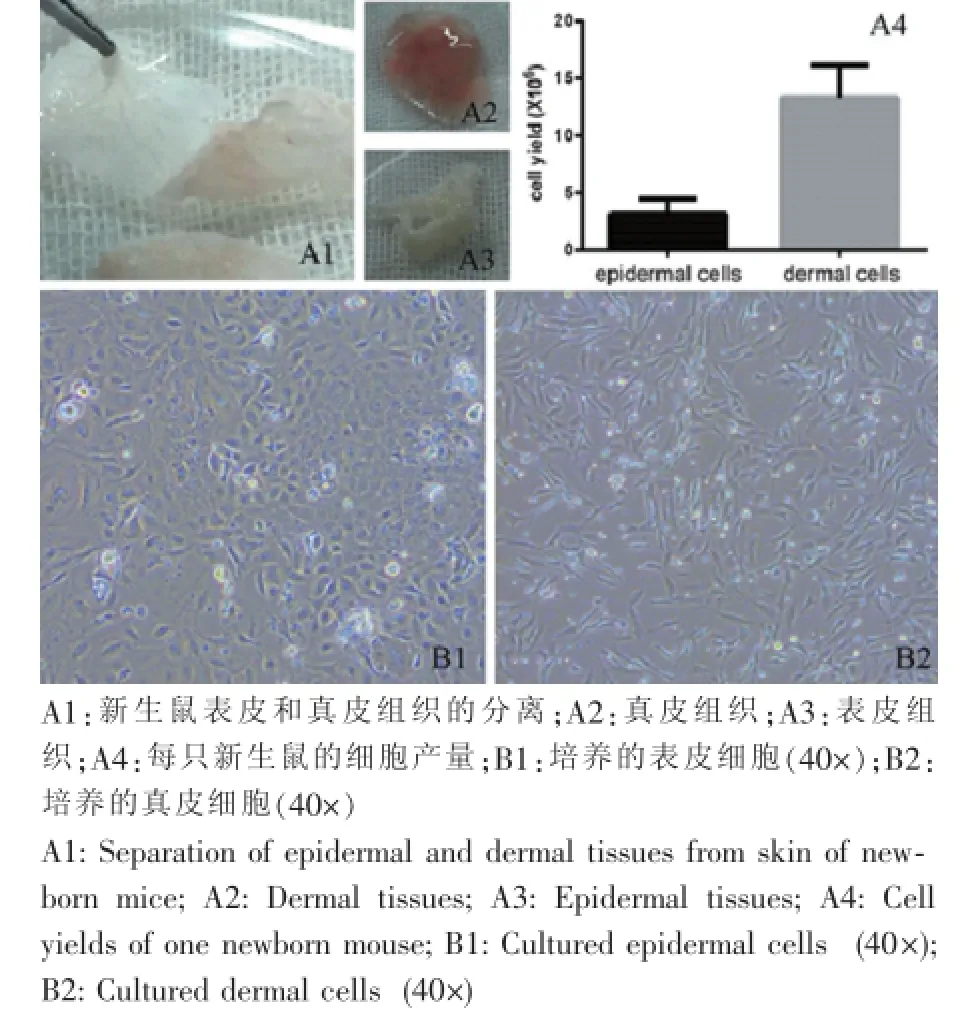
图1 新生鼠表皮和真皮细胞的分离、培养Fig.1 Isolation and culture of epidermal and dermal cells from newborn mice
2.2小室模型的建立及毛发再生的观察
术后7 d拆除小室,见创面边缘有红色肉芽组织,表面偶可见膜状细胞聚集物(图2)。术后10~12 d皮肤创面基本愈合,与正常部位皮肤相比颜色较深。术后16~20 d,多数裸鼠愈合创面有毛发突出体表,随着时间的延长,可见毛发数量和长度明显增加,且极性好、排列整齐;部分裸鼠愈合创面可见瘢痕形成,与正常皮肤颜色接近或部分皮肤颜色变深,但均无毛发长出(图3)。实验过程中我们发现,小室植入位置如靠近尾部,其在生长过程中容易被裸鼠啃咬,创面虽能愈合但无毛发再生;相反,靠近头部位置植入的小室则很难被裸鼠咬到,创口部位一般均有毛发再生,再生毛发致密(图3)。
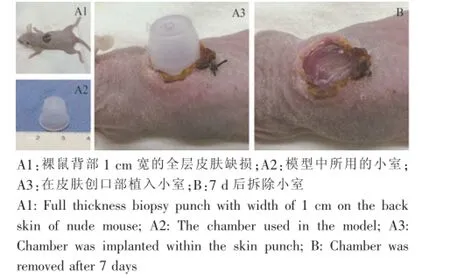
图2 小室的植入和拆除Fig.2 The implantation and removal of chamber
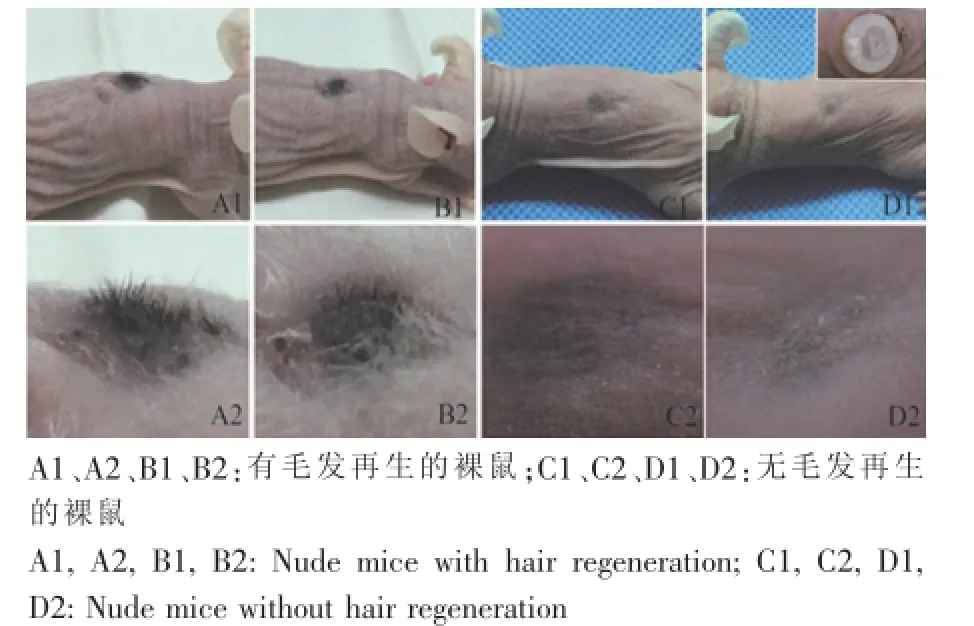
图3 应用小室模型毛发再生情况和小室植入位置对毛发再生的影响Fig.3 Hair regeneration by chamber assay and the effect of chamber implantation sites on the regeneration of hair
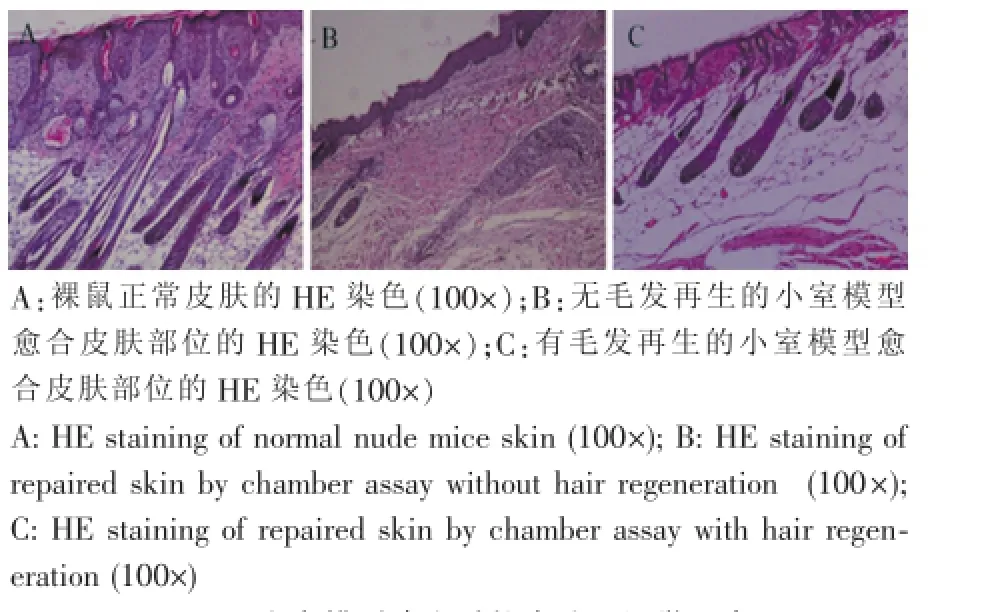
图4 小室模型建立后的皮肤组织学观察Fig.4 Histological observation of regenerated skin by chamber assay
2.3创面愈合后皮肤的组织形态学观察
伴有毛发再生的创面皮肤经HE染色后,镜下可观察到结构完整的毛囊,可见完整的毛干;对于无毛发再生的愈合创面,镜下可见皮肤组织中毛囊结构稀少,平行于表皮的大量胶原纤维束形成瘢痕组织(图4)。
3 讨论
小室模型采用双层硅胶小室,先将下层小室植入裸鼠背部,然后将表皮和真皮细胞混合后注入小室中,而后再盖上上层小室以保护添加至创面上的表皮和真皮细胞[2-3];2008年,Lichti等[4]对该模型进行了改进,进一步简化了小室的结构。相较于皮下注射法和皮瓣法等毛发再生模型,小室模型再生的毛发在质量、密度以及组织形态学结构上与正常毛发更为接近[1,5]。本实验中,我们采用聚乙烯瓶内塞作为小室,成功地构建了该模型并实现了毛发的再生,进一步验证了该模型的可靠性。
我们在模型制备过程中发现,小室植入位置对动物模型成功率和稳定性具有重要影响。小室植入部位如靠近尾部,创面愈合后基本无毛发再生;而靠近头部位置植入的小室,伴随着创口的愈合,毛发的数量和长度明显增加。我们观察发现,近尾部植入的小室容易在植入第2天被裸鼠啃咬,使得细胞暴露于空气中,丧失了小室的保护作用,植入细胞的活性可能因此受到不同程度的影响。从而出现了不同的创面愈合情况,如有的创面基本无植入细胞参与,愈合后皮肤色泽与裸鼠其他部位皮肤无异;有的创面愈合后则有明显的黑色素沉着,与毛发再生部位皮肤相类似。靠近头部植入的小室创面愈合后均有毛发再生,其主要原因在于该部位小室无破损现象发生,更好地保护了植入的细胞,并且在拆除小室时可观察到膜样的新生组织。之前的报道对小室植入位置的研究较少,有学者为了保护植入的小室,曾应用金属线网覆盖在小室表面以免小室被裸鼠啃咬[6]。我们通过改变植入位置即可达到保护小室的目的,进一步简化了该模型的制备流程并提高了成功率。
毛囊再生是表皮细胞和真皮细胞相互作用的结果,不同的研究在毛囊再生小室模型构建中采用了不同来源的真皮和表皮细胞。其中,真皮细胞主要包括胎鼠[6]和新生鼠[2,7-8]来源的真皮细胞、成鼠毛乳头细胞[8-13]、成纤维细胞[13]等,表皮细胞包括胎鼠[6]和新生鼠[9-12]来源的表皮细胞,以及成鼠外根鞘细胞[13]等。研究表明,胎鼠和新生鼠真皮细胞、成鼠毛乳头细胞与表皮细胞混合后均可使毛发再生,这些细胞经培养后毛发再生能力减弱,而成纤维细胞则不具备毛发再生能力[2,8]。我们应用新鲜分离的新生鼠真皮和表皮细胞实现了毛发的再生,与之前文献研究结果一致。新生鼠真皮和表皮细胞均为异质性细胞群体,真皮细胞中包含了毛乳头细胞、成纤维细胞、血管内皮细胞等,表皮细胞则包含了不同发育阶段的表皮细胞以及毛囊源性表皮细胞[2,8]。小室模型为细胞的毛囊再生能力研究提供了一个非常好的模型,借助该模型对新生鼠真皮和表皮细胞中不同类型的细胞群体进行更为深入的研究,有利于进一步阐明毛发再生的机制。
参考文献
[1]Liang Y,Silva KA,Kennedy V,et al.Comparisons of mouse models for hair follicle reconstitution[J].Exp Dermatol,2011,20 (12):1011-1015.
[2]Lichti U,Weinberg WC,Goodman L,et al.In vivo regulation of murine hair growth:insights from grafting defined cell populations onto nude mice[J].J Invest Dermatol,1993,101(1 Suppl):124S-129S.
[3]Yang CC,Cotsarelis G.Review of hair follicle dermal cells[J].J Dermatol Sci,2010,57(1):2-11.
[4]Lichti U,Anders J,Yuspa SH.Isolation and short-term culture of primary keratinocytes,hair follicle populations and dermal cells from newborn mice and keratinocytes from adult mice for in vitro analysis and for grafting to immunodeficient mice[J].Nat Protoc,2008,3(5):799-810.
[5]Balana ME,Charreau HE,Leiros GJ.Epidermal stem cells and skin tissue engineering in hair follicle regeneration[J].World J Stem Cells,2015,7(4):711-727.
[6]Yuspa SH,Morgan DL,Walker RJ,et al.The growth of fetal mouse skin in cell culture and transplantation to F1 mice[J].J Invest Dermatol,1970,55(6):379-389.
[7]Blanpain C,Lowry WE,Geoghegan A,et al.Self-renewal,multipotency,and the existence of two cell populations within an epithelial stem cell niche[J].Cell,2004,118(5):635-648.
[8]Weinberg WC,Goodman LV,George C,et al.Reconstitution of hair follicle development in vivo:determination of follicle formation, hair growth,and hair quality by dermal cells[J].J Invest Dermatol, 1993,100(3):229-236.
[9]Kishimoto J,Ehama R,Wu L,et al.Selective activation of the versican promoter by epithelial-mesenchymal interactions during hair follicle development[J].Proc Natl Acad Sci U S A,1999,96 (13):7336-7341.
[10]Rendl M,Polak L,Fuchs E.BMP signaling in dermal papilla cells is required for their hair follicle-inductive properties[J]. Genes Dev,2008,22(4):543-557.
[11]Kishimoto J,Burgeson RE,Morgan BA.Wnt signaling maintains the hair-inducing activity of the dermal papilla[J].Genes Dev, 2000,14(10):1181-1185.
[12]Shimizu H,Morgan BA.Wnt signaling through the beta-catenin pathway is sufficient to maintain,but not restore,anagen-phase characteristics of dermal papilla cells[J].J Invest Dermatol, 2004,122(2):239-245.
[13]Gharzi A,Reynolds AJ,Jahoda CA.Plasticity of hair follicle dermal cells in wound healing and induction[J].Exp Dermatol, 2003,12(2):126-136.
【中图分类号】Q813.1+2
【文献标识码】A
【文章编号】1673-0364(2016)03-0160-03
doi:10.3969/j.issn.1673-0364.2016.03.004
作者单位:100144北京市中国医学科学院整形外科医院研究中心。
通讯作者:杨志岗(E-mail:yzg365cn@163.com)。有实验动物均为SPF级,层流室内饲养。
收稿日期:(2016年3月12日;修回日期:2016年3月28日)
The Research of Hair Regeneration by Chamber AssayYANG Ying,YANG Zhigang,XIAO Ran.Research Center, Plastic Surgery Hospital,CAMS,Beijing 100144,China.Corresponding author:YANG Zhigang(E-mail:yzg365cn@163.com). 【Abstract】ObjectiveTo establish a hair reconstitution chamber model for experimental study of hair regeneration. MethodsEpidermal and dermal cells from newborn C57BL/6 mice were isolated,mixed and injected into the chambers.7 days after the removal of the chambers,hair regeneration at the wound site was continually observed.At 30 days,the skin of wound sites was obtained and HE staining was performed to observe the morphological structures.ResultsWound healing and hair regeneration were observed at chamber implantation site,the regenerated hair had no significant difference from normal skin,with well-maintained polarity and density.By analyzing the wound sites without hair regeneration,we found that chamber implantation sites have great influence on hair regeneration.ConclusionNewborn epidermal and dermal cells can successfully regenerate hair by chamber assay,chamber assay is a good animal model for hair regeneration,and chamber implantation sites play an important role in the success foundation of chamber model.
【Key words】Hair regeneration;Hair follicle reconstitution;Chamber model
