MSCs在缺氧状态下的基因差异性表达
2016-07-25徐梁白珊珊段惠川余东
徐梁 白珊珊 段惠川 余东
MSCs在缺氧状态下的基因差异性表达
徐梁白珊珊段惠川余东
【摘要】目的探讨MSCs在缺氧环境中细胞生物学特性及相关生长因子的变化,为修复组织损伤提供临床应用依据。方法体外进行MSCs缺氧处理,免疫荧光染色观察细胞特性,RT-PCR检测VEGF、bFGF、TGF-β和IL-1α基因,从细胞分化、生长因子和细胞信号通路等方面,来探讨MSCs在缺氧环境下发生的转变。结果MSCs经1%O2缺氧培养24 h后,镜下观察示细胞成活良好,未见形态、生长方式等发生明显变化。免疫荧光及双荧光染色观察缺氧处理24 h的MSCs有向内皮细胞,特别是血管内皮转化的趋势。VEGF、bFGF、TGF-β和IL-1α在缺氧处理后的MSCs中表达均增强,而未经缺氧处理的MSCs相关因子表达微弱。结论在缺氧的环境下,MSCs可向血管内皮细胞方向分化,并且与促进血管形成和生长相关的VEGF、bFGF、TGF-β和IL-1α基因表达均增强,可直接或间接促进损伤组织的血管化。
【关键词】间充质干细胞基因表达血管化缺氧培养
间充质干细胞 (Mesenchymal stem cells,MSCs)是具有自我更新与多向分化潜能的成体干细胞,可分化为骨、软骨、肌肉、脂肪、真皮、神经等多种组织,干细胞移植可广泛应用于各种组织损伤,包括心肌缺血及缺血再灌注损伤[1]、急性肾衰竭[2]、肺损伤[3]、皮瓣修复[4]等。早期研究发现,组织损伤所造成的缺
1 材料与方法
1.1材料
实验动物:4周龄的Wistar雄性大鼠,体质量约200 g(中国科学院上海实验动物中心提供)。
试剂:DMEM-LG培养液(Gibco,美国);PBS、FBS (HYCLONE,美国);胰酶、FITC-UEA-1(Sigma,美国);青霉素,链霉素(Gibco,美国);RT-PCR试剂盒(Takara,日本);引物合成(上海博迈生物技术公司);FITC、PE、CD45,CD90(eBioscience,美国);Ⅷ因子(Abcam,美国);DiI-ac-LDL(Molecular Probes,美国)。
仪器:低氧培养箱(Binder,德国);定量PCR扩增仪(Stratagene,美国);荧光显微镜(Nikon,日本)。1.2方法
1.2.1MSCs的分离、培养与传代
4周龄Wistar雄性大鼠处死后,75%乙醇浸泡30 min;移至超净台中,无菌条件下获取两侧股骨和胫骨,剔除软组织。用2 mL注射器抽取DMEM-LG培养液,反复冲洗骨髓腔,冲出骨髓,所得悬液以200目钢网过滤,置于50 mL离心管中,1 500 r/min离心5 min后弃上清,PBS(含2%FBS)5 mL重悬,充分吹打,将悬液缓慢地叠加到预先装有5 mL Percoll细胞分离液(密度为1.077 g/mL)的15 mL离心管上层,2 200 r/min离心30 min,小心吸取分离介质之间白色混浊带,将其移入新的50 mL离心管中,加入PBS,震荡混合均匀后,离心去上清,如此反复洗涤2遍。以DMEM-LG全培养基(含10%FBS,100 U/mL青霉素,100 U/mL链霉素)重悬,定容至10 mL,吸取30 μL细胞悬液与台酚蓝染液对比稀释后,在计数板上计数并检查细胞活力。
加入DMEM-LG全培养基,以5×106cells/mL密度接种于10 cm培养皿中,在37℃、5%CO2正常氧分压的饱和湿度培养箱内原代培养,4 d后首次换液,去除非贴壁细胞,以后每2~3天换液1次。
细胞生长达到80%~90%融合时,进行传代,吸除培养液,PBS洗涤2遍,吸尽后加入约1 mL 0.05%胰酶消化液,镜下观察细胞出现收缩后,一般约在10 sec左右,加入含10%FBS的DMEM-LG培养液3 mL终止消化,以头部装有细胶管的细胞刮子轻轻地将培养皿底部的细胞刮下,收集在50 mL离心管中,1 500 r/min离心 5 min后弃上清,以DMEM-LG培养基重悬,定容至10 mL,吸取30 μL细胞悬液与台酚蓝染液对比稀释后,在计数板上计数并检查细胞活力。加入适量的DMEM-LG培养液,按1∶4的比例接种,进行传代培养。
在倒置相差显微镜下连续观察MSCs的原代和传代培养的贴壁时间、生长特点、细胞形态、基质分泌和融合程度。
1.2.2MSCs的鉴定
收获第3代的MSCs,消化后过滤制成单细胞悬液,将细胞悬液中分别依次加入CD45、CD90。4℃环境下,避光,培育30 min,PBS冲洗后移入冰盒,进行流式细胞仪检测。
1.2.3细胞缺氧培养
取传代24 h后的第3代的MSCs,置于37℃、5%CO2、1%O2、饱和湿度的缺氧培养箱内培养24 h。
1.2.4免疫学方法
进行细胞的Ⅷ因子免疫组化,激光共聚焦荧光显微镜观察细胞的Flk-1免疫荧光。
1.2.5双荧光染色测定
分别取缺氧处理和正常培养的第3代MSCs消化传代至24孔板中,24 h后进行Dil-ac-LDL和FITC-UEA-1双荧光染色。细胞在含10 μg/mL Dilac-LDL的培养液中避光孵育10 h,4%中性甲醛固定10 min,PBS漂洗,加10 μg/mL FITC-UEA-1避光孵育1 h。PBS再次漂洗,荧光显微镜观察,显示红色荧光的为ac-LDL阳性细胞,绿色荧光的为UEA-1阳性细胞,双荧光阳性的细胞则为黄色。最后,为观察细胞阳性数,将细胞核染成蓝色。
1.2.6RT-PCR检测方法
分别抽提缺氧培养和正常培养的MSCs的总RNA。根据研究需要,确定需检测的基因为:VEGF、bFGF、TGF-β和IL-1α。在GENEBANK查出其gi号和mRNA全序列。在Primer软件上设计引物,引物设计完毕后,进行BLAST验证,得出最佳引物(内参为β-actin,长度为592 bp)。PCR反应后应用Gel-Pro Imager Kit凝胶图像处理系统在紫外光下观察VEGF、bFGF、TGF-β、IL-1α的表达(表1)。
2 结果
2.1倒置显微镜观察
MSCs经1%O2的缺氧培养24 h,镜下观察细胞成活良好,未见形态、生长方式等的明显变化(图1)。
2.2MSCs的流式细胞学鉴定
流式细胞鉴定所培养贴壁细胞为 CD45-、CD90+,符合MSCs特点,细胞纯度80%以上(图2)。
2.3免疫组化及免疫荧光观察
缺氧处理24 h的MSCs,其Ⅷ因子及Flk-1表达为阳性,而正常培养的MSCs则未见表达,表明MSCs在缺氧的状态下有向内皮细胞,特别是血管内皮转化的趋势(图3,4)。
2.4双荧光染色
Dil-ac-LDL和FITC-UEA-1双荧光染色发现,缺氧处理的MSCs很多表现为双荧光染色阳性,在荧光显微镜下呈现红加绿合成的黄色(图5),而正常培养的第3代MSCs很少出现双荧光阳性表现。针对ac-LDL的吞噬功能是内皮细胞的特点,双荧光染色阳性往往作为血管内皮祖细胞的一个特性,结果提示MSCs在缺氧的环境下可能向血管内皮祖细胞或血管内皮细胞进行了分化。
2.5RT-PCR检测结果
选取VEGF、bFGF、TGF-β、IL-1α作为检测指标,以592 bp β-actin为内参,进行缺氧处理和正常培养MSCs的上述目的基因检测。结果表明,VEGF、bFGF、TGF-β、IL-1α在缺氧处理的MSCs中有程度不同的表达,其中 IL-1α和 TGF-β表达较强,VEGF、bFGF表达增强;而正常培养的MSCs中,IL-1α未表达,VEGF、bFGF、TGF-β表达微弱(图6,7)。

表1 引物序列Table 1 Primer sequence

图1 倒置相差显微镜下原代接种24 h的MSCs(100×)Fig.1 P0 MSCs after 24 hours under inverted microscope(100×)

图2 MSCs流式细胞学鉴定Fig.2 Identification of MSCs by flow cytometry

图3 Ⅷ因子免疫组化染色(100×)Fig.3 Immunohistochemical staining of Ⅷfactor(100×)

图4 Flk-1免疫荧光(100×)Fig.4 Immunofluorescence staining of Flk-1(100×)
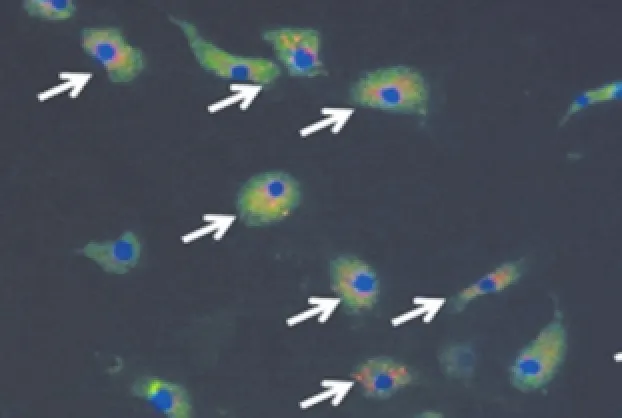
图5 双荧光染色(100×)Fig.5 Double immunofluorescence staining(100×)

A:IL-1α;B:β-actin图6 IL-1α在缺氧和未缺氧MSCs的表达Fig.6 Expression of IL-1α in MSCs under hypoxia and normaxia

图7 TGF-β、VEGF和bFGF在缺氧和未缺氧MSCs的表达Fig.7 TGF-β,VEGF and bFGF in MSCs under hypoxia and normaxia
3 讨论
目前,组织修复方法有很多,包括干细胞移植、生长因子修复、基因治疗、激光物理治疗和生物材料修复等多种方法。近年来,MSCs因其来源广泛、获取便利、扩增迅速、高可塑性等特点,被广泛应用于各种损伤组织的修复。Ichioka等[6]将BMSCs于术后即刻皮下注射至小鼠背部任意皮瓣,随后制造缺血再灌注模型,7 d后皮瓣的成活面积明显增加,皮下、肌肉层下的肉芽组织厚度增加,荧光显微镜下观察到移植的细胞出现在血管壁结构中。Kobayashi等[7]发现,BMSCs移植到鼠心肌缺血模型后,可分泌多种促血管生成因子并向内皮细胞分化,表明MSCs移植后可有效抑制损伤组织细胞凋亡、刺激细胞增殖和促进微血管再生。
利用MSCs移植修复成功的关键包含许多因素,其中损伤部位的微环境尤为重要,包括损伤部位生长因子的分泌、血液循环、渗透压和氧浓度等[8]。从生命起源、胚胎发育过程来看,MSCs均是在低氧(相对体外环境)微环境中生存的,所以细胞在体内的氧张力是低于大气中的氧张力的,同时机体病理状态下组织氧张力将更低。一方面,缺血缺氧条件下,由于营养物质和氧气的供给不足,会导致MSCs死亡和移植治疗的失败[9],另一方面,近20年来,越来越多研究发现,低氧培养下的MSCs细胞增殖速率加快[10],凋亡率降低,细胞迁移速度加快。目前,多认为低氧环境是通过调控缺氧诱导因子(HIFs)来影响细胞生长、生存、分化、增殖、凋亡等[11]。研究显示,低氧处理后的MSCs用于治疗损伤的肠上皮细胞时,可增加其生存及增殖能力[12]。Forte等[13]发现,在低氧环境下,MSCs可激活cMet蛋白,通过介导肝细胞生长因子,激活ERK1/2、p38有丝分裂原激活蛋白酶及PI3K/Akt信号通路,增强组织再生能力。Tawa等[14]发现,缺氧环境下MSCs可通过缺氧诱导因子(Hypoxia-inducible factor,HIF)增加血管内皮生长因子的表达来促进血管生成。这些均说明MSCs在低氧条件下被应用于组织修复时,不仅使得自身增殖能力增加,并可促进血管新生。同时,低氧也是血管生成的重要诱因之一[15],表现为细胞的增殖能力增强,同样培养时间下,细胞数量较正常高一倍左右;趋化和移行能力增强;成血管功能增强等[16]。
低氧培养的MSCs使得损伤部位局部血管化增强的同时,与血管形成相关的生长因子必然会有所改变。免疫组化及免疫荧光发现,缺氧处理24 h的 MSCs,其Ⅷ因子及Flk-1表达阳性。Flk-1也被称为VEGFR-2(Vascular endothelial growth factor receptor),是一种Ⅲ型跨膜蛋白激酶,属于酪氨酸激酶受体,主要表达在血管内皮细胞上,介导内皮细胞的增殖。Vladau等[17]通过抑制VEGF/VEGER作用,发现牙周组织血管内皮细胞数量减少,血管密度降低,损伤加重。Shalaby等[18]发现,Flk-1基因敲除小鼠由于造血和血管内皮细胞发育的缺陷,死于胚胎发育的8.0~8.5 d,均提示Flk-1对于血管内皮细胞的分化和增殖是必不可少的。Ⅷ因子是由内皮细胞分泌的凝血因子,也可作为内皮细胞的标志物,两者阳性表达说明MSCs在缺氧的状态下有向内皮细胞,特别是血管内皮转化的趋势。内皮祖细胞吞噬低密度脂蛋白(ac-LDL)是其重要的生物学功能之一,既往研究常以吞噬Dil标记乙酰化低密度脂蛋白能力作为鉴定内皮祖细胞的一个重要指标。本实验中,Dilac-LDL和FITC-UEA-1双荧光染色发现,缺氧处理的MSCs很多表现为双荧光染色阳性,说明其在缺氧状态下很可能向内皮细胞或者内皮祖细胞转化。
VEGF是目前公认的最具特异性,且作用最强的内源性血管生成因子,它必须与受体结合,才能实现其促血管内皮细胞有丝分裂的作用。在体外,VEGF是强有力的内皮细胞的有丝分裂原,在培养的内皮细胞中,VEGF可激动磷脂酶C、诱导Ca2+水平上调,刺激内皮细胞释放von Willebrand因子,诱导组织对VEGF的活性表达。VEGF的分泌还影响血管内皮细胞的增殖及毛细血管网的形成。RTPCR发现,VEGF表达增加,作为血管化最具有代表性的因子,说明缺氧处理后的MSCs可使得组织血管化作用增强。有研究表明,MSCs移植可以上调局部VEGF的表达,VEGF水平上调可直接刺激内皮细胞的扩增与分化。目前已证实,VEGF主要通过VEGF受体2(即Flk-1)促进内皮细胞的移行能力,而低氧可增加内皮细胞的Flk-1表达[19]。研究发现,利用20%胎牛血清和5%O2培养MSCs后,其表达的VEGF-A增加,这和我们的实验结果一致。VEGF表达的增强可进一步刺激内皮细胞生长,促进新生血管生成,有利于损伤和疾病恢复。但是,也有报道认为,单纯使用VEGF或VEGF基因治疗可能引起血管通透性增加、下肢水肿或局部血管过度增生等。
本实验发现,在缺氧刺激下,MSCs的TGF-β的mRNA表达上调明显。TGF-β不仅对血管新生和组织创伤有重大意义,还抑制T细胞活化,减轻免疫反应。Sanchez-Elsner等[20]发现,低氧环境下TGF-β可协同VEGF的表达来刺激血管生成。所以缺氧很可能通过刺激TGF-β和VEGF的表达,增加两者间的协调作用来加强血管化作用。将脐带来源间充质干细胞在缺氧条件下培养,发现TGF-β表达也增强[21],与我们的结果是一致的。我们认为,经缺氧处理后的MSCs的TGF-β表达增加可以促进组织损伤的血液循环,治疗与缺血相关的疾病。
同时,IL-1α也明显上调。IL-1是一种强烈的促炎细胞因子,除调节T细胞和B细胞介导的免疫功能外,还作用于中性粒细胞、巨噬细胞及血管内皮细胞,在炎症反应和炎症损伤中起着重要作用,炎症反应或炎症损伤可诱使组织自身合成IL-1,通过自分泌或旁分泌的形式,使组织损伤加重。但IL-1还是重要的调节因子,可同时调节其他生长因子的表达。因此,IL-1在损伤中的作用可能是双向性的。研究发现,IL-1α可通过刺激炎症细胞和血管内皮细胞之间的VEGF-VEGFR-2信号通路诱发血管形成,表明其自身主要作用是增加炎症反应,但同时可通过调节其他因子来诱发血管形成。利用低氧培养的人脐带间充质干细胞修复小鼠后肢缺血肌肉时,发现炎症因子IL-1、IL-12减少,说明IL-1的变化可能与细胞的培养方式,低氧处理时间长短,体内外环境的不同或者细胞来源有关。
将MSCs移植在受损皮肤中,发现MSCs可分化为真皮成纤维细胞,或通过其合成、分泌促进伤口愈合的细胞因子,如TGF-β和bFGF,然后合成胶原,通过其增殖、收缩等一系列活动,促进伤口愈合。另外,人们应用bFGF可以促进缺血皮瓣的血管生长,增强细胞对缺血缺氧的耐受,减轻皮瓣的缺血再灌注损伤。本实验研究发现,其表达增强,说明bFGF在低氧条件下的表达升高可以刺激血管内皮细胞增殖和管腔形成,Naaldijik等[22]还发现bFGF可促进低氧培养下MSCs的细胞迁移。
综上所述,我们发现缺氧处理后的MSCs有向血管内皮细胞或者内皮祖细胞分化的趋势;另外,缺氧可刺激MSCs的VEGF、bFGF、TGF-β和IL-1α的表达,表明缺氧处理后的MSCs可通过上调血管因子的表达,来促进损伤组织血管化的形成,提高了组织对缺血的耐受能力,有利于组织损伤的修复及缺血缺氧相关疾病的治疗。
参考文献
[1]Chen P,Wu R,Zhu W,et al.Hypoxia preconditioned mesenchymal stem cells prevent cardiac fibroblast activation and collagen production via leptin[J].PLoS One,2014,9(8):e103587.
[2]Yao W,Hu Q,Ma Y,et al.Human adipose-derived mesenchymal stem cells repair cisplatin-induced acute kidney injury through antiapoptotic pathways[J].Exp Ther Med,2015,10(2):466-476.
[3]Hayes M,Curley GF,Masterson C,et al.Mesenchymal stromal cells are more effective than the MSC secretome in diminishing injury and enhancing recovery following ventilator-induced Lung injury[J].Intensive Care Med Exp,2015,3(1):1-14.
[4]Rodríguez-Lorenzo A,Arufe MC,De la Fuente A,et al.Influence of flap prefabrication on seeding of subcutaneously injected mesenchymal stem cells in microvascular beds in rats[J].Ann Plast Surg,2014,73(2):234-238.
[5]Haque N,Rahman MT,Abu Kasim NH,et al.Hypoxic culture conditions as a solution for mesenchymal stem cell based regenerative therapy[J].ScientificWorldJournal,2013,2013:632972.
[6]Ichioka S,Kudo S,Shibata M,et al.Bone marrow cell implantation improves flap viability after ischemia-reperfusion injury[J].Ann Plast Surg,2004,52(4):414-418.
[7]Kobayashi T,Hamano K,Li TS,et al.Enhancement of angiogenesis by the implantation of self bone marrow cells in a rat ischemic heart model[J].J Surg Res,2000,89(2):189-195.
[8]Schraufstatter IU,Discipio RG,Khaldoyanidi S,et al.Mesenchymal stem cells and their microenviroment[J].Front Biosci(Landmark Ed),2011,16:2271-2288.
[9]Noort WA,Feye D,Van Den Akker F,et al.Mesenchymal stromal cells to treat cardiovascular disease:strategies to improve survival and therapeutic results[J].Panminerva Med,2010,52(1):27-40.
[10]Rylova JV,Buravkova LB.Long term expansion of multipotent mesenchymal stromal cells under reduced oxygen tension[J].Cell Tissue Biol,2013,8(2):107-114.
[11]Mostafa E,Shamsasenjan K,Aliakbar M,et al.The effect of hypoxia on mesenchymal stem cell biology[J].Adv Pharm Bull, 2015,5(2):141-149.
[12]Du L,Yu Y,Ma H,et al.Hypoxia enhances protective effect of placental-derived mesenchymal stem cells on damaged intestinal epithelial cells by promoting secretion of insulin-like growth factor-1[J].Int J Mol Sci,2014,15(2):1983-2002.
[13]Fort G,Minieri M,Cossa P,et al.Hepatocyte growth factor effects onmesenchymalstemcells:proliferation,migration,and differentiation[J].Stem Cells,2006,24(1):23-33.
[14]Tawa H,Rikitake Y,Takahashi M,et al.Role of afadin in vascular endothelial growth factor-and sphingosine 1-phosphate-induced angiogenesis[J].Circ Res,2010,106(11):1731-1742.
[15]Nagaraju GP,Bramhachari PV,Raghu G,et al.Hypoxia inducible factor-1alpha:Its role in colorectal carcinogenesis and metastasis [J].Cancer Lett,2015,366(1):11-18.
[16]Choi KS,Bae MK,Jeong JW,et al.Hypoxia-induced angiogenesis during carcinogenesis[J].J Biochem Mol Biol,2003,36(1):120-127.
[17]Vladau M,Cimpean AM,Balica RA,et al.VEGE/VEGER2 axis inperiodontaldiseaseprogressionandangiogenesis:basic approach for a new therapeutic strategy[J].In Vivo,2016,30(1): 53-60.
[18]Shalaby F,Rosant J,Yamaguchi TP,et al.Failure of blood-island formation and vasculogenesis in Flk-1-deficient mice[J].Nature, 1995,376(6535):62-66.
[19]Pugh CW,Ratcliffe PJ.Regulation of angiogenesis by hypoxia: role of the HIF system[J].Nat Med,2003,9(6):677-684.
[20]Sanchez-Elsner T,Botella LM,Velasco B,et al.Synergistic cooperation between hypoxia and transforming growth factor-beta pathways on human vascular endothelial growth factor gene expression[J].J Biol Chem,2001,276(42):38527-38535.
[21]Han KH,Kim AK,Kim MH,et al.Enhancement of angiogenic effects by hypoxia-preconditioned human umbilical cord-derived mesenchymal stem cells in a mouse model of hindlimb ischemia [J].Cell Biol Int,2016,40(1):27-35.
[22]Naaldijk Y,Johnson AA,Ishak S,et al.Migrational changes of mesenchymal stem cells in response to cytokines,growth factors, hypoxia,and aging[J].Exp Cell Res,2015,338(1):97-104.(收稿日期:2015年12月11日;修回日期:2016年3月4日)
【中图分类号】Q813.1+1
【文献标识码】A
【文章编号】1673-0364(2016)03-0147-05
doi:10.3969/j.issn.1673-0364.2016.03.001
作者单位:200011上海市上海交通大学医学院附属第九人民医院整复外科;上海市组织工程研究重点实验室。
通讯作者:余东(E-mail:drxuliang@126.com)。血缺氧环境并不利于MSCs的存活和修复。目前,大量研究证实,缺氧条件下培养的MSCs,其分化、增殖、迁移功能均可增强,并可促进损伤组织血管生长。所以,MSC移植后修复损伤部位的成功率与其低氧环境密切相关[5]。为明确MSCs在缺血缺氧环境中发生的改变,本实验将MSCs在体外进行缺氧处理,观察其细胞生物学特性,然后对相关生长因子进行检测,旨在发现MSCs在缺血缺氧环境刺激下的细胞特性,以及分泌相关因子的改变,为临床修复组织损伤及治疗缺血缺氧性疾病提供依据。
The Gene Differential Expression of Mesenchymal Stem Cells Under Hypoxia
XU Liang,BAI Shanshan,DUAN Huichuan,YU Dong.Department of Plastic and Reconstructive Surgery,Shanghai Ninth People's Hospital,Shanghai Jiaotong University School of Medicine,Shanghai Key Laboratory of Tissue Engineering,Shanghai 200011,China.Corresponding authors:YU Dong(E-mail:drxuliang@126.com).
【Abstract】ObjectiveTo investigate the biological characteristics and related factors of mesenchymal stem cells(MSCs) under hypoxia and to extend the knowledge for repairing clinical tissue injury.MethodsMSCs were cultured and exposed to the hypoxic condition in vitro.The cell properties were observed by immunofluorescence staining,RT-PCR were performed to investigate the expression of VEGF、bFGF、TGF-β and IL-1α,in order to explore the changes of MSCs under hypoxia from the aspects of cell differentiation,related factors and cell signaling pathways.ResultsCultured under hypoxia for 24 hours,cells were observed under inverted microscope and survived well,and no significant changes of cell morphology and growth patterns were observed.Immunofluorescence and double immunofluorescence staining found out there was a tendency that MSCs cultured in hypoxia transform into endothelial cells,particularly vascular endothelial cells.The expression of VEGF,bFGF,TGF-β and IL-1α were all up-regulated in MSCs exposed to the hypoxic condition,but a weak expression in MSCs cultured in normoxia.ConclusionUnder the hypoxic condition,MSCs can differentiate into vascular endothelial cell, and expression of factors VEGF,bFGF,TGF-β and IL-1α,which can enhance the formation and growth of vascular,are all up-regulated,directly or indirectly accelerate the vascularization in tissue injury.
【Key words】Mesenchymal stem cells;Gene expression;Vascularization;Hypoxia
