重组人组织因子在毕赤酵母中的高效分泌表达的研究
2016-07-24张秀华钊倩倩刘飞朱希强
张秀华,钊倩倩,刘飞,朱希强,2Δ
(1.山东省药学科学院 山东省生物药物重点实验室/山东省多糖类药物工程实验室/多糖类药物发酵与精制国家地方联合工程实验室,山东 济南 250101;2.山东福瑞达医药集团公司,山东 济南 250101)
重组人组织因子在毕赤酵母中的高效分泌表达的研究
张秀华1,钊倩倩1,刘飞1,朱希强1,2Δ
(1.山东省药学科学院 山东省生物药物重点实验室/山东省多糖类药物工程实验室/多糖类药物发酵与精制国家地方联合工程实验室,山东 济南 250101;2.山东福瑞达医药集团公司,山东 济南 250101)
目的 构建含有人组织因子(hTF)基因的毕赤酵母高效表达系统,实现胞外高效分泌表达。方法 全基因合成hTF胞外区序列,PCR扩增该基因片段,经Xho I和Xba I双酶切后,和表达载体pGAPZaA相连,并电转化毕赤酵母SMD1168H。在YPD培养基中进行表达,取培养基上清进行SDS-PAGE检测,并利用Western进行确证,通过BCA法检测胞外蛋白表达量。结果 在毕赤酵母中成功表达人组织因子,通过Western确证目的蛋白分子量大小正确,BCA法检测摇瓶表达胞外总蛋白达1 g/L,Bandscan软件分析目的蛋白占胞外总蛋白80%以上。结论 本研究实现了截短型人组织因子在毕赤酵母中的高效分泌表达,获得了具有与完整因子相同凝血活性的截短型组织因子。
重组人组织因子;毕赤酵母SMD1168H;Western blot;高效分泌表达
凝血因子III,又称组织因子(tissue factor,TF),广泛存在于各种动物组织[1],在凝血过程中发挥着重要作用,是凝血过程的启动者。在创伤等外界刺激下组织因子释放,在钙离子作用下与因子VII结合,并依次激活因子VII、因子X,然后活化凝血酶原为凝血酶,进一步将纤维蛋白原酶解为纤维蛋白单体,并交联形成稳定的纤维蛋白凝块,最终凝血[2-3]。
组织因子是一种由263个氨基酸残基组成的单链跨膜糖蛋白。完整的组织因子含有263个氨基酸残基,分子量为47 kDa,含三个结构域,胞外区包含1-219氨基酸残基,疏水跨膜区包含220-242氨基酸残基,243-263为胞内区[4]。其中胞外区含有两个二硫键和三个N糖基化位点,组织因子与因子VIIa形成复合物并激活因子X的主要功能即位于胞外区[5]。由于毕赤酵母表达系统既具有原核细胞的可操作特点,也具有真核细胞的翻译后加工能力,表达水平较高,且产物是以活性状态分泌到培养基中,易于后续分离纯化。本课题拟在毕赤酵母中表达只含胞外区的截短型组织因子,在胞外实现可溶性表达,且实验数据证实截短型组织因子具有和完整组织因子相同的激活作用[6-7]。
王羽雄等[8]在毕赤酵母中利用pPIC9K载体,经甲醇诱导后组织因子表达量仅为182 mg/L。赵邑等[5]在大肠杆菌中表达人组织因子,在30 L发酵罐上表达量为6.56 mg/L。宋后燕等[10]在大肠杆菌中表达组织因子,形成包涵体,不仅复性困难,产量也低。目前报道的重组组织因子表达量均较低[11],且发酵过程需要诱导或形成包涵体,诱导剂的加入不仅增加毒性,也给后续分离纯化带来困难,本课题拟构建一株不需要诱导同时表达量高的菌株,以满足工业生产的需求,降低生产成本。
1 材料与方法
1.1 材料
1.1.1 质粒与菌株:pGAPZaA质粒、E.coliTop10、SMD1168H毕赤酵母表达宿主菌均为本实验室保藏。
1.1.2 培养基:液体低盐LB培养基(g/L):蛋白胨10,酵母粉5,氯化钠5,调节至pH7.5。固体低盐LB培养基含1.5%~2%琼脂粉。YPB培养基(g/L):胰蛋白胨20,酵母粉10,葡萄糖20。固体YPD培养基含1.5%~2%琼脂粉。
1.1.3 试剂:限制性内切酶(Xba I,Xho I,Bln I)、T4 DNA连接酶、Protein Marker、Pfu DNA 聚合酶(Fermentas)、Zeocin;PCR引物、DNA Marker、质粒抽提试剂盒、PCR产物纯化试剂盒、DNA胶回收试剂盒(上海生工生物工程有限公司);TF(C-7):sc-393657、goat anti-mouse IgG-HRP:sc-2005(Santa cruz biotechnology)。其他试剂均为市售分析纯。
1.1.4 实验仪器:三层摇床Ampere chart Mnltitron II(伊孚森生物技术中国有限公司);AG 22331 Hamburg PCR仪(Eppendorf);Thermo Micro7/21R离心机(Thermo);Sunrise-Basic Tecan酶标仪(TECAN);Mini-PROTEAN Tetra Cell SDS-PAGE电泳槽(Bio-RAD);DYCP-40C型电泳仪(北京市六一仪器厂)。
1.2 方法
1.2.1 TF基因的获得:查阅Genebank得到人组织因子基因序列,Gene ID:7018,取其胞外区657个碱基(219 aa),按照毕赤酵母表达宿主菌偏好的密码子进行序列优化,分别在优化好的序列上下游添加Xho I,Xba I酶切位点,并送济南博尚生物技术有限公司进行序列合成。利用Oligo软件设计上下游引物(上游引物:5’-CCGCTCGAGAAAAGAGAGGCTGAAG-3’下游引物:5’-GCTCTAGATTACTCTCTGAACTCAC-3’)以对目的片段进行扩增,合成该引物。
1.2.2 pGAPZaA-rTF重组质粒的构建并电转化毕赤酵母SMD1168H:将PCR获得的rTF基因片段和pGAPZaA质粒载体分别用限制性内切酶Xho I、Xba I进行双酶切,纯化后用T4 DNA连接酶连接,获得pGAPZaA-rTF重组质粒,并转化Top10感受态细胞,涂布含25 μg/mL Zeocin的低盐LB平板。获得的转化子经单酶切和PCR验证正确后进行测序分析。测序正确后,提取pGAPZaA-rTF重组质粒经限制性内切酶Bln I线性化后准备电转化毕赤酵母。电转化过程按《毕赤酵母表达操作手册》[12]中操作,山梨醇活化后涂布含1 μg/mL、5 μg/mL Zeocin抗性的平板。
1.2.3 重组人组织因子的表达:从1 μg/mL、5 μg/mL Zeocin抗性平板上挑取SMD1168H-pGAPZaA-rTF工程菌单菌落,分别接种至含1 μg/mL、5 μg/mL Zeocin抗性的YPD培养基中进行表达,SDS-PAGE电泳检测目的蛋白表达量,从中筛选出表达量高的菌株接种至含相同浓度Zeocin的YPD液体培养基中,30 ℃振荡培养过夜,保存菌种。同时按6%接种量将种子液接种至含100 mL YPD培养基的摇瓶中, 30 ℃继续培养,并分别在发酵40、50、62、75、87、99、110 h时取样。
表达结束后,样品经12000 r/min,离心5 min,取发酵液上清进行SDS-PAGE电泳(具体操作方法参考精编分子生物学实验指南334-335[13]),检测目的蛋白表达情况及分子量。
1.2.4 重组人组织因子的Western免疫学研究:取胞外发酵液,稀释后取1 μg进行SDS-PAGE电泳,电泳结束后利用转膜仪将蛋白从SDS-PAGE胶转移至PVDF膜上,预染蛋白分子量marker作为转膜是否完全的标志。转膜后Western操作过程按照精编分子生物学实验指南[13]操作,利用小鼠IgG1-TF单抗作为一抗,稀释比例1︰1000;羊抗鼠IgG-HRP作为二抗,稀释比例1︰10000, DAB显色试剂盒显色。为防止实验结果假阳性,分别取3批不同发酵批次的发酵液上清进行Western验证。
2 结果
2.1 TF基因的获得 利用添加酶切位点的特异性引物对合成的序列进行PCR扩增,扩增后的片段进行切胶回收,回收后的片段进行0.8%琼脂糖凝胶电泳,结果见图1。从图中可知得到的目的基因片段约在700 bp,与理论值相一致。

图1 TF胞外区基因片段结果1:DNA Marker;2,3:TF目的基因Fig.1 Extracellular domain of TF gene1:DNA Marker;2,3:TF gene
2.2 pGAPZaA-rTF重组质粒的构建 从转化平板上挑取重组子单菌落至低盐LB液体培养基中,37 ℃培养过夜,提取质粒后用Xho I单酶切,并进行PCR验证,0.8%琼脂糖凝胶电泳结果见图2。从图中可以看出,单酶切后的空质粒约为3100 bp,单酶切后的重组质粒在3800 bp附近,差值与目的基因理论值相一致。以重组子为模版利用PCR扩增得到的目的基因,也与TF基因700 bp大小相一致,而阴性对照组以pGAPZaA为模版,无法扩增出目的片段。测序结果也显示插入的序列与设计的序列完全一致。
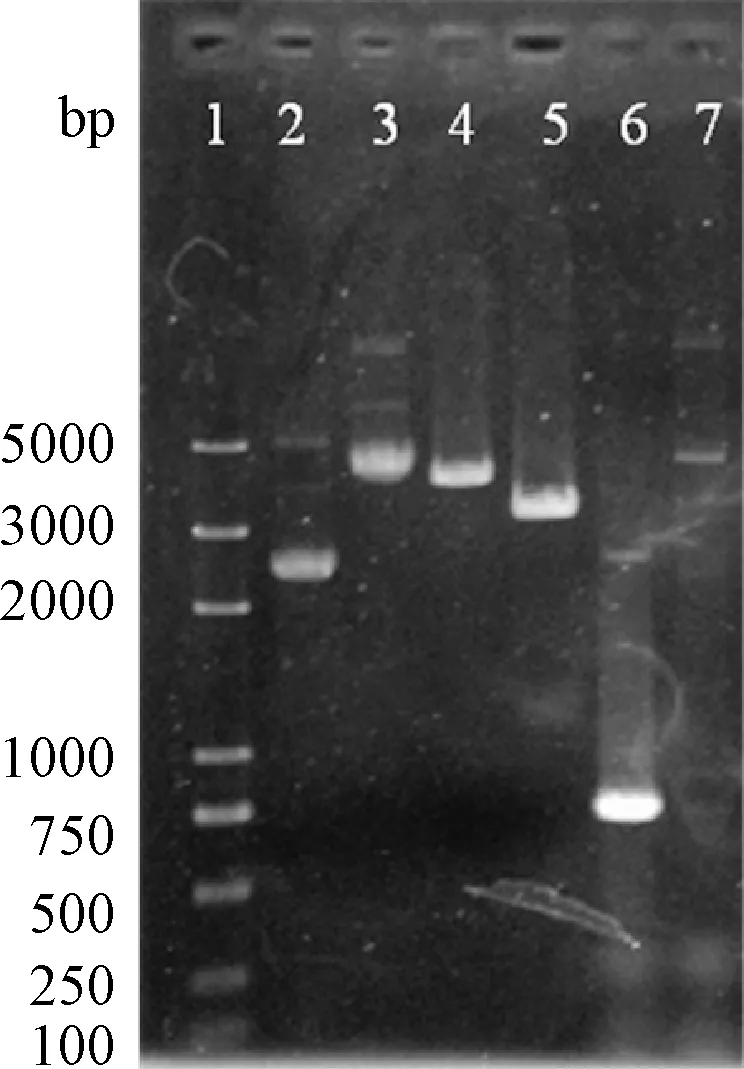
图2 pGAPZaA-rTF重组质粒单酶切及PCR验证结果1:DNA Marker;2:pGAPZaA 空质粒;3:pGAPZaA-rTF重组质粒;4:pGAPZaA-rTF重组质粒经Xho I单酶切;5:pGAPZaA空质粒经Xho I单酶切;6:pGAPZaA-rTF重组质粒经PCR扩增;7:pGAPZaA空质粒经PCR扩增Fig.2 Single-digested and PCR validation of recombinant pGAPZaA-rTF1:DNA Marker;2:pGAPZaA plasmid;3:recombinant pGAPZaA-rTF plasmid;4:Single digested of pGAPZaA-rTF by Xho I;5:Single digested of pGAPZaA by Xho I;6:PCR validation of recombinant pGAPZaA-rTF;7:PCR validation of pGAPZaA
测序正确的重组质粒pGAPZaA-rTF经Bln I单酶切线性化后电转化毕赤酵母SMD1168H,将在5 μg/mL Zeocin抗性平板上筛选得到转化子,破壁后进行PCR扩增,得到同样大小的目的基因片段,证明重组质粒成功在毕赤酵母SMD1168H基因组中同源重组。
2.3 重组人组织因子的表达 SMD1168H-pGAPZaA-rTF菌株在YPD培养基中表达,电泳结果见图3。

图3 人组织因子表达情况SDS-PAGE分析1:蛋白分子量Marker;2-8:表达40、50、62、75、87、99、110 h发酵上清液中蛋白表达情况Fig.3 SDS-PAGE analysis of the expression of human rTF1:Protein molecular weight Marker;2-8:Expression of rTF in culture medium at 40,50,62,75,87,99,110 h
图3中可以看出,发酵40 h后蛋白已有明显表达,蛋白分子量在37~40 kDa。酵母表达胞外总蛋白用BCA蛋白含量试剂盒检测,见图4,从图中看出随着发酵时间的延长蛋白表达量增多,表达至87 h后蛋白表达量几乎不再上升,因此可适当缩短表达时间。

图4 人组织因子表达胞外总蛋白含量Fig.4 Total extracellular protein of human TF expression
经BCA蛋白含量试剂盒检测,胞外总蛋白表达量可达1 g/L,Bandscan软件分析目的蛋白占胞外总蛋白80%以上。
2.4 重组人组织因子的免疫学研究 重组人组织因子Western结果见图5。从图中可以看出空载体处没有任何条带,样品处出现3条特异性条带,大小在37~40 kDa,而经去糖基化酶去糖基化后只出现一条特异性条带,说明3条均为目的蛋白条带,是由于糖基化程度不同而出现分子量的差异。取不同发酵批次的发酵液进行Western验证,结果证明均在同一位置处出现目的条带,即确定该位置处条带为目的条带。

图5 人组织因子Western结果(n=3)1:蛋白分子量Marker;2:空载体对照;3:蛋白表达样品;4:蛋白样品去糖基化Fig.5 Western results of human rTF(n=3)1:Protein molecular weight Marker;2:Proteins expressed by SMD1168H-pGAPZaA; 3:Proteins expressed by SMD1168H-pGAPZaA-rTF;4:Deglycosylated protein expressed by SMD1168H-pGAPZaA-rTF
3 讨论
完整组织因子包括胞外区、疏水跨膜区和胞内区共263 aa,理论分子量为24.8 kDa,实际分子量为47 kDa,本课题表达人组织因子胞外区部分,含有219 aa,推算分子量约为39 kDa。而从Western结果中看出,存在3条特异性条带,对应分子量Marker推算分子量分别约为37、39、40 kDa,与理论分子量相符。3条特异性条带处蛋白均为人组织因子蛋白,由于人组织因子胞外区有3个N糖基化位点,分析原因可能是由于糖基化程度的不同导致目的蛋白在分子量上有些许区别,但该区别不影响蛋白活性[8,14-15]。
本课题利用pGAPZaA载体,将人组织因子在毕赤酵母中中表达,无需诱导,利用摇瓶发酵胞外总蛋白产量即可达1 g/L,其中目的蛋白占80%以上,这也是目前所报道的重组人组织因子表达的最高产量。表达量是赵邑等[7]的150倍,是王羽雄等[8]的5.5倍,更加适合工业上大规模生产。本课题后续将进行发酵罐发酵表达,在良好的发酵条件下,蛋白表达量将有明显提高。同时将表达产物分离纯化,提高组织因子蛋白的质量,进行凝血酶原试剂盒的开发,为凝血酶原时间测定实验标准化提供重要保障。
[1] 周瑞芳,于敏.组织因子功能的研究进展[J].检验医学与临床,2012,9(7):846-848.
[2] Rao LVM,Pendurthi UR.Tissue factor-factor VIIa signaling[J].Arterioscler Thromb Biol, 2005, 25(1):47-56.
[3] Chen J,Kasper M, Heck T,et al.Tissue factor as a link between wounding and tissue repair[J].Diabetes, 2005, 54(7):2143-2154.
[4] Morrissey JH, Fakhrai H,Edgington, TS[J].Cell, 1987, 22(50):129-135.
[5] Shigematsu Y, Miyata T, Higashi S, et al.Expression of human soluble tissue factor in yeast and enzymatic properties of its complex with factor VIIa[J].J Biol Chem,1992, 267(267):21329-21337.
[6] Wiinberg B,Jensen AL,Rojkjaer R, et al.Validation of human recombinant tissue factor-activated thromboelastography on citrated whole blood from clinically healthy dogs[J].Vet Clin Pathol, 2005, 34(4):389-393.
[7] 赵邑,齐延红,潘薇薇,等.可溶性重组人组织因子分泌型表达载体的构建和表达[J].生物技术,2007,17(3):15-17.
[8] 王羽雄,于敏,顾银良,等.人组织因子在毕赤酵母中的表达和纯化[J].复旦学报医学版,2008,35(6):811-814.
[9] 赵邑,郝建平,赵峰梅,等.基因工程菌生产重组人组织因子的发酵研究[J].工业微生物, 2006,36(4):33-36.
[10] 宋后燕,于敏,王羽雄.重组可溶性组织因子及其制备方法和应用[P].中国专利,CN1496992A,2004-05-19.
[11] 孙金霞,郭振中,孙雷,等.基于重组组织因子凝血活酶试剂的研究进展[J].第二军医大学学报,2012,33(2):220-223.
[12] Pichia Expression Kit: A Manual of Methods for Expression of Recombinant Proteins in Pichia pastoris.Invitrogen, USA, Catalog no.K1710-01.
[13] 奥斯伯 FM.精编分子生物学实验指南[M].金由辛,译,第5版.北京:科学出版社,2008:334-335、366-369.
[14] Martin JS, Wolfram RUF, David JM, et al.Recombinant soluble human tissue factor secreted by Saccharomyces cerevisiae and refolded from Escherichia coli inclusion bodies: glycosylation of mutants, activity and physical characterization[J].Biochem J,1995, 310(310):605-614.
[15] 关明,吕元.重组人类凝血活酶的表达及其临床应用[J].国外医学临床生物化学与检验学分册,2000,21(5):270-271.
(编校:王冬梅)
High level secretory expression of recombinant human tissue factor inPichiapastoris
ZHANG Xiu-hua1, ZHAO Qian-qian1, LIU Fei1, ZHU Xi-qiang1,2Δ
(1.Key Laboratory of Biopharmaceuticals/Engineering Laboratory of Polysaccharide Drugs/National-Local Joint Engineering Laboratory of Polysaccharide Drugs Fermentation and Purification, Shandong Academy of Pharmaceutical Sciences, Jinan 250101, China;2.Shandong Freda Pharmaceutical Group Co.Ltd., Jinan 250101, China)
ObjectiveTo construct a eukaryotic expression vector inPichiapastoriscontaining human tissue factor(hTF) gene,in order to achieve high level secretory expression in extracellular.MethodsExpression plasmid, pGAPZaA-hTF, was constructed by inserting the synthesized sequence encoding human extracellular tissue factor into yeast expression vector pGAPZaA and transformed intoPichiapastorisSMD1168H with electroporation.Having been selected by Zeocin, transformants containing hTF cDNA were expressed in YPD, extracellular proteins were detected by SDS-PAGE and confirmed by Western bolt.ResultsSuccessfully constructed the recombinant pGAPZaA-hTF expression system inPichiapastoris.SDS-PAGE showed that the molecular weight of the expression product was about 37 - 40 kDa.Western-blot indicated that it was human extracellular tissue factor.The crude yield of total protein in medium was up to 1 g/L, more than 80% of which was hTF.ConclusionTruncated rTF gene is expressed inPichiapastorisand the active products are secreted into the medium which have the same activation as the native TF.
recombinant human tissue factor;Pichiapastoris; Western blot; high yield
国家高技术研究发展(863)计划(2014AA093603);山东省科技发展计划,(2014GSF121043);山东省自主创新成果转化专项(2014GGZH1306);山东省重点研发计划(2015GSF121003);济南市重大专项(201403009);山东省科技重大专项(重大关键技术)(2015ZDJS04002)
张秀华,女,硕士,研究方向:生物药学,E-mail:wfzxh0318@163.com;朱希强,通信作者,男,博士,研究员,研究方向:生物技术,E-mail:lfshwu@163.com。
Q786
A
10.3969/j.issn.1005-1678.2016.04.09
