抗HPV11病毒样颗粒单克隆抗体的性质鉴定及初步应用
2016-07-24李敏林知捷魏希李少伟夏宁邵赵勤俭
李敏,林知捷,魏希,李少伟,4,夏宁邵,4,赵勤俭Δ
(1.厦门大学 分子疫苗学和分子诊断学国家重点实验室,福建 厦门 361102;2.厦门大学 公共卫生学院,福建 厦门 361102;3.厦门万泰沧海生物技术有限公司,福建 厦门 361000;4.厦门大学 生命科学学院,福建 厦门 361102)
抗HPV11病毒样颗粒单克隆抗体的性质鉴定及初步应用
李敏1,2,林知捷3,魏希3,李少伟1,2,4,夏宁邵1,2,4,赵勤俭1,2Δ
(1.厦门大学 分子疫苗学和分子诊断学国家重点实验室,福建 厦门 361102;2.厦门大学 公共卫生学院,福建 厦门 361102;3.厦门万泰沧海生物技术有限公司,福建 厦门 361000;4.厦门大学 生命科学学院,福建 厦门 361102)
目的 分析和鉴定抗HPV11病毒样颗粒(virus-like particle,VLP)鼠源单克隆抗体的性质,筛选性质和生物学活性较优的抗体,并初步应用于抗原或疫苗的质量分析。方法 分别利用间接ELISA法和Western blot对HPV11的22株单克隆抗体的亚类、与HPV11 VLP的结合能力和构象敏感性进行检测;采用血凝抑制实验对单克隆抗体的血凝抑制活性进行分析;运用基于假病毒的抗体中和实验对单克隆抗体的中和活性进行鉴定,选出中和活性高的单抗进行两两配对,采用双抗夹心ELISA法捕获单抗并筛选合适的配对双抗。结果 对22株单抗的性质进行了详细和完整的鉴定,并根据构象敏感性进行排序,筛选出6株型别特异、结合活性强且中和活性高的单抗(2A2、4A1-3、16G7、14A6、9C12和19C7);成功建立了基于单抗的双抗夹心(14A6:Ag:9C12-HRP)ELISA定量分析方法。结论 获得了较全面的HPV11 VLP单抗性质信息,建立了重组HPV11抗原质量分析的双抗夹心ELISA法,为HPV11抗原的生命周期管理或尖锐湿疣疫苗的研发、工艺优化、产品放行和稳定性研究等提供了技术支持。
人乳头瘤病毒;单克隆抗体;假病毒;中和活性;质量分析
人乳头瘤病毒(human papillomavirus,HPV)是一类无包膜的正二十面体对称的DNA病毒,主要侵害皮肤和粘膜组织,持续感染可引起上皮细胞增生甚至癌变[1]。目前,已鉴定出200多种亚型,约40种HPV可侵犯人体粘膜组织[2]。研究表明,多种HPV类型都可引起生殖器和肛周部位的疣状病变,即尖锐湿疣,其中近90%是由低危型HPV6/11引起[3-6]。迄今,市场上仅有2种基于重组病毒样颗粒(virus-like particle,VLP)研发的对HPV6/11有保护作用的疫苗,分别是Gardasil®-4四价疫苗(HPV6/11/16/18)和Gardasil®-9九价疫苗(HPV6/11/16/18/31/33/45/52/58)[7]。目前,由本实验室研发的HPV6/11尖锐湿疣疫苗已进入临床实验I期。
与传统的减毒或灭活疫苗相比,重组VLP疫苗不含有病毒基因,相对较安全,其功能对完整结构的依赖性更强,且不同病毒的重组VLP疫苗的质量分析方法具有共性。在宫颈癌疫苗的研究中,有两家公司已经建立了基于特异性中和单抗的较为完善的质量分析体系,其中较为重要的单抗分别为HPV16.V5和HPV18.J4[8]。目前,有关HPV6/11单抗的研究很少,尚未有优势单抗用于尖锐湿疣疫苗质量分析的报道。所以,本研究主要是对本实验室研发HPV11 VLP(尖锐湿疣疫苗的有效成分之一)的单抗盘进行详细地性质分析和鉴定,筛选型别特异、构象敏感、中和活性高的单抗,并将其初步用于建立HPV11 VLP的质控方法(双抗夹心ELISA法),为尖锐湿疣疫苗的周期管理、生产放行和工艺改进等提供技术支持。
1 材料与方法
1.1 材料
1.1.1 病毒及细胞:实验所用HPV6/11 VLP抗原、22株鼠源单克隆抗体及HPV11假病毒均为实验室生产纯化并保存[8-10];293FT细胞购自Invitrogen公司。
1.1.2 实验动物:Balb/C小鼠购自上海莱斯克实验动物有限责任公司,饲养于厦门大学分子疫苗学与分子诊断学国家重点实验室 SPF 级动物房内。本实验遵循《实验动物保护条例》,得到本校实验动物伦理委员会批准,厦门大学实验动物许可证号: SCXK(闽) 2013-0001。
1.1.3 试剂:羊抗鼠多抗GAM购自万域美蓝公司;单抗分型试剂盒购自英国Serotec公司;胎牛血清(南美血源)购自PAN Biotech;Bradford蛋白浓度测定试剂盒购自碧云天生物技术研究所;硝酸纤维素膜为德国Schleicher&Schuell公司产品;Western blot ECL试剂盒购自美国Advansta公司;辣根过氧化物酶(HRP)购自Sigma公司;ELISA实验中的封闭液、样品稀释液和标酶稀释液均为实验室配制,命名为ED;ELISA实验终止液和显色液购自北京万泰生物公司;其余生化药品均为分析纯。
1.1.4 仪器:荧光斑点分析仪(ImmunSpot@S5 UV Analyzer)购自美国CTL公司;蛋白电泳仪(Basic)及转移装置(TE77)购自美国Bio-Rad公司;酶标仪(PHOMO)购自安图实验仪器(郑州)有限公司;自动洗板机(DEM-3)购自北京拓普分析仪器有限责任公司。
1.2 方法
1.2.1 基于间接ELISA法的单抗性质检测
① 单抗与抗原结合活性检测:重组蛋白HPV11 VLP(1 μg/mL)包被96孔板,每孔100 μL,用ED封闭(200 μL/孔);将22株抗HPV11 VLP单抗分别用ED稀释至1 μg/mL,加入首孔,2倍系列稀释11个梯度,双孔重复,室温放置1 h;酶标二抗GAM-HRP(1:5000)100 μL/孔,室温放置1 h;室温显色10 min,终止,酶标仪450 nm波长处检测;使用GraphPad Prism 5(GraphPad, USA)软件进行数据分析,以四参数模型进行曲线的拟合,计算EC50数值。
② 单抗构象敏感性检测:重组蛋白HPV11 VLP进行变性处理:用含有20 mM二硫苏糖醇(DTT)的20 mM碳酸盐缓冲液(pH 9.6)将蛋白稀释至2 μg/mL,50 μL/孔加入96孔板内,37 ℃处理过夜烘干,获得构象破坏的抗原,并用ED室温封闭2 h;同时,使用未处理的HPV11 VLP 以100 ng/孔包被96孔板。实验过程中,单抗分别与完整HPV11 VLP和变性的HPV11抗原反应,进行四参数拟合,分别得到EC50, Native和EC50, Denatured。单抗对所识别抗原表位的构象敏感性由rEC50(rEC50= EC50,Native/EC50,Denatured)表示,rEC50值越大说明单抗构象敏感性越强。
③ 单抗亚类鉴定:采用Serotec公司抗体分型试剂盒通过间接ELISA法对单抗亚类进行鉴定。
④ 单抗与HPV6 VLP的交叉反应性检测(型别特异性):将固定浓度的HPV11单抗(1 μg/mL)分别与包被在96孔板中的HPV6/11抗原反应。HPV11型单抗与HPV6 VLP交叉反应率为:OD450,HPV6/ OD450,HPV11×100%。
1.2.2 Western blot检测单抗性质:将HPV11 VLP 进行SDS-PAGE凝胶电泳,转膜,封闭;将膜裁剪为0.5 cm宽的矩形条,分别与22株单抗(1 μg/mL)反应1 h,清洗3次,与酶标二抗GAM-HRP(1:5000)反应1 h,清洗3次,曝光显色。
1.2.3 基于细胞水平的单抗性质检测
① 小鼠红细胞凝集与凝集抑制实验:Balb/C小鼠眼球后取血,阿氏液抗凝;将采集到的小鼠血用PBS清洗,2500 r/min离心5 min,清洗3次,再与PBS按体积比1:99配制成1%的红细胞悬液;取96孔U型板,在第1-11孔中加入40 μL 用PBS 1.5倍稀释的HPV11抗原,在第12孔中加入40 μL PBS(阴性对照),双孔重复;每孔加入40 μL 1%的红细胞悬液,室温静置4 h,观察抗原使小鼠红细胞凝集现象;以引起血凝现象的抗原最低浓度的4倍作为凝集抑制实验的抗原浓度。
取96孔U型板,用PBS将抗体(首孔45 μg/mL)进行1.5倍系列稀释到第10孔,每孔终体积40 μL,在第12孔中加入80 μL PBS;将稀释好的抗原加入板中1-11孔,每孔40 μL;将1%的红细胞悬液缓慢加入板中,每孔40 μL,双孔重复;室温静置4 h,观察小鼠红细胞凝集抑制现象。以抗体抑制血凝现象最低浓度的4倍作为抗体的血凝抑制滴度。
② 假病毒中和试验测定单抗的中和活性:基于假病毒的中和试验参考已有报道[8,11-12],简介如下:将100 μL 293FT细胞铺于96孔细胞培养板中(1.5×104个细胞/孔)培养至贴壁;单抗用10%DMEM培养基2倍系列稀释,双孔重复,每个梯度取60 μL与同样体积稀释于10%DMEM培养基的假病毒液(MOI=0.2)混合;取100 μL抗体-假病毒混合液加入细胞板,37 ℃孵育72 h;荧光斑点分析仪读取荧光点数,单抗的感染抑制率=[1-(样品孔计数点-阴性对照孔计数点)/(阳性孔计数点-阴性对照孔计数点)]×100%,以单抗感染抑制率和单抗浓度拟合中和曲线。抗体中和活性为抑制50%假病毒感染细胞的浓度。
1.2.4 基于非重叠双表位的双抗夹心ELISA方法建立:基于以上单抗性质,筛选型别特异、结合活性强、构象敏感、中和活性高的单抗,分别进行HRP标记,两两配对(排除自身配对);其中捕获抗体浓度为1 μg/mL,每孔100 μL包板;抗原首孔为1 μg/mL,2倍系列稀释11个梯度,室温静置1 h;酶标二抗X-HRP(1:4000)100 μL/孔,室温静置1 h;显色,终止,酶标仪(450 nm)检测。
数据分析采用平行线分析法:得到的双孔重复ELISA数据偏差不超过20%时认为重复性良好,去除偏差超过20%的数据后,用 “GraphPad Prism 5” 四参数模型进行第一次拟合,得到4个Hillslope,样品的Hillslope与对照样品的Hillslope偏差不超过20%时样品曲线有效,否则不能参与下一步拟合;排除不可用曲线后,数据进行第二次拟合,用四参数模型进行等底、等高和等斜率拟合,得到EC50值;样品的相对效价rEC50=(EC50, Reference)/(EC50, Sample)×100%。
2 结果
2.1 基于免疫化学检测方法(间接ELISA)的单抗性质检测
2.1.1 单抗与抗原的结合活性测定:通过单抗浓度与显色效应值拟合结合曲线,计算得到EC50,EC50值越小说明单抗与抗原的结合活性越强,见图1。单抗盘中2A2、4A1-3、16G7、10D6、14A6、9C12、19C7、18D3、1H8和17B9 10株单抗的EC50均<20 ng/mL,与抗原的结合活性较高,且均为IgG1亚型(见表1)。
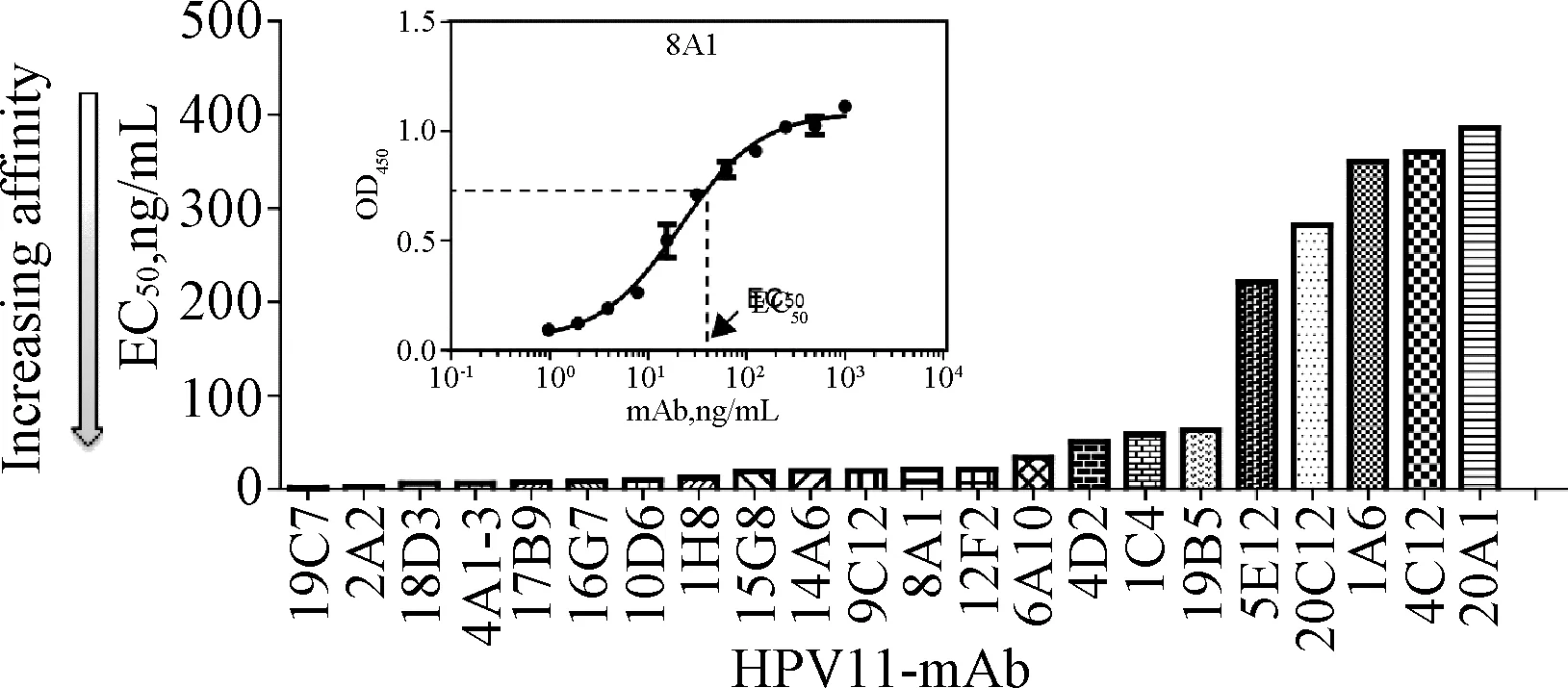
图1 基于EC50排序的单抗与抗原结合活性(插图:以8A1为例说明抗体与抗原的结合反应曲线)Fig.1 Affinity ranking based on EC50 derived from a direct ELISA assay (Inset: Binding profiles for one mAb(8A1)with strong affinity to native HPV11 antigen in a direct binding ELISA)

抗体分型结合滴度(完整VLP)EC50,ng/mL结合活性(变性VLP)EC50,ng/mL构象敏感性(rEC50)中和活性NT50,ng/mL血凝抑制滴度μg/mL与HPV6VLP交叉反应(%)Ⅰ.构象非常敏感组(rEC50>15)2A2IgG12.7>1000>36022.0>45—4A1-3IgG16.4>1000>1502.05.93—16G7IgG18.3>1000>1204.045—10D6IgG110.2>1000>98.2>1000309514A6IgG119.3>1000>51.81.945—9C12IgG119.4>1000>51.73.9>45—12F2IgG2b21.4>1000>46.722.03023Ⅱ.构象敏感组(rEC50,2.0~15)19C7IgG11.31310.31.7305418D3IgG16.328.54.62.230185E12IgG1220.8>1000>4.550.545—20C12IgM282.3>1000>3.5<1301008A1IgG121.372.13.419.230394C12IgG2a359.8>1000>2.8344.5>45271A6IgG3349.8775.32.2212.330—Ⅲ.构象不敏感组(rEC50,0.5~2.0)19B5IgG163.6791.2>1000>45744D2IgG150.661.21.2>100020—6A10IgG2a3433.31>100020—1C4IgG158.645.90.8>100013.339115G8IgG118.7130.7>10008.8910020A1IgG1386212.60.6>100020100Ⅳ.与变性抗原反应增强组(rEC50<0.5)1H8IgG112.34.50.4>100030-17B9IgG17.30.90.1>10008.89100
2.1.2 单抗构象敏感性检测:以9C12、17B9和19C7 3株单抗为例展示拟合曲线,根据拟合曲线计算抗体与抗原的结合活性EC50,进而求得rEC50,见图2A。根据rEC50值的大小将22株单抗分为4组:构象非常敏感组、构象敏感组、构象不敏感组和与变性抗原反应增强组。2A2、4A1-3、16G7、10D6、14A6、9C12、12F2和19C7 8株单抗的rEC50比值均在10以上,具有较强构象敏感性,可用于抗原结构完整性的检测。见表1。

图2 ELISA检测HPV11单抗的构象敏感性A:9C12、17B9和19C7 的ELISA检测曲线;B:单抗的构象敏感性排序Fig.2 Conformational sensitivity of a panel of murine anti-HPV11 VLP mAbs based on their binding activity using native vs.denatured antigen in a direct ELISA assayA: The primary ELISA binding profiles to denatured HPV11 VLP (black curve) as compared to native HPV11 VLP (red curve), using three representative mAbs, 9C12, 17B9 and 19C7; B: Conformational sensitive priority of mAbs according to rEC50
2.1.3 单抗型别特异性鉴定:间接ELISA法检测结果显示:2A2、4A1-3、16G7、14A6、9C12、5E12、1A6、4D2、6A10和1H8共10株单抗与HPV6 VLP均无反应,为HPV11型别特异的单抗;其余12株单抗与HPV6 VLP均有不同程度的交叉反应(见表1)。
2.2 Western blot检测单抗的效价 Western blot检测结果显示:单抗与HPV11 VLP作用后在55 kDa 左右有明显条带;6A10、15G8、17B9、20A1、4D2、1C4、1H8、1A6和8A1等单抗与变性HPV11抗原反应较明显,为识别线性表位单抗;其余单抗反应不明显,为识别构象表位单抗;该结果与图2中ELISA检测结果一致,见图3。

图3 Western blot检测HPV11单抗的构象敏感性Fig.3 Conformational sensitivity of a panel of murine anti-HPV6 VLP mAbs based on Western blot assay
2.3 小鼠红细胞凝集与凝集抑制实验 在小鼠红细胞凝集实验中,HPV11 VLP浓度为3.94 μg/mL时可引起小鼠红细胞凝集,以4倍该浓度即15.76 μg/mL为凝集抑制实验抗原的浓度;以4A1-3为例展示单抗抑制小鼠红细胞凝集现象,随着单抗浓度的降低,其血凝抑制能力逐渐减弱,见图4。除2A2、9C12、4C12和19B5 4株单抗在浓度45 μg/mL时未观察到凝集抑制现象,其余18株单抗均可以产生凝集抑制现象,但其效力不同(见表1)。表明HPV11 VLP具有完整的生物活性,且部分抗体可抑制由HPV11 VLP引起的细胞凝集反应。

图4 HPV11单抗的血凝抑制活性Fig.4 Cell-based hemagglutination inhibition activity of anti-HPV11 mAbs
2.4 基于假病毒中和试验的单抗中和活性 以抗体浓度与假病毒感染抑制率拟合曲线,结果见图5。通过抑制曲线计算抗体的中和滴度NT50(ng/mL),结果见表1。NT50越小说明抗体的中和活性越高,综合表1数据可发现:中和活性越高的单抗与抗原的结合活性越高,构象敏感性越强。

图5 基于假病毒(L1+L2)中和模型的HPV11单抗中和活性拟合曲线(以4A1-3,5E12和8A1为例)Fig.5 Profiles of viral neutralizing activity of anti-HPV11 mAbs (taking 4A1-3,5E12 and 8A1 for examples) in a HPV PsV-based assay
2.5 基于非重叠双表位的双抗夹心ELISA方法建立 根据以上对HPV11 VLP单抗的性质鉴定,筛选出型别特异、结合活性强、构象敏感、中和活性高的6株单抗(2A2、4A1-3、9C12、10D6、16G7、19C7和14A6)。以上6株抗体与结合活性较高、构象较敏感的单抗10D6共同用于双抗夹心ELISA法的建立。如图6A所示:以19C7:Ag:X-HRP为例,每种配对均可得到完整的拟合曲线并求得EC50,EC50值越小说明该配对的灵敏度越高。通过初步筛选(图6B),确定14A6、19C7和9C12作为候选捕获单抗,9C12、10D6和19C7作为候选检测单抗,进行重现性考察。
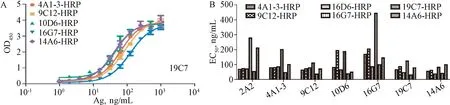
图6 基于非重叠双表位的双抗夹心方法的初步筛选A:以19C7为捕获抗体的配对拟合曲线;B:双抗夹心ELISA配对初步结果Fig.6 Screening of two none-overlapping epitopes based sandwich ELISA assay in detecting the elative antigenicity determination of HPV11 antigenA: Profiles of 19C7:Ag:X-HRP in a sandwich ELISA; B: Preliminarily screening of the capture mAb and detection mAb in a sandwich ELISA assay


图7 基于非重叠双表位的双抗夹心ELISA方法的建立A:候选双抗夹心ELISA法单抗配对重现性考察;B:双抗夹心ELISA方法14A6:Ag:9C12-HRP的确立Fig.7 Establishing of two none-overlapping epitopes based sandwich ELISA assay in detecting the elative antigenicity determination of HPV11 antigenA: Reproducibility study of 7 candidates in the sandwich ELISA; B: Profiles used to show the relative antigenicity(rEC50)of HPV11 using 14A6:Ag:9C12-HRP
3 讨论
重组VLP疫苗的质量分析是运用定性或定量的方法对可诱发保护性中和抗体表位进行分析的过程。HPV型别特异的中和单抗可特异性的识别VLP上的表位,间接反映VLP的结构特点和活性成分,因此,可利用特异性的单抗建立疫苗的质量分析方法[13-15]。本研究对HPV11 VLP的单抗盘进行了详细的性质分析,获得了22株单抗的亚类、与抗原的结合活性、构象敏感性、血凝抑制活性及中和活性等性质,并根据单抗的构象敏感性将其分为4组:构象非常敏感组、构象敏感组、构象不敏感组和与变性后抗原结合活性增强组。根据单抗性质,筛选出型别特异、构象敏感、中和活性高的抗体6株(2A2、4A1-3、9C12、16G7、19C7和14A6),与结合活性高、构象较敏感的10D6共同用于建立HPV11抗原及疫苗的质量分析方法;利用14A6和9C12 2株单抗建立了灵敏度高、重现性较好的双抗夹心ELISA法,可用于疫苗抗原的生产周期管理,疫苗的放行、工艺改进及稳定性研究。
双抗夹心ELISA方法可作为疫苗的体外效力评价实验(in vitro relative potency assay,IVRP)。有公司已通过长期的数据积累确立了IVRP与动物实验之间的相关性,并将其取代动物实验用于HPV疫苗的常规生产监测和放行实验中[16]。本课题组亦将积累IVRP与动物实验的相关数据,并分析2者的相关性,为IVRP代替动物实验应用于疫苗生产和放行中提供数据支持。
型别特异、构象敏感、中和活性高的单抗作为分子探针可以用于疫苗的免疫效果评价[17-19],从而更好的认识和理解抗原表位信息,有利于进一步研究HPV11抗原与机体的作用机制[20-22]。为获得更加详细的抗原表位信息,后期课题组将尝试通过X-射线晶体衍射技术或低温电镜三维立体重建技术确定关键中和抗体识别的表位,这将有助于新的治疗手段或新型疫苗的研发[23-25]。
综上,本研究获得了较为详细的HPV11 VLP单抗盘的信息,为建立基于抗原抗体特异反应的多角度全方位的疫苗抗原分析方法奠定了工作基础;利用筛选出的单抗建立了HPV11抗原质量分析的双抗夹心ELISA法,为基因工程重组尖锐湿疣疫苗的研发、工艺优化、产品放行和稳定性研究等提供了技术支持。
[1] De Villiers EM.Cross-roads in the classification of papillomaviruses[J].Virology,2013,445(1-2): 2-10.
[2] Chesson HW,Dunne EF,Hariri S,et al.The estimated lifetime probability of acquiring human papillomavirus in the United States[J].Sex Transm Dis,2014,41(11):660-664.
[3] Aubin F,PRETET JL,Jacquard AC,et al.Human papillomavirus genotype distribution in external acuminata condylomata: A large French national study (EDiTH IV)[J].Clin Infect Dis,2008,47(5): 610-615.
[4] Bosch FX,Burchell AN,Schiffman M,et al.Epidemiology and natural history of human papillomavirus infections and type-specific implications in cervical neoplasia[J].Vaccine,2008,26 Suppl 10(K1-16).
[5] Garland SM,Steben M,Sings HL,et al.Natural history of genital warts: analysis of the placebo arm of 2 randomized phase III trials of a quadrivalent human papillomavirus (types 6,11,16,and 18) vaccine[J].J Infect Dis,2009,199(6): 805-814.
[6] Gissmannl L,Wolnik L,Ikenbenrg H,et al.Human papillomavirus types 6 and 11 DNA sequences in genital and laryngeal papillomas and in some cervical cancers[J].Proc Natl Acad Sci U S A,1983,80(2): 560-563.
[7] Dochez C,Bogers JJ,Verhelst R,et al.HPV vaccines to prevent cervical cancer and genital warts: an update[J].Vaccine,2014,32(14): 1595-1601.
[8] Smith JF,Kowalski R,Esser MT,et al.Evolution of type-specific immunoassays to evaluate the functional immune response to Gardasil: a vaccine for human papillomavirus types 16,18,6 and 11[J].Hum Vaccin,2008,4(2): 134-142.
[9] 杨春燕,李少伟,王晋,等.大肠杆菌来源的人乳头瘤病毒11型病毒样颗粒的制备及其免疫原性[J].微生物学报,2009,49(11):1527-1533.
[10] 潘晖榕,李少伟,刘波,等.人乳头状瘤病毒6型类病毒颗粒的制备及其中和抗体的检测[J].肿瘤免疫,2009,29(1):71-76.
[11] 卢五迅,程通,李少伟,等.人乳头瘤病毒16型假病毒中和实验的建立和初步应用[J].生物工程学报,2006,22(6):990-995.
[12] 赵慧,李娟,潘晖榕,等.HPV16/18假病毒中和抗体检测方法的验证[J].微生物学免疫学进展,2012,40(6):20-24.
[13] Culp TD,Spatz CM,Reed CA,et al.Binding and neutralization efficiencies of monoclonal antibodies,Fab fragments,and scFv specific for L1 epitopes on the capsid of infectious HPV particles[J].Virology,2007,361(2):435-446.
[14] Guan J,Bywaters SM,Brendle SA,et al.Structural comparison of four different antibodies interacting with human papillomavirus 16 and mechanisms of neutralization[J].Virology,2015,483:253-263.
[15] Rizk RZ,Christesen ND,Michael KM,et al.Reactivity pattern of 92 monoclonal antibodies with 15 human papillomavirus types[J].J Gen Virol,2008,89(Pt 1):117-129.
[16] Shank-retzlaff M,Wang F,Morley T,et al.Correlation between mouse potency and In Vitro relative potency for human papillomavirus vype 16 virus-like particles and gardasil(R)vaccine samples[J].Hum Vaccines,2005,1(5):191-197.
[17] Wang ZH,Christensen N,Schiller JT,et al.A monoclonal antibody against intact human papillomavirus type 16 capsids blocks the serological reactivity of most human sera[J].J Gen Virol,1997,78:2209-2215.
[18] Roberts C,Green T,Hess E,et al.Development of a human papillomavirus competitive luminex immunoassay for 9 HPV types[J].Hum Vacc Immunother,2014,10(8):2168-2174.
[19] Zhao QJ,Potter CS,Carragher B,et al.Characterization of virus-like particles in GARDASIL(R)by cryo transmission electron microscopy[J].Hum Vacc Immunother,2014,10(3):734-739.
[20] Combita AL,Touze A,Bousarghin L,et al.Identification of two cross-neutralizing linear epitopes within the L1 major capsid protein of human papillomaviruses[J].J Virol,2002,76(13):6480-6486.
[21] Vidyasagar P,Sridevi VN,Rajan S,et al.Generation and characterization of neutralizing monoclonal antibodies against baculo-expressed HPV 16 VLPs[J].Eur J Microbiol Immunol (Bp).,2014,4(1):56-64.
[22] Zhang X,Xin L,Li S,et al.Lessons learned from successful human vaccines: Delineating key epitopes by dissecting the capsid proteins[J].Hum Vaccin Immunother,2015,11(5):1277-1292.
[23] Fleury MJJ,Touze A,Coursaget P.Human papillomavirus type 16 pseudovirions with few point mutations in L1 major capsid protein FG loop could escape actual or future vaccination for potential use in gene therapy[J].Mol Biotechnol,2014,56(5):479-486.
[24] Schellenbacher C,Kwak K,Fink D,et al.Efficacy of RG1-VLP vaccination against infections with genital and cutaneous human papillomaviruses[J].J Invest Dermatol,2013,133(12):2706-2013.
[25] Huber B,Schellenbacher C,Jindra C,et al.A chimeric 18L1-45RG1 virus-like particle vaccine cross-protects against oncogenic alpha-7 human papillomavirus types[J].PloS one,2015,10(3): e0120152.
(编校:吴茜)
Monoclonal antibodies against HPV11 virus-like particles: functional characteristics and application on quality assessment
LI Min1,2, LIN Zhi-jie3, WEI Min-xi3, LI Shao-wei1,2,4, XIA Ning-shao1,2,4, ZHAO Qin-jian1,2 Δ
(1.State Key Laboratory of Molecular Vaccinology and Molecular Diagnostics, Xiamen University, Xiamen 361102, China;2.School of Public Health, Xiamen University, Xiamen 361102, China; 3.Innovax Corporation, Xiamen 361000, China;4.School of Life Science, Xiamen University, Xiamen 361102, China)
ObjectiveTo quantitatively analyze the characteristics of a panel of murine anti-human papillomavirus(HPV)11 L1-derived virus-like particle(VLP)monoclonal antibodies(mAbs)and establish the mAb-based methods for antigen quality analysis.MethodsA panel of 22 murine anti-HPV11 mAbs were characterized in details with their isotype, and binding affinity, conformational sensitivity were examined quantitatively in the direct binding ELISA and Western blot.The hemagglutination inhibition activity of mAbs were identified using the hemagglutination inhibition assay and the pseudovirus(PsV)neutralization efficiency were examined quantitatively using the PsV-based neutralization assay.The type-specific, highly conformational sensitive and neutralizing mAbs were selected to be used in the sandwich ELISA assay.ResultsBased on the quantitative and semi-quantitative results, six type-specific, highly conformational sensitive and neutralizing mAbs (2A2, 4A1-3, 16G7, 14A6, 9C1 and 19C7) were identified.These mAbs, along with 10D6 were screened as the capture mAb or as the detection mAb in the sandwich ELISA.ConclusionThe binding affinity, conformational sensitivity and neutralization efficiency of anti-HPV11 mAbs were characterized in details.A mAb-based sandwich ELISA assay (14A6:Ag:9C12-HRP) were developed, which could be used in the in vitro potency analysis of HPV11 VLP-based vaccine.
human papillomavirus; monoclonal antibody; pseudovirion; neutralization; quality analysis
重大新药创制(2015ZX09101034)
李敏,女,硕士在读,研究方向:生物大分子质量分析,E-mail:km123ll@163.com;赵勤俭,通信作者,男,博士,教授、博士生导师,研究方向:大分子药物研发,E-mail:qinjian_zhao@xmu.edu.cn。
R373
A
10.3969/j.issn.1005-1678.2016.04.03
