阿维菌素降解菌株AW1—18的生长特性及降解活性
2016-07-23胡秀虹张廷辉黄剑
胡秀虹++张廷辉++黄剑
摘要:从长期施用阿维菌素农药的土壤中分离到1株能以阿维菌素为唯一碳源、氮源和能源的不动杆菌(Acinetobacter tandoii) AW1-18。研究了该菌株对阿维菌素的降解曲线、生长条件以及影响因素。结果表明,AW1-18生长所需阿维菌素的最佳浓度为100 mg/L,最适pH值为7.0,温度为30 ℃,通气量为60 mL,细菌接种浓度为3%,培养至6 d时,该菌对阿维菌素的降解率可达76%。加入较低浓度的碳氮源,能促进该菌对阿维菌素的降解。
关键词:不动杆菌;生物降解;生长条件;阿维菌素
中图分类号: X172文献标志码: A文章编号:1002-1302(2016)05-0447-04
阿维菌素(avermectin)在土壤中主要通过非生物降解和微生物降解,非生物降解包括化学水解和光解作用[1-4]。微生物降解作为生物修复技术具有高效、无毒、无二次污染、经济实用、应用范围广等特点,且操作简便,目前,已成为去除残留农药污染物的最主要方式[5],在阿维菌素降解中同样扮演着重要角色,也是目前研究阿维菌素的一个新领域。
张卫等运用恒温培养法研究了阿维菌素在灭菌土壤和未灭菌土壤中的降解动力学[6],结果表明,阿维菌素在土壤中的降解主要由微生物引起,而非生物消解作用较小。相关研究进一步证实嗜麦芽寡养单胞菌[7]、伯克霍尔德氏菌属[8]、蜡样芽孢杆菌[9]能以土壤中的阿维菌素农药作为唯一的碳源、氮源和能源并将其完全降解。本研究从长期施用阿维菌素农药的菜豆土壤中分离到1株对阿维菌素具有良好降解作用的微生物,经鉴定为不动杆菌,命名为Acinetobacter tandoii AW1-18。本试验对该菌株对阿维菌素的降解活性及生长条件等进行了研究。
1材料与方法
1.1材料
不动杆菌菌株AW1-18(Acinetobacter tandoii AW1-18,简称AW1-18),从贵州省贵阳市花溪区多年使用阿维菌素农药的菜豆地土壤中分离获得,经鉴定后保存。阿维菌素原药(B1a≥96%) 由陕西标正作物科学有限公司提供。 无机盐基础培养液(g/L)[10];LB培养基(g/L)[8]。
1.2方法
1.2.1菌悬母液的配制将目标菌株无菌操作条件下接种至LB培养基中,于30 ℃、150 r/min恒温摇床上培养24 h。按文献[11]的具体方法配制菌悬母液。
1.2.2阿维菌素含量分析采用高效液相色谱法(HPLC法)测定。HPLC法测定条件:Agilent 1100高效液相色谱仪,紫外检测器,检测波长为246 nm,色谱柱为 ZORBAX SB-C18(4.6 mm×250 mm,5 μm),流动相为甲醇-水(92 ∶8,V/V),流量为1 mL/min,进样量为20 μL。
1.2.3菌体生长量的测定以波长为600 nm处的D值表示,即测定菌液在紫外波长为600 nm时的吸光度。
1.2.4阿维菌素降解率的测定取AW1-18菌悬液接于含阿维菌素的无机盐培养基中,滴几滴Tween 80乳化剂,适温避光摇床培养,同时设不接菌的空白对照,每个平行3次重复。定期取样做前处理后测定阿维菌素的含量,计算阿维菌素的降解率[12]。通过降解率的比较,判断菌株的降解能力强弱。
1.2.5菌株生长最佳条件的确定改变菌株的培养条件:pH值、温度、底物浓度、装样量、菌株接种浓度和外加碳氮源,通过阿维菌素降解率和D600 nm值的比较,可以确定菌株生长的最佳条件。
1.2.6阿维菌素降解曲线和AW1-18生长曲线的绘制在菌株生长最佳条件下,将菌株AW1-18菌悬液接种于含 100 mg/L 阿维菌素的无机盐培养基中,30 ℃、150 r/min振动培养,从第1天开始取样,测定培养液中阿维菌素的浓度及菌液D600 nm值,每隔3 d测定1次。计算阿维菌素的降解率,以取样时间为横坐标,阿维菌素降解率和D600 nm值为双纵坐标,绘制阿维菌素降解曲线和AW1-18生长曲线,确定 AW1-18 培养最佳时间。
1.3统计学分析
本试验数据使用SPSS 19.0软件,采用Duncans单因素方差分析,多重极差检验法进行数据分析。
2结果与分析
2.1温度对菌株生长及阿维菌素降解率的影响
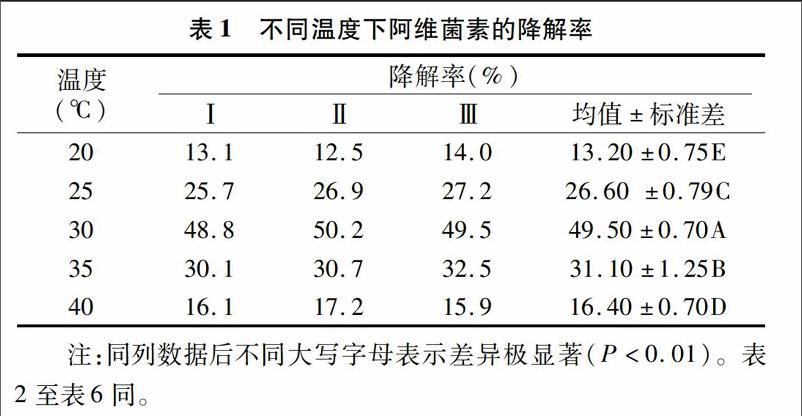
考察温度对菌株AW1-18生长和对阿维菌素降解率的影响。将AW1-18菌悬液按2.5%接种于50 mL含50 mg/L阿维菌素的无机盐培养基中,控制温度分别在20、25、30、35、40 ℃,150 r/min培养6 d后,取样测定细菌D600 nm值和阿维菌素降解率,结果见表1。经统计学显著性差异分析,5个不同温度下AW1-18菌株对阿维菌素的5组降解率存在着极显著差异。
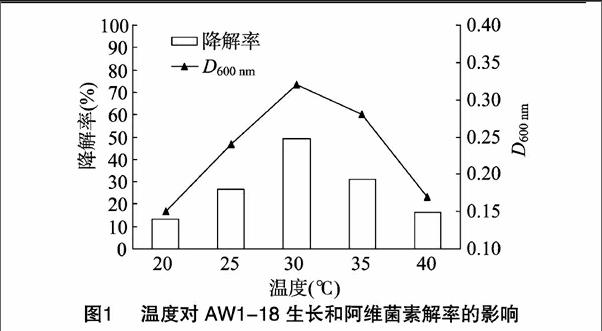
从图1可以看出,不同温度条件下菌株AW1-18的D600 nm值不同,表现出对阿维菌素的降解率也不同。温度主要通过改变酶反应速率来影响菌体的生长,一般温度升高,酶反应速率增大,生长代谢加快,但酶本身又很容易因过热而失去活性。结合统计学分析结果,AW1-18的生长及对阿维菌素的降解受温度影响显著,在温度为20~40 ℃范围内,降解率随培养液温度的升高先增大后减小,当温度为30 ℃时,阿维菌素降解率达到最大值,为49.50%,此时菌体D600 nm值为032,细菌生长最旺盛。结果表明,菌体对阿维菌素的最适降解温度与菌体的最适生长温度是一致的,认为30 ℃为阿维菌素的最佳降解温度。
2.2pH值对菌株生长及阿维菌素降解率的影响
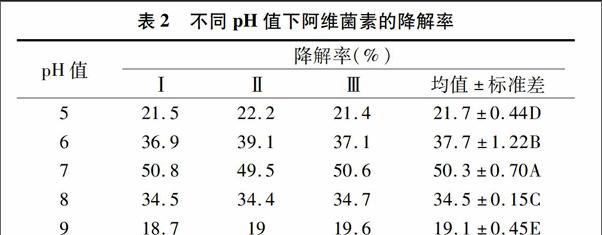
考察培养基初始pH值对菌株AW1-18生长和对阿维菌素降解的影响,将AW1-18菌悬液按2.5%接种于50 mL含50 mg/L阿维菌素的无机盐培养基中,调节pH值为5.0、6.0、7.0、8.0、9.0,在温度为30 ℃条件下,150 r/min培养6 d后,取样测定细菌D600 nm值和阿维菌素降解率,结果见表2。通过统计学显著性差异分析,5个不同pH值下AW1-18菌株对阿维菌素的5组降解率存在着极显著差异,其他依次为6.0、8.0、5.0、9.0。
表2不同pH值下阿维菌素的降解率
pH值降解率(%)ⅠⅡⅢ均值±标准差521.522.221.421.7±0.44D636.939.137.137.7±1.22B750.849.550.650.3±0.70A834.534.434.734.5±0.15C918.71919.619.1±0.45E
从图2可以看出,pH值不同导致菌株AW1-18的D600 nm值不同,表现出对阿维菌素的降解率也不同,说明pH值影响了AW1-18的生长,继而影响了AW1-18对阿维菌素的降解。因为pH值影响菌体细胞膜电荷状况,引起膜渗透性的变化,以及影响营养物离子化程度,从而影响菌体对养分的吸收。在pH值为5~9的范围内,降解率随着培养液的pH值的增大先增大后减小,当pH值为7时,降解率最大,为 50.3%,此时,菌体D600 nm值为0.35。过酸及过碱都会抑制菌株的生长,同时影响其降解酶的活性,从而影响其对阿维菌素的降解。综上分析,得出AW1-18的最佳培养pH值为7.0。
2.3底物浓度对菌株生长及阿维菌素降解率的影响
设置阿维菌素浓度为10、50、100、150、200 mg/L,其他培养条件相同。培养液中不同的阿维菌素起始浓度对菌株AW1-18的生长及其降解性能的影响结果见表3、图3。
不同底物浓度对阿维菌素降解率影响分析结果,10 mg/L与200 mg/L的差异不显著,与50、100、150 mg/L差异极显著,100 mg/L与50 mg/L、150 mg/L、200 mg/L差异极显著。
表3不同底物浓度下阿维菌素的降解率
底物浓度
(mg/L)降解率(%)ⅠⅡⅢ 均值±标准差1031.931.533.532.3±1.05D5052.451.150.151.2±1.15B10077.575.975.876.4±0.95A15044.146.643.744.8±1.57B20031.533.433.232.7±1.04D
试验结果表明,阿维菌素的起始浓度对菌株的生长具有较大影响。培养液中阿维菌素浓度低于100 mg/L时,阿维菌素的增加对降解菌的生长具有促进作用;高于100 mg/L时,阿维菌素对其生长具有一定的抑制作用(图3)。原因是阿维菌素作为降解菌AW1-18生长所需的唯一碳、氮源而被其利用降解,阿维菌素的添加浓度低时,AW1-18因受碳、氮源的限制而生长缓慢;另一方面,AW1-18对阿维菌素的降解代谢是在它分泌的酶作用下进行的,作为此酶的底物,阿维菌素浓度过高可能会对其产生抑制,从而也在一定程度上限制了降解菌对营养物质的摄取量,因而其生长受到影响。从图3可以看出,阿维菌素起始浓度为100 mg/L时,菌株降解率达最大,为76.4%,当到达200 mg/L时,其降解率仍有 32.7%,表明该菌株对阿维菌素具有一定的耐受性。综上分析,100 mg/L 为菌株AW1-18培养所需的阿维菌素最佳初始浓度。
2.4装样量对菌株生长及阿维菌素降解率的影响
装样量反映的是菌株生长需氧量的多少。装样体积(培养液体积) 越大通气量越小,菌株所获得的氧气量越低。不同装样量条件下的阿维菌素降解率见表4。当装样量为60 mL 时,阿维菌素降解率最大。试验结果还表明,不同的装样量在对阿维菌素降解率的影响存在差异,处理间差异极显著。
2.5细菌接种量对菌株生长及阿维菌素降解率的影响
不同细菌接种量条件下的5组菌株AW1-18对阿维菌素的降解率见表5,以接种量为4%时的阿维菌素降解率最大。为验证试验结果和分析的可行性,对表5中的原始数据进行统计学分析,结果表明,不同接种浓度条件下,菌株AW1-18对阿维菌素的降解率差异极显著。接种浓度3%与4%差异不显著,与2.5%、2.0%、1.0%差异极显著。由此得出3%是阿维菌素降解时接种的最佳浓度。
从图5可以看出,随着菌株AW1-18的接种量增加,菌株的D600 nm值增大,阿维菌素的降解率也增大,但是随着接种量增加而增大的趋势在低菌量时表现更为明显,当接种量增加到3%时,降解率虽然仍呈上升趋势,但已趋于平缓。原因可能是随着接种量的增加,微生物生长所需的碳、氮源相对不足,导致有效菌源不多,从而对阿维菌素降解率的影响不大。
2.6不同碳、氮源对菌株生长及阿维菌素降解率的影响
添加0.2%的不同碳、氮源在不同程度上均有利于阿维菌素的降解,其中加入少量蛋白胨和酵母浸膏时,阿维菌素降解率最大。这是由于外加碳、氮源能够促进菌株的生长,使其生物种群增大,从而促进了其对阿维菌素的降解。统计学分析得出,外加少量不同的碳、氮源和空白不加时,阿维菌素降解率差异极显著,但添加蛋白胨与酵母浸膏之间差异不显著,处在同一最高水平上,而与葡萄糖、可溶性淀粉和空白对照之间差异极显著,葡萄糖和可溶性淀粉均与对照存在极显著差异(表6、图6)。
2.7阿维菌素降解曲线和AW1-18生长曲线
在菌株AW1-18生长的最佳条件下研究其生长曲线及阿维菌素的降解曲线,从图7可以看出,阿维菌素降解率与菌株培养时间相关。伴随培养时间的延长,AW1-18菌液的D600 nm值先增大而后逐渐降低,阿维菌素降解率先增大后增大趋势减小直至趋于零。这是因为菌体的生长经过延滞期、对数生长期、稳定期和衰减期4个阶段,在1~3 d,菌体生长还处于延滞期,生长量增长速度相对较慢,3~6 d时增长迅速,菌体可能处在对数生长期,阿维菌素的降解趋势与其保持一致,当培养至6 d时,菌体生长基本到达稳定期,此时,D600 nm值为0.43,阿维菌素降解率为76%,而6 d后菌体生长又开始衰减,生长量逐渐下降,阿维菌素再降解渐少,阿维菌素 15 d 的降解率为86%。由此可得出AW1-18的最佳培养时间为6 d。
3讨论与结论
通过考察温度、pH值、阿维菌素初始浓度等培养条件对菌株AW1-18降解阿维菌素性能的影响,采用单因素方差分析法和Duncan多重比较法对获得的试验数据进行统计学分析,结果表明,培养条件对AW1-18降解阿维菌素的性能有显著的影响,只有在适宜的环境条件下,菌株才能充分发挥其降解能力。AW1-18高效降解阿维菌素的最佳条件与其最适生长条件是一致的。
阿维菌素的初始浓度、温度、pH值、接种量等条件对阿维菌素的降解率均有影响。pH值为7.0,培养温度为30 ℃,阿维菌素初始浓度为100 mg/L,细菌接种量为3%,通气量为 60 mL 时,是菌株AW1-18生长的最适条件,也是阿维菌素降解的最佳条件。在最优条件下,菌株AW1-18对 100 mg/L 阿维菌素6 d的降解率为76%,15 d的降解率为86%。外加少量的碳源、氮源,能够明显促进该菌对阿维菌素的降解。
分析菌株AW1-18的生长曲线及阿维菌素的降解曲线,得出菌株AW1-18在3~6 d生长旺盛,阿维菌素降解迅速,6 d后菌株AW1-18生长衰减,阿维菌素降解缓慢,几乎很少降解,因而得出6 d为菌株AW1-18培养的最佳时间。
参考文献:
[1]张卫,林匡飞,虞云龙,等. 农药阿维菌素在水中的光解动态及机理[J]. 生态环境学报,2009,18(5):1679-1682.
[2]张卫,虞云龙,谭成侠,等. 阿维菌素水解动力学的研究[J]. 农业环境科学学报,2004,23(1):174-176.
[3]Crouch L S,Feely W F,Arison B H,et al. Photodegradation of avermectins B1a thin films on glass[J]. Journal of Agricultural and Food Chemistry,1991,39(7):1310-1319.
[4]Demchak R J,Dybas R A. Photostability of abamectin/zein microspheres[J]. Journal of Agricultural and Food Chemistry,1997,45(1):260-262.
[5]张久刚,闫艳春. 微生物对拟除虫菊酯类农药残留的生物修复[J]. 生物技术通讯,2006,17(6):1004-1007.
[6]张卫,虞云龙,林匡飞,等. 阿维菌素在土壤中的微生物降解研究[J]. 应用生态学报,2004,15(11):2175-2178.
[7]张卫,虞云龙,吴加伦,等. 阿维菌素高效降解菌的筛选及其降解特性[J]. 上海交通大学学报:农业科学版,2004,22(2):157-161,180.
[8]李荣,管晓进,陈荣宗,等. 阿维菌素降解菌株AW70的分离鉴定及降解特性研究[J]. 土壤,2009,41(4):607-611.
[9]李玉华. 阿维菌素降解菌的筛选及其降解特性研究[D]. 扬州:扬州大学,2010.
[10]周德庆. 微生物学实验手册 [M]. 上海:上海科学技术出版社,1986:137-162.
[11]王琨. 高效氯氟氰菊酯降解菌的分离及其降解特性[D]. 南京:南京理工大学,2008.
[12]胡秀虹,李景壮,叶胜蓝,等. 一株阿维菌素降解菌AW1-18的筛选与分类鉴定[J]. 生物技术通报,2012(10):223-228.梁胜男,赵玲,董元华,等. 生物质灰渣对红壤中Cd含量及其生物有效性的影响[J]. 江苏农业科学,2016,44(5):451-453.
