核桃楸青果皮中胡桃醌的提取工艺
2016-07-23冯迟王舒雅高俊
冯迟++王舒雅++高俊
摘要:以核桃楸青果皮为原料,以固液比、超声温度、超声时间和超声功率为考察因素,通过单因素试验优选核桃楸青果皮中胡桃醌的最佳提取方法,通过L9(34)正交试验对提取过程进行优化,结果表明,超声辅助提取为最佳提取方法,其最佳工艺条件:提取溶剂为90%乙醇溶液,固液比1 mg ∶18 L,超声温度30 ℃,超声时间30 min,超声功率 200 W,此时胡桃醌的提取率为1.72 mg/g。
关键词:胡桃醌;核桃楸青果皮;正交试验;超声辅助提取
中图分类号: R284.2文献标志码: A文章编号:1002-1302(2016)05-0340-03
核桃楸(Juglans mandshurica)为胡桃科胡桃属落叶乔木,是我国珍贵的药源植物。核桃楸青果皮中含有较多的活性物质胡桃醌(5-羟基-1,4-萘醌)[1]。核桃成熟期间,大量核桃楸青果皮被当作垃圾堆放于地头、沟边或田间,对环境造成极大污染,如果能对核桃楸青果皮中的有效物质进行有效利用,则在保护环境的同时还能增加果农的收入,具有显著的经济效益和社会效益。现代药用研究表明,胡桃醌具有很好的镇痛、抗肿瘤和抑癌作用,胡桃醌进入细胞体具有抗真菌细胞毒素和抗滤过性病原体的性质[2-3]。本试验以胡桃醌提取率为评价指标,对胡桃醌的提取方法及其工艺进行优化,旨在为核桃楸青果皮及其药用价值的充分利用提供依据[4-6]。
1材料与方法
1.1材料与试剂
核桃楸果实,购自吉林省通化市(长白山林区);对照品为胡桃醌,纯度≥97%,由Sigma公司生产;甲醇为色谱纯,由J&K化学有限公司生产;去离子水自制;其他试剂均为国产分析纯。
1.2仪器
Agilent 1260LC高效液相色谱仪,配置G1311-B四元泵、G1311-B自动进样器、G1316-A柱温箱、G1314-F紫外检测器,由美国Agilent公司生产;Milli-Q纯水仪,由美国Millipore公司生产;KQ-250DE型数控超声波清洗器,由江苏省昆山市超声仪器有限公司生产;Allegra X-30R型离心机,由美国Beckman Coulter公司生产。
1.3原料的预处理
因胡桃醌为小分子萘醌,于45 ℃左右易升华,所以采用真空冷冻干燥方法,先将核桃楸青果皮用真空冷冻干燥机进行干燥,再将核桃楸青果皮进行粉碎,过60~80目筛,即得试验所需原料[7]。
1.4分析方法
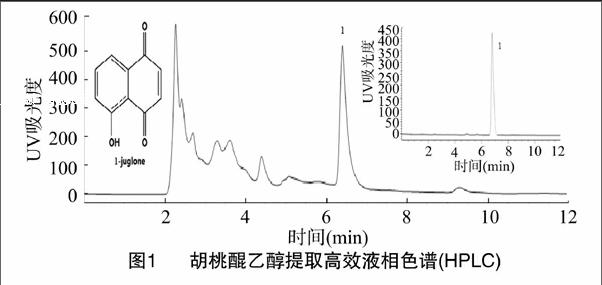
通过全波长扫描,胡桃醌在250 nm处有特征吸收峰,采用高效液相色谱法检测样品中胡桃醌含量(图1)[8]。色谱条件为:Agilent ODS-C18色谱柱(250 mm×4.6 mm,5 μm);柱温25 ℃;流速1.0 mL/min;进样量10 μL;流动相A相为超纯水溶液,B相为甲醇溶液,流动相配比为A ∶B=35 ∶65[9]。
1.5胡桃醌标准曲线的建立
精确称取胡桃醌标准品4.00 mg,用甲醇溶解于10 mL容量瓶中,定容[10],作为标准品贮备液;精确量取标准品储备液,用甲醇稀释配制成浓度为0.2、0.1、0.05、0.025、0.012 5、0.006 25、0.003 125 mg/mL的标准品溶液;分别用0.22 μm滤膜过滤,进行HPLC检测,每个浓度重复进样3次[11]。以胡桃醌浓度(XJuglone)为横坐标,以胡桃醌峰面积积分值(YJuglone)为纵坐标绘制标准曲线,得回归方程YJuglone=99.053XJuglone -0.237 15(r2=0.999 4),胡桃醌在0.006 25~0.3 mg/mL 范围内线性关系良好。
1.6提取方法的比较
1.6.1索式提取法准确称取绝干核桃楸青果皮样品 1.0 g,置于500 mL索氏提取器烧瓶中,加入20 mL乙醇溶液,热回流2次,水浴温度为80 ℃,每次30 min;离心,取上清液,用0.22 μm滤膜过滤;HPLC检测。
1.6.2冷浸法准确称取绝干核桃楸青果皮样品1.0 g,加入20 mL乙醇溶液,密封,置于避光处冷浸12 h;离心,取上清液,用0.22 μm滤膜过滤;HPLC检测。
1.6.3超声辅助提取法准确称取绝干核桃楸青果皮样品1.0 g,置于50 mL锥形瓶中,加入20 mL乙醇溶液,密封,超声辅助提取30 min(超声温度30 ℃、功率250 W);离心,取上清液,用0.22 μm滤膜过滤;HPLC检测。
1.7单因素试验
1.7.1乙醇浓度对胡桃醌提取率的影响准确称取绝干核桃楸青果皮样品1.0 g,依次加入浓度为80%、85%、90%、95%、100%的乙醇溶液 20 mL,超声提取30 min(超声温度 30 ℃、超声功率250 W);离心,取上清液,用0.22 μm滤膜过滤;HPLC检测。
1.7.2固液比对胡桃醌提取率的影响准确称取绝干核桃楸青果皮样品1.0 g,以1 g ∶12 mL、1 g ∶14 mL、1 g ∶16 mL、1 g ∶18 mL、1 g ∶20 mL 的固液比加入90%乙醇溶液,超声提取30 min(超声温度30 ℃、超声功率250 W);离心,取上清液,用 0.22 μm 滤膜过滤;HPLC检测。
1.7.3超声温度对胡桃醌提取率的影响准确称取绝干核桃楸青果皮样品1.0 g,以1 g ∶16 mL的固液比加入90%乙醇溶液,在超声功率250 W条件下,依次以20、25、30、35、40 ℃ 的超声温度反应30 min;离心,取上清液,用0.22 μm滤膜过滤;HPLC检测。
1.7.4超声时间对胡桃醌提取率的影响准确称取绝干核桃楸青果皮样品1.0 g,以1 g ∶16 mL的固液比加入90%乙醇溶液,在超声功率250 W、超声温度30 ℃条件下,依次超声反应10、20、30、40、50 min;离心,取上清液,用0.22 μm滤膜过滤;HPLC检测。
1.7.5超声功率对胡桃醌提取率的影响准确称取绝干核桃楸青果皮样品1.0 g,以1 g ∶16 mL的固液比加入90%乙醇溶液,在30 ℃超声温度条件下,依次以超声功率150、175、200、225、250 W反应30 min;离心,取上清液,用0.22 μm滤膜过滤;HPLC检测。
1.8正交试验设计
运用超声法提取,以固液比(A)、超声温度(B)、超声时间(C)、超声功率(D)为考察因素,进行4因素3水平L9(34)正交试验(表1) [12]。
2结果与分析
2.1提取方法的比较
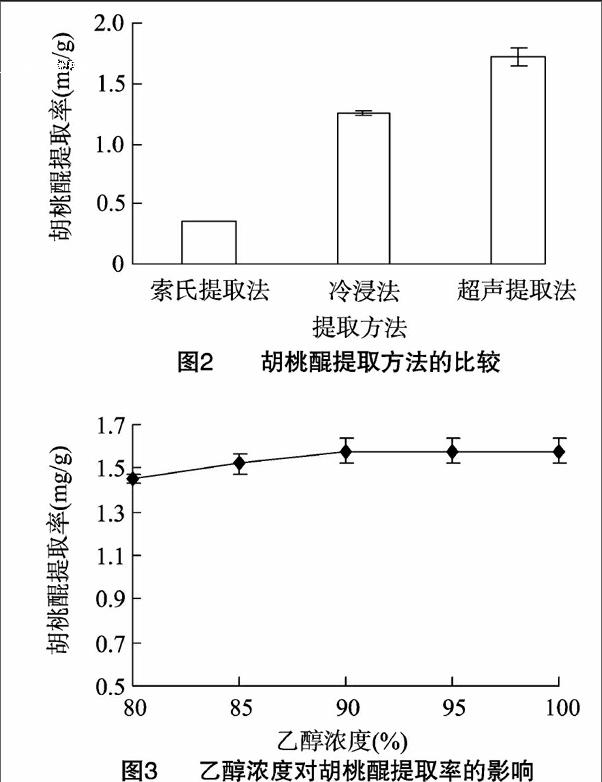
游离的醌类化合物一般都具有升华性,而胡桃醌属于小分子萘醌,具有挥发性,温度过高时胡桃醌会随溶剂挥发而损失,导致提取率最低。由图2可知,索式提取法对胡桃醌的提取率相对最低;超声提取法所用时间短、提取效率相对最高,优于冷浸法。
2.2单因素对胡桃醌提取率的影响
2.2.1乙醇浓度对胡桃醌提取率的影响由图3可见,随乙醇浓度的增加,胡桃醌提取率逐渐增加,乙醇浓度为80%~90%时,胡桃醌提取率增加较快,这是由于有机溶剂的增加有助于胡桃醌的溶解;当乙醇浓度进一步增加时,胡桃醌提取率增长趋势趋于平缓,基本持平。因此,90%乙醇溶剂是最为适宜用量。
2.2.2固液比对胡桃醌提取率的影响由图4可见,固液比在1 g ∶(12~16) mL时,胡桃醌提取率随提取溶剂用量的增加而增加,这说明溶剂量增大,会直接影响胡桃醌从原料内部向外部扩散;固液比在1 g ∶(16~20) mL时,胡桃醌提取率基本持平。考虑到提取溶剂用量增加时,不仅会增加生产成本,还会增加分离纯化难度,所以固液比以1 g ∶16 mL为宜。
2.2.3超声温度对胡桃醌提取率的影响由图5可见,超声温度为20~30 ℃时,胡桃醌提取率随温度上升而增加,这是由于温度升高,胡桃醌扩散系数增大,有效成分浸出速度加快,从而提取率增加较快;当超声温度为30~40 ℃时,胡桃醌提取率下降,这是由于温度过高,胡桃醌结构遭到破坏。所以,超声温度以30 ℃为宜。
2.2.4超声时间对胡桃醌提取率的影响由图6可见,超声时间为10~30 min时,胡桃醌提取率随提取时间延长而逐渐增加,这是由于随着超声时间的延长,超声波对底物产生的搅拌和空化作用增强,进而使溶出物质增多;超过30 min时,超声波会破坏提取物中部分胡桃醌的结构,从而导致提取率降低。因此,为保证有效成分结构完好且提取尽可能完全,超声时间以30 min为宜。
2.2.5超声功率对胡桃醌提取率的影响超声波作用的效果取决于单位面积输出的超声功率和所提取物的结构与性质,不同的提取物有不同的适宜超声功率范围,超过此范围,超声作用可能对提取物结构造成损害,从而影响其提取量。由图7可见,胡桃醌提取率随超声功率的增加而增加;当超声功率超过200 W,胡桃醌提取量随超声功率的增加而下降,这可能是由于高超声功率可使胡桃醌分解。所以,胡桃醌提取超声功率以200 W为宜。
2.3正交试验优选最佳工艺组合
由表2、表3可见,影响核桃楸青果皮中胡桃醌提取率的因素从大到小依次为固液比>超声功率>超声时间>超声温度,核桃楸青果皮中胡桃醌的最佳提取工艺为A3B2C2D2,即固液比1 g ∶18 mL、超声温度30 ℃、超声时间30 min、超声功率200 W。按正交试验优化工艺条件进行3次验证,测得核桃楸青果皮中胡桃醌的平均提取率为1.72 mg/g。
3结论
胡桃醌为小分子萘醌,45 ℃左右易升华,所以索式提取法胡桃醌提取率相对最低。超声提取法由于直接作用于分子内部,提取效率高,提取率高于索氏提取法、冷浸法。本试验对核桃楸青果皮中胡桃醌提取工艺的影响因素进行单因素试验,在此基础上设计正交试验,最终确定超声波辅助提取的最佳工艺条件:90%乙醇溶液为溶剂、固液比为1 g ∶18 mL、超声温度为30 ℃、超声时间为30 min、超声功率为200 W,此条件下胡桃醌的提取率为1.72 mg/g,这为核桃楸青果皮中有效成分胡桃醌的开发利用提供了一个较为科学合理的理论依据。
参考文献:
[1]曲中原,邹翔,胡国军,等. 青龙衣中胡桃醌提取工艺研究[J]. 中医药学报,2008,36(4):30-32.
[2]程力惠,黄晓文. 核桃楸树皮中胡桃醌提取方法及其工艺研究[J]. 亚热带植物科学,2010,39(4):33-35.
[3]王文泽,刘洪章,刘淑英,等. 核桃楸青果皮中胡桃醌的提取工艺研究[J]. 北方园艺,2013(15):153-157.
[4]魏赫楠,谭红,包娜,等. 核桃青皮中胡桃醌的提取工艺[J]. 江苏农业科学,2014,42(2):215-217.
[5]赵岩,刘淑萍,吕朝霞. 核桃青皮的化学成分与综合利用[J]. 农产品加工,2008(11):66-68.
[6]李钧,曲中原,邹翔,等. 青龙衣中胡桃醌的分离与鉴定[J]. 哈尔滨商业大学学报:自然科学版,2011,27(5):641-644.
[7]李宇,吴浩杰,周茜,等. 胡桃醌的提取条件优化与定量分析概述[J]. 现代园艺,2014(16):5-6.
[8]Pereira J A,Oliveira I,Sousa A,et al. Bioactive properties and chemical composition of six walnut(Juglans regia L.) cultivars[J]. Food and Chemical Toxicology,2008,46(6):2103-2111.
[9]李青,谭红,袁鑫,等. 高效液相色谱法测定核桃青皮中胡桃醌的含量[J]. 江苏农业科学,2014,42(1):259-261.
[10]Carvalho M,Ferreira P J,Mendes V S,et al. Human Cancer cell antiproliferative and antioxidant activities of Juglans regia L.[J]. Food and Chemical Toxicology,2010,48(1):441-447.
[11]孙墨珑,宋湛谦,方桂珍. 核桃楸总黄酮及胡桃醌含量测定[J]. 林产化学与工业,2006,26(2):93-95.
[12]Wang S Y,Gao J,Chen Y L,et al. Optimisation of the ethanol-based heat reflux extraction of isoflavones from Pueraria lobata (Willd.) Ohwi root[C]. 2014 3rd International Conference on Energy and Environmental Protection,2014:180-186.路志芳,袁超,陈现臣,等. 小麦交联淀粉制备及淀粉性质研究[J]. 江苏农业科学,2016,44(5):343-346.
