鹅副黏病毒病的RT—PCR鉴定及病理组织学观察
2016-07-23黄银云胡新岗郭广富
黄银云++胡新岗++郭广富
摘要:鹅副黏病毒病由副黏病毒科禽副黏病毒Ⅰ型鹅副黏病毒感染引起,主要表现为消化系统、免疫系统、神经系统的症状和病变。通过临床病例观察该病的临床症状和病理变化,利用RT-PCR方法鉴定病原,采用病理组织学技术进行分析。结果表明,鹅副黏病毒是一种泛嗜性病毒,可在鹅体内的多种器官中复制,并造成多器官组织的损伤,从而引起患鹅消化系统、免疫系统、神经系统的症状和病变。
关键词:鹅;副黏病毒;RT-PCR;鉴定;病理组织;观察
中图分类号: S858.335.3文献标志码: A文章编号:1002-1302(2016)05-0302-03
鹅副黏病毒病是由副黏病毒科禽副黏病毒Ⅰ型鹅副黏病毒感染引起的一种急性、高度接触性、病毒性传染病。患鹅主要表现为消化系统、免疫系统、神经系统的症状和病变[1],以肠道糠麸样溃疡、胰腺肿胀且表面有灰白色坏死灶、脾脏肿大并有大小不等的灰白色坏死灶为主要特征[2]。鹅副黏病毒病于1997年在江苏省发现,不同日龄的各品种鹅群不分季节均易感,发病率为40%~100%,死亡率达30%~100%,2周龄以内雏鹅的发病率、死亡率均可达100%,现已成为严重影响我国养鹅业健康发展的重要疫病[3]。2014年夏季,苏北地区某肉鹅场饲养的7周龄狮头鹅发生疑似副黏病毒病,根据流行病学调查、临诊症状观察、分子生物学诊断,确诊为鹅副黏病毒感染,并进行病理组织学观察,为该病的正确诊断提供分子生物学及病理组织学方法。
1材料与方法
1.1材料
1.1.1病料病料采自苏北地区某肉鹅场,该场疑似感染鹅副黏病毒,病鹅的临床症状及肝、脾、胰、肺、肾、肠等病理变化明显。
1.1.2主要设备RM2235型徕卡切片机,PTC-200rev型PCR仪,DYY-7C型电泳仪,DYCP-31DN型琼脂糖水平电泳槽,Mikro200R型冷冻高速离心机,JS-380A型自动凝胶图像分析仪,恒温箱,微量移液器等。
1.1.3常用试剂10%福尔马林、乙醇、石蜡、二甲苯、苏木精、伊红、盐酸、树胶等均为国产试剂。200 bp DNA Ladder Marker购自宝生物工程(大连)有限公司,病毒基因组DNA/RNA提取试剂盒购自天根生化科技(北京)有限公司,2×Lamp MasterMix(含染料)购自康为世纪生物科技有限公司。Murine RNase Inhibitor、HiScriptReverse Transcriptase均购自南京诺唯赞生物科技有限公司。6 nt随机引物购自Fermentas公司。
1.1.4RT-PCR引物设计与合成根据EMBL/GenBank上已公布病毒的相关基因序列,由上海英潍捷基生物技术有限公司采用Primer premier 5.0引物设计软件设计NDV-F引物1对,目的基因片段大小为970 bp。F1:5′-GCCGAATTCCCGAATCATCACGACGCTTAA-3′;F2:5′-GTGAAGCTTGAGTCTGTGAGTCGTAC-3′。
1.2方法
1.2.1流行病学调查通过约谈鹅场饲养员和技术人员、查看养殖档案、进行群体观察和个体检查,了解该鹅群发病的具体情况,为鹅副黏病毒病的正确诊断提供流行病学信息。
1.2.2临床症状观察重点观察病鹅消化系统、神经系统、呼吸系统的症状。观察病鹅的运动姿态,有无扭颈、仰头、转圈等神经症状,有无甩头、咳嗽等呼吸症状。观察粪便的状态及颜色、眼睛有无分泌物等。
1.2.3大体病理剖检重点检查肝脏、脾脏、胰腺,特别是全部肠道、盲肠扁桃体。
1.2.4病理组织学观察采集新鲜病死鹅的消化器官(腺胃、肠)、免疫器官(脾脏、胸腺、法氏囊)、神经器官(脑)等;以福尔马林溶液固定后,利用乙醇经脱水机自控脱水、二甲苯透明、石蜡包埋;采用切片机切成片厚为4~6 μm的薄片,经苏木精-伊红染色(H·E染色)后镜检拍照。
1.2.5双抗PBS的配制将OIE推荐的配方[4]略作调整,采用pH值为7.2的PBS溶液配制运输液,溶液中青霉素(penicilin)、链霉素(streptomycin)的剂量分别为 10 000 unit/mL、10 mg/mL。采用浓度为1 mol/L的NaOH溶液将其pH值调节至7.2。
1.2.6RNA提取及cDNA转录将疑似副黏病毒感染的雏鹅器官病料剪碎,加入预冷双抗的PBS研磨,反复冻融3次后以3 000 r/min离心10 min,每份吸取200 μL上清液用于病毒基因组的提取。根据病毒基因组DNA/RNA提取试剂盒说明书进行RNA的提取,测其含量为320 μg/μL。采用6 nt随机引物进行反转录(于65 ℃加热5 min,迅速置于冰上骤冷并静置2 min)。根据HiScript Reverse Transcriptase说明书进行反转录以获得病毒的cDNA(置于PCR仪中进行反应,反应程序为50 ℃ 45 min、85 ℃ 5 min)。
1.2.7基因片段的扩增根据2×Lamp MasterMix(含染料)说明书进行PCR扩增。PCR反应条件为:94 ℃ 2 min;94 ℃ 30 s;退火温度为55 ℃,72 ℃下延伸时间为1.0 min,30个循环;72 ℃ 5 min。PCR产物经凝胶电泳检测。
2结果与分析
2.1流行病学特点
该鹅场约有7周龄狮头鹅2 100羽,至送检时已发病 7 d,约900羽发病,发病率约为43%;病死320余羽,病死率约为36%。部分病鹅发病5~6 d后逐渐好转,10 d左右康复。发病期间未采取隔离措施,仅以氟苯尼考等药物治疗,效果不理想。
2.2临床症状
患鹅病初食欲下降、精神沉郁,粪便稀薄呈白色。随着病情加重,稀粪呈暗红或微黄色,直至变为水样黄白色。病程中期,患鹅表现为厌食、饮水增加、羽毛逆乱且无光泽、站立不稳,病情严重的鹅质量明显减轻。病程后期患鹅严重脱水、迅速消瘦、翅膀下垂,多数呈瘫痪状,多排绿色粪便,直至衰竭死亡。濒死期的患鹅体温下降、食欲废绝、蹲地,对外界刺激反应迟钝。部分死亡后的鹅表现神经症状,头颈扭曲或昂头,倒提从口中流出水样黏液。
2.3大体剖检病变
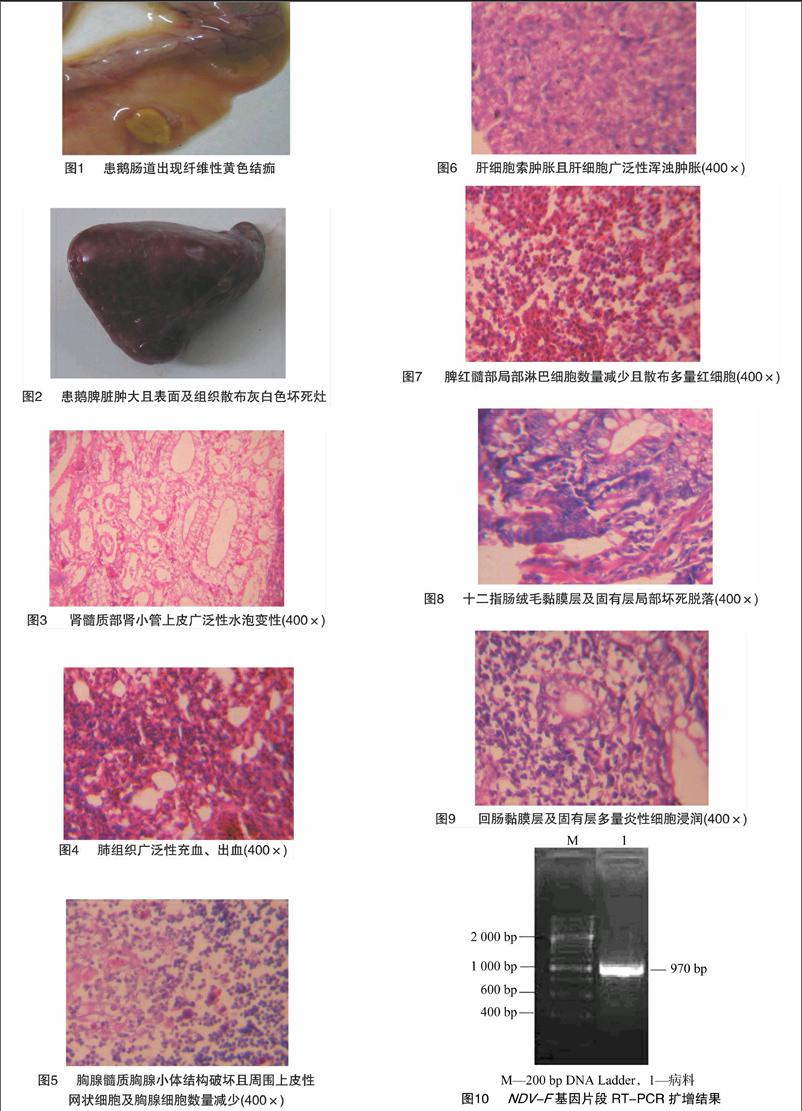
剖检病死鹅可见口腔有大量黏液,气管和支气管环充血、出血,内有大量黏液。食道和腺胃交界处出血、溃疡,食道黏膜附着的纤维性结痂块呈灰白色或黄色;腺胃黏膜充血、出血、溃疡;肌胃和腺胃交界处有出血斑点,肌胃角质层下充血、出血、溃疡。十二指肠、空肠、回肠黏膜附有特征性的黄色纤维性结痂(图1);直肠泄殖腔黏膜出血、溃疡,痂块表面附着的脓汁样分泌物呈灰白色、淡黄色;盲肠扁桃体出血、肿大、溃疡,部分病鹅的盲肠黏膜也有淡黄色痂块、溃疡灶;胰腺黏膜充血、出血。部分病鹅的肝脏质地较硬、肿大、瘀血;胆囊扩张,充盈胆汁;脾脏瘀血、肿大,表面布满灰白色坏死灶(图2);肺脏有不同程度的充血、出血;肾脏略肿大、色淡,输尿管扩张,充满白色尿酸盐;胸腺、法氏囊萎缩;大脑和小脑充血、水肿。
2.4显微病理变化
肾小管上皮严重颗粒变性,部分细胞坏死崩解(图3)。肺组织广泛性充血、出血(图4)。胸腺髓质胸腺小体结构破坏,周围上皮性网状细胞、胸腺细胞数量减少(图5)。肝细胞广泛发生颗粒变性、浑浊肿胀(图6)。脾红髓部局部淋巴细胞数量减少,散布大量红细胞(图7)。十二指肠绒毛黏膜层、固有层局部坏死脱落(图8)。回肠黏膜层、固有层有大量炎性细胞浸润(图9)。
2.5基因片段的扩增结果
电泳检测结果显示,NDV-F的条带大小(图10)与预期结果一致。
3结论与讨论
病理组织学研究显示,鹅副黏病毒可在肝脏、肾脏、脾脏、胰腺、肠道、胸腺等全身多种器官和组织中复制,并对其造成损伤,造成较为典型的显微及大体病理变化。此外,鹅副黏病毒还能导致患鹅心肌纤维广泛发生颗粒变性,并使气管黏膜上皮细胞坏死脱落、固有层充血、毛细血管瘀血[5],使大脑和小脑充血,法氏囊萎缩。可见,鹅副黏病毒是一种泛嗜性病毒,其泛嗜性是导致鹅副黏病毒病在临床上具有较高发病率和病死率的主要原因。患鹅临床表现出的消化系统、神经系统、免疫系统等方面的症状,是由相应器官和组织发生病理变化所致,症状的轻重与病理变化的程度密切相关。
鹅副黏病毒病对各日龄鹅均有易感性,日龄越小则发病率和病死率越高,发病率和病死率均随日龄的增长有所下降,2周龄以内雏鹅的发病率和病死率可达100%[6]。鹅副黏病毒对患鹅免疫系统的侵害比较严重,日龄越小的鹅其免疫系统发育越不成熟,自身免疫能力越低,感染后的发病率和病死率越高;日龄越大的鹅其免疫系统发育越成熟,免疫能力越强,感染后的发病率和病死率有所降低,发病后约7 d有可能逐渐痊愈康复。对小日龄鹅群加强饲养管理,严格执行消毒措施,处理好患鹅所污染的饲料、饮水、垫草、垫料、用具,无害化处理死鹅、内脏、羽毛等,谨防该病通过消化道和呼吸道感染。
鹅副黏病毒属于禽副黏病毒Ⅰ型F基因Ⅶ型毒株,与新城疫常用的弱毒苗、中等毒力苗的毒株基因型不同;因此,仅用这些疫苗进行免疫不能防治鹅副黏病毒病,只有选用经过基因鉴定的毒株制备灭活苗,才能有效预防本病的发生[7-8]。鹅场应制定科学合理的免疫程序,做好鹅群的免疫监测工作,定期检测鹅副黏病毒病的抗体(HI抗体)水平,做到科学免疫。遏制鹅副黏病毒病的发生和流行,必须采取综合防治措施。鸡群也能感染鹅副黏病毒病,因此鹅场须远离鸡场、村户,鹅群内不饲养鸡,避免相互传播[5]。鹅群一旦发病应该立即隔离或淘汰病鹅,同时对假定健康鹅进行紧急免疫接种。
参考文献:
[1]万洪全,刘海侠,吴力力,等. 鹅副黏病毒对鸽的致病性研究[J]. 中国兽医科技,2002,32(5):5-8.
[2]张伟,刁有祥,徐福亮,等. 鹅副黏病毒LS-1株的分离鉴定及F基因分析[J]. 西南大学学报:自然科学版,2011,33(4):31-35.
[3]王永坤,朱国强,金山,等. 水禽病诊断与防治手册[M]. 上海:上海科学技术出版社,2002:36-45.
[4]Anonymous. OIE Manual of standard ford:agnostic tests and vaccines[M]. 2nd ed. Paris,France:Office International des Epizooties,1992.
[5]李鹏飞,李盛强,郭剑英,等. 广东地区几例鹅副黏病毒病的剖检变化[J]. 兽医导刊,2009(11):57.
[6]张伟,季艳菊,陈芳艳,等. 鹅副黏病毒病的诊断与防控[J]. 吉林畜牧兽医,2008,26(12):28-29.
[7]王永坤,田惠芳,周继宏,等. 鹅副黏病毒病的研究[J]. 江苏农学院学报,1998,15(6):12.
[8]吴民. 鹅副黏病毒F基因的克隆和序列分析[J]. 江苏农业科学,2014,42(7):35-36.
