四唑染色法测定茄子种子生活力
2016-07-23余振宙陶鸿占梦丹
余振宙++陶鸿++占梦丹
摘要:根据四唑(2,3,5-Triphenyl Tetrazolium Chloride,缩写TTC)染色法测定种子生活力的原理,研究不同浓度四唑溶液,不同染色温度和不同染色时间对京茄218茄子种子生活力测定的影响,摸索出测定茄子种子生活力的最佳条件。结果表明,四唑溶液浓度,染色温度,染色时间三者之间存在一定的相关性,通过改变三者中的一者或两者可以达到改变其他两者或一者的目的,因此,可根据实际需要来确定测定条件。比较四唑染色法测定京茄218茄子种子生活力的不同条件,本研究提出处理组合11(浸种温度20 ℃、浸种时间18 h、染色液浓度1%、染色温度35 ℃、染色时间18 h)和处理组合23(浸种温度30 ℃、浸种时间4 h、染色液浓度1%、染色温度35 ℃、染色时间18 h)为最理想的2组处理组合,为TTC法快速测定京茄218茄子种子生活力的适宜方法。
关键词:四唑染色;茄子种子;生活力
中图分类号: S641.101文献标志码: A文章编号:1002-1302(2016)05-0206-03
收稿日期:2015-04-09
基金项目:北京市农林科学院青年科研基金(编号:QNJJ201211);国家科技支撑计划(编号:2012BAK26B03);北京市农林科学院科技创新能力建设专项(编号:KJCX201202001、KJCX20140111);北京市科委重大科研项目(编号:D131100000413001)。
作者简介::余振宙(1989—),男,安徽潜山人,硕士。E-mail:291765585@qq.com。
通信作者:孟淑春,副研究员,主要从事蔬菜种质资源和种子技术研究。E-mail:mengshuchun@nercv.org。种子生活力是种子质量的重要指标,是种用价值的主要组成部分,与种子田间出苗率密切相关,是反映种子生命过程中十分重要的特性之一[1]。由于采用常规的发芽试验测定发芽力需要的时间较长,而种子寿命长短各异,为了确定种子是否能用于播种及确定播种量,有必要进行种子生活力的快速高效率测定。目前种子生活力的快速测定法主要有四唑(2,3,5-氯化三苯基四氮唑;2,3,5-triphenyl tetrazolium chloride,TTC)染色法,溴麝香草酚兰(BTB)法和紫外荧光法等。其中种子生活力TTC测定法现已被世界各国广泛使用,其原理为有生活力的种子胚细胞含有脱氢酶,具有脱氢还原作用,被种子吸收的无色TTC接受活种子呼吸过程中脱氢酶产生的氢,而变成还原态的红色稳定不扩散物质[2],即不溶于水的三苯基甲腙(TTF),而无生活力的种子则无此反应,故无染色出现,由此可按胚组织的染色情况区分是否有生活力的种子[3]。
茄子(Solanum melongena L.) 为茄科(Solanaceae)茄属(Solanum)中以浆果为产品的一年或多年生草本植物,起源于亚洲南部热带地区,古印度为其最早驯化地[4],中国栽培茄子历史悠久,是茄子第二起源地,拥有丰富的茄子种质资源[5]。茄子是世界上第四大蔬菜作物,我国是世界上最大的茄子生产国,占世界总面积的49.16%[6]。茄子种植区域广,种子用量大,但是休眠现象比较普遍[7]。如何快速测定茄子种子生活力,确定茄子种子最大发芽潜力,评定种子质量,成为当前休眠茄子种急需解决的主要问题。《国际种子检验规程》(international rules for seed testing)已列入农业、园艺和林木的部分种子种类和应用范围内各类种子的鉴定标准[3],但迄今为止工作比较集中于木本植物及大田作物种子,如水稻[8]、小麦[9]、玉米[10]等。蔬菜种子生活力测定方法的研究极少,仅在番茄[11]、苦瓜[12]、冬瓜[13]等方面有报道。目前,除番茄属作物外,其他蔬菜种子尚未列入《国际种子检验规程》。我国《农作物种子检验规程》和《国际种子检验规程》中均未对茄子种子的TTC染色进行详细描述,茄子种子生活力的具体鉴定标准和茄子种子四唑染色图谱尚未见报道。试验以京茄218茄子种子为材料,研究比较TTC法快速测定茄子种子生活力的适宜条件,快速预测茄子种子最大发芽潜力,以解决茄子种子质量的快速评价和设定田间播种量等生产实际问题,为茄子种子生产和销售提供参考依据,为茄子种子生活力TTC测定法早日列入我国的《农作物种子检验规程》和《国际种子检验规程》奠定基础。
1材料与方法
1.1试验材料
1.1.1种子材料试验所用种子为京茄218茄子种子,2014年9月新采收,由北京京研益农科技发展中心提供。
1.1.2试验仪器和药品试验仪器有发芽箱、发芽盒(透光)、恒温箱(20、30、35 ℃)、培养皿、镊子、解剖刀、解剖针、标签纸、滤纸、量筒、烧杯、容量瓶(100 mL)、棕色瓶、体式显微镜(Leica Microsystems Ltd.)等。试验药品有四唑(2,3,5-tripheny tetrazolium chloride)粉剂,由日本东京化成工业株式会社(Tokyo Chemical Industry,TCI)生产。
1.2试验方法
1.2.1发芽试验对供试京茄218茄子种子经净度分析后,随机选取每重复100粒种子,4次重复,在发芽箱内(20 ℃、16 h 黑暗;30 ℃、8 h光照)进行纸上发芽试验,7 d初数,14 d终数,统计发芽率。
1.2.2适宜浸种温度、时间的探究对供试种子经净度分析后,每次随机数取100粒种子在20 ℃浸种18 h;30 ℃浸种4 h,取出各组种子同一操作者相同方法人工剥皮,分别计时,最终找出最适宜剥皮的一组,其温度、时间即为适宜的浸种温度、时间(以单位时间内剥皮的种子数或剥皮一定的种子数所用的时间为标准来判别和找出最适宜剥皮的那组),试验设4次重复。
1.2.3TTC溶液配制磷酸缓冲液配制[14]:母液Ⅰ,称取9.078 g KH2PO4溶于1 000 mL蒸馏水中;母液Ⅱ,称取9.472 g Na2HPO4或11.876 g Na2HPO4·2H2O溶于1 000 mL蒸馏水中。然后取母液Ⅰ2份和母液Ⅱ3份混合均匀,测pH值介于6.5~7.5之间,即成缓冲液。在该缓冲液中溶解准确数量的四唑盐类,以获得准确的浓度。
不同浓度TTC溶液配制[14]:1%浓度的TTC溶液,称取1 g 四唑粉剂溶解于100 mL磷酸缓冲液中即可。0.2%浓度的TTC溶液:量取1份配好的1%浓度的TTC溶液加入4份磷酸缓冲液混合均匀可得。
四唑溶液必须完全淹没种子,溶液须贮存在黑暗处或棕色瓶里,不能直接露光,因为光线可能使四唑盐类还原而降低其浓度,影响染色效果。
1.2.4TTC染色和观察鉴定在“1.2.2”节得出最适宜浸种温度、时间的条件下,对供试种子进行预湿处理。每次随机选取100粒预湿种子迅速剥皮后,分别选用0.2%、1%2种浓度的四唑染色液,在30、35 ℃恒温条件下染色不同时间(1、18、36 h),4次重复。
染色结束后,观察种子染色情况并记录着色种子数目,对染色种子数超过50%的处理组合的着色种子进行纵切,在体视显微镜下观察种子切面的染色效果,区分种子胚各部分的着色情况,并采集图片,统计生活力指标。种子经染色和处理后,进行正确的观察鉴定十分重要。一般鉴定原则是,凡是胚的主要构造及有关活营养组织染成有光泽的鲜红色,且组织状态正常的,为有生活力种子;凡是胚的主要构造局部不染色或染成异常的颜色和光泽,并且活营养组织不染色部分已超过1/2,或超过容许范围,以及组织软化的,完全不染色或染成无光泽的淡红色或灰白色,且组织已软化腐烂或异常、虫蛀、损伤的均为无生活力种子[14]。
2结果与分析
2.1计算发芽率
发芽试验结束后,观察统计4次重复种子发芽的数目分别为94、96、93、95粒,计算发芽率,
发芽率=(94+96+93+95)/400×100%=95%。
2.2适宜浸种温度、时间的确定
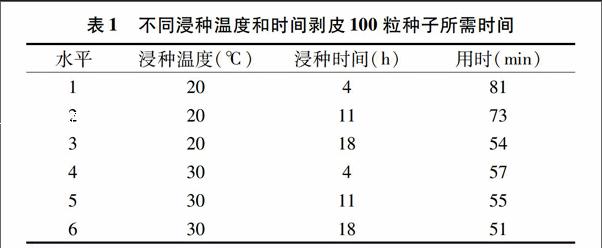
在不同浸种温度、不同浸种时间条件下,剥皮100粒种子所需时间如表1所示。
由表1可以看出,当温度一定时,浸种时间越长,剥皮所用的时间越短,说明种皮越容易剥去;当浸种时间相同时,30 ℃ 浸种剥去种皮所需时间明显少于20 ℃;当浸种温度为30 ℃时,浸种4、11、18 h剥去种皮所需时间相差不大,说明浸种温度对种皮的影响要大于浸种时间对种皮的影响。考虑到试验周期等因素的影响,选择20 ℃、18 h和 30 ℃、4 h为适宜的浸种温度和时间组合。
2.3TTC法测定京茄218茄子种子生活力
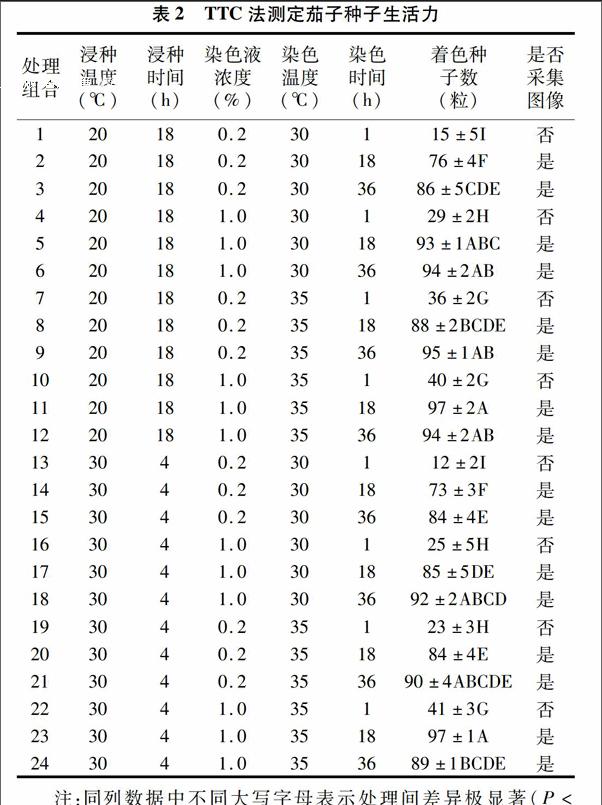
不同浸种温度、时间组合,不同的染色液浓度、染色温度、染色时间条件下,京茄218茄子种子染色情况如表2所示。
从表2中各处理组合着色种子数目及方差分析结果可以看出,当染色时间为1 h(见处理组合1、4、7、10、13、16、19、22),京茄218茄子种子的染色效果很差,多数种子都没有着色,只有少数种子有轻微的着色。
当浸种温度为20 ℃、浸种时间为18 h,染色温度相同(30 ℃)时,随染色时间延长,种子染色效果增强,着色种子数目增多,且在染色液浓度较低(0.2%)时,达到了极显著性差异;而在染色温度(35 ℃)较高时却发现,在较高染色液(1%)浓度下,染色时间为36 h的处理组合12染色效果不及染色时间为18 h的处理组合11,着色种子数目反而减少,但没有出现极显著性差异 。对应比较处理组合5、6和处理组合2、3以及处理组合11、12和处理组合8、9可以发现,在染色温度相同时,染色液浓度(1%)较高,种子染色效果增强,着色种子数目增多且达到了极显著性差异(处理组合12例外,同处理组合9相比,处理组合12着色种子数目减少但没有出现极显著性差异)。对应比较处理组合8、9和处理组合2、3以及处理组合11、12和处理组合5、6可以发现,在染色液浓度相同时,染色温度(35 ℃)较高有利于种子着色,着色种子数目增多(处理组合12和处理组合6着色种子数目相同),其中在染色液浓度较低(0.2%)时,达到了极显著性差异。
当浸种温度为30 ℃、浸种时间为4 h,染色温度(30 ℃)较低时,随染色时间延长,种子染色效果增强,着色种子数目增多,其中在染色液浓度较低(0.2%)时,达到极显著性差异;而在染色温度(35 ℃)较高时却发现,在较高染色液(1%)浓度时,染色时间为36 h的处理组合24染色效果不及染色时间为18 h的处理组合23,着色种子数目减少,且达到了极显著性差异。对应比较处理组合17、18和处理组合14、15以及处理组合23、24和处理组合20、21可以发现,在染色温度相同时,染色液浓度(1%)较高,种子染色效果增强,着色种子数目增多且达到极显著性差异(处理组合24例外,同处理组合21相比,处理组合24着色种子数目减少但没有出现极显著性差异);对应比较处理组合20、21和处理组合14、15以及处理组合23、24和处理组合17、18可以发现,在染色液浓度相同时,染色温度(35 ℃)较高有利于种子着色,着色种子数目增多且达到了极显著性差异(处理组合24 例外,同处理组合18相比,处理组合24着色种子数目减少但没有出现极显著性差异)。说明在染色液浓度(1%)较高、染色温度(35 ℃)也较高时,染色时间(36 h)过长反而不利于种子着色,着色种子数目有减少的趋势,染色效果有所下降。
2.4着色种子纵切,显微镜下观察种子切面染色效果
试验过程中因为处理组合1、4、7、10、13、16、19、22着色种子数目没有超过50粒,故没有进行着色种子纵切在体式显微镜下观察种子切面的染色效果,其余各处理组合均进行了着色种子纵切在体式显微镜下观察种子切面的染色效果并采集图像(图1为有代表性且较为清晰的部分采集图片)。
处理组合9、11、12、15、23、24所采集的图片较为清晰。再结合“2.3”表2中各处理组合着色种子数目及方差分析结果,处理组合15、24着色种子数目分别为(84±4)、(89±1)粒,均没有反映出供试材料的实际生活力情况(见“2.1”节标准发芽试验结果芽率为95%),故处理组合15、24均不适于京茄218茄子种子的生活力测定。处理组合9、11、12、23,着色种子数目分别为(95±1)、(97±2)、(94±2)、(97±1)粒,没有出现极显著性差异且均能反映出供试材料的实际生活力情况。考虑到染色时间对试验周期的影响,处理组合9、12染色时间均为36 h,处理组合11、23染色时间均为18 h,故选择处理组合11、23作为测定京茄218茄子种子生活力的理想处理组合。
3结论与讨论
由标准发芽试验发芽率计算结果可得供试京茄218茄子种子的发芽率为95%。染色时间1 h过短,不适于京茄218茄子种子的生活力测定。这很可能是由于染色时间过短,活种子呼吸过程中脱氢酶产生的[H]非常有限,来不及与四唑染色液充分反应造成的。染色液浓度(1%)较高、染色温度(35 ℃)较高、染色时间延长,均有利于京茄218茄子种子的生活力测定。但在较高的染色液浓度(1%)时,染色温度(35 ℃)较高,同时染色时间(36 h)过长,京茄218茄子种子的染色效果反而出现下降,这可能是因为种子长时间处于较高的染色温度条件下,内部某些物质结构遭到了破坏,导致种子生活力下降而引起的。通过“2.4”节部分的综合分析,可见处理组合11(浸种温度20 ℃、浸种时间18 h、染色液浓度1%、染色温度35 ℃、染色时间18 h)和处理组合23(浸种温度30 ℃、浸种时间4 h、染色液浓度1%、染色温度35 ℃、染色时间18 h)为较理想的处理组合,为TTC法快速测定京茄218茄子种子生活力的适宜方法。试验中普遍存在的问题是种子着色深浅程度不均匀,有些种子着色太浅,不能清晰地观察种子胚各部分的染色情况;有些种子着色又太深,种子部分甚至全部染成深褐色,也无法准确判断种子胚各部分的生活力情况。这可能与种子本身的生活力强弱程度、染色液浓度及染色时间等因素有关。
本试验为探究性试验,得出的结论是在试验设计的各种不同处理组合条件下最为理想的处理组合, 有较强的说服力和科学性。但若想获得TTC法快速测定茄子种子生活力更加适宜的方法,需要设计更多的不同影响因素之间的处理组合,如增加不同浸种温度、时间组合;设计更多的染色液浓度梯度;增加更多的不同染色时间及染色温度的处理组合,并选用不同的茄子品种等。
参考文献:
[1]陈瑛. 实用中药种子技术手册[M]. 北京:人民卫生出版社,1999.
[2]郭巧生. 药用植物栽培学[M]. 北京:高等教育出版社,2004.
[3]景彦彪. 种子生活力的四唑测定在质检中的运用[J]. 种子科技,2006(2):57-58.
[4]李植良,黎振兴,黄智文,等. 我国茄子生产和育种现状及今后育种研究对策[J]. 广东农业科学,2006(1):24-26.
[5]张念,王志敏,于晓虎,等. 茄子种质资源遗传多样性的形态标记分析[J]. 中国蔬菜,2013(14):46-52.
[6]徐长城,肖长惜. 湖北省茄子产业的现状与展望[J]. 长江蔬菜,2009(1):1-2.
[7]马崇坚. 不同化学试剂处理对茄子种子萌发的影响[J]. 种子,2005,4(10):30-31,35.
[8]盛海平,汪为民,刘华开,等. 水稻种子生活力四唑测定值与发芽率间的相关性[J]. 种子,2000(2):30-31.
[9]王辉,马传喜,徐风,等. 热处理对小麦生活力和品质的影响[J]. 种子,1999(6):12-13,16.
[10]王丽红. 几种常用检测玉米种子生活力的方法比较[J]. 种子科技,2012(1):39-40.
[11]虞华丽,陆新德. 加工番茄种子处理及生活力的测定[J]. 农业科技与信息,2007(2):28-29.
[12]曾正明,杨跃华,冉茂林,等. 苦瓜种子生活力四唑测定值与发芽率间的相关性[J]. 绵阳经济技术高等专科学校学报,2001(4):10-11,16.
[13]黄亚军,杨立武,张国萍,等. 四唑染色测定冬瓜种子生活力的研究[J]. 种子,1996(6):8-9.
[14]International rules for seed testing [S/OL]. [2015-04-01]. http://www.seedtest.org/en/international-rules-content-1-1083.html.马俊青,卢绍辉,袁国军,等. 利用电导法测定雀舌黄杨和大叶黄杨的耐寒性[J]. 江苏农业科学,2016,44(5):209-210.
