烟草黑胫病生防菌的筛选鉴定及发酵条件优化
2016-07-23刘畅许家来郭凯
刘畅++许家来++郭凯
摘要:从山东烟田土壤中筛选对山东烟草黑胫病(Phytophthora parasitica var.nicotianae)具有较强拮抗作用的生防菌株。通过稀释涂布法初筛后,用平板对峙法复筛到拮抗效果较好的菌株YCG-2,根据菌株形态与培养特征、ITS序列分析进行鉴定,该菌株与哈茨木霉(Trichoderma harzianum)的亲缘关系较近,且形态与培养特征与哈茨木霉基本相符,因此鉴定为哈茨木霉。通过单因素试验和正交试验优化培养基组分及发酵条件,最优发酵条件为每500 mL瓶 20 g 菇渣,料水比为1 g ∶3.0 mL,种子液接种量1×107 CFU/g,pH值7.0,最适温度28 ℃,恒温恒湿培养箱中培养6 d。
关键词:烟草黑胫病;哈茨木霉;发酵条件;正交试验
中图分类号: S435.72文献标志码: A文章编号:1002-1302(2016)05-0167-04
烟草黑胫病的病原菌为烟草疫霉菌(Phytophthora nicotianae Breda或P. parastica var. nicotianae Tucker)[1],隶属于藻物界(Chromista)、卵菌门(Oomycota)、卵菌纲(Oomycetes)、腐霉目(Pythiales)、腐霉科(Pythiaceae)、疫霉属(Phytophthora)[2]。烟草黑胫病是世界性的严重病害,在我国发生较为普遍,特别在河南和山东黄淮烟区严重影响烟草产量和质量[3]。山东省是老重病区,曾因推广抗病品种在生产上起到较好的作用,但年发病率仍在5%~20%,如1981年安丘县曾因此病绝产667 hm2以上[4]。在不采取防治措施情形下,会出现毁灭性灾害[5]。目前烟草生产上抗黑胫病品种效果有限,黑胫病的防治主要依赖甲霜灵等苯基酰胺类杀菌剂,且防治药物品种单一[6]。
随着烟草和烟草制品逐步向无公害方向发展,生物防治方法应运而生,能够有效克服农药残留和病菌抗药性的问题,生防菌通过与病原真菌的拮抗作用来防治烟草黑胫病。近年来,国内已有不少关于烟草黑胫病生防菌方面的研究。如普城沙雷菌、绿针假单胞菌、黏类芽孢杆菌等细菌都对烟草疫霉有较强的拮抗作用[7-8]。喻会平等筛选出的复配细菌菌株对烟草黑胫病有很好的防治效果[9]。张良等研究显示,长柄木霉(Trichoderma longbrachitum)和泾阳链霉菌(Streptomyces jingyangensis)是具有较高亲和性的增效组合,2个菌株复配后可有效促进烟苗生长和防治烟草黑胫病[10]。但目前为止,筛选出烟草疫霉菌的拮抗菌以细菌居多,真菌较少,且在实际生产中的应用很少。本研究拟从山东省潍坊市洛庄烟草实验站烟田的土壤中分离、纯化、筛选拮抗菌,并对拮抗效果较好的真菌菌株进行了发酵条件的优化,为后期验证该菌株在田间的防治效果,利用该菌株制作菌肥,并应用于烟田奠定基础。
1材料和方法
1.1材料
1.1.1样品来源2014年6月从山东省潍坊市洛庄烟草实验站附近烟草黑胫病发生较为严重的烟田采集土壤5份。采集土壤时,选取病烟株集中地块附近无病烟株,收集烟株根周围土壤,每块烟田取3株,3株烟的根周围土等量混为1份样品,分装入无菌50 mL刻度塑料试管内,贴上标签后带回实验室分离拮抗菌。
1.1.2主要试剂和仪器引物(ITS 1、ITS 4)、Taq mix 购自上海生工生物有限公司,Marker购自Takara公司,其余试剂均为国产分析纯试剂。电泳仪、PCR为Bio-Rad,显微镜为Nikon eclipse E100 。
1.1.3培养基及发酵材料PDA培养基(培养筛选出的拮抗真菌)购自北京奥博星生物技术有限公司,LB培养基(培养筛选出的拮抗细菌,含胰蛋白胨10.0 g/L,酵母提取物 5.0 g/L,NaCl 5.0 g/L,琼脂 15.0 g/L,pH值 7.0),燕麦培养基(OA,燕麦 60.0 g/L,琼脂18.0 g/L),发酵材料为蘑菇渣(蘑菇渣为主要发酵材料,来自山东省枣庄冠宇食用菌有限公司)。
1.2拮抗菌的初筛
5份土壤每份取10 g于盛有90 mL无菌水的三角瓶中,摇床150 r/min振荡30 min,记作1×10-1。取1 mL悬浊液至含有9 mL无菌水的试管中,涡旋60 s,记作1×10-2,依次稀释至1×10-5。取1×10-4和1×10-5这2个浓度上清液各100 μL涂板,3次重复,板中央接病原菌烟草黑胫病WZL-072(由笔者所在实验室分离获得)。28 ℃下培养3~5 d,挑取周围无病原菌丝生长的菌株进行分离纯化。
1.3拮抗菌的复筛
采用平板对峙法,将初筛出来的拮抗菌与烟草黑胫病原菌株WZL-072进行对峙。
1.3.1拮抗细菌与WZL-072对峙试验将5 mm打孔器打孔的WZL-072菌块置于OA培养基上,4个大小相同无菌滤纸片等距离放于WZL-072四周,吸取5 μL 180 r/min、28 ℃培养12 h的拮抗细菌菌液滴于滤纸片上,以等量无菌水为对照,各3次重复。28 ℃下培养5~7 d,每天测量WZL-072菌落直径。
1.3.2拮抗真菌与WZL-072对峙试验利用5 mm打孔器分别打孔拮抗真菌与WZL-072,各取1块置于OA培养基上进行对峙培养,各3次重复。28 ℃下培养5~7 d,每天测量WZL-072菌落直径。
1.3.3抑菌率的计算
抑菌率=对照病原菌菌落直径-处理病原菌菌落直径对照病原菌菌落直径×100%。
1.4菌株的鉴定
1.4.1形态学鉴定滴1滴乳酸酚棉兰染色液于载玻片中央,胶带粘取一点转接3 d的YCG-2 菌丝放于染色液上,滤纸吸去多余的染色液,在10×40、10×100倍的光学显微镜下观察菌丝形态、孢子的大小及形状。参照喻璋等的方法[11]进行形态学鉴定。
1.4.2分子生物学鉴定样品DNA的提取按照艾德莱生物公司的“真菌基因组DNA快速提取试剂盒”中的方法进行,用真菌通用引物(ITS 1:5′-TCCGTAGGTGAACCTGCGG-3′;ITS 4:5′-TCCTCCGCTTATTGATATGC-3′)进行扩增[12],测定其序列。通过Blast程序,从NCBI公共数据库中进行相似性搜索,选取相似性最高且是有效发表的典型菌株的序列,用clusta lX 进行序列比对,用MEGA 4.0的Neighbor-Joining 法选取前250个最好的比对结果构建系统进化树,确定 YCG-2菌株的分类地位。
1.5发酵条件的优化
1.5.1种子液的制备及种子液孢子浓度检测种子液的制备:称20 g菇渣于500 mL三角瓶中,加蒸馏水50 mL,料水比为1 g ∶2.5 mL,121 ℃灭菌40 min,接种5-10块菌块,28 ℃培养6 d。加150 mL无菌水,摇匀后用2层无菌纱布过滤,滤液 5 000 r/min 离心10 min,倒掉上清液,加30%甘油重悬孢子液,混匀后分装入冻存管中,-80 ℃保存。采用活菌计数法检测种子液孢子浓度:取1 mL种子液,梯度稀释后进行平板培养(培养基内加入曲通抑制菌丝生长)。培养温度 28 ℃,时间48 h,3次重复。
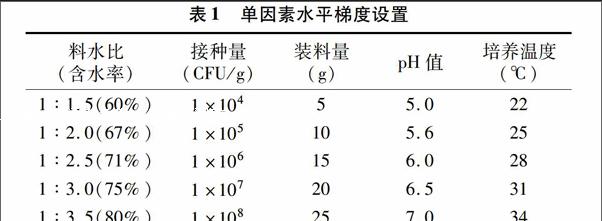
1.5.2单因素试验选择装料量、温度、料水比、接种量、pH值作为影响YCG-2菌株生长的主要因素,通过单因素试验选取正交试验的因素和水平。基本条件为装料量20 g蘑菇渣,料水比为1 g ∶2.5 mL,pH值自然,接种1 mL浓度1×107 CFU/g 的孢子液,28 ℃培养6 d后取出计算活菌数。在基本条件基础上,按照表1所列指标逐项进行单因素试验。每个处理3次重复。
表1单因素水平梯度设置
料水比
(含水率)接种量
(CFU/g)装料量
(g)pH值培养温度
(℃)1 ∶1.5(60%)1×10455.0221 ∶2.0(67%)1×105105.6251 ∶2.5(71%)1×106156.0281 ∶3.0(75%)1×107206.5311 ∶3.5(80%)1×108257.034
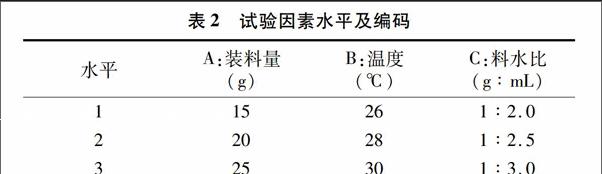
1.5.3正交试验设计根据单因素试验结果,选取料水比(X1)、装料量(X2)、培养温度(X3)3个因素为考察对象,以活菌数量为评价指标,进行正交试验,3次重复,试验因素水平及编码见表2。
1.6数据处理与分析
采用STATA方差分析软件及 Microsoft Excel 2003统计软件进行单因素方差分析和差异显著性分析,采用SPSS 16.0软件进行正交分析。
2结果
2.1拮抗菌的初筛
从采集到的5份土样中初筛得到26株纯培养拮抗细菌,编号为YCG-B1至YCG-B26,8株纯培养拮抗真菌,编号为YCG-1至YCG-8。
2.2拮抗菌的复筛
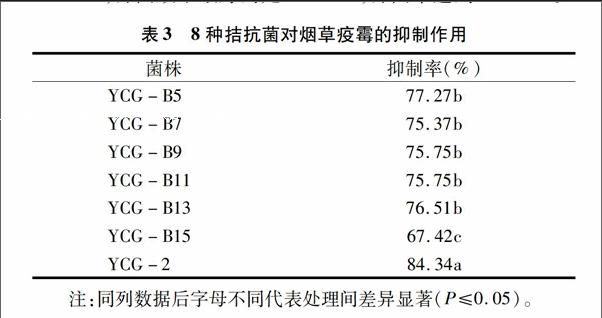
如表3所示,采用对峙培养法进一步筛选,共筛选到7株菌株有抑制效果,其中6株细菌、1株真菌,抑菌率67.42%~84.34%,抑菌效果最好的是YCG-2,抑菌率达到84.34%。
2.3经典分类学特征
观察发现:在PDA培养基上,YCG-2菌株菌落开始为白色絮状,逐渐变为绿色,后期变为暗绿色,颜色由浅变深,状态由絮状逐渐变得紧而密。通过光学显微镜观察发现:YCG-2菌株的菌丝纤细无色,具分隔,多分枝,分枝间夹角呈锐角。分生孢子梗从菌丝的侧枝上生出,对生或互生,一般有2~3次分枝,着生分生孢子的小梗瓶形或锥形。分生孢子多为球形(图1)。
2.4系统发育学特征
用真菌通用引物ITS 1和ITS 4扩增菌株YCG-2的核糖体DNA,得到595 bp的 ITS DNA序列,利用Blast程序与NCBI中已登录的基因序列进行比对,选取与其同源性较高且已定名的菌株的相关序列信息,进行系统发育分析,取前250个最好的比对结果建树(图2),可以看出,菌株YCG-2的序列与哈茨木霉的序列相似性较高。
2.5拮抗菌株YCG-2发酵条件优化单因素试验结果
2.5.1料水比变化对YCG-2孢子产量的影响由图3可见,料水比对菌株YCG-2的生长有很大影响,料水比为
1 g ∶1.5 mL时,YCG-2菌株的孢子产量最少,孢子数为8.00×108 CFU/g;料水比为1 g ∶3.0 mL时YCG-2产生的孢子最多,达到29.00×108 CFU/g,所以1 g ∶3.0 mL为菌株YCG-2产生孢子的最佳料水比。
2.5.2接种量变化对YCG-2孢子产量的影响由图4可知,接种量对YCG-2菌株的生长有一定影响,在装料20 g蘑菇渣,料水比为1 g ∶3.0 mL,自然pH值,28 ℃条件下,随着接种量的增大,YCG-2孢子产量也会增加,接种量为1×107 CFU/g 时YCG-2孢子产量最大,孢子数达到29.50×108 CFU/g,当接种量继续增大,YCG-2菌株的活菌数则急剧降低,这可能是因为蘑菇渣中的菌体过多,导致营养成分不能满足过量菌体的生长,从而影响活菌数。
2.5.3装料量变化对YCG-2孢子产量的影响由图5可见,YCG-2菌株的孢子产量随着装料量的增加,孢子产量越高,此时料水比为1 g ∶3.0 mL,自然pH值,接种1 mL浓度 1×107 CFU/g 的孢子液,温度28 ℃。在每瓶20 g装料量情况下菌株的生长状况最好,孢子产量达到最高值29.01×108 CFU/g。当装料量达到每瓶25 g时,孢子产量有所降低,这可能与物料堆积过多造成透气量下降有关。
2.5.4初始pH值变化对YCG-2菌株生长的影响用氢氧化钠溶液调节物料pH值。从图6可以看出,在试验所设置的pH值梯度区间内(5.5~7.5),YCG-2菌株都能生长,且在pH值为7.0时孢子产量达到最高值。在pH值为7.0时YCG-2的产孢量最多,达到40.11×108 CFU/g。物料pH值偏大或偏小,孢子产量均减少。
2.5.5温度变化对YCG-2菌株生长的影响分别在22、25、28、31、34 ℃下进行培养,测定不同温度下的活菌数,结果(图7)表明,温度变化对YCG-2菌株的生长影响很大。在28 ℃下孢子产量达到最高值39.60×108 CFU/g。随着温度的升高,YCG-2孢子产量越来越低,34 ℃时孢子产量降低到6.0×104 CFU/g。
2.6孢子产生条件优化正交试验
为了验证单因素试验结果,通过SPSS统计软件设计正交试验。本试验选取装料量、培养温度、料水比3个因素为考察对象,进行正交试验设计。每个试验重复3次,取其平均值,正交试验结果与分析见表4,方差分析见表5。
由表5可知,3个因素对YCG-2菌株生长的影响作用大小依次为A>B>C,即装料量>温度>料水比。通过该正交试验结果确定最佳组合水平为A2B2C2。在装料量为20 g、培养温度为28 ℃、料水比为1 g ∶3.0 mL的最佳条件下进行验证试验,重复3次,平均产孢量为40.18×108 CFU/g。
3小结与讨论
烟草黑胫病是烟草生产中危害最严重的土传病害之一,山东省是受害比较严重的产烟省,每年经济损失高达亿元,仅次于烟草病毒病[1]。由于生物防治对环境无污染及不容易产生抗药性等特点成为病害防治研究的热点,需要研究和开发环境友好的土传病害生物防治技术。
本研究从山东省烟草黑胫病发生严重的烟田里选择长势良好无病烟株,取其根际土,经过初筛和复筛,获得1株对对烟草疫霉具有较强抑制作用的真菌菌株YCG-2,该菌株的抑菌率最高可达到84.34%。鉴于此,选择YCG-2菌株作为后期的主要研究对象,利用传统分类方法和18S rDNA 序列测定法对菌株YCG-2 进行了鉴定,确定菌株YCG-2为哈茨木霉。采用单因素和正交设计试验对菌株YCG-2进行发酵条件的优化,得到其最佳发酵配方和最适发酵条件。最适培养温度为28 ℃,pH值为7.0,这与庄敬华等[13]、于晓丹等[14]的关于木霉发酵条件研究结果相似,但张爱华等[15]关于哈茨木霉发酵条件的初步研究结果显示最适培养温度为 22 ℃,本研究结果与之相差较大,可能是因为哈茨木霉菌株不同、所用培养基不同等。
为了能降低菌种扩大生产成本,本试验以废弃菇渣为培养基质,并以孢子产生量为指标,优化了相应的发酵条件,为推广应用打下了基础。Harman研究认为,木霉的生防作用与其根际定殖能力密切相关[16-17],因此YCG-2菌株的根际定殖能力有待于进一步研究,以期能尽快将其推向大田应用。
参考文献:
[1]方中达,陆家云,叶钟音,等. 中国农业百科全书:植物病理学卷[M]. 北京:农业出版社,1996:534-535.
[2]Hawksworth D L,Sutton B C. Ainsworth and bisbys dictionary of the fungi [M]. 8th ed. CAB International,1995.
[3]周嘉平,王宝华. 烟草黑胫病田间动态研究[J]. 植物病理学报,1984,14(1):39-45.
[4]王智发,刘延荣,谢成颂,等. 山东省烟草黑胫病菌生理小种初步鉴定[J]. 植物保护学报,1985,12(1):51-55.
[5]Shew H D,Lucas G B. Compendium of tobacco diseases[M]. Saint Paul,Minnesota:American Phytopathological Society Press,1991:17-20.
[6]李梅云,祝明亮. 烟草黑胫病菌对甲霜灵的抗性测定[J]. 中国农学通报,2006,22(9):377-379.
[7]王晶晶,蒋士君,常淑娴,等. 两株生防菌对烟草黑胫病的抑制活性及其鉴定[J]. 中国烟草学报,2011,17(6):89-92.
[8]曹明慧,冉炜,杨兴明,等. 烟草黑胫病拮抗菌的筛选及其生物效应[J]. 土壤学报,2011,48(1):151-155.
[9]喻会平,罗定棋,代园凤,等. 烟草黑胫病拮抗菌复合菌株的筛选与防治效果评价[J]. 中国农学通报,2015,31(8):102-107.
[10]张良,刘好宝,顾金刚,等. 长柄木霉和泾阳链霉菌复配对烟苗生长及其抗病性的影响[J]. 应用生态学报,2013,24(10):43-45.
[11]喻璋,张猛. 半知菌分属图册[M]. 北京:科学出版社,2009.
[12]Kamel A A,Ibrahim N A,Mohmed A A,et al. PCR identification of Fusarium genus based on nuclear ribosomal-DNA sequence data[J]. African Journal of Biotechnology,2003,2(4):82-85.
[13]庄敬华,高增贵,刘限,等. 不同发酵条件对木霉产孢类型的影响[J]. 中国生物防治,2005,21(1):37-40.
[14]于晓丹,张彩霞,林英,等. 拮抗木霉菌株T21发酵条件的研究[J]. 安徽农业科学,2005,33(2):215-216.
[15]张爱华,白石,周国兴,等. 哈茨木霉发酵条件的初步研究[J]. 安徽农业科学,2008,36(23):9821-9822.
[16]Harman G E. Development and benefits of rhizosphere competent fungi for biological control of plant pathogens[J]. Plant Nutrition,1992,15(6):835-843.
[17]Harman G E. Myths and dogmas of biocontrol:changes in peiceptions derived from research on Trichoderma harzianum T-22[J]. Plant Diseases,2000,84(4):377-393.辛蓓,郑雅楠,刘佩旋. 寄生蜂毒液的功能与其主要作用成分[J]. 江苏农业科学,2016,44(5):171-174.
