摩西球囊霉促进花生光合作用的机制
2016-07-23胡彦江杨德翠
胡彦江++杨德翠
摘要:以摩西球囊霉(Funneliformis mosseae)侵染的花生植株为研究材料,测定了在苗期、花期、结荚期和饱果期4个不同时期花生叶片荧光动力学的变化,从而探索摩西球囊霉促进花生光合作用的机制。结果表明:与非菌根对照相比,菌根花生地上部干质量、开花数、果荚数、果荚质量均显著或极显著增加,叶绿素含量、净光合速率Pn增加;基于光吸收的性能指数PI与实际光化学效率ΦPSⅡ均明显升高;菌根与非菌根间的荧光差值ΔVt曲线变化最大处在30 ms 附近,Ⅰ相降低,而光系统线性电子传递速率ETR与电子传递的量子产额ΦEo升高,单位面积有活性反应中心数量RC/CSo增加,光化学猝灭系数qP升高;PSⅠ的活性(ΔI/Io)明显升高。摩西球囊霉侵染增强了花生叶片PSⅠ和PSⅡ的活性,促进了电子的传递,增强了对光能的利用,从而提高了花生生长量和产量。
关键词:花生;摩西球囊霉(Funneliformis mosseae);叶绿素荧光;光系统Ⅰ;光系统Ⅱ
中图分类号: S565.201文献标志码: A文章编号:1002-1302(2016)05-0145-04
丛枝菌根(arbuscular mycorrhiza,AM)是植物根系与某些种类的真菌形成的互惠共生,70%以上的陆生植物能够形成这种共生体[1]。AM真菌不仅能改善植物营养、生长状况[2],还能提高植物的抗逆性[3-5]。光合作用是高等植物合成有机物和获得能量的基础,叶绿素是绿色植物进行光合作用的最主要色素,是植物光合作用时捕获光能的重要物质。AM真菌能够通过提高叶绿素含量,改善叶片叶绿素荧光和光合作用[3,5-6]。玉米在高温或低温胁迫下对植株造成的伤害可通过接种AM真菌提高叶绿素含量及光合作用来减轻[3,6]。
叶绿素荧光技术是近年来应用于光合作用机理研究的新技术[7],是研究光合器官的无损伤探针,通过荧光参数和荧光动力学曲线的变化量化分析光系统的性能。赵昕等报道,接种AM真菌能有效提高喜树幼苗叶片的最大光能转换效率(Fv/Fm),提高光化学猝灭系数(qP),有效降低非光化学猝灭系数(NPQ)[8];不同AM真菌对喜树幼苗叶片叶绿素荧光参数影响不同。
花生产业在我国经济中占有重要的地位,2013年我国花生种植面积471万hm2[9]。目前,我国花生栽培和其他作物栽培中遇到的同样问题之一,是由于长期重施化肥,导致土壤板结、贫瘠、微生物活性降低。因此,如何利用有限的土壤资源,最大限度地提高作物产量,实现资源的可持续性发展显得尤为重要。研究表明,AM真菌能够促进花生生长,提高其产量,特别是在营养贫瘠土壤中效果尤为显著[10-12]。本研究发现,AM真菌侵染花生后,产量和光合速率均有提高,那么提高光合作用的机制是什么呢?AM真菌侵染对光合机构又有怎样的影响?
本研究旨在通过荧光动力学技术研究AM真菌促进花生光合作用的机制,为AM真菌在农业中的应用提供理论支持,为花生的高产栽培提供指导。
1材料与方法
1.1试验材料
1.1.1供AM真菌摩西球囊霉[Funneliformis mosseae (Nicoll. & Gerd.) Gerd. & Trappe],分离自山东省花生研究所莱西花生试验田花生根际土。接种前进行扩大培养:将园土和河沙按1 ∶1体积比混合,121 ℃、0.1 MPa蒸汽灭菌2 h,放置1周后装入花盆(23 cm×20 cm),每盆先装2 000 g培养土、50 g AM真菌菌剂,上面撒三叶草种子,最后用1 cm厚灭菌河沙覆盖。每周浇1次Hoagland营养液,其他均按常规管理。播种3个月后,用土壤钻随机挖取三叶草根系,剪成 1 cm 长根段,用Phillips & Hayman染色方法[13]对根段染色,检查菌根形成情况。待形成泡囊、丛枝及孢子时,剪去三叶草地上部,将盆土及剪碎的根系混合均匀,装入布袋,保存在阴凉、干燥的地方。
1.1.2供试植物供试花生品种为花育22号,是目前山东省主栽品种之一,由植物病理生理研究室提供。
1.1.3接种及管理栽培基质由园土和河沙按2 ∶1体积比混合,高压蒸汽灭菌2 h后混合均匀,每个花盆(23 cm×20 cm)装入2 000 g。花生播种时先将50 g摩西球囊霉菌剂平铺于灭菌栽培基质上,然后撒花生种子,用厚度为1 cm的栽培基质覆盖。待种子发芽出土后露天放置,并定苗至每盆4株。对照不接AM菌剂。每个处理9盆,每3盆1个重复,不同处理间随机放置。每周浇1次Hoagland营养液,其他按常规管理。
1.2花生菌根侵染率测定
播种后1个月,用土壤钻随机挖取花生根样,流水轻轻洗掉黏附在根部的沙土,剪成1 cm长根段,用Phillips等的方法[13]对根进行染色。菌根侵染率测定参考刘润进等的方法[2]。
1.3花生生长量的测定
待花生生长至开花下针期时测量株高,统计开花数;收获后将花生地上、地下部分分开,在80 ℃烘箱烘至恒质量后称其干质量。
1.4花生叶片气体交换参数的测定
使用便携式光合仪CIRAS-1(英国,PP-Systems公司),分别在花生生长的苗期、花期、结荚期、饱果期,取花生的功能叶测定气体交换参数。以仪器自带二极管提供光源,设置光照度1 200 μmol/(m2·s),温度25 ℃,相对湿度45%,CO2为大气浓度。09:00至11:00测定净光合速率(Pn)、气孔导度(Gs)和细胞间隙CO2浓度(Ci),重复6次。
1.5花生叶片叶绿素含量的测定
花生叶绿素含量测定参考Arnon的方法[14]。称取花生功能叶片0.1 g,置于10 mL 80%丙酮中暗处浸提48 h后,用U-2900分光光度计(日立、日本)分别测定663、645 nm处的吸光度,计算总叶绿素含量,重复3次。
1.6花生叶片叶绿素荧光参数的测定
Fo、Fm、Fm′、Fs 等荧光参数用FMS-2脉冲调制式荧光仪(Hansatech,英国)测定。在生长不同时期取花生功能叶,将叶片暗适应30 min后,测定最大荧光Fm及PSⅡ最大光化学效率Fv/Fm。光适应下PSⅡ实际光化学效率按ФPSⅡ=(Fm′-Fs)/Fm′计算;电子传递速率ETR=PFD×0.84×0.5,PFD为测定时的照度;光适应下荧光参数Fm′和Fs的测定参考陈大印等的方法[15]。
1.7花生叶片快速叶绿素荧光诱导动力学曲线测定以及PSⅠ活性的测定
花生叶片快速叶绿素荧光诱导动力学曲线(OJIP曲线)测定参考Schansker等方法[16],利用M-PEA(Hansatech,英国)测定光吸收曲线表示PSⅡ活性的变化,利用820 nm光吸收相对差值(ΔI/Io)表示PSⅠ活性变化。在花生苗期、花期、结荚期、饱果期,测定菌根花生和非菌根花生功能叶叶绿素荧光。用暗适应夹夹住叶片暗适应20 min,再用M-PEA进行测定,测定方法参照杨德翠等的方法[17],参数计算公式参考Strasser等的方法[18-20]。
1.8数据处理
用SAS 8.1数据分析软件对各处理间的数据进行方差分析。
2结果与分析
2.1花生根系摩西球囊霉侵染率
花生菌根侵染率为70%,根内形成丛枝、泡囊结构,根外外延菌丝发达。未接种AM菌剂的花生根部未观察到丛枝、泡囊、根内和根外外延菌丝。这说明菌根菌与花生根系已建立了良好的共生关系。
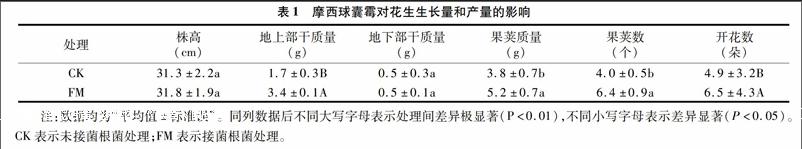
2.2摩西球囊霉对花生生长量和产量的影响
从表1看出,在测定时间内,菌根花生株高、地下部干质量与非菌根花生相比无显著差异,但地上部干质量、开花数、果荚数或果荚质量与非菌根相比有显著或极显著的差异。菌根花生地上部干质量、开花数、果荚数、果荚质量分别比非菌根花生分别增长了100%、33%、60%、37%。
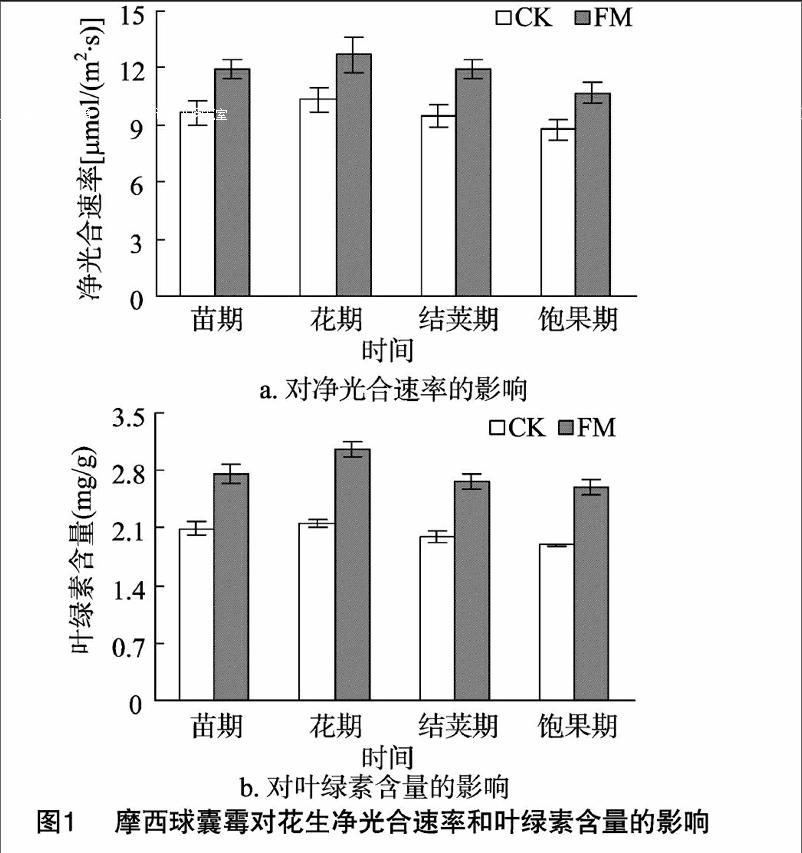
2.3 摩西球囊霉对花生叶片净光合速率(Pn)和叶绿素含量的影响
花生净光合速率和叶绿素含量如图1所示,在不同测定时期,净光合速率和叶绿素含量曲线均表现为先升高后降低的趋势,高峰值均在花期,且二者在菌根花生叶片中高于非菌根花生叶片。
这说明AM真菌侵染增加了花生叶片叶绿素含量,从而促进了花生的光合作用。
2.4摩西球囊霉对花生PSⅡ活性的影响
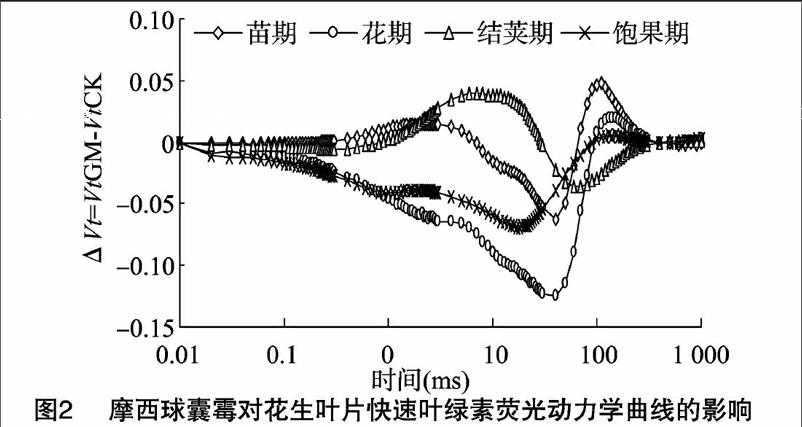
2.4.1摩西球囊霉对花生叶片荧光动力学曲线(OJIP)的影响菌根花生与非菌根花生OJIP曲线的荧光差值ΔVt 曲线变化如图2所示。Ⅰ相反应了PQ库的异质性,即快还原型PQ库和慢还原型PQ库的大小。二者最大差值出现在约30 ms 处,说明AM真菌侵染最大程度地影响了曲线上I点的变化。Ⅰ相降低,说明AM真菌侵染加快了电子传递速度。
2.4.2摩西球囊霉对花生叶片PI和ФPSⅡ的影响PI是基于光吸收的性能指数,能灵敏地反映PSⅡ的活性变化。从图3-a可知,在不同测定时期,FM处理PI值分别比对照升高44.36%、39.31%、22.70%、37.90%,说明AM真菌侵染使PSⅡ的活性增强。ΦPSⅡ为实际光化学效率,它能反映在照光下PSⅡ反应中心部分关闭的情况下,实际光化学效率。与非菌根对照相比,在不同测定时期,菌根花生叶片ΦPSⅡ均明显增强(图3-b),在苗期、花期分别升高28.12%、21.83%。说明菌根花生PSⅡ的光合机构活性增强。
2.4.3摩西球囊霉对花生叶片光系统电子传递的影响ETR表示整个光系统线性电子传递速率,用来衡量植物体内总光合电子传递能力。菌根花生叶片ETR明显高于对照(图4-a),在4个时期分别升高51.8%、26.8%、23.1%、26.0%。ΦEo表示用于电子传递的量子产额。从图4-b可知,菌根花生叶片ΦEo均有升高,说明电子传递能力增强。
上述结果说明,菌根花生叶片吸收的光能用于电子传递的能量增加,整个光系统电子传递速率加快。
2.4.4摩西球囊霉对花生反应中心活性的影响RC/CSo表示单位面积有活性反应中心数量。由图5-a可知,与对照相比,在各测定时期菌根花生叶片RC/CSo明显升高。光化学猝灭系数qP(图5-b)反映PSⅡ反应中心的开放程度,与对照相比,菌根花生叶片反应中心的开放程度加大。
上述结果说明,FM处理植株叶片不但反应中心数量增加,而且反应中心的开发程度增加,利用光能的效率增加。
2.5摩西球囊霉对花生PSⅠ活性的影响
利用花生叶片820nm光吸收相对差值(ΔI/Io)代表PSⅠ的活性。从图6看出,菌根花生叶片PSⅠ的活性显著上升,在不同测定时期,菌根与非菌根对照相比在苗期没有明显差异,但在花期、结荚期和饱果期分别上升了30.31%、1422%、4219%。这说明摩西球囊菌侵染提高了PSⅠ的活性。
3结论与讨论
AM真菌能够促进植物的生长,增加其生物量[10,21]。本研究中,摩西球囊菌侵染花生植株,在花生的苗期、花期、结荚期和饱果期4个时期中,菌根花生与非菌根花生相比地上部干质量、开花数、果荚数、果荚质量均有显著或极显著增加,光合速率与叶绿素含量明显升高。叶绿素含量的高低在一定程度上反映了植物光合能力的大小。AM真菌侵染后,宿主叶绿素含量增加,并伴随着生物量的增加[3,6,8,21]。
仅用叶绿素含量的变化很难对光合性能的改变作出准确的解释。本研究中用叶绿素荧光动力学技术对摩西球囊菌侵染花生植株后的光合机构进行研究。基于菌根花生叶片光吸收性能指数PI与实际光化学效率ΦPSⅡ显著升高,说明摩西球囊霉侵染后光合机构性能增强。菌根花生叶片光系统线性电子传递速率ETR与电子传递的量子产额ΦEo也显著升高,单位面积有活性反应中心数量RC/CSo增加,光化学猝灭系数qP升高,这也说明菌根花生叶片对光能的利用率增强。Pinior等在研究干旱胁迫下根内球囊霉(Glomus intraradices)对月季的影响时发现,与AM共生的植株在水分胁迫下有更高的PI值,有较高的活性反应中心数量,ΦEo也显著升高,PSⅡ向PSⅠ电子传递加快[22]。Rathod等的研究发现,F. mosseae 可促进侵染大豆在水份胁迫下的生长,大豆叶片荧光参数RC/ABS 和 ETo/ABS 都显著升高,故认为在AM菌存在时减少了反应中心的失活[23]。姚娟等研究发现,菌根烟苗的PSⅡ实际光合效率、光化学猝灭系数、最大相对电子传递速率均高于无菌根烟苗[21]。欧静等发现,桃叶杜鹃接菌苗的ETR、Fv/Fm和光化学猝灭 qP 均显著提高[24]。以上参数反映出PSⅡ活性的变化,对PSⅠ活性鲜有研究。本研究中利用820 nm光吸收相对差值(ΔI/Io)代表PSⅠ的活性,发现与非菌根相比,菌根花生叶片PSⅠ活性显著升高,促进了电子由PSⅡ向PSⅠ的传递。另外,研究还发现菌根花生叶片与非菌根叶片之间的荧光差值ΔVt的变化在30 ms 附近,Ⅰ相降低,这说明AM真菌侵染使花生叶片电子传递速度加快,目前还未见这方面的研究报道。
参考文献:
[1]Parniske M. Arbuscular mycorrhiza:the mother of plant root endosymbioses[J]. Nature Reviews Microbiology,2008,6(10):763-775.
[2]刘润进,陈应龙.菌根学[M]. 北京:科学出版社,2007.
[3]Zhu X C,Song F B,Xu H W. Arbuscular mycorrhizae improves low temperature stress in maize via alterations in host water status and photosynthesis[J]. Plant and Soil,2010,331(1/2):129-137.
[4]Hajiboland R,Aliasgharzadeh N,Laiegh S F,et al. Colonization with arbuscular mycorrhizal fungi improves salinity tolerance of tomato (Solanum lycopersicum L.) plants[J]. Plant and Soil,2010,331(1/2):313-327.
[5]陈笑莹,宋凤斌,朱先灿,等. 高温胁迫下丛枝菌根真菌对玉米光合特性的影响[J]. 华北农学报,2013,28(2):108-113.
[6]何跃军,钟章成,刘锦春,等. 石灰岩土壤基质上构树幼苗接种丛枝菌根(AM)真菌的光合特征[J]. 植物研究,2008,28(4):452-457.
[7]李鹏民,高辉远,Strasser R J.快速叶绿素荧光诱导动力学分析在光合作用研究中的应用[J]. 植物生理与分子生物学学报,2005,31(6):559-566.
[8]赵昕,宋瑞清,阎秀峰. 接种AM真菌对喜树幼苗生长及光合特性的影响[J]. 植物生态学报,2009,33(4):783-790.
[9]2014—2019中国花生行业市场深度调研及投资价值分析研究报告[EB/OL]. (2014-06-30)[2015-03-01]. http://www.chinairn.com/report/20140630/090737890.html.
[10]Krishna K R,Bagyaraj D J. Growth and nutrient uptake of peanut inoculated with the mycorrhizal fungus Glomus fasciculatum compared with non-inoculated ones[J]. Plant and Soil,1984,77:405-408.
[11]Carling D E,Roncadori R W,Hussey R S. Interactions of arbuscular mycorrhizae,Meloidogyne arenaria,and phosphorus fertilization on peanut[J]. Mycorrhiza,1996,6:9-13.
[12]Abdalla M E,Abdel-Fattah G M. Influence of the endomycorrhizal fungus Glomus mosseae on the development of peanut pod rot disease in Egypt[J]. Mycorrhiza,2000,10(1):29-35.
[13]Phillips J M,Hayman D S. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection[J]. Transactions of the British Mycological Society,1970,55(1):158-163.
[14]Arnon D I. Copper enzymes in isolated chloroplasts. Polyphenoloxidase in Beta vulgaris[J]. Plant Physiology,1949,24(1):1-15.
[15]陈大印,刘春英,袁野,等. 不同光强与温度处理对“肉芙蓉”牡丹叶片PSⅡ光化学活性的影响[J]. 园艺学报,2011,38(10):1939-1946.
[16]Schansker G,Srivastava A,Strasser R J. Characterization of the 820 nm transmission signal paralleling the chlorophyll a fluorescence rise (OJIP) in pea leaves[J]. Functional Plant Biology,2003,30:785-796.
[17]杨德翠,刘超,盖树鹏,等. 牡丹柱枝孢叶斑病(Cylindrocladium canadense)对叶片光合系统功能的影响[J]. 园艺学报,2013,40(3):515-522.
[18]Strasser R J,Srivastava A,Govindjee. Ployphasic chlorophyll a fluorescence transients in plants and cyanobacteria[J]. Photochemistry and Photobiology,1995,61(1):32-42.
[19]Strasser R J,Srivastava A,Tsimilli-Michael M. The fluorescence transient as a tool to characterize and screen photosynthetic samples[M]. London:Taylor and Francis Press,2000:445-483.
[20]Strasser R J,Tsimill-Michael M,Srivastava A. Analysis of the chlorophyll a fluorescence transient[M]. Netherlands:Kap Press,2004:1-47.
[21]姚娟,王茂胜,石俊雄,等. AM真菌对烟苗生长及叶绿素荧光特性的影响[J]. 贵州农业科学,2012,40(9):109-114.
[22]Pinior A,Grunewaldt-Stcker G,Alten H,et al. Mycorrhizal impact on drought stress tolerance of rose plants probed by chlorophyll a fluorescence,proline content and visual scoring[J]. Mycorrhiza,2005,15:596-605.
[23]Rathod D P,Brestic M,Shao H B. Chlorophyll a fluorescence determines the drought resistance capabilities in two varieties of mycorrhized and non-mycorrhized Glycine max Linn.[J]. African Journal of Microbiology Research,2011,5(24):4197-4206.
[24]欧静,何跃军,刘仁阳,等. 杜鹃花类菌根真菌对桃叶杜鹃幼苗光合性能及叶绿素荧光参数的影响[J]. 微生物学通报,2013,40(8):1423-1436.徐安阳,段维,吴慧,等. 3种植物生长调节剂对向日葵产量与品质的影响[J]. 江苏农业科学,2016,44(5):149-151.
