湖南省柑橘溃疡病菌gyrB和16S rRNA的扩增和序列分析
2016-07-23
摘要:为了解湖南省不同地区柑橘溃疡病菌遗传多样性,从湖南省黔阳、祁阳、衡山、道县、茶陵、永兴、沅江、零陵8个柑橘主产区采集样本,分离病原菌,PCR扩增其gyrB基因和16S rRNA序列,阳性样品送样测序。利用生物信息学软件,将测序结果与GenBank中柑橘溃疡病菌相近的黄单胞杆菌构建系统发生树,对比2个不同序列扩增的分辨率。结果表明,gyrB基因比16S rRNA序列分辨率高;利用gyrB基因除了能分析亲缘较近的外源菌株,还能对同属但是生长地区有异的菌株进行更深入的区分。
关键词:柑橘溃疡病;遗传多样性;gyrB基因;16S rRNA
中图分类号: S436.661.1+2文献标志码: A文章编号:1002-1302(2016)05-0076-03
1912年首次在美国发现[1],中国相关最早的报道出现在1918年[2]。至今全球已有30多个国家和地区报道发现了该病害,占世界柑橘种植国家和地区的50%以上[3-4]。柑橘溃疡病对我国柑橘产业有较大影响,不仅降低了全国柑橘产量和品质,还制约了我国柑橘产业的发展[5];其中发病严重的地区包括湖南、福建、广东、广西等。柑橘溃疡病是一种细菌性病害,病原菌为地毯草黄单胞柑橘致病变种(Xanthomonas axonopodis pv. citri),病菌主要通过自然孔口和伤口感染健康植株。该病菌在叶、枝梢及果实的病斑中越冬,翌年春条件适宜时从病部溢出,借风雨、昆虫传播,经寄主的气孔、皮孔和伤口侵入,使叶片、嫩梢和果实发病[6]。叶片受害,开始在叶背产生针头大小的黄色、油渍状小点,后逐渐扩大。同时,在叶片正反两面逐渐隆起成圆形病斑,病部表皮破裂,病斑木栓化如海绵状,表面粗糙,灰褐色。其后中央凹陷并有细微轮纹,周围有黄色晕圈,在晕圈的内侧常有褐色釉光边缘,后期病斑中心开裂并且凹陷,呈火山口状。柑橘溃疡病自然条件下传播距离较近,主要途径是风雨、虫害和农作时造成的伤口以及植株间摩擦等[7]。
rRNA是细菌系统分类学研究中最常用的“分子钟”,其种类少,含量大,可占到细菌RNA总量的80%[8]。由于其大小适中且保守性很好,所以广泛应用于物种间的遗传分化距离和亲缘关系的研究中。16S rRNA是一种常用核糖体RNA,其高度的保守性[9]使之成为分子生物学研究的一个热点。
促旋酶(gyrase)B亚单位基因简称为gyrB,是一种细菌共有的蛋白质编码基因[10]。随着分子生物学的发展,gyrB基因序列扩增技术在细菌亲缘关系及系统发育研究中的作用越来越明显[11],可以用其作为分子标记来研究细菌的系统发育水平,还可区分近源种和菌株。已知的gyrB序列,包括其相关产物的gyrB数据被存放于由日本建立的ICB[12]数据库中,用于细菌分类鉴定方面的研究和细菌亲缘种的鉴定。Dauga等研究表明,比较肠杆菌科(Enterobacteriaceae)不同属的系统进化关系时,gyrB基因比16S rRNA更加适用于种属内或种属间的精确遗传距离分析和发育关系比较[13] 。
中国柑橘溃疡病研究表明,部分地区的菌种中仍然存在更细致的分化[14],本研究采集湖南省主要柑橘产区的柑橘溃疡病样本,分离致病菌进行纯化培养及致病性检测,提取病原菌DNA选取多种引物进行PCR扩增,最终选出自行设计的gyrB基因片段的特异性引物[15]和16S rRNA引物[16]来分析湖南柑橘溃疡病的遗传多样性。
1材料与方法
1.1材料
供试材料取自于湖南省黔阳、祁阳、衡山、道县、茶陵、永兴、沅江、零陵等地的柑橘主要种植区,大部分为叶片,少部分为发病果实。采用的致病菌标准菌由湖南农业大学国家柑橘改良中心长沙分中心提供。
1.2方法
1.2.1柑橘溃疡病菌分离、鉴定按稀释分离法对采集的柑橘溃疡病样本进行病原菌分离[17],得到的病原物经JYF5/JYR5引物进行PCR扩增、验证。JYF5/JYR5引物序列为:JYF5:5′-TTCGGCGTCAACAACCTG-3′,JYR5:5′-AACTCCAGCACATACGGGTC-3′,目标片段长度在410左右,基本都扩增到了目标条带,从 8个地区的样品中经过分离和鉴定共获得了22个病原菌的菌株。
1.2.2gyrB引物gyrB序列引物是通过Primer Premier 5.0软件[18]设计的引物GGS1F/GGS2R,其序列为GGS1F:5′-CCCTGCTGCTGACCTTCTTCT-3′和GGS2R:5′-GGTTGACCGTGG TTTCCCATA-3′。反应参数:预变性95 ℃ 4 min;变性95 ℃ 30 s,退火62 ℃ 30 s,延伸72 ℃ 30 s,35个循环;延伸72 ℃ 7 min,4 ℃保存。
1.2.316S rRNA序列16S rRNA序列的引物为27F:5′-AGAGTTTGATCMTGGCTCAG-3′和1492R:′-TACGGHTACCTT ACGACTT-3′。 反应参数:预变性95 ℃ 4 min;变性 95 ℃ 30 s,退火58 ℃ 30 s,延伸72 ℃ 30 s,40个循环;延伸72 ℃ 7 min,4 ℃保存。
1.2.4序列分析和系统发育树的构建gyrB及16S rRNA序列引物PCR扩增产物送至上海生工测序,测序结果用软件MEGA 4.0的非加权平均数聚类法(Unweighted Pair Group Method with Arithmatic mean,UPGMA)构建系统发育树。
2结果与分析
2.1gyrB引物的PCR扩增结果
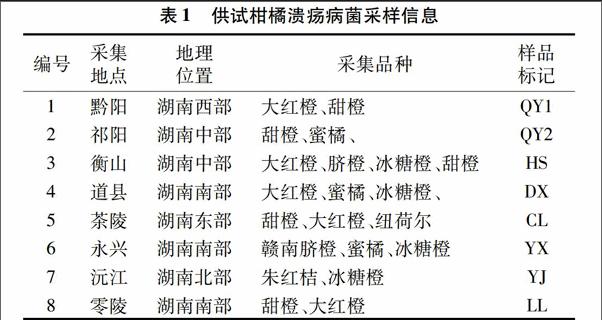
通过GGS1F/GGS2R引物对22个已经鉴定的柑橘溃疡病病原菌进行PCR扩增,目标片段的大小约为760 bp,扩增产物进行凝胶电泳,结果见图1。
2.216S rRNA序列PCR扩增结果
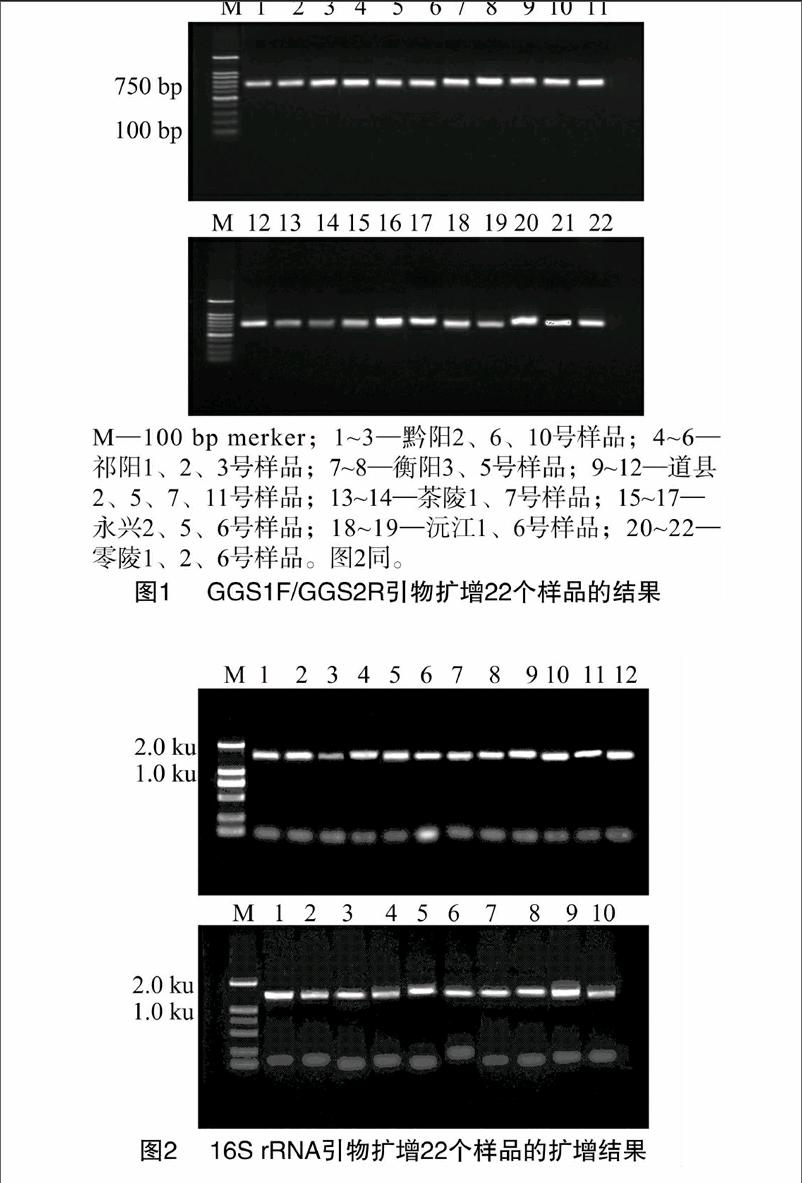
16S rRNA序列引物PCR扩增22个经过鉴定的菌株,目标片段的大小约为1.5 ku,PCR扩增产物进行凝胶电泳,结果见图2。
2.3构建gyrB和16SrRNA序列的系统发育树
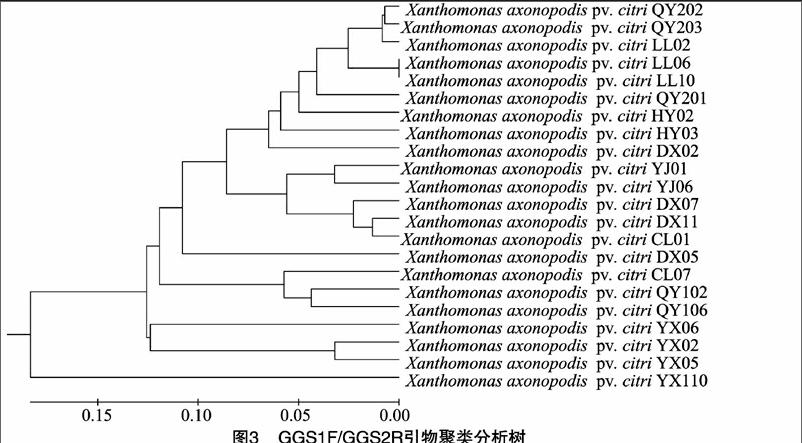
2.3.1gyrB序列系统发育树gyrB序列引物扩增产物序列建树结果(图3)表明,不同地区的病原菌样品间的遗传距离比较明显。在遗传距离大于0.18时22个供试菌株为同一簇,当遗传距离为0.055时,所有的菌株可以分成7个不同的簇,其分布情况基本与菌株采样地点在湖南省的地理位置相关。
2.3.216S rRNA序列系统发育树16S rRNA 引物扩增产物序列建树结果(图4)表明,所采用的菌株样品之间的遗传距离非常小。遗传距离为0.0046左右时,所有的菌株一共可以分为3个不同的簇,其分布规律基本与地域的差距有很大关系。
3讨论
通过16S rRNA及gyrB序列引物PCR扩增结果建树可以明显看到湖南省中部、东部及北部部分样品,西部和部分北部样品,南部、部分西部样品分成了3个遗传距离相对大一点的3部分。其分布与病原菌来源地的位置有着较大联系,而且寄主植物差异也是造成遗传差距的主要因素之一,且gyrB基因序列分辨率要明显高于16S rRNA序列。16S rRNA序列分析仅能在属的水平区分这些菌株,gyrB序列分析还可将区分程度扩展到属内小种。
16S rRNA序列在目前使用比较广泛,但其不足之处也逐渐显露。16S rRNA基因序列相比gyrB基因序列所携带的信息量多,长度适中,但其分辨率较低。gyrB引物扩增序列在菌株分类程度上有了进一步的提高,在湖南省柑橘溃疡病的小种分析中gyrB基因序列的分辨率较前者高,效果比较好;但是由于gyrB基因的序列较短,鉴定细菌的准确度依然不够。目前,gyrB基因序列在分子生物学中应用不多,还需要进一步开发利用。
参考文献:
[1]Dopson R N. The eradication of citrus canker[J]. Plant Dis Rept,1964,48:30-31.
[2]Lee H A. Further data on the susceptibility of rutaceous plants to citrus canker[J]. Agr Res,1918,15:661-665.
[3]Gottwald T R,Graham J H,Schubert S T. Citrus canker:the pathogen and its impact [R/OL].[2015-12-20]. http://www.plantmanagementnetwork.org/pub/php/review/citruscanker/.
[4]Schubert T S,Rizvi X,Sun T R. Meeting the challenge of eradicating citrus in Florida-Again[J]. Plant Disease,2001,85:340-356.
[5]杨枫. 多胺在提高柑橘溃疡病抗性中的作用及其机理研究[D]. 武汉:华中农业大学,2014.
[6]陈小帆,莫瑾,左静,等. 利用双重PCR技术检测柑橘溃疡病菌[J]. 华南农业大学学报,2010,31(3):32-35.
[7]Gottwald T R,Timmer L W. The efficacy of windbreaks in reducing the spread of citrus canker caused by Xanthomonas campestris pv. citri[J]. Tropical Agriculture,1995,72(3):194-201.
[8]Hou W G,Wang S,Dong H L,et al. A comprehensive census of microbial diversity in hot springs of Tengchong,Yunnan Province,China using 16S rRNA gene pyrosequencing[J]. PLoS One,2013:e81.
[9]Hiroshi M,Maruyama F,Kato H,et al. Design and experimental application of a novel non-degenerate universal primer set that amplifies prokaryotic 16S rRNA genes with a low possibility to amplify eukaryotic rRNA genes[J]. DNA Research,2014,21:217-227.
[10]Kirby B M,Everest G J,Meyers P R. Phylogenetic analysis of the genus Kribbella based on the gyrB gene:proposal of a gyrB-sequence threshold for species delineation in the genus Kribbella[J]. Antonie Van Leeuwenhoek,2010,97(2):131-142.
[11]Carrasco G,Valdezate S,Garrido N,et al. Identification,typing,and phylogenetic relationships of the main clinical nocardia species in Spain according to their gyrB and rpoB genes[J]. Journal of Clinical Microbiology,2013,51(11):3602-3608.
[12]Teng L J,Hsueh P R,Huang Y H,et al. Identification of bacteroides thetaiotaomicron on the basis of an unexpected specific amplicon of universal 16S ribosomal DNA PCR[J]. Journal of Clinical Microbiology,2004,42(4):1727-1730.
[13]Dauga C. Evolution of the gyrB gene and the molecular phylogeny of Enterobacteriaceae:a model molecule for molecular systematic studies[J]. International Journal of Systematic and Evolutionary Microbiology,2002,52(2):531-547.
[14]彭耀武. 中国柑橘溃疡病病原菌多态性研究[D]. 重庆:西南大学,2014.
[15]安然,易图永,肖启明,等. gyrB基因在细菌分类和检测中的应用[J]. 江西农业学报,2010,22(4):18-20,24.
[16]李霞,高谦.16S rRNA基因序列分析在临床微生物学中的应用[J]. 微生物与感染,2006,1(3):184-186.
[17]董玉兰. 湖南省柑橘溃疡病菌系分化及拮抗菌筛选[D]. 长沙:湖南农业大学,2012.
[18]张新宇,高燕宁. PCR引物设计及软件使用技巧[J]. 生物信息学,2004,2(4):15-18,46.曾云英,万强,马存琛. 抑菌剂及接种条件在矮牵牛开放式快速繁殖中的效果[J]. 江苏农业科学,2016,44(5):79-80.
