大花三色堇FPNI—PCR反应体系的优化
2016-07-23李婧曾媛龚胜
李婧++曾媛++龚胜


摘要:融合引物与巢式聚合酶链式反应(fusion primer and nested integrated PCR,FPNI-PCR)是一种分离并扩增已知序列旁未知序列的有效方法。以大花三色堇(Viola×wittrockiana Gams.)为材料,为提高FPNI-PCR产物特异性,增加条带清晰度,降低非特异性条带的干扰,对FPNI-PCR反应体系中第1轮的模板DNA浓度进行对比,优化了第3轮反应中引物浓度、Taq DNA 聚合酶浓度、缓冲液用量,筛选了第3轮特异性引物的退火温度,进一步完善了FPNI-PCR反应体系。各因素优化比对试验表明:FPNI-PCR第1轮反应体系应以稀释后的DNA为模板,20 μL体系中,用量在4.5~10 ng。第3轮最优反应体系为:20 μL反应体系中,特异性引物浓度0.2 μmol/L,引物SP2浓度 0.75 μmol/L,Taq DNA酶用量1.0 U,dNTP用量2 μL,10×buffer(20 mmol/L,Mg2+ plus)用量2 μL,模板1 μL(第2轮反应稀释100倍后取1 μL为模板),ddH2O补足。第3轮反应中,退火温度为64 ℃或66 ℃时条带最为清晰。
关键词:大花三色堇;FPNI-PCR;体系优化
中图分类号: Q785文献标志码: A[HK]
融合引物与巢式聚合酶链式反应(fusion primer and nested integrated PCR,FPNI-PCR)是一种基于热不对称交错PCR (thermal asymmetric interlaced PCR,TAIL-PCR)技术原理的PCR方法[1],主要是利用目标序列旁的已知序列设计3 个嵌套特异性引物,与给出的9个特殊设计的随机简并引物(arbitrary degenerate prime,AD)相结合,进行1次巢式反应,并在简并引物的基础上设计2个嵌套的特殊引物替换第1轮PCR所用随机引物用于第2、3轮的扩增。FPNI-PCR中融合引物(fusion primer),即特殊设计的随机简并引物,由3′端的随机寡核苷酸(arbitrary degenerate oligonucleotides)和5′端可设计特异引物的一段序列组成,该序列用以替换初次PCR所用简并引物。经过热不对称循环后的产物含有特异引物结合位点,能有效降低产物稀释后非特异性扩增的影响[2]。FPNI-PCR具有高效灵敏、产物特异性高、重复性好、能够在较短的时间内获得目标片段等优点,是扩增基因侧翼序列特别是启动子的有效方法[3]。
FPNI-PCR与TAIL-PCR技术类似,其反应产物的稳定性、可重复性明显受到反应体系模板、引物、Taq DNA 聚合酶、Buffer以及3轮退火温度等因素的影响[4]。在进行 FPNI-PCR 反应获取未知序列时,有必要根据上述因素,对不同因素进行优化组合,以获得最优的反应结果。
大花三色堇(Viola×wittrockiana Gams.)是重要的冬春季花卉,有着十分丰富的花色和花斑类型,是研究植物花斑形成的理想植物[5]。笔者所在实验室先前的研究表明,二氢黄酮醇还原酶(dihydroflavonol reductase,DFR)和花青素合成酶 (anthocyanidin synthase,ANS)基因是三色堇花斑由无色转向着色的关键性基因[6]。关于DFR和ANS的相关研究发现,其启动子中含有的众多调控元件,与花色素调控密切相关[7-9]。因而这2个基因的启动子结构特点,可能是花斑位置形成的一个关键性因素,其启动子的克隆,对于进一步研究三色堇色斑的形成具有十分重要的意义。FPNI-PCR技术是克隆启动子序列的有效方法,而目前关于三色堇FPNI-PCR技术研究尚无相关报道,本研究以三色堇为材料,对其FPNI-PCR反应体系进行优化,为三色堇VwDFR和VwANS基因启动子的克隆提供技术基础。
1材料与方法
1.1材料与试剂
大花三色堇品种“宾哥”,花色为黄底黑斑,栽培于海南大学园艺园林学院基地。
1.2方法
1.2.1模板DNA的提取
提取三色堇幼叶DNA,步骤参考尚啸等的改良CTAB法[10],仅核酸分离时改用加1/10体积的5 mol/L NaAc。提取的DNA用0.8%的琼脂糖凝胶电泳检测DNA质量,电泳结果通过凝胶成像仪(Dolophin- Doc,美国)拍照,利用紫外分光光度计测浓度。小管分装-20 ℃保存。
1.2.2试验中用到的引物包括FPNI-PCR反应体系中的第1轮、第2轮、第3轮的简并引物、特殊引物(表1)[1]以及根据VwANS基因设计的特异引物(表2)。
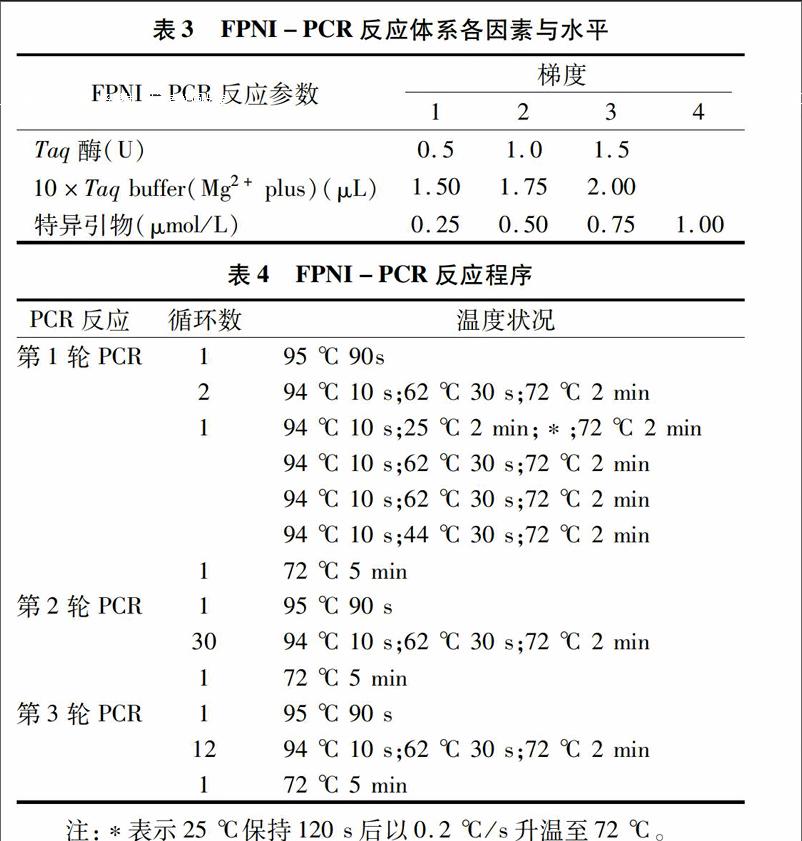
1.2.3FPNI-PCR体系的优化(1)模板DNA浓度筛选。将提取的DNA稀释100、200倍,然后将未稀释的DNA和稀释不同倍数的DNA作为第1轮PCR反应的模板,反应采用表1中的FP5、FP6、FP7、FP9这4条简并引物,反应程序见表3,反应体系为20 μL,具体组分见参考文献。
(2)FPNI-PCR反应退火温度的梯度筛选。根据设计的特异性引物GSP3的TM值,对第3轮退火温度进行梯度筛选,筛选温度分别是62、64、66 ℃。
(3)引物、10×buffer(20 mmol/L,Mg2+ plus)、Taq DNA酶用量的对比。 PCR反应采用20 μL反应体系,分别对影响第3轮反应体系中的主要参数:引物、10×buffer(Mg2+ plus)、Taq DNA酶,设置不同的浓度梯度,具体参数值见表3。此外,每20 μL反应体系中均含有dNTP(2.5 mmol/L)2 μL、特异性引物0.2 μmol/L,模板为第2轮反应产物稀释100倍取1 μL,加ddH2O补足至20 μL。逐一优化每个参数值,优化时,其他参数值均采用表3所列反应参数的第一水平值,引物采用参考文献中的FP5、FP6、FP7、FP9这4条简并引物 (表1),反应程序见表4。
2结果与分析
2.1DNA的提取结果
以三色堇嫩叶为材料提取DNA,经紫外分光光度计检测,浓度为(0.901±0.019)μg/L,D260 nm/D280 nm介于1.8~2.0之间,说明样品DNA中杂质较少。0.8%琼脂糖凝胶电泳结果如图1所示,点样孔无滞留,条带清晰明亮,无明显拖尾现象,说明RNA等杂质去除较干净。结果表明,采用改良CTAB法可以有效地提取三色堇幼叶的DNA[10],对于后续PCR反应有利。
2.2DNA的浓度对FPNI-PCR的影响
模板DNA的用量对FPNI-PCR反应有着非常直观的影响,过多或者过少都会造成产物的不稳定或者无法产生条带。普通方法提取的DNA通常含有杂质,而杂质对PCR产物的影响是非常显著的。为了获得清晰条带,降低非特异性扩增,本试验以3个浓度的DNA为模板,利用FP5、FP7、FP9这3种简并引物分别扩增,其他条件相同,结果如图2所示。
以未稀释DNA为模板,3轮扩增后均无清晰条带(图2)。将DNA模板分别稀释100、200倍,随着DNA稀释倍数的增加,简并引物FP5扩增出的条带数量明显增加,且条带清晰度明显提升;简并引物FP9扩增的结果,100倍稀释比200倍稀释扩增条带数量更多、条带更加清晰(图2)。同时,7号引物在多个模板浓度下皆无明显条带,说明利用FPNI-PCR进行扩增时,模板的稀释倍数应配合不同的简并引物进行筛选,以期降低杂质等对反应的影响,才能获得更为清晰的条带。
2.3退火温度对扩增产物的影响
通过对5、7、9号引物扩增反应的第3轮扩增的退火温度进行筛选,筛选温度为62、64、66、68 ℃,结果见图3。总体来看,64、66 ℃反应效果更好,但是不同引物反应的最佳退火温度不同,如FP5引物64 ℃下扩增效果较好,FP9号中超过700 bp 的条带,在66 ℃下更清晰。
2.4Taq酶的用量对FPNI-PCR的影响
Taq酶在PCR反应体系中用量少,却极为重要,Taq酶的类型、用量,甚至是生产商,都会对PCR产物造成明显的影响。在本研究中,分别对以FP6和FP7简并引物扩增获得的PCR产物进行Taq酶的优化,其他条件全部相同,结果如图4所示。试验发现,Taq酶的用量对反应条带的数量和清晰度都有一定影响,随着Taq酶用量的增加,FP6和FP7扩增的PCR产物的量均有所提高,但FP6更为明显,能获得较为清晰的条带,而FP7无明显的清晰条带。以简并引物FP6扩增,Taq酶用量1.5 U时比1.0 U时条带亮度只略有提升,且非特异性扩增也更为明显,表明Taq酶用量1.0 U更为合适。
2.510×Taq buffer(Mg2+ plus)用量对FPNI-PCR的影响
分别以简并引物FP6和FP7进行扩增,通过改变10×Taq buffer(Mg2+ plus)用量,其他条件均相同,结果见图5。结果显示,以简并引物FP6扩增,3种缓冲液用量均获得条带,但用量为2 μL时,目的条带更为清晰;以简并引物FP7扩增,缓冲液为1.5 μL时无条带,由1.75 μL增至2 μL时,条带数量增加,清晰度略有增加。
2.6引物浓度对FPNI-PCR的影响
以FP6和FP7这2种简并引物扩增,对第3轮引物SP2浓度进行筛选。结果(图6)显示,引物浓度为0.25 μmol/L时,均无条带,随着引物浓度的上升,条带数量、亮度明显增加,非特异性扩增同样增加,条带出现模糊现象。由图6可知,以FP6和FP7为简并引物扩增,第3轮引物SP2浓度为0.75~1.0 μmol/L时,均有较好结果。但从节约成本、提高条带清晰度、减少非特异性扩增角度考虑,0.75 μmol/L时更佳。
3结论与讨论
3.1结论
从试验结果来看,FPNI-PCR适合以低浓度DNA为模板,第1轮反应以稀释后的DNA为模板,20 μL体系中,用量在4.5~10 ng。对三色堇FPNI-PCR第3轮体系进行优化,最优反应体系是:20 μL反应体系中,特异性引物浓度 0.2 μmol/L,引物SP2浓度0.75 μmol/L,Taq DNA酶用量10 U,dNTP用量2 μL,10×buffer(20 mmol/L,Mg2+ plus)用量2 μL,模板为第2轮反应稀释100倍后取1 μL,ddH2O补足。第3轮反应经温度筛选,退火温度64 ℃或66 ℃时条带最佳。
3.2讨论
FPNI-PCR是基于热不对称PCR技术原理的PCR方法,共包括3轮PCR反应。其中,第1轮反应中,含3次高严谨反应,目的是使高退火温度的特异性引物SP1与模板序列退火延伸;1次低严谨反应,目的是使简并引物结合到较多的目的序列上;5次热不对称的高低特异性循环交替反应,使目的片段得以指数性扩增。第2、3轮为普通PCR反应,通过特异性嵌套引物进一步扩增目的条带。它与普通TAIL-PCR的主要区别在于给出了经过优化后的一系列简并引物,并在简并引物的基础上设计了嵌套的特殊引物FSP1、FSP2用于第2、3轮的扩增[2]。特异性嵌套引物的存在,使非目的条带得不到大量扩增,而非目标序列中的发卡结构也能抑制其扩增,从而提高了目的片段扩增的准确性[11]。
由于FPNI-PCR反应步骤较多,因此影响扩增结果的因素也较多。首先,第1轮的高低严谨热不对称反应是目标片段扩增的最初环节,而本试验证明,模板浓度是影响第1轮反应结果的关键因素。在研究中发现,低浓度的DNA模板更容易获得扩增结果,且模板DNA的稀释倍数对不同简并引物扩增的影响不同。在其他PCR反应的研究中同样发现,植物DNA模板的浓度对于目的片段的扩增具有很大的影响[12]。在TAIL-PCR中,通常需要对模板进行稀释,才能获得较为清晰的条带[4,13]。原因可能是DNA中所含杂质的影响,未稀释的高浓度DNA中所含杂质更多,影响条带扩增,另外,不同简并引物对模板的浓度要求也可能不同,所适应的模板浓度存在差异。
在FPNI-PCR反应中,第1轮扩增产物因条带杂、浓度低,往往无法通过凝胶成像显示,需要通过第2轮对目标条带的进一步扩增获得初步结果。通过第2轮产物凝胶成像,以有条带的第2轮稀释产物为模板,通过第3轮反应进一步扩增,以期获得较第2轮更为清晰的条带。因此,第3轮反应体系的优化对最终结果的获得具有重要作用。
本研究中,针对第3轮PCR反应中部分因素进行了优化,结果发现,与buffer(Mg2+ plus)、Taq DNA酶用量相比,引物的浓度影响最为显著,随着引物浓度的上升,条带数量、亮度明显增加。需要注意的是,较高的引物浓度虽有利于扩增,但会造成条带模糊、非特异性条带增加,这与其他PCR反应类似[14],不利于与第2轮条带比对推测目的条带。虽然 FPNI-PCR中融合引物特殊且相对较短,有利于与DNA模板结合扩增目的条带,但经过3轮反应虽然在一定程度上降低了非特异条带的干扰,但杂条带的影响仍是影响试验结果的重要原因[15]。因此,在第3轮反应中选出最适当的引物浓度,具有十分重要的作用。含Mg2+ 的buffer缓冲液主要对引物和模板的退火、Taq DNA酶的稳定起作用,当缓冲液低于一定限度不能产生条带,但用量过多也会使dNTP过量结合,非特异性条带增加,不利于反应[16-17]。与缓冲液相对应,Taq DNA酶用量的多少,同样对PCR反应存在直接影响,不同的Taq酶需要配合相应的缓冲液使用,过少无法产生条带,过多也会造成非特异性扩增[18-19]。在本试验中,较高的buffer浓度和Taq DNA酶均有利于扩增。
PCR反应中除各因素外,退火温度对目的条带的获取同样具有重要作用。相关研究发现,对热不对称PCR第3轮反应退火温度的优化,能有效地促进目的片段的富集[20]。本试验第3轮PCR反应中,特异性引物的Tm值为65 ℃,通过温度筛选得出,退火温度为64 ℃或66 ℃时,条带更为清晰。
综上所述,本研究发现,在FPNI-PCR中通过优化反应体系中各因素的浓度或用量,筛选3轮PCR的退火温度,均能有效地增加目的条带的清晰度,减少非特异性扩增,为后续研究打下良好基础,为其他物种基因启动子的研究提供一定的借鉴作用。
[HS2*2][HT8.5H]参考文献:[HT8.SS]
[ZK(#]Wang Z,Ye S F,Li J J,et al. Fusion primer and nested integrated PCR (FPNI-PCR):a new high-efficiency strategy for rapid chromosome walking or flanking sequence cloning[J]. BMC Biotechnology,2011,11(1):16697-16702.
[2]李昆鹏,朱化彬,郝海生,等. 基于PCR方法的基因序列全长获取策略[J]. 中国生物工程杂志,2012,32(11):115-123.
[3]方子义. 蜡梅查尔酮合成酶基因(CHS)启动子及相关转录因子的克隆与功能分析[D]. 武汉:华中农业大学,2014.
[4]郑岑,张立平,唐忠辉,等. TAIL-PCR技术及其在植物基因中的克隆[J]. 基因组学与应用生物学,2009,28(3):544-548.
[5]张其生,包满珠,卢兴霞,等. 大花三色堇育种研究进展[J]. 植物学报,2010,45(1):128-133.
[6]李琴. 三色堇花色素合成结构基因的克隆与表达差异分析[D]. 海口:海南大学,2013.
[7]唐杏姣,韩科厅,胡可,等. 菊花CmDFR与CmANS基因启动子序列克隆与瞬时表达分析[J]. 生物技术通报,2012,28(5):81-88.
[8]Dong W,You Y X,Niu L L,et al. Isolation and analysis of the promoter of an anthocyanin synthase gene from purple-fleshed sweet potato tubers[J]. Acta Physiologiae Plantarum,2014,36(10):2637-2649.
[9]Gollop R,Even S,Colova-Tsolova V,et al. Expression of the grape dihydroflavonol reductase gene and analysis of its promoter region[J]. Journal of Experimental Botany,2002,53(373):1397-1409.
[10][ZK(#]尚啸,王健,龚胜,等. 三色堇叶片DNA不同提取方法比较[J]. 湖北农业科学,2014,53(20):4999-5002.
[11]刘慧,刘贯山,刘峰,等. 烟草T-DNA插入位点侧翼序列扩增方法的筛选与优化[J]. 中国烟草科学,2014,35(1):96-101,107.
[12]李宗菊,熊丽,桂敏,等. 非洲菊基因组DNA提取及[ISSR-PCR扩增模板浓度优化[J]. 云南植物研究,2004,26(4):439-444.
[13]罗静瑶,陈云云,谢俊,等. TAIL-PCR的技术改良及对香蕉[WTBX][STBX]NBS-RGC5[WTBZ][STBZ]基因侧翼序列的克隆[J]. 广东农业科学,2013,40(10):143-145,170.
[14]刘阳,杨淑霞,李敏惠,等. 引物浓度与退火温度不当导致巢式PCR非特异性扩增[J]. 成都医学院学报,2008,3(2):111-114.
[15]胡丹. 月季“月月红”酵母单杂交cDNA文库及RrMYB7诱饵载体的构建[D]. 武汉:华中农业大学,2014.
[16]Liu X D,Zheng D,Zhou Y N,et al. Restriction endonucleases digesting DNA in PCR buffer[J]. Journal of Forestry Research,2005,16(1):58-60,85-86.
[17]王云,秦伟,王永丰. 新疆野苹果S基因特异性PCR体系优化[J]. 新疆农业科学,2013,50(11):2023-2030.
[18]李谋强,师桂英,叶树辉,等. ‘兰州百合ISSR-PCR体系的优化[J]. 甘肃农业大学学报,2014,49(6):76-81.
[19]周雨晴,杜沛霖,傅鹏,等. 青天葵ISSR-PCR体系优化及引物筛选[J]. 中国实验方剂学杂志,2014,20(21):95-99.
[20]陈军营,沈向磊,辛玉茹,等. 改良TAIL-PCR技术在小麦PM H+-ATPase基因启动子克隆中的应用[J]. 河南农业大学学报,2008,42(1):1-5.
