猪宰后不同部位白肌肉与正常肉品质变化、能量代谢的差异
2016-07-22郭守立候良忠郭晓峰魏健王
郭守立++候良忠++郭晓峰++魏健++王子荣

摘 要:对猪宰后不同部位白肌(pale soft exudative,PSE)肉与正常肉的品质变化及能量物质的代谢差异进行研究。选取“杜长大”阉公猪宰后背最长肌、股二头肌均为正常肉和PSE肉,测定不同时间点肉品质指标(pH值、离心失水率、剪切力、L*)及能量物质(糖原、腺苷三磷酸(adenosine triphosphate,ATP)、腺苷二磷酸、腺苷酸)含量的变化,并分析各自的相关性。结果表明:宰后2 h内,股二头肌ATP含量显著高于背最长肌
(P<0.05)。宰后8 h内所有样本ATP含量下降显著(P<0.05);宰后48 h内,正常肉股二头肌糖原含量显著高于其他样本(P<0.05);离心失水率变化和L*值变化呈正相关(P<0.01);糖原含量和ATP含量的变化呈正相关(P<0.01)。因此,股二头肌肉品质优于背最长肌,股二头肌的糖原、ATP含量高于背最长肌,背最长肌能量代谢速率高于股二头肌。
关键词:猪白肌肉;背最长肌;股二头肌;肉品质;能量
猪白肌(pale soft exudative,PSE)肉,肉色苍白、质地松软、表面有较明显的汁液渗出,是一种常见的劣质猪肉[1]。PSE肉食用后虽然无毒无害,但在屠宰后会产生较大的滴水损失,烹饪后有较大的蒸煮损失,嫩度比正常肉差,不被消费者接受,给生猪屠宰企业带来较大的经济损失[2]。因此,探究PSE肉产生原因及机制,对采取有效控制措施防止PSE猪肉的产生具有较大意义。
目前,对于PSE肉产生的机理尚未完全查明,宰后肌肉糖酵解伴随着乳酸的产生、积累,导致宰后肌肉pH值的变化[3],被证实为导致PSE肉产生的主要原因[4]。邱宏强等[5]研究发现PSE肉有较快的糖原下降速率和较低的最终pH值。大量研究者提出PSE肉的糖酵解速度快,ATP等能量物质被快速消耗,但鲜有研究者提供具体数据,无法判断正常肉与PSE肉能量物质代谢的差异程度。而且从以往对猪PSE肉的研究来看,普遍以猪背最长肌作为研究对象[6],鲜有对其他部位产生的PSE肉进行研究。由于应激反应对机体的影响有组织特异性,同样是骨骼肌,股直肌、腰肌在应激中可能有不同的反应[7]。谢华等[8]
研究表明股二头肌的汁液流失率仅次于背最长肌;而腿部肌肉约占整个胴体质量的1/3,腿部肌肉一旦产生PSE肉,对市场销售产生的影响更大。目前,对猪宰后不同部位产生的PSE肉进行详细对比的研究还比较少,因此,比较不同部位正常肉与PSE肉品质、能量代谢的差异,得出肉品质以及能量物质在一定的时间的变化规律及相互关系,可为猪肉品质调控与PSE肉的研究提供进一步理论基础及数据参考。
1 材料与方法
1.1 材料与试剂
在新疆天康食品公司取样,选择饲养条件相同、年龄相同的“杜长大”三元杂交阉公猪。
5-腺苷三磷酸(adenosine triphosphate,ATP)钠盐、5-腺苷二磷酸(adenosine diphosphate,ADP)钠盐、5-腺苷酸(adenine nucleotides,AMP)钠盐(均为分析纯) 北京博奥拓达科技有限公司。
1.2 仪器与设备
testo205便携式pH计 德图仪器国际贸易(上海)有限公司;TA.XT.Plus物性仪 英国Stable Micro System公司;PHS-3C pH计 上海仪电科学仪器股份有限公司;JZ-350色彩色差计 深圳市金准仪器设备有限公司;FSH-2可调高速匀浆机 江苏省金坛市环宇科学仪器厂;ODS-3色谱柱(4.6 mm×250 mm,5 μm)、
LC-20A高效液相色谱仪、SPD-20A紫外检测器 日本岛津公司。
1.3 方法
1.3.1 样品制备
屠宰方法按照GB/T 17236—1998《生猪屠宰操作规程》进行屠宰。刺杀放血后20 min采样,设定此时为0 h。采用便携式pH计测定猪胴体股二头肌和背最长肌的pH值,同一头猪2 个部位同时pH<6.0即判定为PSE肉样。确定6 头正常(red firm non-exudative,RFN)肉样和6 头PSE肉样。4 ℃条件下保存,并于不同时间点(0、5、12、24、48、72、96 h)测定样品的pH值、持水性、剪切力、肉色。在0、4、8、24、48、72 h取样,装入冻存管后液氮中保存,用于糖原的测定。在0、2、4、8、24、48 h取样,装入冻存管后液氮中保存,用于ATP、ADP、AMP的测定。
1.3.2 pH值的测定
宰后20 min,使用便携式pH计测定倒数3~4肋间背最长肌的pH值。同时对准后腿叉骨与后腿拳骨的结合处上方插入腿部中心部位测定股二头肌的pH值。每个样测3次。
1.3.3 离心失水率的测定
参照Bouton等[9]的方法。切取1 cm厚的肉片,取中心部位肉样3.00~3.50 g。称质量后用滤纸将肉样包裹好,放入底部已装有脱脂棉的10 mL离心管中,4 ℃条件下4 000 r/min离心20 min。取出样品,剥去滤纸,对肉样再次称质量,计算水分损失百分比。每个样测3 次。
1.3.4 剪切力的测定
参考NY/T 1180—2006《肉嫩度的测定剪切力测定法》,并作适当调整。取中心温度为0~4 ℃的肉样,放入恒温水浴锅中80 ℃水浴,用数字探针食品中心测温仪测量肉样中心温度,待肉样中心温度达到70 ℃时,将肉样取出冷却至中心温度为0~4 ℃。用取样器顺肌纤维方向取1 cm×1 cm×3 cm的肉块,每个样品不少于3 个平行。用TA.XT.Plus物性仪测定剪切力。
1.3.5 肉色的测定
测定前将肉样切开,切面于室温下暴露15 min,使用色差计测量L*(亮度),每次测定前进行校正,每个样品重复测3 次。
1.3.6 糖原的测定
糖原的测定采用南京建成生物工程研究所生产的肌糖原测定试剂盒。具体方法如下:称取85 mg肉样,按照1∶3(m/V)加入碱液255 μL。沸水煮20 min,流水冷却,制成糖原水解液。将糖原水解液加入1.36 mL双蒸水制成5%的糖原检测液。在含有1.0 mL双蒸水的空白管和1.0 mL已知浓度的标准管中各加入2 mL显色液。测定管中加0.9 mL双蒸水和0.1 mL待测糖原检测液以及2 mL显色液。混匀后置沸水中水浴5 min,冷却后于620 nm波长、1 cm光径、空白管调零条件下,测各管吸光度,按公式(1)计算糖原含量。
(1)
式中:A1为测定管的吸光度;A2为标准管的吸光度;m为标准管溶液含量(0.01mg);n为样本测试前稀释倍数。
1.3.7 ATP、ADP、AMP的测定
参考沈晓玲[10]、孙蕊[11]等的方法,采用液相色谱法同步测定。
样品处理:取2.00 g肉样加入10 mL预冷的5%高氯酸,充分匀浆后,3 500 r/min冷冻离心10 min,将上清液滤于烧杯中,残渣再用5 mL预冷的5%高氯酸振荡后3 500 r/min冷冻离心10 min,合并滤液,用5%和1% NaOH溶液调滤液pH值至6.8,转至25mL容量瓶中,预冷超纯水定容。0℃以下保存,12h内用完。标准品和样品进样前都需用0.45μm滤膜过滤。
色谱条件:流动相为0.05 mol/L磷酸盐缓冲液(pH 6.8),使用前用0.45 μm滤膜抽滤,超声波脱气20 min。流动相流速:0.8 mL/min;进样量:20 μL;检测波长:245 nm;柱温:30 ℃。
1.4 数据处理
所有数据均以平均值±标准差表示,采用SPSS19.0统计分析软件的One-Way ANOVA程序进行方差分析和Duncans多重比较;相关性分析采用Pearson法。
2 结果与分析
2.1 宰后不同部位正常肉与PSE肉品质的变化
2.1.1 pH值
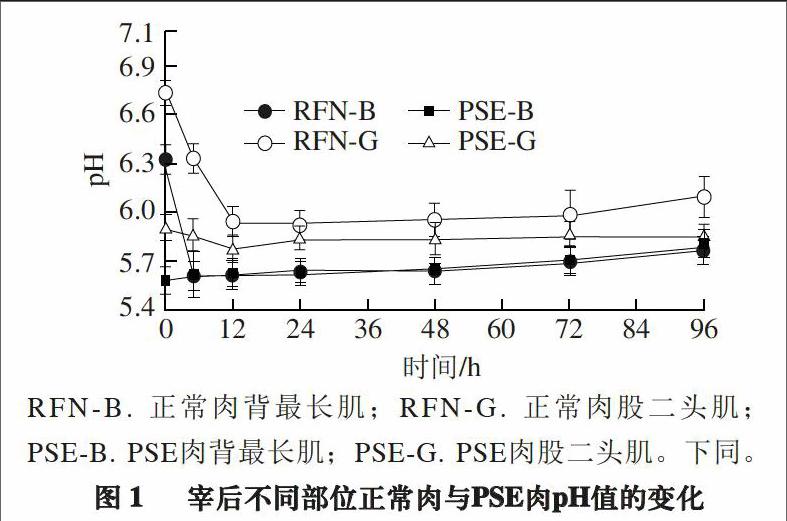
RFN-B. 正常肉背最长肌;RFN-G. 正常肉股二头肌;PSE-B. PSE肉背最长肌;PSE-G. PSE肉股二头肌。下同。
肌肉的pH值是反映家畜宰后肌肉糖原降解速率的重要指标,也是鉴定正常肉或异常肉的依据[12]。由图1可知,宰后正常肉pH值的变化呈先降后升的趋势,宰后0 h,PSE肉与正常肉pH值差异显著(P<0.05)。背最长肌PSE肉在0 h的pH值最低,之后变化不显著。股二头肌PSE肉的pH值变化趋势与正常肉相同,但pH值显著低于正常肉(P<0.05)。同一头猪背最长肌的pH值在宰后72 h内显著低于股二头肌(P<0.05)。同一头猪背最长肌的pH值下降速率比股二头肌的pH值下降速率快,就正常肉而言,宰后5 h背最长肌pH值达到观测时间点的最低值,股二头肌在12 h后pH值才达到观测时间点的最低值。
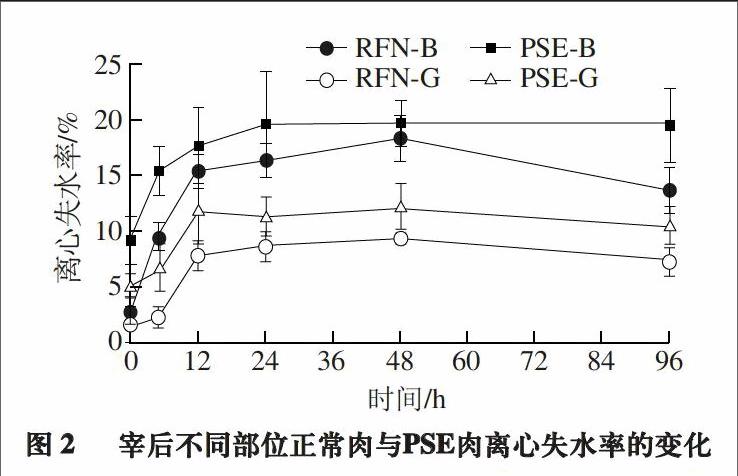
2.1.2 离心失水率
持水力是肌肉在贮存过程中,对自身水分的保持能力和对外加水分的水合能力,又称保水性或系水力[13]。离心失水率是衡量系水力的一种方法。由图2可知,随时间变化,宰后不同部位正常肉和PSE肉的离心失水率都呈先升后降的趋势。宰后0 h背最长肌正常肉和股二头肌正常肉的离心失水率差异不显著(P>0.05),说明宰后0 h,背最长肌正常肉和股二头肌正常肉的系水力都较好。宰后5 h内相同部位PSE肉的离心失水率显著高于正常肉(P<0.05),背最长肌正常肉与PSE肉离心失水率在宰后5 h后差异不显著,股二头肌正常肉与PSE肉离心失水率在宰后12 h后差异不显著(P>0.05)。由此可见,宰后PSE肉样较早就呈现出较差的系水力,正常肉样维持较好系水力的时间较长。
2.1.3 剪切力
剪切力的变化主要反映的是肉嫩度的改变[14]。由图3可知,宰后肌肉剪切力的变化呈现先升高后降低的趋势,宰后0 h,正常肉的剪切力显著低于PSE肉的剪切力(P<0.05)。宰后12 h后正常肉股二头肌的剪切力显著小于背最长肌(P<0.05),宰后12~48 h之间相同部位PSE肉的剪切力显著大于正常肉的剪切力(P<0.05)。宰后5 h肌肉逐渐达到僵直状态,剪切力会升高,之后逐渐降低,PSE肉比正常肉更早达到尸僵状态,解僵过程更慢。宰后96 h,相同部位正常肉与PSE肉剪切力的差异不显著(P>0.05)。由此得出,正常肉的嫩度好于PSE肉,股二头肌的嫩度优于背最长肌。
2.1.4 肉色
PSE肉的最大特点就是颜色与正常肉的差异,PSE肉的颜色苍白(肉色L*较高)[15]。由图4可知,宰后不同部位正常肉和PSE肉的L*都呈先升高后降低的趋势,PSE肉的L*始终大于正常肉的L*,差异显著(P<0.05)。同一头猪背最长肌的L*高于股二头肌的L*,但总体看差异不显著。L*的改变可能是由于蛋白质发生变性,肉表面的水分渗出,增强了肉表面对光线的反射作用引起的[16]。
2.2 宰后不同部位正常肉与PSE肉能量物质的变化
2.2.1 糖原含量
注:同行大写字母不同,表示不同部位正常肉与PSE肉组间相同宰后时间点差异显著(P<0.05);同列小写字母不同,表示相同部位正常肉与PSE肉组内不同宰后时间点之间差异显著(P<0.05)。下同。
由表1可知,宰后不同部位正常肉与PSE肉的糖原含量都呈现逐渐下降的趋势,这与邱宏强等[5]的研究结果一致。宰后48 h内,正常肉股二头肌糖原含量显著高于其他组(P<0.05)。宰后8 h内股二头肌糖原含量高于背最长肌,不同部位正常肉之间差异显著(P<0.05),不同部位PSE肉之间差异不显著。宰后48 h内相同部位正常肉的糖原含量高于相同部位PSE肉的糖原含量。
2.2.2 ATP含量
由表2可知,宰后不同部位正常肉与PSE肉的ATP含量都呈现逐渐下降的趋势,宰后8 h内正常肉与股二头肌PSE肉ATP含量下降显著(P<0.05)。宰后2 h内,不同部位正常肉与PSE肉的ATP含量差异显著(P<0.05),正常肉的ATP含量显著高于PSE肉的ATP含量,股二头肌的ATP含量显著高于背最长肌的ATP含量(P<0.05)。而背最长肌PSE肉0 h的ATP含量与正常肉背最长肌8h的ATP含量接近,说明背最长肌PSE肉的ATP含量在刺杀放血20 min内就已经被快速消耗。通过比较4 h内股二头肌正常肉与PSE肉ATP的下降速率,发现股二头肌正常肉ATP含量下降了35.3%,而股二头肌PSE肉ATP含量下降了82.6%。因此可推断,PSE肉的ATP下降速率较正常肉ATP的下降速率快。
2.2.3 ADP含量
由表3可知,宰后正常肉ADP含量的变化主要呈现出先升高后下降的趋势,PSE肉ADP含量的变化呈现先下降再升高在下降的趋势,其主要差异在宰后前2 h内,正常肉呈上升趋势,PSE肉呈下降趋势。宰后4 h内,PSE肉背最长肌的ADP含量显著低于其余组(P<0.05)。
2.2.4 AMP含量
由表4可知,正常肉背最长肌和PSE肉股二头肌的AMP含量都呈先上升后降低的趋势,正常肉股二头肌和PSE肉背最长肌的AMP含量则呈先降低再升高再降低的变化规律。宰后24 h之后,AMP含量变化不显著(P>0.05)。
2.3 相关性分析
2.3.1 pH值、离心失水率、剪切力及L*之间的相关性
由表5~6可知,正常肉和股二头肌PSE肉的pH值和离心失水率呈极显著负相关(P<0.01),正常肉pH值和L*相关性显著(P<0.05),股二头肌PSE肉pH值和L*相关性极显著(P<0.01)。各组的离心失水率和L*呈极显著正相关(P<0.01)。股二头肌的剪切力与离心失水率呈极显著负相关(P<0.01),背最长肌的剪切力与离心失水率也呈负相关,但不显著(P>0.05)。背最长肌PSE肉的剪切力与L*极显著负相关(P<0.01),其余组剪切力与L*相关性则不显著(P>0.05)。
2.3.2 ATP、ADP、AMP与糖原之间的相关性
选取相同测定时间点的糖原及ATP、ADP、AMP的测定结果进行相关性分析。由表7~8可知,糖原含量的变化和ATP含量的变化都呈极显著正相关(P<0.01)。正常肉、股二头肌PSE肉的糖原和ADP呈极显著正相关(P<0.01),背最长肌PSE肉的糖原和ADP呈显著正相关(P<0.05)。股二头肌正常肉和背最长肌PSE肉ATP含量和AMP含量之间极显著正相关(P<0.01),正常肉背最长肌ATP含量和AMP含量之间显著相关
(P<0.05)。
3 讨 论
生猪屠宰后,胴体肌肉伴随着pH值、温度变化及蛋白质变性等一系列生化反应[17]。从本实验结果来看,宰后不同部位正常肉与PSE肉品质差异较大,能量物质的起始含量及代谢速率也有所不同。在肉品质方面,宰后不同部位正常肉与PSE肉的pH值变化都呈先升后降的趋势,这与动物宰后肌肉pH值的变化规律一致[18]。在持水性方面,PSE肉的离心失水率高于正常肉,其原因可能是宰后肌肉pH值迅速下降同时肌肉的温度没有下降,使肌纤维急剧萎缩,肌内膜断裂,肌浆还未达到凝胶化就游离渗出,从而导致肌肉的持水性较差[19]。Kristensen等[20]认为,肌肉成熟过程中,肌原纤维间隙增加,胞外水分会重新渗入胞内。因此,随着宰后时间的延长,肌肉系水力有所回升。PSE肉僵直发生的早、较严重,且持续时间长。研究表明僵直发生的时间与宰后肌肉ATP的含量有关,当ATP降为20%左右时僵直完成[21]。有学者在动物实验中,从家兔股动脉注入ATP溶液,发现在不同条件下,既可推迟尸僵的出现,也可使已出现的尸僵强度减弱[22]。因此ATP的消失或许是肌肉僵直的主要原因。股二头肌的ATP代谢速率较背最长肌慢,所以背最长肌的尸僵更严重。僵直的持续时间可能与肉的缓冲性有关,Molette等[23]研究发现糖酵解快的动物,肉的缓冲能力较低,这可能是PSE肉品质差,且在贮藏中没有明显改善的原因。
宰后不同部位正常肉和PSE肉能量代谢的主要区别在于糖原,ATP等能量物质的起始含量及代谢速率。在刺杀放血20 min内背最长肌PSE肉的糖原及ATP等已消耗殆尽,Min等[24]研究表明宰后放血过程中,无氧代谢使得细胞内ATP快速减少。实验结果发现ATP的变化最具有规律性,ADP、AMP的改变则有所不同,随着宰后死亡时间的延长,ATP含量呈减少趋势,而ADP和AMP的含量却没有呈比例增加,这与Moesgaard[25]、Bendall[26]等的研究发现相似。肌肉中的磷酸肌酸是ATP的主要来源,肌酸激酶将磷酸肌酸中的高能磷酸键转移给ADP来补充ATP,当70%磷酸肌酸被消耗时,糖原无氧酵解过程被启动[27],由贮存的糖原继续供给磷酸化反应,维持宰后肌肉中ATP的含量,减缓僵直的发生,这就说明了肌肉中ADP的含量与ATP的含量相差较大的原因。比较宰后前4 h,正常肉背最长肌和股二头肌的ATP的下降比例,发现背最长肌下降了51.9%,股二头肌下降了35.3%,可得出在宰后前4 h的背最长肌ATP的代谢速率较股二头肌快,因此背最长肌糖原的消耗就比股二头肌早,所以股二头肌宰后0 h糖原的含量显著高于0 h背最长肌的糖原含量,且下降速率也慢。因此背最长肌PSE肉的发生率较股二头肌高,且程度较股二头肌重。不少研究者通过宰后禁食来减少宰后肌肉中糖原的含量来遏制pH值的降低,减少PSE肉的发生[28-29]。从本实验的结果来看,发现宰后肌肉中糖原含量的高低并不是PSE肉产生的根本原因,其根本原因在于宰后能量物质的异常代谢,如何控制宰后肌肉中能量物质的代谢速率或许才是防止PSE肉产生的正确思路,仅通过禁食这种单一的方式,有可能造成宰后正常代谢的猪pH值居高不下,形成DFD(dark firm dry)肉。对于不同部位的能量代谢速率的差异的原因,还有待进一步研究。
4 结 论
在实验时间内,宰后股二头肌的pH值高于背最长肌,L*低于背最长肌。股二头肌的剪切力比背最长肌小,持水性比背最长肌好。宰后同一头猪背最长肌PSE肉恶化程度较股二头肌PSE肉严重,股二头肌糖原、ATP的起始含量比背最长肌高,能量物质的代谢速率较背最长肌慢。
参考文献:
[1] 王珺, 尚永彪, 李洪军. PSE猪肉的鉴别与控制[J]. 食品工业科技, 2012, 33(14): 380-384.
[2] 李凤娜, 王继成, 陈晓安. 猪肉品质及其影响因素的研究概况[J]. 肉类研究, 2006, 20(7): 46-50.
[3] BRISKEY E J. Etiological status and associated studies of pale, soft, exudative porcine musculature[J]. Advances in Food Research, 1964, 13: 89-178.
[4] SCHEFFLER T L, GERRARD D E. Mechanisms controlling pork quality development: the biochemistry controlling postmortem energy metabolism[J]. Meat Science, 2007, 77: 7-16. DOI:10.1016/j.meatsci.2007.04.024.
[5] 邱宏强, 宋照军, 刘玺. PSE肉和DFD肉中糖原含量变化分析[J]. 食品工业科技, 2011, 32(7): 129-131.
[6] 王彤, 刘显军, 程奇. PSE肉的形成机理、鉴别及预防措施[J]. 黑龙江畜牧兽医, 2014(4): 27-28.
[7] 卢庆萍, 张宏福. 动物应激的研究进展[J]. 动物营养学报, 2007(增刊1):
465-468. DOI:10.3969/j.issn.1006-267X.2007.z1.007.
[8] 谢华, 张春晖, 王永林. 猪PSE肉的pH值判定及其与汁液流失关系的研究[J]. 肉类工业, 2006(10): 45-46. DOI:10.3969/j.issn.1008-5467.2006.10.015.
[9] BOUTON P E, HARRIS P B, SHORTHOSE W R. The effects of ultimates pH on ovine muscle: mechanical properties[J]. Journal of Food Science,1972, 37(3): 356-360.
[10] 沈晓玲. 猪肉肌苷酸沉积规律及其与新鲜度的相关性研究[D]. 雅安: 四川农业大学, 2008.
[11] 孙蕊, 贾鹏禹, 俞龙浩, 等. 反相高效液相色谱法测定小鼠心肌中ATP、ADP和AMP含量及分析[J]. 黑龙江八一农垦大学学报, 2012, 24(2): 30-32. DOI:10.3969/j.issn.1002-2090.2012.02.010.
[12] 尹靖东. 动物肌肉生物学与肉品科学[M]. 北京: 中国农业大学出版社, 2011.
[13] 陶迎梅, 高蓉彬. 猪肉持水力的影响因素及其宰后变化机理研究进展[J]. 甘肃畜牧兽医, 2015, 45(5): 41-43. DOI:10.3969/j.issn.1006-799X.2015.05.023.
[14] 王晓宇, 周光宏, 徐幸莲, 等. 猪肉剪切力的测定方法[J]. 食品科学, 2012, 33(21): 64-67.
[15] 朱学伸. 家禽“类PSE肉”的品质特性及其改善因素研究[D]. 南京: 南京农业大学, 2011.
[16] 王晓香, 刘爽, 尚永彪, 等. 宰后高温诱导制备类PSE兔肉[J]. 食品科学, 2014, 35(13): 87-92. DOI:10.7506/spkx1002-6630-201413016.
[17] WARNER R D, GREENWOOD P L, PETHICK D W, et al. Genetic and environmental effects on meat quality[J]. Meat Science, 2010, 86(1): 171-183.
[18] QI Jun, LI Chunbao, CHEN Yinji, et al. Changes in meat quality of ovine longissimus dorsi muscle in response to repeated freeze and thaw[J]. Meat Science, 2012, 92(4): 619-626.
[19] ZHU X, RUUSUNEN M, GUSELLA M, et al. High early post-mortem temperature induces activation of AMP-activated protein kinase and development of pale, soft and exudative characteristics in turkey muscles[J]. Meat Science, 2013, 93(3): 600-606.
[20] KRISTENSEN L, PURSLOW P P. The effect of ageing on the water-holding capacity of pork: role of cytoskeletal proteins[J]. Meat Science, 2001, 58(1): 17-23.
[21] BENDALL J R. The shortening of rabbit muscles during rigor mortis: relation to the breakdown of adenosine triphosphate and certain phosphate and to muscular contraction[J]. Journal of Physiology, 1951, 114(1/2): 71-88.
[22] 赵子琴. 法医病理学[M]. 北京: 人民卫生出版社, 2009.
[23] MOLETTE C, R?MIGNON H, BABIL? R. Modification of glycolyzing enzymes lowers meat quality of turkey[J]. Poultry Science, 2005, 84(1): 119-127.
[24] MIN D, SHEN Q W, ZHU M J. Role of β-adrenoceptor signaling and AMP-activated protein kinase in glycolysis of postmortem skeletal muscle[J]. Journal of Agricultural and Food Chemistry, 2005, 53(8): 3235-3239.
[25] MOESGAARD B, QUISTORFF B, CHRISTENSEN V G, et al. Differences of post-mortem ATP turnover in skeletal muscle of normal and heterozygote malignant-hyperthermia pigs: comparison of (31)P-NMR and analytical biochemical measurements[J]. Meat Science, 1995, 39(1): 43-57.
[26] BENDALL J R. In structure and function of muscle[M]. New York: Academic Press, 1973: 243-309.
[27] 周光宏. 肉品加工学[M]. 北京: 中国农业出版社, 2009.
[28] GUARDIA M D, ESTANY J, BALASH S, et al. Risk assessment of PSE condition due to pre-slaughter conditions and RYR1 gene in pigs[J]. Meat Science, 2004, 67(3): 471-478.
[29] 杨文娇, 王保有, 李岩. 屠宰前禁食对肉猪的影响[J]. 中国畜牧兽医, 2009, 36(8): 186-188.
