L—精氨酸对鸡胸肉中肌球蛋白凝胶特性的影响
2016-07-22付渊周存六
付渊++周存六


摘 要:以鸡胸肉中提取的肌球蛋白为研究对象,考察不同添加量(0~0.09%)L-精氨酸对肌球蛋白凝胶的硬度、保水性和微结构等凝胶特性以及肌球蛋白溶液热特性的影响。结果表明:L-精氨酸可显著提高肌球蛋白凝胶的保水性(P<0.05),降低凝胶硬度(P<0.05)。扫描电镜显示空白组样品呈现大小不均的孔洞与颗粒状聚集物共存的凝胶结构,而添加0.03%~0.05% L-精氨酸的样品呈现相对致密的凝胶结构。L-精氨酸添加量达到0.03%以上时,肌球蛋白的第1个变性温度TM1显著降低;L-精氨酸添加量达到0.04%以上时,肌球蛋白的第2个变性温度TM2显著降低(P<0.05)。
关键词:肌球蛋白;L-精氨酸;保水性;硬度;微观结构;热特性
保水性和质构是肉制品的重要品质特性,对肉制品的产率与口感有十分重要的影响[1]。钠盐的使用是目前提高肉制品保水性和质构的重要手段之一。在肉制品加工过程中,氯化钠能够改善产品的风味、嫩度和多汁性等品质特性,有利于产品的保藏[2]。但是,摄入过量钠盐可诱发高血压[3],增加中风及心脑血管的发病几率[4];降低肉制品钠盐的使用量,将降低产品风味、口感,缩短产品货架期。因此,研发钠盐替代物显得尤为重要。
研究表明,添加精氨酸可提高猪肉肠的保水性、硬度、咀嚼性、弹性以及其他感官性能,提高猪肉糜蛋白的变性温度,有利于光滑、致密、均匀凝胶的形成[5],在肉制品加工中具有潜在的应用前景。
盐溶蛋白是肌肉中的重要蛋白成分,参与肉凝胶的形成过程,对肉制品的保水性和质构特性产生重要影响[6]。研究精氨酸对盐溶蛋白凝胶形成的影响有利于揭示精氨酸对肉制品保水性和质构特性的影响机制。然而,迄今为止,国内外关于外源性氨基酸对盐溶蛋白热凝胶的影响研究很少[7];精氨酸对肌球蛋白热诱导凝胶的影响尚未见报导。本研究以鸡胸肉中提取的肌球蛋白为研究对象,考察不同添加量(0~0.09%)L-精氨酸对肌球蛋白凝胶的硬度、保水和微结构等凝胶特性以及肌球蛋白溶液热特性的影响,以探讨L-精氨酸对肉制品保水性和质构特性影响的机制,为低钠肉制品研发提供参考。
1 材料与方法
1.1 材料与试剂
鸡胸肉购于合肥市家乐福超市。
磷酸氢二钾、磷酸二氢钾、二硫苏糖醇(dithiothreitol,DTT)、焦磷酸钠、乙二胺四乙酸二钠、氯化钾、无水乙醇、丙酮、戊二醛、甲醛等均为分析纯。
1.2 仪器与设备
BC/BD-241冰柜 青岛Haier集团公司;ML104型电子分析天平 梅特勒-托利多仪器(上海)有限公司;SCX-8/2A绞肉机 上海双碟厨具有限公司;DS-1组织捣碎机 上海越磁电子科技有限公司;GL-21M高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;CT14RD冷冻离心机 上海天美生化仪器设备有限公司;8S-1磁力搅拌器 江苏省金坛市金城国胜实验仪器厂;752N紫外-可见分光光度计 上海精密科学仪器有限公司;FD-1A-50冷冻干燥机 北京博医康实验仪器有限公司;TA-XT Plus硬度仪 英国Stable Micro System公司;JSM6490LV扫描电子显微镜 日本JEOL公司。
1.3 方法
1.3.1 肌球蛋白的提取
肌球蛋白提取:参照Chen等[8]的方法,将鸡胸肉剔除可见脂肪和结缔组织,切碎后取约150 g,在0~4 ℃条件下提取肌球蛋白。肌球蛋白溶液浓度的测定参照Zhou等[9]的方法,利用0.6 mol/L氯化钾磷酸盐缓冲溶液(pH 6.5),将蛋白质质量浓度调整至20 mg/mL,待用。
1.3.2 肌球蛋白-精氨酸混合溶液的制备
参照史可夫等[10]的方法,分别向50 g 20 mg/mL肌球蛋白溶液中加入L-精氨酸,使L-精氨酸质量分数分别达到0.00%、0.01%、0.03%、0.05%、0.07%、0.09%。在0~4 ℃条件下缓慢搅拌30 min,至完全溶解,在冰箱中(约4 ℃)静置过夜(约12 h),形成肌球蛋白-精氨酸混合溶液待用。
1.3.3 肌球蛋白-精氨酸混合凝胶的制备
参照史可夫等[10]的方法,将处理后的肌球蛋白-精氨酸混合凝胶样品倒入小烧杯(27 mm×35 mm),放在20 ℃水浴锅中,以2 ℃/min的升温速率加热至80 ℃,并恒温处理30 min,取出小烧杯放入冰水浴中冷却10 min,放入冰箱中过夜(约12 h),待测。
1.3.4 凝胶保水性的测定
参照Qin等[11]的方法。取约10 g肌球蛋白-精氨酸凝胶在1 000 g/min下离心10 min,重复检测3 组。
1.3.5 凝胶硬度的测定
参照Zhou等[9]的方法。采用TA-XT Plus质构仪,设定GMIA程序测定肌球蛋白-精氨酸混合凝胶的硬度。参数设定:探头选用P/0.5,测试前速率1.50 mm/s,测试中速率1.00 mm/s,测试后速率1.00 mm/s,穿刺距离4 mm,触发力5 g。检测重复3 次。
1.3.6 扫描电子显微镜的测试
参照Qin等[11]的方法。将肌球蛋白-精氨酸凝胶样品放置在4%甲醛和2.5%戊二醛混合溶液(1∶1,V/V)中浸泡固定2 h,在凝胶样品固定变硬后,将样品均匀地切成10 mm×10 mm×2 mm的薄片;采用0.1 mol/L磷酸盐缓冲溶液(pH 7.2)漂洗5~10 次;用不同体积分数的乙醇(30%、40%、60%、80%和100%)溶液脱水,每次浸泡10 min,在通风厨中用冷风除去易挥发的有机溶剂;在真空冷冻干燥机中干燥15 h;喷金,观察。
1.3.7 肌球蛋白热特性的检测
参照陈星[12]的方法并稍加改动。称取10~15 mg蛋白样品,密封于铝坩埚中,放入设备中,并同时以空的铝坩埚作为对照。起始温度为20 ℃,并在此温度下平衡5 min,再以2 ℃/min升至80 ℃,收集其热相变温度T及相变焓值△H。实验重复3 次。
1.4 数据处理
结果以平均值±标准差的形式表示,采用Excel 2007进行数据处理,以Origin 8.0进行绘图,方差分析中的显著性检验采用IBM SPSS 19.0软件进行分析,当P<0.05时视为显著。
2 结果与分析
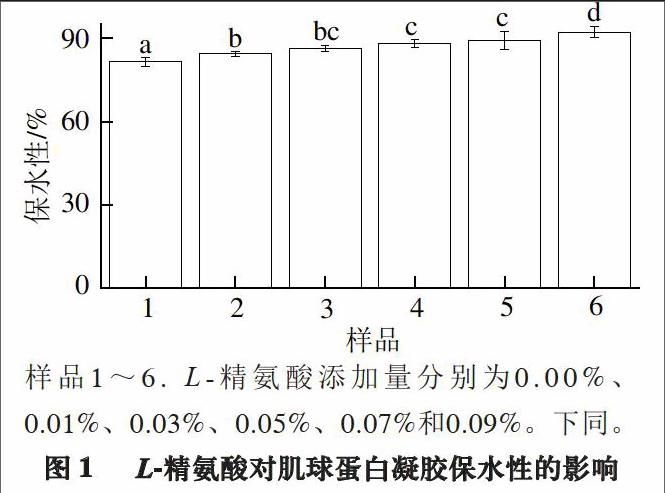
2.1 不同添加量L-精氨酸对肌球蛋白凝胶保水性的影响
样品1~6. L-精氨酸添加量分别为0.00%、0.01%、0.03%、0.05%、0.07%和0.09%。下同。
由图1可知,与空白组相比,添加精氨酸
(L型,下同)能够很明显地提高肌球蛋白凝胶的保水性
(P<0.05)。这一现象与将精氨酸、赖氨酸分别添加到猪肉香肠中能显著提高其保水性的研究结果相似[7,13]。李俊[7]、Zhou[13]等推测由于精氨酸为碱性氨基酸,加入精氨酸可以改变猪肉香肠的pH值,使其偏离等电点,进而改变其保水性。已有研究[14]指出:调整牛肉的pH值可以提高其产率,进一步支持他们的观点。Guo等[15]研究发现精氨酸能够增加猪肉肌球蛋白的溶解性,表明精氨酸能够增强肌球蛋白的水合作用,进一步说明添加精氨酸能够增加蛋白凝胶的保水性。另一方面,Qin等[11]研究结果表明随着精氨酸添加量的增加,鸡盐溶性蛋白凝胶的保水性也随之增加;该研究指出随着精氨酸添加量的增加,盐溶性蛋白的微观组织结构发生改变是可能导致上述结果的又一重要原因。另外,精氨酸添加量为0.03%与0.01%、0.05%与0.03%以及0.07%与0.05%的蛋白凝胶的保水性差异不显著(P>0.05),这可能是由于精氨酸添加量的变化不足以明显改变蛋白溶液的pH值,或添加精氨酸所导致的pH值的改变不足以显著提高其保水性。虽然差别不显著,但是仍然可以发现,随着精氨酸的增加,肌球蛋白凝胶的保水性呈逐渐升高的趋势,意味着精氨酸的添加有利于改善肉制品的产率及多汁性。
2.2 不同添加量L-精氨酸对肌球蛋白凝胶硬度的影响
由图2可知,相对于空白组,添加了精氨酸的肌球蛋白混合凝胶的硬度显著降低(P<0.05);并且,肌球蛋白凝胶的硬度随着精氨酸添加量的增加而显著降低(P<0.05)。Ma等[16]研究表明,在超高压条件下添加卡拉胶和CaCl2到盐溶蛋白体系后,其凝胶硬度也出现显著性降低(P<0.05)。有学者[17-18]指出肌球蛋白凝胶的质构可以通过高静压等不同技术处理或外源性成分的添加来实现;经上述处理,肌球蛋白得以展开并暴露出更多的带电基团,这种变化可能与其凝胶硬度相关。另外,有学者指出pH值的变化也对肉蛋白凝胶的硬度产生影响[19],并指出最优的pH值约为6.0。精氨酸的等电点为10.8[20],可以推测精氨酸的添加能够显著改变肌球蛋白体系的pH值,导致凝胶硬度的降低。但精氨酸影响肌球蛋白凝胶的硬度的机制尚不清楚,有待进一步的探究。然而,Zhou等[5]发现添加精氨酸能够明显增加猪肉肠的硬度(P<0.05),这与目前的研究结果相反,可能由于猪肉蛋白与鸡肌球蛋白的凝胶性质有很大差异。Qin等[11]研究也指出鸡盐溶蛋白凝胶的硬度随精氨酸添加量的增加而显著提高。除了肌球蛋白,盐溶性蛋白中还含有肌动蛋白、肌动球蛋白[21],这些成分的存在对肌球蛋白凝胶特性有重要的影响[22],可能是导致Qin等[11]的结果与本结果不同的原因。
2.3 不同添加量L-精氨酸对肌球蛋白凝胶微观结构的影响
A~F. L-精氨酸添加量分别为0.00%、0.01%、0.03%、0.05%、0.07%和0.09%。
由图3可知,空白组的肌球蛋白凝胶由大小不均一的无规则的空洞和不规则的团状聚集物共同组成。
Qin[11]、Sun[23]等研究表明,未添加精氨酸的肌盐溶蛋白加热也形成相对粗糙的凝胶。当精氨酸的加入量达到0.03%和0.05%时,可以明显观察到肌球蛋白凝胶较为平整,且团状聚集物呈现减少的现象。随着添加量增加到0.07%和0.09%时,可以看到肌球蛋白凝胶三维网状结构中分布着较为均匀的孔洞。Sun等[23]认为,蛋白凝胶的保水性与其孔径呈负相关,添加精氨酸导致凝胶结构的变化可能与其保水性的变化密切相关。另外,多孔的凝胶结构与其硬度降低也可能有关。
2.4 不同添加量精氨酸对肌球蛋白凝胶热特性的影响
由图4及表1可知,空白组的差示扫描量热(differential scanning calorimetry,DSC)呈现出2 个特征峰,分别位于52.81 ℃和66.95 ℃,这与Ma等[16]的研究结果基本一致。有研究[23-24]报道,位于52.81 ℃特征峰为肌球蛋白头部变性所致,而位于66.95 ℃特征峰为肌球蛋白尾部变性所致。相较于空白组,精氨酸的添加量达到0.03%以上时,第1个峰对应的温度显著降低
(P<0.05),表明添加精氨酸之后肌球蛋白头部的转变温度朝较低的温度方向移动、稳定性呈现降低的趋势。精氨酸的添加量达到0.04%以上时,第2个峰对应的温度显著降低(P<0.05),表明添加精氨酸之后肌球蛋白尾部的变性温度降低、稳定性下降。Qin等[11]发现精氨酸添加到鸡胸盐溶蛋白中导致盐溶蛋白对应的第1个峰消失,而第2个峰对应的温度降低。Ma等[16]研究也表明,同时向猪盐溶蛋白中加入0.2% CaCl2和0.6%卡拉胶的混合物,可以显著降低肌球蛋白尾部的变性温度,同时肌球蛋白头部的转变峰消失。这些研究报导与本研究结果基本类似。Ma等[16]指出加入的Ca2+可能激活了内源性谷氨酰胺酶,同时卡拉胶可能与蛋白质间产生静电作用,两者共同作用于盐溶蛋白,导致上述结果。
3 结 论
添加精氨酸能够提高肌球蛋白凝胶的保水性,降低硬度(P<0.05)。同时,添加0.03%和0.05%精氨酸的样品呈现结构均匀致密的凝胶网状,显著改变肌球蛋白凝胶的微观结构。精氨酸的添加量达到0.03%以上显著降低肌球蛋白头部变性温度,添加量达0.04%以上显著降低尾部变性温度(P<0.05)。本研究表明,精氨酸的添加改变了肌球蛋白溶液的热特性及肌球蛋白凝胶的微观结构,可能导致最终肌球蛋白凝胶保水性的提高、硬度的降低。
参考文献:
[1] 于功明, 孙春禄, 王成忠, 等. 海藻酸钠在低温肉制品中的应用研究[J]. 肉类研究, 2008, 22(3): 41-43.
[2] Pszczola D E. Tackling meat issues in a lean economy[J]. Food Technology, 2010, 64(4): 49-58.
[3] Law M R, Frost C D, Wald N J. By how much does dietary salt reduction lower blood pressure? Ⅱ.Analysis of observational data among populations[J]. British Medical Journal, 1991, 302: 815-818.DOI:10.1136/bmj.302.6780.819.
[4] Ruusunen M, Puolanne E. Reducing sodium intake from meat products[J]. Meat Science, 2005, 70(3): 531-541. DOI:10.1016/j.meatsci.2004.07.016.
[5] Zhou C L, Li J, Tan S J, Sun G J. Effects of arginine on physicochemical and sensory characteristics of pork sausage[J]. Advance Journal of Food Science and Technology, 2014, 6(5): 660-667.
[6] 周佺, 郭善广, 蒋爱民, 等. 肌肉盐溶蛋白热诱导凝胶特性研究进展[J]. 食品与机械, 2009, 25(3): 129-131. DOI:10.13652/j.issn.1003-5788.2009.03.031.
[7] 李俊. 赖氨酸和精氨酸分别对猪肉肠品质特性影响的研究[D]. 合肥: 合肥工业大学, 2013.
[8] Chen X, Chen C G, Zhou Y Z, et al. Effects of high pressure processing on the thermal gelling properties of chicken breast myosin containing к-carrageenan[J]. Food Hydrocolloids, 2014, 40: 262-272.
[9] Zhou Y Z, Chen C G, Chen X, et al. Contribution of three ionic types of polysaccharides to the thermal gelling properties of chicken breast myosin[J]. Journal of Agricultural and Food Chemistry, 2014, 62(12): 2655-2662. DOI:10.1021/jf405381z.
[10] 史可夫, 肖雄, 吴双双, 等. 超高压对肌球蛋白-海藻酸钠-氯化钙混合凝胶特性的影响[J]. 食品科学, 2015, 36(23): 33-37. DOI:10.7506/spkx1002-6630-201523007.
[11] Qin H, Xu P, Zhou C L, et al. Effects of L-arginine on water holding capacity and texture of heat-induced gel of salt-soluble proteins from breast muscle[J]. LWT-Food Science and Technology, 2015, 63(2): 912-918. DOI: 10.1016/j.lwt.2015.04.048.
[12] 陈星. 超高压处理对肌原纤维蛋白-多糖混合凝胶特性的影响及其机制研究[D]. 合肥: 合肥工业大学, 2014.
[13] Zhou C L, Li J, Tan S J. Effect of L-lysine on the physicochemical properties of pork sausage[J]. Food Science and Biotechnology, 2014, 23(3): 775-780. DOI:10.1007/s10068-014-0104-6.
[14] Young O A, Zhang S X, Farouk M M, et al. Effects of pH adjustment with phosphates on attributes and functionalities of normal and high pH beef[J]. Meat Science, 2005, 70(1): 133-139. DOI:10.1111/j.1365-2621.1972.tb03688.
[15] Guo X Y, Peng Z Q, Zhang Y W, et al. The solubility and conformational characteristics of porcine myosin as affected by the presence of L-lysine and L-histidine[J]. Food Chemistry, 2015, 170: 212-217. DOI: 10.1016/j.foodchem.2014.08.045.
[16] Ma F, Chen C G, Zheng L, et al. Effect of high pressure processing on the gel properties of salt-soluble meat protein containing CaCl2 and κ-carrageenan[J]. Meat Science, 2013, 95(1): 22-26.
[17] Cao Y Y, Xia T L, Zhou G H, et al. The mechanism of high pressure-induced gels of rabbit myosin[J]. Innovative Food Science and Emerging Technologies, 2012, 16: 41-46. DOI:10.1016/j.ifset.2012.04.005.
[18] Galazaka V B, Smith D, Ledward D A, et al. Complexes of bocine serum albumin with sulphated polysaccharides: effects of pH, ionic strength and high pressure treatment[J]. Food Chemistry, 1999, 64(3): 303-310.
[19] 费英, 韩敏义, 杨凌寒, 等. pH对肌原纤维蛋白二级结构及其热诱导凝胶特性的影响[J]. 中国农业科学, 2010, 43(1): 164-170. DOI:10.3864/j.issn.0578-1752.2010.01.019.
[20] Reddy KRC, Lilie H, Rudolph R, et al. L-Arginine increases the solubility of unfolded species of hen egg white lysozyme[J]. Protein Science, 2005, 14(4): 929-935. DOI:10.1110/ps.041085005.
[21] 周光宏. 畜产品加工学[M]. 北京: 中国农业出版社, 2011.
[22] Samejima K, Ishioroshi M, Yasui T. Relative roles of the head and tail portions of the molecule in heat-induced gelation of myosin[J]. Journal of Food Science, 1981, 46(5): 1412-1418.
[23] Sun J X, Wu Z, Xu X L, et al. Effect of peanut protein isolate on functional properties of chicken salt-soluble proteins from breast and thigh muscles during heat-induced gelation[J]. Meat Science, 2012, 91(1): 88-92. DOI:10.1016/j.meatsci.2011.12.010.
[24] CHEN H H, Xu S Y, Zhang W. Interaction between flaxseed gum and meat protein[J]. Journal of Food Engineering, 2007, 80(4): 1051-1059. DOI:10.1016/j.jfoodeng.2006.08.017.
