微生物转化法制备双脱甲氧基姜黄素糖苷化产物及其对HepG2肿瘤细胞的抑制作用
2016-07-21李锐刘芳李芸香贾坤张秀梅徐伟苏国龙黄维维罗静雯
李锐,刘芳,李芸香,贾坤,张秀梅,徐伟,苏国龙,黄维维,罗静雯
1(西华大学 食品与生物工程学院,四川 成都,610039) 2(四川大学 华西药学院,四川 成都,610041)
微生物转化法制备双脱甲氧基姜黄素糖苷化产物及其对HepG2肿瘤细胞的抑制作用
李锐1*,刘芳1,李芸香1,贾坤1,张秀梅1,徐伟1,苏国龙1,黄维维1,罗静雯2
1(西华大学 食品与生物工程学院,四川 成都,610039) 2(四川大学 华西药学院,四川 成都,610041)
摘要双脱甲氧基姜黄素是一种具有极强抗氧化活性和抗肿瘤活性的天然酚类成分,但是极差的水溶性和稳定性制约了其在食品、医药领域的广泛应用。通过微生物转化进行结构改造,引入亲水性的葡萄糖苷键基团是有效解决其水溶性的手段。该研究利用不同微生物体系对双脱甲氧基姜黄素进行微生物转化,发现华根霉Rhizopus chinensis IFFI 3043能够将双脱甲氧基姜黄素(Bisdemethoxycurcumin,BDMC)转化为双脱甲氧基姜黄素-O-葡萄糖苷(BDMC-O-glucoside),且转化效率达到63%。研究利用高效液相色谱-质谱联合(high performance liquid chromatography-mass spectormeter,HPLC-MS)、核磁共振(nuclear magnetic resonance,NMR)等检测手段,确认了BDMC-O-glucoside转化产物的化学结构,完成了其转化过程的动态曲线分析,并通过MTT细胞毒活性法发现BDMC-O-glucoside对HepG2肿瘤细胞的抑制作用显著强于BDMC。
关键词双脱甲氧基姜黄素;华根霉;生物转化;糖苷化;抗肿瘤
姜黄为姜科姜黄属植物姜黄(CurcumalongaL.)的干燥根茎,主产于中国、印度、日本等国家,其提取物主要用于食品添加剂及天然色素生产[1-2]。姜黄素(curcumin)、脱甲氧基姜黄素(demethoxycurcumin)、双脱甲氧基姜黄素(bisdemethoxycurcumin, BDMC)为代表的姜黄素类化合物是姜黄的主要活性成分[3-4]。有研究报道表明,姜黄素类化合物具有显著的抗氧化、抗肿瘤、抗炎症作用以及抗阿尔茨默症等生理活性[5-8],双脱甲氧基姜黄素(bisdemethoxycurcumin, BDMC)在化学结构上缺少2个甲氧基基团(结构式见图1),使其在抗氧化和抑制肿瘤细胞生长方面的活性甚至优于其他两种姜黄素[9-11],且该类化合物无毒副作用,是一种在食品、医药领域极具开发潜力的天然酚类活性成分。
由于双脱甲氧基姜黄素水溶性差、结构不稳定,使其在食品和医药工业领域的应用受到极大的限制。其在酸性和中性pH环境中几乎不溶,只溶于丙酮、甲醇等少数有机溶剂,且久置或光照容易分解。因此,保持双脱甲氧基姜黄素原有生物活性的基础上,获得该类成份新的衍生物与类似物,改变其物理、化学性质成为近期研究的热点。其中,天然产物的糖苷化,是一种改变其水溶性的有效手段[12]。但是尚未有通过化学合成将葡萄糖苷键与其结合的报道,因为姜黄素类化合物的结构特殊,其独特的1,7-二芳基庚酸骨架存在烯醇互变体,在化学合成反应中极不稳定,容易发生结构变化。

图1 双脱甲氧基姜黄素(BDMC)的化学结构Fig.1 Chemical structure of bisdemethoxycurcumin (BDMC)
本文利用不同微生物体系对双脱甲氧基姜黄素进行微生物转化研究,发现华根霉(Rhizopuschinensis) IFFI 3043能够有效地将葡萄糖苷键链接在双脱甲氧基姜黄素的羟基基团(-OH)上,形成糖苷化产物,且转化效率达到63%。我们利用高效液相色谱-质谱联合(high performance liquid chromatograpty-mass spectormeter,HPLC-MS)、核磁共振(nuclear magnetic resonance,NMR)等检测手段,确认了糖苷化转化产物的结构,完成了转化过程动态曲线分析,并通过MTT细胞毒活性法研究了其对HepG2肿瘤细胞的抑制作用。
1材料与方法
1.1试剂与材料
硅胶G (柱色谱用200~300目)为青岛海洋化工厂产品。所用试剂乙酸乙酯、丙酮、三氯甲烷、甲醇等均为成都科龙试剂产品,分析纯。双脱姜黄素(BDMC)由实验室分离获得,纯度经HPLC检测达到95%以上。
1.2微生物培养及生物转化试验
微生物培养:所有菌株购自中国普通微生物菌种保藏管理中心,4 ℃下保存于固体斜面培养基上,培养采用PDA培养基。PDA培养基的配制:取去皮马铃薯200 g,切成小块,置烧杯中加水1.0 L煮沸30 min,滤除马铃薯块,将葡萄糖20 g加入滤液中,搅拌至完全溶解,再补足滤液至1 L。固体斜面培养基另加2.5%琼脂。以上培养基分装后封口,于121 ℃, 1.06 kg/cm2条件下湿热灭菌30 min。
生物转化试验:将菌株接种于300 mL三角瓶中,每瓶盛100 mL液体培养基,25 ℃下于180 r/min摇床上避光培养24 h。吸取其中7 mL菌液置于1 000 mL三角瓶中,每瓶盛400 mL液体培养基,在相同条件下继续培养,当菌丝生长旺盛时,按照每瓶12 mg剂量,加入BDMC底物。对照组:在实验过程中,设立菌液空白对照组,对照组不加入DMC底物,于180 r/min摇床上25 ℃避光条件下,按照实验组相同方法进行平行培养。同时设立底物对照组,即未接种微生物的空白培养基中加入相同量的BDMC底物,平行操作后进行分析。
1.3菌种筛选
本实验对5株真菌(见表1)进行BDMC的生物转化预试,经HPLC分析,若检测到BDMC经生物转化后被大量消耗,则证明该真菌对BDMC的生物转化能力较强,以此筛选转化能力最强的菌株。

表1 五种不同微生物菌株对BDMC的生物转化预实验
Note: +++,BDMC大量被转化; +, BDMC少量被转化; -, BDMC无法被转化。
1.4HPLC分析及LC/MS分析
HPLC分析方法:使用Agilent系列1200高效液相色谱仪,配有DAD检测器。色谱柱:YMC-Pack-ODS-A C18reversed column (250 mm×4.6 mm i.d., 5 μm) 及Agilent Zorbax SB-C18保护柱 (12.5 mm×4.6 mm i.d., 5 μm)。流动相:乙腈(A)-水溶液(B),洗脱程序:0~15 min:20%~40% A;8~10 min:40%~54% A;10~24 min:54% A; 24~37 min:54%~95% A。柱温:30 ℃ ;流速:1.0 mL/min;检测波长为425 nm。
LC/MS分析方法:LCQ Advantage型离子阱质谱仪(Thermo, USA)通过电喷雾离子源(ESI)与Aglient 1200液相色谱仪相连。HPLC流出液经分流后进入离子源进行分析。雾化气为高纯氮气(N2),碰撞气为超高纯氦气(He)。质谱条件为:鞘气,45 u;助气,10 u;进样毛细管温度,325 ℃;毛细管电压,-4 V;透镜电压,-45 V。负离子模式检测,质谱扫描范围为m/z100~1 000。
1.5NMR结构鉴定
1H NMR、13C NMR及2D-NMR采用Bruker Avance III (1H: 400 MHz;13C: 100 MHz)型核磁共振仪测定。
1.6MTT细胞毒活性法
采用MTT法测定转化产物对HepG2细胞增殖的抑制作用。在DEME低糖培养基(10%胎牛血清)中培养肿瘤细胞,收集对数期细胞,按5×104/mL接种于96孔板。将不同浓度的转化产物溶液(0.5% DMSO为溶媒)准确加入到细胞培养基中,37 ℃,5% CO2和饱和湿度的培养箱中培养48 h。于每孔加入20 μL的MTT溶液继续培养4 h,再想每孔中加入150 μL DMSO溶解结晶物,摇床振荡10 min后于全自动酶联免疫检测仪测定各孔在490 nm波长的OD值。按公式(1)计算细胞存活率:

(1)
分别设计对照组(0.5% DMSO溶剂)和空白组,所有实验结果均测量3次取平均值。
2结果与分析
2.1菌株选择
由表1可知,华根霉RhizopuschinensisIFFI 3043对BDMC的转化能力最强,通过HPLC检测到大量BDMC底物被消耗;而酿酒酵母SaccharomycescerevisiaeACCC 2168对BDMC少量转化;另外3种菌株:链格孢AlternariaalternateAS 3.4578、总状共头霉SyncephalastrumracemosumAS 3.264、蓝色梨头霉AbsidiacoeruleaBainier AS 3.3389对BDMC不产生转化作用。综合考虑转化率与提取率等因素,选择华根霉RhizopuschinensisIFFI 3043对BDMC进行转化实验。
2.2华根霉素RhizopuschinensisIFFI 3043对BDMC的放大生物转化
按照1.2小节方法进行放大实验,向培养的R.chinensis菌液中,每瓶中加入12 mg BDMC的丙酮溶液,共计加入1200 mg底物。继续共培养3 d,滤除菌丝,滤液以乙酸乙酯萃取5次,有机相合并浓缩,蒸干获得5.5 g浸膏备用。
2.3转化产物的HPLC-MS定性分析
将加入BDMC底物转化前的菌液和转化48 h后菌液以乙酸乙酯萃取后,制备检测样品,采用HPLC-MS分析获得BDMC转化前后的HPLC图谱(如图2所示)。BDMC经转化48 h后基本被完全消耗,425 nm检测波长下在18 min左右检测到产物1的峰信号,为极性比BDMC更大的转化产物。
通过对产物1进行ESIMS分析可知,其MS1出现m/z469的[M-H]-分子离子峰,其MS2出现m/z307的双脱甲氧基姜黄素(BDMC)的特征离子峰[8],推测其为丢失162 Da (六碳糖)中性离子产生,而MS2出现的碎片离子m/z187和m/z119均为BDMC
的特征离子峰,此外,UV检测发现产物1的最大紫外吸收波长为414 nm,为姜黄素类化合物的特征吸收范围。综合以上检测结果推导,初步确定转化产物产物1为双脱甲氧基姜黄素-O-葡萄糖苷,即BDMC-O-glucoside。
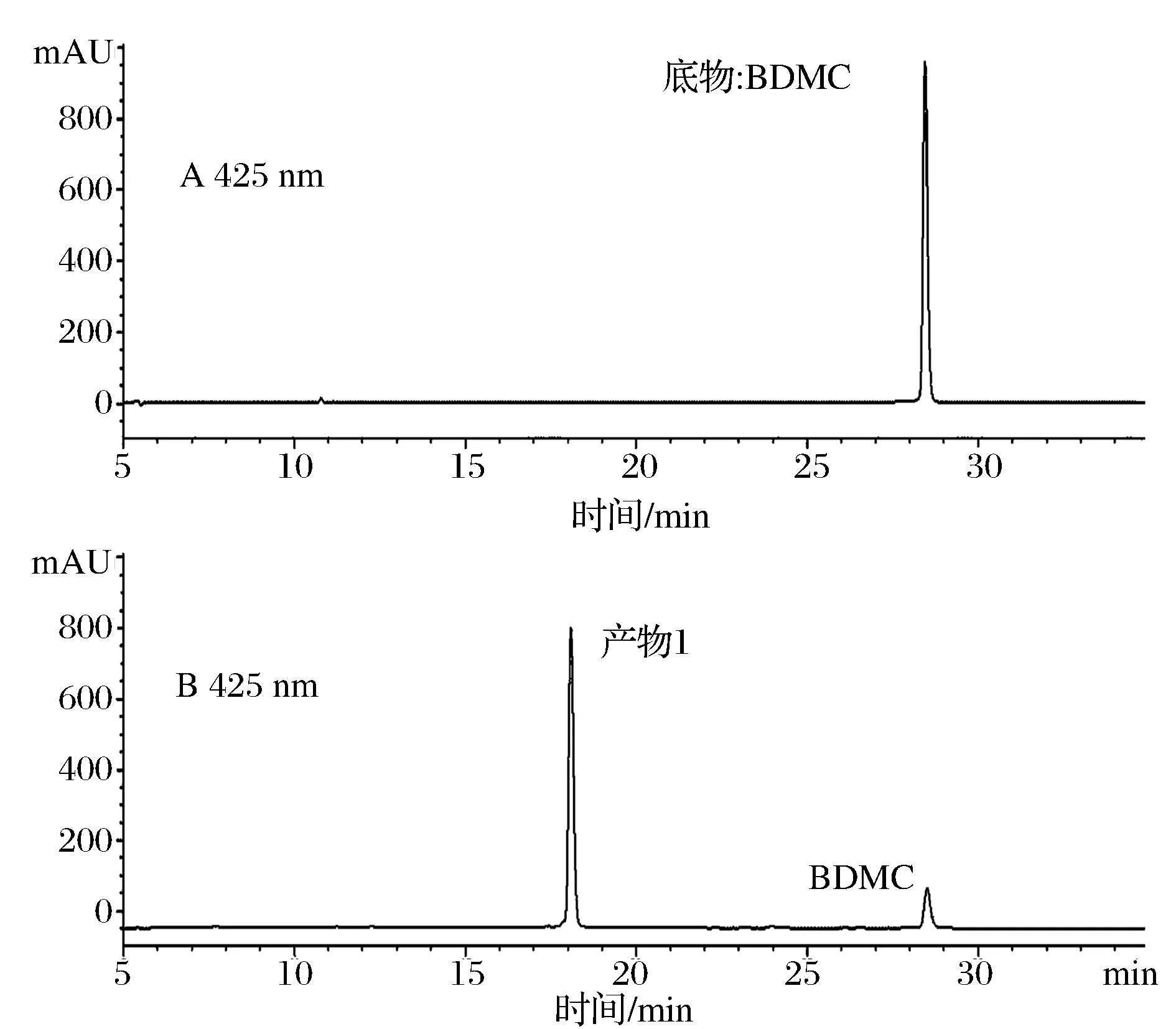
图2 (A) 转化前BDMC的HPLC图谱;(B) 转化48 h后剩余BDMC和产物1的HPLC图谱Fig.2 (A) The HPLC chromatograms of BDMC before biotransformation; (B) The HPLC chromatograms of biotransformed product 1 and remnant BDMC after 48 h biotransformation

(A) BDMC-O-glucoside的化学结构及LC/MS裂解途径; (B) BDMC-O-glucoside的[M-H]- 离子峰及MS2 裂解图谱; (C) BDMC-O-glucoside的UVmax图谱图3 HPLC-DAD-ESI/MS法鉴定转化产物1(BDMC-O-glucoside)的结构Fig.3 Identification of the biotransformed product 1 (BDMC-O-glucoside) by HPLC/DAD/ESI-MS
2.4转化产物的分离与NMR结构鉴定
2.2项下浸膏(5.5 g)经硅胶柱G色谱分离,以三氯甲烷-(甲醇)(100∶1, 50∶1 和10∶1,v/v)分别进行梯度洗脱。洗脱的馏分经薄层色谱检查,成分相似的馏分合并得到10个部分。馏分8经制备液相色谱进一步纯化,以甲醇-水(50∶50,v/v)等度洗脱,分离得到转化产物共计626 mg。
转化产物产物1为黄色粉末,EIMS在m/z469.2处显示[M]+峰,提示其分子量为469。其分子量比双脱甲氧基姜黄素(BDMC)大162 Da,推测分子中有六碳糖取代。经1H NMR、13C NMR及2D-NMR数据分析,碳谱中显示出糖的共振峰,其中ε101.1为端基碳信号(glc-1′)。转化产物1的C-4′较双脱甲氧基姜黄素(BDMC)的C-4′向低场位移至ε150.2 (△ε+0.7),提示有基团在此处取代;此外,2D-NMR分析中显示出H (glc-1′)与C-4′较强的HBMC远程相关,提示糖基取代在BDMC结构的4′-位。参考已发表文献[4],将糖基的碳、氢信号与已知化合物结构对比,确定该糖基为葡萄糖,糖苷键为β-构型。经过鉴定确认转化产物1结构与LC/MS推测结果完全一致,转化产物为双脱甲氧基姜黄素 4′-O-β-D-葡萄糖苷 (BDMC-O-glucoside); 外观形状及1H、13C数据如下所示:黄色粉末。UV (MeOH)λmax: 414 nm;1H NMR (acetone-d6, 400 MHz): ε(ppm) 7.62 (1H, d, J = 16.0 Hz, H-1), 7.61 (1H, d, J = 16.0 Hz, H-7), 6.9-7.41 (8H, m, H-Ar), 6.78 (1H, d, J = 16.0 Hz, H-2), 6.74 (1H, d, J = 16.0 Hz, H-6), 6.01 (1H, s, H-4), 5.05 (1H, d, J = 7.2 Hz, Glc-H-1), 3.40-4.30 (6H, m, Glc-H);13C NMR (acetone-d6, 100 MHz): ε(ppm) 184.3 (C-3), 183.4 (C-5), 150.2 (C-4′), 149.5 (C-4″), 149.5 (C-3′), 148.4 (C-3″), 141.4 (C-1), 139.8 (C-7), 129.6 (C-1′), 127.1 (C-1″), 123.5 (C-2), 122.5 (C-6), 122.1 (C-6′), 121.2 (C-6″), 116.6 (C-5′), 115.7 (C-5″), 111.8 (C-2′), 110.3 (C-2″), 101.3 (C-4), 101.1 (glc-1′), 77.2 (glc-2′), 77.1 (glc-3′), 73.7 (glc-4′), 70.5 (glc-5′), 61.5 (glc-6′); ESIMS:m/z469.0 [M-H]-,以上数据和参照文献中BDMC数据一致[4]。根据以上推导,确定转化合物产物1的结构为:双脱甲氧基姜黄素4′-O-β-D-葡萄糖苷。
2.5转化过程的动态分析
由以上研究结果可得出BDMC经华根霉RhizopuschinensisIFFI 3043转化后的转化路径图,如图4所示。本研究进一步考察了再48 h之内,BDMC及转化产物BDMC-O-glucoside在培养液中浓度与培养时间的动态变化关系。在0、2、4、6、8、12、24、48 h不同时间点取样,样品经萃取处理后进HPLC在420 nm下检测,在不同时间点以BDMC和BDMC-O-glucoside的峰面积计算得出动态变化曲线。如图5所示,在48 h内BDMC被华根霉RhizopuschinensisIFFI 3043快速转化,BDMC-O-glucoside的产率达到63%(以峰面积计算),而在24 h和48 h检测到BDMC-O-glucoside浓度比12 h略有下降,可能是由于转化产物的浓度增大,在培养液中由于溶解度不够造成的不均匀分布导致。

图4 双脱甲氧基姜黄素(BDMC)经华根霉R. chinensis IFFI 3043生物转化的转化产物Fig.4 Biotransformation of BDMC by R. chinensis IFFI 3043, and its product
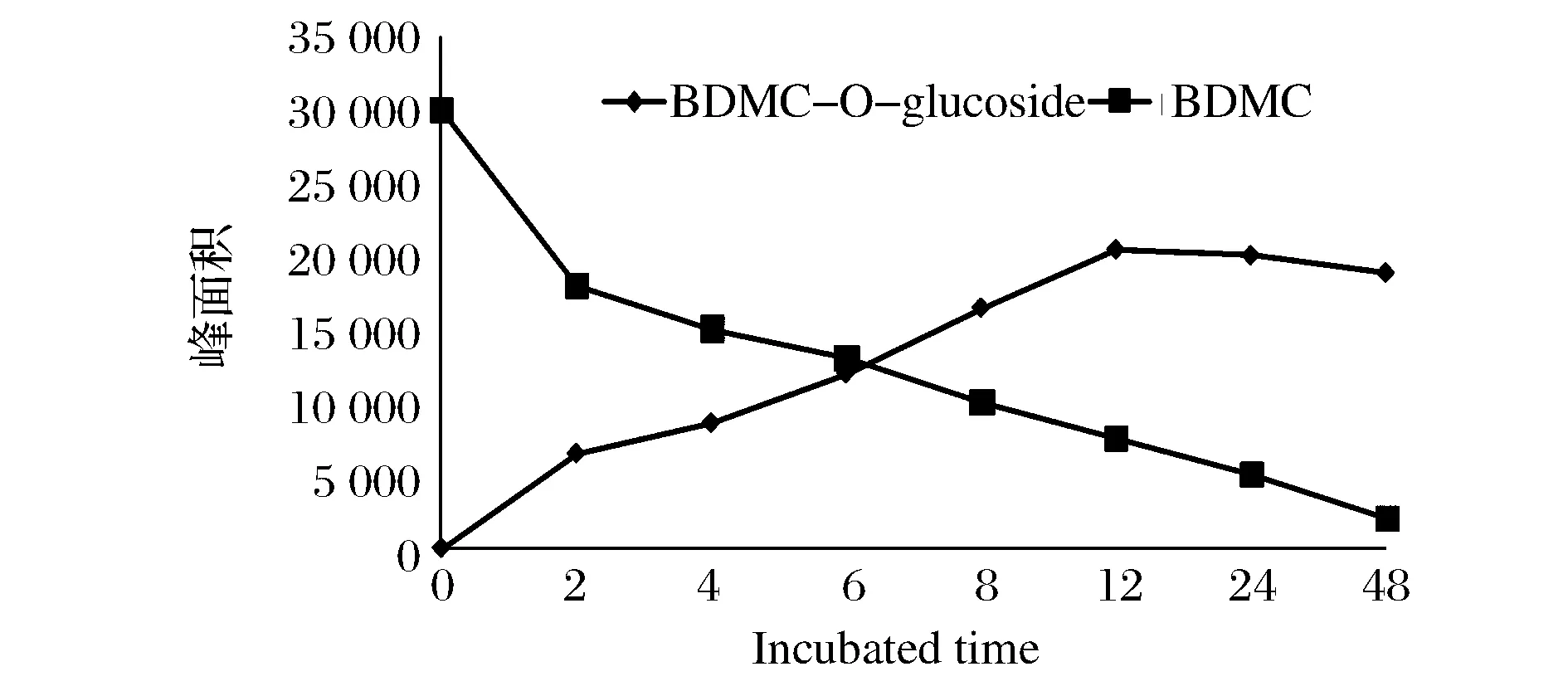
图5 BDMC转化为BDMC-O-glucoside的转化动态分析Fig.5 Biotransformation kinetics of BDMC to BDMC-O-glucoside
2.6BDMC-O-glucoside与BDMC的抗肿瘤活性比较
为研究BDMC-O-glucoside对肿瘤细胞的抑制作用,实验设立BDMC组作为对照。实验方法同1.6。结果显示在各个不同浓度的实验组别中,BDMC-O-glucoside比BDMC对HepG2肝癌细胞都有更好的抑制作用(P<0.05)(见图6),当BDMC-O-glucoside的浓度为40 μmol/L时,HepG2细胞存活率仅为18.7%,而BDMC组的HepG2细胞存活率为37.8%。由于葡萄糖苷键的存在,转化产物BDMC-O-glucoside相比原型成分BDMC的极性和水溶性都得到了提高,通过生物转化引入极性基团-葡萄糖苷键可能是其抗肿瘤细胞活性增强的原因。
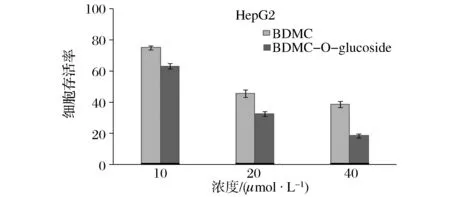
图6 BDMC与BDMC-O-glucoside对HepG2肝癌细胞的抑制作用比较研究Fig.6 The comparison of inhibitory effect to HepG2 cells between BDMC and BDMC-O-glucoside
3”结论
本实验以双脱甲氧基姜黄素(BDMC)为目标,通过对不同微生物菌株的筛选,确定了华根霉RhizopuschinensisIFFI 3043对BDMC有最强的转化能力;以HPLC检测建立了底物与转化产物之间转化过程的动态曲线分析;通过LC/MS方法推测转化产物结构,并通过放大实验获得大量转化产物纯品进行NMR测试,最终确认其结构为双脱甲氧基姜黄素 4′-O-β-D-葡萄糖苷 (BDMC-O-glucoside);此外,通过MTT法初步证明了BDMC-O-glucoside对HepG2肿瘤细胞的抑制作用比底物BDMC更强。本项目研究结果表明华根霉Rhizopuschinensis对BDMC的转化以糖苷化反应为主,所获得转化产物BDMC-O-glucoside有更大的极性和水溶性,对肿瘤细胞的抑制作用较底物显著提高,且转化产率可达到63%(以峰面积计算),提示BDMC-O-glucoside在功能性食品、医药领域有极大的应用前景。
活性天然产物作为预防和治疗疾病的有效手段,近年来已经成为医药和食品领域的研究热点,然而中药及普通植物中的天然活性成分含量往往偏低,如紫杉醇、人参皂苷等成分在植物中含量仅为万分之几或更低[13],这一特性使得从中药及普通植物提取物中获得大量活性天然产物非常困难。此外,天然产物复杂的化学结构使其化学合成及结构修饰的反应难度大、反应过程复杂,成本较高,也不适用于天然产物的合成和结构改造。以微生物转化技术为先导建立的植物生物转化法,是利用植物组织或植物中的酶系进行的生物转化,具有低成本、反应温和、污染小等特点,并且有较高的选择性,能够完成化学合成反应难以完成的反应。生物转化技术不仅能够改变中药的主要活性成分含量、活性物质结构,还能够对有毒中药进行增效减毒,在天然药物的创新研发领域有广阔的应用空间[14-15]。目前,已经对于黄酮类成分、蟾蜍甾烯类成分、萜类化合物及生物碱类成分都已进行了较为系统的生物转化研究[16-17]。随着技术的进步,生物转化技术在食品工业领域的发展潜力巨大。本文介绍的基于华根霉素对姜黄素类成分进行生物转化获得糖苷化产物的方法对活性天然产物的深入开发具有极强的指导意义。
参考文献
[1]韦星船, 杜志云, 涂增清,等. 姜黄素衍生物与类似物的构效关系研究进展[J]. 化学研究与应用,2010, 22 (5): 527-538.
[2]仲明远, 全山丛, 胡晋红, 姜黄素制剂学研究进展[J]. 中成药,2007, 29 (2): 255-258.
[3]ANAND P, THOMAS S G, KUNNUMAKKARA A B, et al. Biological activities of curcumin and its analogues (congeners) made by man and mother nature[J]. Biochemical Pharmacology,2008, 76 (11): 1 590-1 611.
[4]MOHRI K, WATANABE Y, YOSHIDA Y, et al. Synthesis of glycosylcurcuminoids[J]. Chemical Pharmaceutical Bulletin,2003,51 (11): 1 268-1 272.
[5]ITOKAWA H, MORITA H, MIDORIKAWA I, et al. Diarylheptanoids from the rhizome of Alpinia officinarum Hance[J]. Chemical Pharmaceutical Bulletin,1985, 33 (11): 4 889-4 893.
[6]ZHAO Jun, GUAN Shu-hong, CHEN Xiao-bin, et al. Two new compounds derived from bufalin[J]. Chinese Chemical Letters,2007, 18 (11): 1 316-1 318.
[7]DAI Jun-gui, QU Run-Jiang, ZOU Jian-hua, et al. Structural diversification of taxanes by whole-cell biotransformation[J]. Tetrahedron,2008, 64 (35): 8 102-8 116.
[8]JIANG Hong-liang, SOMOGYI A, JACOBSEN N E, et al. Analysis of curcuminoids by positive and negative electrospray ionization and tandem mass spectrometry[J].Rapid Communications in Mass Spectrometry,2006a, 20 (6): 1 001-1 012.
[9]AGGARWAL B B, KUMAR A, BHARTI A C. Anticancer potential of curcumin: Preclinical and clinical studies[J]. Anticancer Research, 2003, 23 (1A): 363-398.
[10]RAMSEWAK R S, DEWITT D L, NAIR M G, et al. Cytotoxicity, antioxidant and anti-inflammatory activities of curcumins Ⅰ-Ⅲ fromCurcumalonga[J]. Phytomedicine, 2000, 7(4): 303-307.
[11]李剑明,杨和平,刘松青. 3种姜黄色素单体抑制人内皮细胞作用的实验研究[J]. 重庆医学,2002, 31(9): 804-805.
[12]KAMINAGA Y, NAGATSU A, AKIYAMA T, SUGIMOTO N, et al. Production of unnatural glucosides of curcumin with drastically enhanced water solubility by cell suspension cultures ofCatharanthusroseus[J]. FEBS Letters, 2003, 555(2): 311-316.
[13]贺赐安,余旭亚,孟庆雄, 等. 生物转化对天然产物进行结构修饰的研究进展[J]. 天然产物研究与开发,2012, 24(5): 843-847.
[14]邱海龙,陈建伟,李祥. 生物转化技术在中药研究中的应用[J]. 中国现代中药,2012, 14 (2): 3-7.
[15]王煜丹,程桂广,余旭亚,等. 生物转化对天然产物化学中的研究进展[J]. 化学与生物工程,2010, 27(2): 7-10.
[16]崔莉,孙娥,陈玲玲,等. 生物转化在黄酮类化合物中的研究与应用[J]. 中华中医药杂志,2013,28(3): 764-767.
[17]马骁驰,果德安.中药活性成分生物转化的研究思路与方法[J]. 中国天然药物,2007, 5(3): 162-168.
The preparation of bisdemethoxycurcumin-glucoside by microbial transformation method and its inhibitory effect to HepG2 Tumor cells
LI Rui1*, LIU Fan1, LI Yun-xiang1, JIA Kun1, ZHANG Xiu-mei1, XU Wei1,SU Guo-long1, HUANG Wei-wei1, LUO Jing-wen2
1(School of Food and Bioengineering, Xihua University, Chengdu 610039,China)2(West China School of Pharmacy, Sichuan University, Chengdu 610041, China)
ABSTRACTBisdemethoxycurcumin is a nature-derived phenolic compound with potent anti-oxidant and anti-tumor activities. However, the application of bisdemethoxycurcumin in food and medicine industry was restricted by its poor solubility and stability. The introduction of glucoside bond by microbial transformation method to improve the water solubility through structural transformation is an effective way. In this paper, the transformation of bisdemethoxycurcumin by different microbial strains was studied. It was found that bisdemethoxycurcumin could be transformed to bisdemethoxycurcumin-glucoside by Rhizopus chinensis IFFI 3043, and the conversion rate was up to 63%. The chemical structure of bisdemethoxycurcumin-glucoside was confirmed by HPLC-MS and NMR methods. The analysis on dynamic curve of transformation was also completed. It was also discovered that the inhibitory effect of bisdemethoxycurcumin-glucoside on HepG2 tumor cells was stronger than that of bisdemethoxycurcumin by MTT method. The microbial transformation method established in this paper could have great potential in functional food and medicine industry.
Key wordsbisdemethoxycurcumin; Rhizopus chinensis; microbial transformation; glucoside; anti-tumor
DOI:10.13995/j.cnki.11-1802/ts.201606004
基金项目:国家自然科学基金(81302742);教育部春晖计划项目(13205638);四川省教育厅重点项目(11ZA005)
收稿日期:2016-01-04,改回日期:2016-02-25
第一作者:博士研究生,副教授(本文通讯作者,E-mail: lirui-elite@163.com)。
