胎盘多肽对病毒性脑炎患儿外周血T细胞亚群及红细胞免疫指标的影响研究
2016-07-15付胡海
范 丽,付胡海
(1.贵州省人民医院儿科,贵州 贵阳 550002;2.武警贵州总队第一支队卫生队,贵州 贵阳 550002)
胎盘多肽对病毒性脑炎患儿外周血T细胞亚群及红细胞免疫指标的影响研究
范丽1,付胡海2
(1.贵州省人民医院儿科,贵州 贵阳550002;2.武警贵州总队第一支队卫生队,贵州 贵阳550002)
摘要:目的观察并分析辅以胎盘多肽注射液联合治疗对病毒性脑炎患儿细胞免疫功能指标的变化。方法采用随机数字表法将从该院收治的病毒性脑炎患儿90例分为两组,每组各45例。对照组在入院后仅给予抗病毒及对症支持治疗,观察组则在对照组的治疗基础上辅以胎盘多肽注射液联合治疗,比较并分析两组患儿的红细胞免疫指标[红细胞免疫复合物(RBC-ICR) 、红细胞免疫亲和力受体(FEER)、红细胞C3b受体(RBC-C3bR)]及其它红细胞指标和外周血T细胞亚群(CD4+/CD8+,CD8+,CD4+,CD3+)在治疗前后的变化。结果治疗后,观察组患儿的RBC-ICR,FEER,RBC-C3bR及红细胞聚集指数、红细胞刚性指数、红细胞电泳指数均较对照组明显改善(t=7.545,-9.902,-17.314,10.169,9.934,7.418,均P<0.05),其差异有统计学意义;观察组患儿的CD4+/CD8+、 CD4+和CD3+水平均明显高于对照组(t=-13.078,-9.515,-4.459,均P<0.05),患儿的CD8+水平明显低于对照组,差异有统计学意义(t=6.950,P<0.01)。结论胎盘多肽注射液可使病毒性脑炎患儿的细胞免疫功能状态得到显著的改善,值得在临床工作中推广应用。
关键词:脑炎,病毒性;胎盘提取物;T淋巴细胞亚群
病毒性脑炎是一种由感染所致的中枢神经系统疾病[1],多见于儿童时期,且病毒侵犯的范围和部位不同,其形式多样,病情变化亦可轻可重,其以颅内高压征以及脑实质损害的症状为主要临床表现[2]。儿童的中枢神经系统受损常由病毒性脑炎所致[3]。目前临床上对于病毒性脑炎的治疗缺乏有效的治疗方案,因为目前医疗条件欠缺,而导致种类繁多的病毒性脑炎病毒无法进行病原学诊断。为了研究作为生物免疫调节剂的胎盘多肽注射液对病毒性脑炎患儿细胞免疫功能的影响,对我院儿科收治的90例病毒性脑炎患儿给予胎盘多肽注射液作为辅助治疗,观察病毒性脑炎患儿在接受胎盘多肽注射液治疗前后细胞免疫指标的变化,从而为病毒性脑炎提供新的有效的治疗参考。
1资料与方法
1.1临床资料采用随机数字表法将从贵州省人民医院在2014年6~11月期间收治的病毒性脑炎患儿90例平均分为两组,观察组45例,女20例,男25例;年龄2~11岁,平均年龄(7.21±2.43)岁;对照组45例,女19例,男26例;年龄3~10岁,平均年龄(7.42±2.71)岁;两组患者病程均约为2周。所有患者参加研究前均知情同意,且本研究获得贵州省人民医院医学伦理学委员会批准。所有病毒性脑炎患儿主要以不同程度的发热、头痛、乏力伴呕吐等为临床表现[4]。儿童病毒性脑炎诊断及其分期均以文献[5]为准,临床医师对所有患儿进行必要的检查,且所有患儿均符合以上标准。两组患儿的性别、年龄、病程等一般临床资料组间对比,差异无统计学意义(P>0.05),见表1。
1.2研究方法对照组患儿在入院后给予脱水剂、病毒唑、镇静剂、干扰素以及降温等对症支持治疗[6],观察组则在对照组的治疗基础上给予静脉滴注胎盘多肽注射液(Placenta Polypeptide Injection,贵州泰邦生物制品有限公司),每天1次,每次4 mL,两组均以2周为一个疗程。

表1 两组患儿的临床资料对比
1.3免疫指标检测分别在治疗前与治疗3 d后检测两组患儿的红细胞免疫复合物(RBC-ICR)、 红细胞免疫亲和力受体(FEER)和红细胞C3b受体(RBC-C3bR)以及红细胞其它指标,以了解患儿红细胞免疫水平的变化;在治疗前及治疗一个疗程后,抽取两组患儿空腹状态静脉血3 mL,运用流式细胞术进行T细胞亚群(CD4+/CD8+,CD8+,CD4+,CD3+)的检测,以了解其变化[7]。
1.4统计学方法将本组研究涉及数字录入SPSS18.0行数据分析,计数资料行χ2检验,计量资料行t检验,治疗前后的比较用配对t检验,P<0.05为有统计学意义。
2结果
2.1红细胞免疫以及红细胞其它指标两组患儿在治疗后红细胞免疫水平以及红细胞其它指标均较治疗前有所改善,而观察组患儿比对照组改善更为显著,差异有统计学意义(t=7.545,9.902,17.314,10.169,9.934,7.418,均P<0.05),见表2。
2.2外周血T细胞亚群治疗后两组患儿的CD4+/CD8+,CD4+,CD3+水平均有所升高,且观察组患儿CD4+/CD8+,CD4+,CD3+水平升高较对照组更为显著(t=-13.078,-9.515,-4.459,均P<0.05);治疗后两组患儿的CD8+水平均有所降低,且观察组患儿CD8+降低较对照组更为显著,差异有统计学意义(t=6.950,P<0.01),见表3。
3讨论
胎盘多肽注射液是从健康人胎盘多种营养成分中深度萃取出的具有活性的小分子功能多肽制作而成的[8]。胎盘多肽注射液可能含有多种因子可诱导血管再生,具有较好的修复、再生、强化以及免疫调节能力[9],胎盘多肽注射液的修复、再生功能是通过抑制或调节机体内的过氧化反应以及将体内过多的自由基清除等过程,从而达到减缓细胞的衰老速度。通过修复由机体内各种因素导致的损伤DNA,使胎盘多肽注射液具有一定的抑制突变反应作用,从而维持机体内的生物抗体数量及功能的正常及保障遗传因子稳定性[10-12]。胎盘多肽注射液还可以激活并调节NK细胞和T淋巴细胞,对其生长、分化和增殖具有一定的促进和调节能力,从而可以显著地提高机体的免疫检测能力,增强机体由细胞介导的免疫应答能力,进一步提高机体免疫稳态。近年来许多学者多项研究表明,胎盘多肽注射液能够提高机体的免疫是通过减轻机体内炎症因子对免疫系统的损伤,抑制炎症介质的产生,调整患者自身免疫能力以及增强Th免疫细胞功能而起作用的[13],并将其用于临床,在免疫功能紊乱性疾病、恶性肿瘤、病毒性疾病等多种疾病的治疗上均有较为理想的疗效。
病毒性脑炎是一种由感染所致的中枢神经系统疾病,多见于儿童,单纯疱疹病毒和肠道病毒是导致儿童脑炎的主要病毒[14],严重影响患儿生命和生活质量。病毒性脑炎的预后与病毒种类、环境、季节以及儿童的营养条件均有一定的关联[15]。最近几年,儿童病毒性脑炎发生率升高,与腮腺炎、麻疹、风疹以及其它病毒性疾病的预防接种存在一定的联系。儿童病毒性脑炎的发病通常认为毒力较强,数量一定的病毒在机体免疫能力下降时,可通过血脑屏障途径进入机体中枢神经系统从而导致变态反应性脑损害或神经细胞坏死[16]。从目前免疫学观点出发,免疫应答反应的发生部位和强弱以及免疫反应的最终表现形式均与T细胞的功能紧密关联,以此表明T细胞在机体免疫反应过程中发挥极为重要的调节作用。CD4+、CD8+是T细胞的两个重要亚群,能够在某种程度上反映机体细胞的免疫能力[17]。机体通过CD4+、CD8+两者相互制约、诱导而形成以T淋巴细胞为主的调节控制网络,使机体产生针对抗原的适当的免疫应答反应,从而使机体的正常免疫功能得以维持。许多学者研究表明,大部分病毒性脑炎患儿有T细胞及其亚群功能以及数量的下降,其外周血中CD8+、CD4+、CD3+细胞所占比例明显下降[18],由此可见,病毒性脑炎的发生以及进展的重要因素是机体细胞免疫功能紊乱或者功能低下,这种改变可能与Ts细胞功能亢进或Th细胞功能不足存在一定的关联[19]。该研究结果显示,胎盘多肽注射液作为一种生物免疫调节剂,值得在儿童病毒性脑炎治疗过程中推广。因为辅以胎盘多肽注射液联合治疗的观察组与只作病毒性脑炎常规治疗的对照组相比,观察组可明显升高患儿外周血中的CD4+/CD8+,CD4+,CD3+水平,提升白细胞的数量,使损伤的免疫系统得到修复,从而提高免疫力;显著改善患儿红细胞免疫水平以及红细胞其它各项指标,红细胞免疫指标的改变表明机体清除循环免疫复合物的能力得以提高,巨噬细胞对免疫复合物吞噬的作用以及T淋巴细胞的免疫应答得以增强,从而改善病毒情脑炎的预后[20]。
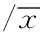
表2 治疗前后两组患儿的红细胞指标的对比±s
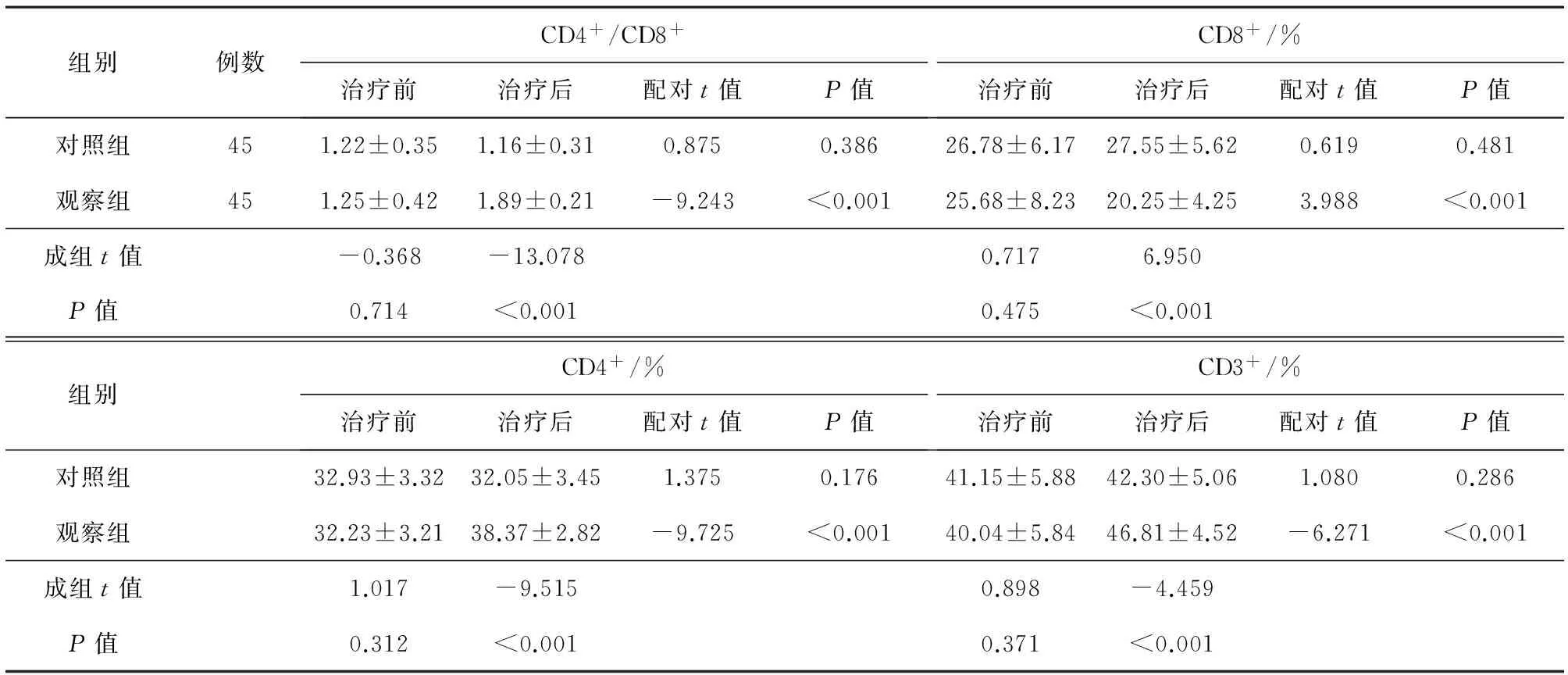
表3 两组患儿治疗前后的外周血T细胞亚群水平对比
综上所述,对于儿童病毒性脑炎的治疗,胎盘多肽注射液可明显改善患儿的细胞免疫功能状态,是值得在儿童病毒性脑炎治疗过程中广泛推广的一种生物免疫调节剂。
参考文献
[1]王楠楠.儿童肺炎支原体感染并发脑炎32例临床分析[J].安徽医药,2014,18(4):702-703.
[2]Polymeros D,Tsiamoulos ZP,Koutsoumpas AL,et al.Bioinformatic and immunological analysis reveals lack of support for measles virus related mimicry in Crohn’s disease[J].Bmc Complem Alternm,2014,12(1):139.
[3]Lind S.Practices offered£60 per home visit for out-of-area patients[J].Ieee Pulse,2014,7(2):723-727.
[4]Cornelis MC.Gene-Diet Interactions in Type 2 Diabetes[J].Current Nutrition Reports,2014,3(4):302-323.
[5]Ali A,Tirloni L,Isezaki M,et al.Reprolysin metalloproteases from Ixodes persulcatus,Rhipicephalus sanguineus and Rhipicephalus microplus ticks.[J].Exp Ther Med & Exp Appl Acarol,2014,63(4):559-578.
[7]Xiao J,Li G,Hu J,et al.Anti-inflammatory effects of recombinant human PDCD5 (rhPDCD5) in a rat collagen-induced model of arthritis[J].Mediat Inflamm,2014,38(1):1-9.
[8]Liupina IuV,Orlova ASh,Gornostaev NG,et al.Plasticity of nervous and immune systems in different species:T7e role of proteasomes[J].Zhurnal Obshcheǐ Biologii,2014,75(1):3-24.
[9]Solodeev I,Zahalka MA,Moroz C.The Novel C24D Synthetic Polypeptide Inhibits Binding of Placenta Immunosuppressive Ferritin to Human T Cells and Elicits Anti-Breast Cancer Immunity In Vitro and In Vivo 1[J].Neoplasia,2014,16(9):741-750.
[10] 郭伟立,韩虹,石凯丽,等.EB病毒性脑炎患儿淋巴细胞免疫功能研究[J].中国药物与临床,2014,14(1):124-126.
[11] Cantón GJ,Katzer F,Maley SW,et al.Inflammatory infiltration into placentas of Neospora caninum challenged cattle correlates with clinical outcome of pregnancy.[J].Res Vet Sci,2014,45(1):91-96.
[12] Romão VC,Lima A,Bernardes M,et al.Three decades of low-dose methotrexate in rheumatoid arthritis:Can we predict toxicity[J].Immunol Res,2014,60(2/3):289-310.
[13] Rafaelsen S,Johansson S,Rder H,et al.Long-term clinical outcome and phenotypic variability in hyperphosphatemic familial tumoral calcinosis and hyperphosphatemic hyperostosis syndrome caused by a novel GALNT3 mutation;case report and review of the literature[J].Bmc Med Genet,2014,15(5):232-233.
[14] Yang M,Ding J,Zhou X,et al.Effects of lycium barbarum polysaccharides on neuropeptide Y and heat-shock protein 70 expression in rats exposed to heat[J].Biomedical Reports,2014,2(5):687-692.
[15] Tan Y,Xu Q,Li Y,et al.Crosstalk between the p38 and TGF-β signaling pathways through TβRI,TβRII and Smad3 expression in plancental choriocarcinoma JEG-3 cells[J].Oncol Lett,2014,8(3):1307-1311.
[16] Sun YN,Liu YJ,Zhang L,et al.Expression of Organic Anion Transporting Polypeptide 1c1 and Monocarboxylate Transporter 8 in the Rat Placental Barrier and the Compensatory Response to Thyroid Dysfunction[J].PLoS One,2014,9(4):e96047.
[17] Vamos Z,Ivic I,Cseplo P,et al.Pituitary Adenylate Cyclase-Activating Polypeptide (PACAP) Induces Relaxations of Peripheral and Cerebral Arteries,which are Differentially Impaired by Aging[J].J Mol Neurosci,2014,54(3):535-542.
[18] Fujioka K,Hanada S,Inoue Y,et al.Effects of Silica and Titanium Oxide Particles on a Human Neural Stem Cell Line:Morphology,Mitochondrial Activity,and Gene Expression of Differentiation Markers[J].Int J Mol Sci,2014,15(7):11742-11759.
[19] Matsumoto H, Tsuchiya T, Yoshiura K,et al.ABCC11/MRP8 Expression in the Gastrointestinal Tract and a Novel Role for Pepsinogen Secretion[J].Acta Histochem Cytochem,2014,47(3):85-94.
[20] 余婕,郭虎,郑帼,等.病毒性脑炎患儿的管理[J].中华实用儿科临床杂志,2015,30(23):1838-1840.
doi:10.3969/j.issn.1009-6469.2016.06.054
(收稿日期:2016-01-27,修回日期:2016-05-04)
