微小RNA在心脏疾病中的研究进展
2016-07-15梁时雨汤依群
梁时雨,汤依群
(中国药科大学基础医学院与临床药学院,江苏 南京 210009)
微小RNA在心脏疾病中的研究进展
梁时雨,汤依群
(中国药科大学基础医学院与临床药学院,江苏 南京210009)
摘要:微小RNA(miRNA)是一种小分子的非编码RNA,可以通过抑制翻译,诱导降解的方式参与多种基因调控的表达。目前为止,miRNA被描述存在于相关心血管系统的所有细胞类型和细胞过程中。心血管疾病是最常见的疾病之一,尤其多发于中老年人,近些年也逐步向青壮年人群中发展。其中包括了心肌梗死,心肌肥大,心肌缺血,心力衰竭等。许多研究报道表明miRNA参与心血管系统多种疾病的发生发展。因此探讨miRNA在心血管疾病中的可能的调控机制和在心血管系统表达水平有助于今后对心血管疾病的临床治疗提供新的思路。该文就miRNA在几种心血管疾病中作为潜在的生物标志物进行综述,对可能分子机制和临床诊断价值做出探讨。
关键词:微小RNA;生物标志物;心肌梗死;心肌肥厚;心力衰竭
微小RNA(miRNA)是一种小分子的非编码RNA,可以通过抑制翻译,诱导降解的方式参与多种基因调控的表达。近些年受到许多研究者的广泛关注。心脏疾病是心血管疾病中最常见的疾病之一,尤其多发于中老年人,近些年也逐步向青壮年人群中发展。其中包括了心率失常,心肌梗死,心肌肥大,心肌缺血,心力衰竭等。心肌缺血和心肌梗死和其他心脏疾病有着十分密切的联系。当心脏的冠状动脉出现病变时,其冠状动脉所供血的心肌组织会出现缺血的状态,如果这一病理状态得不到改善或缓解,就会发展成为心肌梗死。另外,心肌耗氧量剧烈增加或冠状动脉痉挛也可诱发急性心肌梗死。心肌梗死患者一周后容易发生心室重构从而发展成心力衰竭[1]。miRNA不仅能作为诊断心脏疾病的潜在标志物,并且也可能参与其疾病的发生发展。本文分别从miRNA与心肌梗死,心肌肥厚和心力衰竭的关系三个方面进行讨论和概述。
1miRNA与心肌梗死
心肌梗死尤其是急性心肌梗死(AMI)是一种非常常见的心血管系统疾病,有着较高的发生率和致死率。急性心肌梗死的患病率和死亡率随着年龄增加而增加。早发急性心梗主要危险因素为男性,吸烟,腹部肥胖,到了中老年后发生的重要危险因素为糖尿病[2]。虽然发生心肌缺血没有致死的危险[3],但是有报道证明AMI后新发房颤与继发恶性心律失常风险增加有密切关系[4],并且AMI对心肌组织造成的损伤可能使之发展成心力衰竭。因此早期正确的诊断并及时治疗有可能降低其致死率[5]。对于诊断,最常用的方法就是检测疾病的生物标志物。对于诊断AMI患者,检测心肌中的相关蛋白质水平来诊断AMI的方法已经得到广泛应用[6]。许多生物标志物如肌红蛋白,肌钙蛋白T,肌酸激酶等已经被用于临床诊断[7]。
miRNA作为潜在的生物标志物,在肿瘤等疾病上研究较多[8],近几年在心血管疾病上的作用越来越受到研究者的关注。Wang等[9]为了研究急性心肌梗死在循环系统中的心脏特异性的miRNA用来作为潜在的生物标志物。研究人员选取了肌肉组织丰富的miRNA,miR-1,miR-133,miR-499,miR-208a。前三个miRNA在正常人血浆中含量极少,而最后一个在血浆中没有表达。在大鼠AMI模型的动物实验中,miR-208a在冠脉结扎0 h血浆中未检测,1 h后显著性升高。在AMI患者中,这四个miR水平都高于健康人,但是miR-208a能在90.9% AMI病人中轻易检测出,并且在100% AMI病人有症状时4h内检测出。Shyu等[10]也发现在大鼠左冠脉结扎致AMI中miR-208a表达水平会升高,而miR-208a会激活内皮因子的表达从而导致心肌纤维化。用洛伐他丁和缬沙坦通关过减少miR-208a和内皮因子的表达的治疗会减少心肌纤维化。以上表明miR-208可能是新的潜在生物标志物。肌钙蛋白T是用于诊断心肌梗死的生物标志物,He等[11]测量了AMI患者和健康人血浆中miR-328,miR-134和肌钙蛋白T的水平,结果显示了miR-328和miR-134的水平显著高于健康的对照组人群。ROC曲线分析表明了miR-329和miR-134在AMI诊断中有着重要意义,但是这两种miRNA都没有优于肌钙蛋白T。Gidlöf等[12]也做了类似的比较,发现miR-208b和miR-499-5p MI病人中水平较高,但是比肌钙蛋白T低。Huang等[13]为了探寻在循环系统中miRNAs在中国人群中AMI发生率的关联,77种miRNAs显示出不同的表达水平,结果发现miR-320b和miR-125b在AMI患者血浆中比对照组显著下降,并且这种低水平的miRNA和AMI的发生率有着密切的关联。研究也表明了在冠脉疾病中miR-320b和miR-125b能够调节多种信号转导途径中基因水平的表达。这种miRNA在AMI中表达的差异是否跟地区,人种有关还需要进一步的研究,但是有些miRNA可以在不同年龄性别的人群中稳定表达。Ai等[14]用RT-qPCR检测受试者血浆中的miRNA水平,研究发现miR-1在AMI的病人在和非AMI人的血浆中的表达水平相比,显著上升;在通过药物治疗出院后,下降至正常水平,并且这一水平和年龄,性别,血压,糖尿病无关。
miRNA在心肌梗死中不仅会反应出表达水平的变化,还会对某些通路或蛋白酶进行调控,从而保护心脏或加重梗死病情。Liu等[15]在AMI小鼠模型和人类患者中,发现miR-150在单核细胞的表达减少,离体实验发现miR-150异常的表达能够显著减少单核细胞的迁移和促炎因子的产生,阻断miR-150会发生相反的结果。在体实验发现miR-150的过表达能够提高小鼠的心功能,减少心肌梗死的面积,组织细胞凋亡的发生,减少炎症性Ly-6Chigh单核细胞水平。机制研究表明miR-150是通过抑制趋化因子受体 4 (CXCR4)的表达来调节单核细胞迁移。以上结果表明了miR-150有保护性作用。Mao等[16]用TNF-α诱导早骨髓-间充质干细胞(BM-MSC)损伤模型,研究发现miR-23a通过调节半胱天冬酶-7 (caspase-7) 来参与BM-MSC的凋亡过程。把在BM-MSC损伤模型中过表达的miR-23a注射到MI的大鼠模型中,能够提高大鼠左心室功能,减少梗死面积。加入miRNA的阻断剂或者用miRNA治疗为心肌梗死的治疗提供了新的思路。
2miRNA与心肌肥厚
心肌肥厚(CH)是一种常见的病理性特征,在许多心脏疾病如高血压,心肌缺血,糖尿病性心肌病,主动脉狭窄等都有表现[17-18]。短期的CH通常会被认为是维持心室功能的最初适应性反应,但是长期的心肌肥厚会被认为是心力衰竭明显的征兆,预示着不良的心肌结构重构[19]。越来越多的研究表明miRNA参与了心肌肥厚的发生和发展过程。
Roncarat等[20]检测了12种miRNA (miR-27a,-199a-5p,-26a,-145,-133a,-143,-199a-3p,-126-3p,-29a,-155,-30a,-21) 在心肌肥大患者血浆中显著升高。但是只有3种mi RNA (miR-199a-5p,-27a,-29a)和CH有关联。更重要的是,miR-29a和纤维化也有关联。表明了29a是一种的评价心肌肥大中心肌重构的潜在生物标志物。miRNA不仅在CH中作为一种有发展前景的生物标志物,更多的miRNA会在其病理过程中起着作用。Tu等[21]用一种新的miRNA成像监测系统来检测miR-22在用异丙肾上腺素(ISO)诱导心肌肥大的小鼠中的表达。离体和在体实验都发现,心肌肥厚的病理状态中,miR-22会过表达。而给予miR-22拮抗剂可以逆转miR-22的上调,减轻肥大的症状。在主动脉缩窄(TAC)小鼠模型中,Wu等[22]给予miR-455治疗会使小鼠CH加重,然而miR-455替代疗法会减轻心肌纤维化,抑制细胞凋亡,表明miR-455替代疗法会阻止心室肌重构。miR-455也被确定以钙网蛋白为靶点,而钙网蛋白在心脏发展过程中起着重要的作用。甲亢能够促进CH,并且血管紧张素1受体(AT1R)已经被证明调控部分应答。Diniz等[23]发现AT1R是甲亢促进心肌肥大关键的调控因子。并且在CH组中,β-MHC,miR-208b的表达下调,在对甲亢应答中,α-MHC,miR-208a 表达上调。数据得出AT1R参与调控甲亢诱导的肥大中α-MHC,miR-208a 水平的上调,但是不影响β-MHC,miR-208b表达水平的减少。以上发现表明病理性的刺激可以双向的改变miRNA的表达,而这种表达的改变也会促进病理过程的发展。
也不是所有的心肌肥厚都是病理性的,一些心肌肥厚是生理性的肥厚,常见于运动员人群中。Fernandes等[24]发现有氧运动能够减少生理性肥厚,而这种有益的结果有多种miRNA的参与。通过游泳有氧运动可以使miRNA-29增加,胶原减少从而减轻心肌纤维化。游泳还可以使血管再生通过miRNA-126来抑制血管内皮生长因子(VEGF,vascular endothelial growth factor)通路的负性调控物。这也说明了有氧运动对于人们身体的好处,并且这一过程也是有miRNA直接参与的。
一些miRNA会直接参与信号通路或酶活性的调控。 Duan等[25]研究发现在大鼠膀胱重构期间miRNA-133的表达会下调。进一步研究发现用逐渐增大浓度的外源性TGF-β1刺激膀胱平滑肌细胞(BSMC)会使miRNA-133a/b剂量依赖性的减少。转染miRNA-133可以减轻TGF-β1诱导的α-smooth muscle actin,细胞外基质亚型和纤维生长因子的表达。并且133可以下调p-Smad3,而不是p-Smad2。此外,miRNA-133过表达会抑制由TGF-β1诱导的BSMC肥大和增殖,通过影响细胞周期的分布。最后实验发现了miRNA-133调节BSMC的表型是通过TGF-β-Smad3信号通路靶向CTGF(connective tissue growth factor)。有研究发现在心肌肥厚和心衰发展过程中,啮齿类动物心肌中miR-25表达水平减少[26],这种现象被归因于一个碱性螺旋-环-螺旋(Basic helix-loop-helix ,bHLH)转录因子HAND2的水平上调。这种因子在右心室肥大发生中起着重要作用,也有研究说明它促进心肌的增殖[26-27]。令人疑惑的是Wahlquist等[28]发现在心衰的人类和啮齿类动物中,其miR-25水平是增加的,并且miR-25直接靶向SERCA2a从而导致钙离子摄取减少,心肌收缩力受到损害。 Lee等[29]给予TAC小鼠miR-1能减轻CH,然而给予miR-1的拮抗剂可以改善有缺血再灌引起的心肌凋亡和心功能下降。也有研究表明了miR-1能够影响钙离子从心肌细胞中的释放,从而直接调控了钠钙交换体1(NCX1)和膜联蛋白A5(AnxA5)。因为AnxA5能控制NCX1的活性,在心肌肥厚和心力衰竭的心肌细胞中,AnxA5水平升高会破坏NCX1功能从而减少钙离子释放[30-31]。通过这些miRNA可以看出他们参与的调控可能不是单一的,一个miRNA可能有多个靶基因。因此今后应该继续研究探索miRNA可能的分子机制。
3miRNA与心力衰竭
心力衰竭(HF)是一种造成死亡和残疾的全球性的心血管疾病,多病发于老年人。心力衰竭是有多种临床症状的复杂的进行性疾病,其原因是由于病变的心脏不能提供维持器官代谢需要的血流量。此外,许多病理疾病状态都可能发展成为心力衰竭,如心肌梗死,心肌肥大,心肌炎等[32]。miRNA在HF的诊断中的作用也日渐重要。HF可分为射血分数保留的心衰(HFPEF)和射血分数下降的心衰(HFREF)。Watson等[33]选择(miR-30c,-146a,-221,-328,-375)5种miRNA分析其表达量。在非HF和HF患者血浆中,miRNA的表达量不同。用BNP(脑钠肽)值作为HF诊断的标准,结果发现和单纯用BNP诊断相比,联合miRNA中一种或多种分析HF可以显著提高区分HFPEF和HFREF。同样的,Wong等[34]采集了HFPEF,HFREF,和非HF患者的血浆样本。发现miR-1233,-183-3p,-190a,-193b-3p,-193b-5p,-211-5p,-494,-671-5p和非心衰有差异。对照组相比,在HFREF患者中miR-125a-5p,-183-3p,-193b-3p,-211-5p,-494,-638,-671-5p 水平发生改变,HFPEF患者中miR-1233,-183-3p,-190a,-193b-3p,-193b-5p,-545-5p 水平改变,对比发现四种miRNA(miR-125a-5p,-190a,-550a-5p,-638) 在HFREF和HFREF中的水平有差别。用这几种miRNA和BNP联合诊断能提高灵敏性和特异性。Ellis等[35]也发现4中miRNA(miR-103,miR-142-3p,miR-30b,miR-342-3p)联合脑钠肽前体(NT-proBNP)水平分析能提高其诊断价值。近些年研究表明了某些mi-RNA能够对HF起到改善作用。Sang等[36]发现在慢性心衰的患者和大鼠中,miR-133a的表达水平降低。miR-133a在心衰大鼠的心脏中的过表达可能引起心体比, 左室舒张末压(LVEDP, left ventricular end-diastolic pressure)降低,左心室收缩压(LVSP, Left Ventricular Systolic Pressure)和左心室内压的最大上升速率(LV +dP/dtmax)升高。
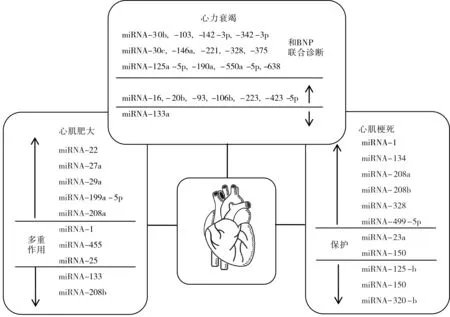
图1 miRNA在心脏疾病中的表达水平和作用
而miR-133a抑制剂能够使心体比和LVEDP上升,LVSP和 LV +dP/dtmax下降。并且miR-133a过表达显著降低心衰大鼠心脏纤维化程度。Akt(也称为PKB,是丝氨酸/苏氨酸蛋白激酶 )抑制剂TCN能够消除由miR-133a引起的的心体比,LVEDP降低,LVSP 和LV dP/dtmax升高。而miR-133a可以增加磷酸化的Akt的表达增加。实验结果表明了miR-133a是通过抑制心衰大鼠心脏Akt来改善心功能和纤维化。图1归纳总结了本文所探讨的miRNA在心脏疾病中的表达水平和作用。作为潜在的疾病生物标志物,其表达水平在病理状态不尽相同,和其他临床应用的生物标志物联合诊断能提高诊断价值。某些miRNA对心脏组织的作用也为心脏疾病的治疗提供了新的思路。
4总结与展望
随着人类科技的发展和人类预期寿命的延长,心脏病已经成为威胁全球人类健康的头号杀手。人们不健康的生活习惯也会诱发各种心脏疾病。因此了解心脏疾病的病理过程及其分子机制也是十分必要的。根据以上探讨的内容,我们确实可以得出结论:miRNA作为一种小分子的非编码RNA,可以通过抑制翻译,诱导降解的方式参与多种基因调控的表达;在心脏疾病的发生发展过程中均有参与。
近些年来国内外随着研究更加深入了解了各种miRNA的调控机制,作用靶点等。用miRNA作为治疗心脏疾病的潜在靶点也随之出现。目前把miRNA作为心血管疾病诊断的生物标志有着重要的突破,尤其是在心肌梗死和心力衰竭的诊断上面。miRNA联合心脏疾病中经典的生物标志物能够提高诊断的特异性。但是把miRNA作为靶点的治疗方法还需要大量的实验来进行验证,其安全性,可行性和稳定性有待提高。一些miRNA的靶点是否具有特异性也需要大量分子生物学上的研究。许多miRNA其作用机制已经明确,但这只是冰山一角,大量的miRNA的作用调控机制还未清楚,尚停留在表达水平的检测阶段。真正把miRNA作为治疗方法还需要进一步探索,但是miRNA在心血管疾病目前的探索为以后开发新的分子水平的治疗方法提供了新的思路。
参考文献
[1]王亚静,吴新华.心肌梗死后心力衰竭发生机制的研究进展[J].疑难病杂志,2012,11(9): 726-727.
[2]卞玲,陈寒萼,韩志华,等.急性心肌梗死患者不同年龄阶段的临床特点分析[J].安徽医药,2015,19(1):91-94.
[3]Roger VL,Go AS,Lloyd-Jones DM,et al.Heart disease and stroke statistics-2012 update:a report from the American Heart Association[J].Circulation,2012,125(1):e1001.
[4]范婷婷,许邦龙.急性心肌梗死后新发房颤与继发恶性心律失常临床相关性分析[J].安徽医药,2015,19(3):515-517.
[5]White HD ,Chew DP.Acute myocardial infarction[J].Lancet,2008,372(9638):570-584.
[6]Jaffe AS,Babuin L,Apple FS.Biomarkers in acute cardiac disease:the present and the future[J].J Am Coll Cardiol,2006,48(1):1-11.
[7]de Winter RJ,Koster RW,Sturk A,et al.Value of myoglobin,troponin T,and CK-MBmass in ruling out an acute myocardial infarction in the emergency room[J].Circulation,1995,92(12):3401-3407.
[8]桂瑞丰,胡文辉.miRNA在肝癌患者血清中的表达及意义[J].安徽医药,2016,20(1):126-128.
[9]Wang GK,Zhu JQ,Zhang JT,et al.Circulating microRNA:a novel potential biomarker for early diagnosis of acute myocardial infarction in humans[J].Eur Heart J,2010,31(6):659-666.
[10] Shyu KG,Wang BW,Cheng WP,et al.MicroRNA-208a Increases Myocardial Endoglin Expression and Myocardial Fibrosis in Acute Myocardial Infarction[J].Can J Cardiol,2015,31(5):679-690.
[11] He F,LUE P,Zhao X,et al.Predictive value of circulating miR-328 and miR-134 for acute myocardial infarction[J].Mol Cell Biochem,2014,394(1/2):137-144.
[12] Gidlöf O,Smith JG,Miyazu K,et al.Circulating cardio-enriched microRNAs are associated with long-term prognosis following myocardial infarction[J].BMC Cardiovasc Disord,2013,13:12.
[13] Huang S,Chen M,Li L,et al.Circulating MicroRNAs and the occurrence of acute myocardial infarction in Chinese populations[J].Circ Cardiovasc Genet,2014,7(2):189-198.
[14] Ai J,Zhang R,Li Y,et al.Circulating microRNA-1 as a potential novel biomarker for acute myocardial infarction[J].Biochem Biophys Res Commun,2010,391(1):73-77.
[15] Liu Z,Ye P,Wang S,et al.MicroRNA-150 protects the heart from injury by inhibiting monocyte accumulation in a mouse model of acute myocardial infarction[J].Circ Cardiovasc Genet,2015,8(1):11-20.
[16] Mao J,Lv Z,Zhuang Y.MicroRNA-23a is involved in tumor necrosis factor-alpha induced apoptosis in mesenchymal stem cells and myocardial infarction[J].Exp Mol Pathol,2014,97(1):23-30.
[17] Ho YL,Wu CC,Lin LC,et al.Assessment of the coronary artery disease and systolic dysfunction in hypertensive patients with the dobutamine-atropine stress echocardiography:effect of the left ventricular hypertrophy[J].Cardiology,1998,89(1):52-58.
[18] 李晓怡,卢忠心.miRNA与心血管疾病研究进展[J].国际检验医学杂志,2014,35(21):2912-2914.
[19] Bourajjaj M,Armand AS,da Costa Martins PA,et al.NFATc2 is a necessary mediator of calcineurin-dependent cardiac hypertrophy and heart failure[J].J Biol Chem,2008,283(32):22295-22303.
[20] Roncarati R,Viviani Anselmi C,Losi MA,et al.Circulating miR-29a,among other up-regulated microRNAs,is the only biomarker for both hypertrophy and fibrosis in patients with hypertrophic cardiomyopathy[J].J Am Coll Cardiol,2014,63(9):920-927.
[21] Tu Y,Wan L,Zhao D,et al.In vitro and in vivo direct monitoring of miRNA-22 expression in isoproterenol-induced cardiac hypertrophy by bioluminescence imaging[J].Eur J Nucl Med Mol Imaging,2014,41(5):972-984.
[22] Wu C,Dong S,Li Y.Effects of miRNA-455 on cardiac hypertrophy induced by pressure overload[J].Int J Mol Med,2015,35(4):893-900.
[23] Diniz GP,Takano AP,Barreto-Chaves ML.MiRNA-208a and miRNA-208b are triggered in thyroid hormone-induced cardiac hypertrophy - role of type 1 Angiotensin II receptor (AT1R) on miRNA-208a/alpha-MHC modulation[J].Mol Cell Endocrinol,2013,374(1/2):117-124.
[24] Fernandes T,Baraúna VG,Negrão CE,et al.Aerobic exercise training promotes physiological cardiac remodeling involving a set of microRNAs[J].Am J Physiol Heart Circ Physiol,2015,309(4):H543-H552.
[25] Duan LJ,Qi J,Kong XJ,et al.MiR-133 modulates TGF-beta1-induced bladder smooth muscle cell hypertrophic and fibrotic response:implication for a role of microRNA in bladder wall remodeling caused by bladder outlet obstruction[J].Cell Signal,2015,27(2):215-227.
[26] Dirkx E,Gladka MM,Philippen LE,et al.Nfat and miR-25 cooperate to reactivate the transcription factor Hand2 in heart failure[J].Nat Cell Biol,2013,15(11):1282-1293.
[27] Schindler YL,Garske KM,Wang J,et al.Hand2 elevates cardiomyocyte production during zebrafish heart development and regeneration[J].Development,2014,141(16):3112-3122.
[28] Wahlquist C,Jeong D,Rojas-Muoz A,et al.Inhibition of miR-25 improves cardiac contractility in the failing heart[J].Nature,2014,508(7497):531-535.
[29] Lee S,Lim S,Ham O,et al.ROS-mediated bidirectional regulation of miRNA results in distinct pathologic heart conditions[J].Biochem Biophys Res Commun,2015,465(3):349-355.
[30] Tritsch E,Mallat Y,Lefebvre F,et al.An SRF/miR-1 axis regulates NCX1 and annexin A5 protein levels in the normal and failing heart[J].Cardiovasc Res,2013,98(3):372-380.
[31] Kumarswamy R,Lyon AR,Volkmann I,et al.SERCA2a gene therapy restores microRNA-1 expression in heart failure via an Akt/FoxO3A-dependent pathway[J].Eur Heart J,2012,33(9):1067-1075.
[32] Johnson FL.Pathophysiology and Etiology of Heart Failure[J].Cardiol Clin,2014,32(1):9-19.
[33] Watson CJ,Gupta SK,O'Connell E,et al.MicroRNA signatures differentiate preserved from reduced ejection fraction heart failure[J].Eur J Heart Fail,2015,17(4):405-415.
[34] Wong LL,Armugam A,Sepramaniam S,et al.Circulating microRNAs in heart failure with reduced and preserved left ventricular ejection fraction[J].Eur J Heart Fail,2015,17(4):393-404.
[35] Ellis KL,Cameron VA,Troughton RW,et al.Circulating microRNAs as candidate markers to distinguish heart failure in breathless patients[J].Eur J Heart Fail,2013,15(10):1138-1147.
[36] Sang HQ,Jiang ZM,Zhao QP,et al.MicroRNA-133a improves the cardiac function and fibrosis through inhibiting Akt in heart failure rats[J].Biomed Pharmacother,2015,71(2015):185-189.
The research advance of miRNA in heart disease
LIANG Shi-yu,TANG Yi-qun
(SchoolofBasicmedicineandClinicalPharmacy,ChinaPharmaceuticalUniversity,Nanjing,Jiangsu210009,China)
Abstract:miRNAs are small molecular noncoding RNAs involved in controlling the patterns of gene expression through blocking translation or inducing degradation of mRNAs.So far,miRNAs were described in all cellular processes and types.Cardiovascular diseases (CVDs) including myocardial infarction,myocardial hypertrophy,myocardial ischemia,and heart failure have high incidence in middle-aged and elder population,which also have more incidence in youth population than before in recent years.Some reports demonstrated that miRNAs were involved in the progression and development of CVDs.Thus,reviewing the possible mechanism and expression of miRNAs is useful to new therapy method.
Key words:miRNA;Biomarker;Myocardial infarction;Myocardial hypertrophy;Heart failure
基金项目:国家新药创制重大专项资助(2011ZX09401-021)
作者简介:梁时雨,男,硕士研究生 通信作者:汤依群,女,副教授,硕士生导师,研究方向:心律失常及其离子通道的研究,E-mail:tyq@cpu.edu.cn
doi:10.3969/j.issn.1009-6469.2016.06.005
(收稿日期:2016-03-09,修回日期:2016-04-13)
