饲喂硬脂酸和癸酸对工蜂合成10-HDA的影响
2016-07-14杨晓慧王瑞明
刘 丽,杨晓慧,王瑞明
(齐鲁工业大学 生物工程学院,济南 250353)
饲喂硬脂酸和癸酸对工蜂合成10-HDA的影响
刘丽,杨晓慧,王瑞明
(齐鲁工业大学 生物工程学院,济南250353)
为探讨硬脂酸和癸酸对工蜂合成10-HDA及其生物合成相关酶基因表达的影响,在工蜂基础日粮中添加不同质量分数的硬脂酸和癸酸,采用高效液相色谱法和半定量RT-PCR技术测定不同日龄段工蜂上颚腺10-HDA的合成量和相关酶基因的表达量。结果显示,工蜂日粮中添加不同质量分数的硬脂酸和癸酸可在一定程度上提高工蜂上颚腺10-HDA的产量,在工蜂5、10、15日龄时,w=5%硬脂酸组和w=1%癸酸组10-HDA的合成量均显著高于空白组(P<0.05),且全期10-HDA产量的平均值分别较空白组提高11.82%和13.37%。另外,w=5%硬脂酸组和w=1%癸酸组能使工蜂上颚腺10-HDA的分泌高峰提前,由原来的20日龄分别提前至15日龄和10日龄。同时,添加硬脂酸和癸酸后,工蜂在15日龄前的ETF-β和KAT基因表达量均增加。表明,硬脂酸和癸酸可影响工蜂10-HDA生物合成相关酶基因的表达,促进工蜂上颚腺合成10-HDA,在短时间内提高10-HDA的产量。
硬脂酸;癸酸;10-HDA;ETF-β;KAT;高效液相色谱
10- 羟基-2癸烯酸(10-Hydroxy-2-Decenoic acid,10-HDA)是由工蜂上颚腺分泌的一种不饱和脂肪酸,是蜂王浆的高效生物活性物质[1]。研究表明,10-HDA具有增强免疫力[2]、抗氧化[3]、抗衰老[4]等多种生理功能。
目前,国内主要采用物理提取法、化学合成法及选育高产10-HDA的蜜蜂品种来提高10-HDA的产量。但这3种途径均存在一定的缺陷,前2种方法工艺繁琐,收率低,第3种方法选育周期较长。Plettner等[5-7]采用稳定同位素氘(D)标记的方法发现,10-HDA生物合成的起始物质是硬脂酸,随后硬脂酸在ω端发生羟基化,生成ω-羟基硬脂酸,再通过脂肪酸β氧化,碳链缩短形成10碳的碳链,这一发现为研究10-HDA合成途径开辟了道路。另有报道[5]指出,工蜂上颚腺可以利用简单脂肪酸合成硬脂酸。因此,本研究拟从10-HDA合成途径[8]入手,在工蜂基础日粮中添加10-HDA合成前体,促进工蜂上颚腺10-HDA的合成,提高10-HDA产量。在10-HDA生物合成体系中存在多种酶的催化作用,前期已有研究通过蛋白质组学的方法鉴定出与10-HDA生物合成相关的酶-电子转移黄素蛋白β(Electron transfer flavoprotein subunit beta-like,ETF-β,又称辅酶Q氧化还原酶)和3-酮酯酰CoA硫解酶(3-KetoacyI-CoA Thioase,KAT),发现ETF-β为脱氢酶的电子受体,通过ETF脱氢酶可将电子转移给主要的呼吸链,参与脂肪酸β氧化过程[9]。而KAT催化脂肪酸β-氧化循环中的硫解反应,与脂质的合成、降解及能量产生有关[10-11]。因此,ETF-β与KAT在10-HDA生物合成中起重要作用。
本研究以当地驯化的意大利工蜂为材料,在工蜂基础日粮中添加不同质量分数的硬脂酸和癸酸,检测添加外源物质对工蜂合成10-HDA及10-HDA生物合成相关酶基因表达的影响,以期为进一步完善10-HDA生物合成途径,提高10-HDA产量奠定基础。
1材料与方法
1.1材料与仪器
1.1.1蜂群刚出房(时间不超过6 h)的意大利蜜蜂(Apismelliferaligustica)蜂群,由山东师范大学西门蜂场提供,蜂群活动正常。引物由生工生物工程(上海)股份有限公司合成。
1.1.2试剂硬脂酸(w≥99%,天津市凯通化学试剂有限公司),癸酸(w≥98.5%,国药集团化学试剂有限公司),无水乙醇(色谱纯,天津市富宇精细化工有限公司);盐酸(色谱纯,天津市大茂化学试剂厂);甲醇(色谱纯,天津市大茂化学试剂厂);10-HDA标准品(w≥98%,Adamas Reagent),2×TaqPCR MasterMix(北京艾德莱生物科技有限公司),UNIQ柱式Trizol总RNA抽提试剂盒[生工生物工程(上海)股份有限公司]。
1.1.3主要仪器2720 Thermal型PCR仪(美国应用生物系统公司),5804R型高速冷冻离心机(Eppendorf艾本德中国有限公司),FA124S型电子天平(杭州汇尔仪器设备有限公司),岛津高效液相色谱仪(色谱柱:4.6 mm×250 mm的不锈钢柱,填充物不定形硅胶C18键合相,孔径10 μm),ChampGel5500凝胶成像系统( 北京赛智创业科技有限公司)。
1.2方 法
1.2.1花粉饲料的配制于9月中旬进行,该时期无外界蜜粉源,意大利蜜蜂主要以人工饲喂基础日粮为食。基础日粮由25 g蔗糖、25 g花粉、20 g脱脂豆粉和20 mL水组成[12]。在基础日粮中分别添加w=1%、5%、10%的硬脂酸和w=1%、2.5%、5%的癸酸,饲喂蜜蜂。
1.2.2工蜂的标记与采集挑选7组蜂群势力相当的蜂箱,每箱随机挑选500只刚出房的幼蜂,在其背部用记号笔作标记,记为0日龄,放回原蜂箱。随机选择1箱饲喂基础日粮,作为空白组,另外6箱分别饲喂含不同质量分数硬脂酸和癸酸的饲料,连续饲喂蜜蜂,并于标记后每隔5 d采集相应日龄的标记蜂。
1.2.3标记蜂的处理将采集到的标记蜂分为两部分,一部分分成5组,每组5只,即5个平行,剪下其头部,置于盛放少量甲醇的匀浆器中充分研磨,将研磨液转移至10 mL容量瓶,定容至刻度并摇匀,经0.22 μm纤维素酯微孔滤膜过滤,即获得工蜂头部10-HDA样品溶液。另一部分标记蜂每9只1组,对其头部进行解剖,获取上颚腺,提取总RNA并反转录合成cDNA,作为半定量RT-PCR的模板。
1.2.4工蜂上颚腺10-HDA的测定分别吸取0.02、0.05、0.125、0.313、0.781、1.953 mL质量浓度为1 g/L的 10-HDA标准母液移至25 mL容量瓶(即获得0.8、2、5、12.5、31.25、78.125 mg/L 10-HDA),甲醇定容并摇匀,0.22 μm纤维素酯微孔滤膜过滤,即得标准品溶液。采用高效液相色谱法[13]测定标准品的质量浓度,绘制标准曲线。根据标准曲线,计算样品溶液中10-HDA质量浓度。色谱检测条件:波长212 nm;流动相由V(甲醇)∶V(0.01 mol/L 盐酸)∶V(超纯水)=55∶10∶35组成;流速1.0 mL/min;进样量10 μL;柱温25 ℃。
1.2.5半定量RT-PCR检测ETF-β和KAT基因的表达量半定量RT-PCR主要用于确定目的基因的mRNA表达量。通常以管家基因为参照,以等量的cDNA为模板,通过特异性引物进行PCR扩增获得目的基因和管家基因片段。由于不同目的基因或不同组织来源的同一基因的表达量不同,在同一PCR体系条件下扩增得到的产物也不同,而管家基因的表达量相同。采用灰度扫描软件确定灰度值,计算目的基因与管家基因PCR产物灰度值的比值,比较目的基因的表达水平。
根据NCBI发表的ETF-β(登录号:571558662)、KAT(登录号:571554458)、β-actin(登录号:297591984) 基因序列,采用Premier 5软件分别设计引物,扩增目的片段大小分别为505、506、182 bp。所用引物序列见表1。

表1 半定量RT-PCR引物序列
管家基因β-actin反应条件:94 ℃ 5 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 60 s,扩增27个循环;72 ℃延伸10 min。ETF-β、KAT基因PCR扩增的退火温度均为60 ℃,28个循环,其他条件与β-actin基因相同。
通过10 g/L琼脂糖凝胶电泳检测PCR产物,并通过凝胶成像系统观察拍照,采用Quantity One软件进行灰度值分析,根据目的基因与管家基因PCR产物灰度值的比值,判断靶基因的表达情况。
2结果与分析
2.1饲喂硬脂酸对工蜂合成10-HDA的影响
硬脂酸是蜜蜂上颚腺10-HDA合成的起始物质,可作为外源性物质直接被蜜蜂上颚腺利用。由图1可知,与空白组相比,花粉饲料中添加w=1%、5%、10%的硬脂酸可提高15日龄前工蜂上颚腺10-HDA的分泌量,且w=5%硬脂酸作用效果显著(P<0.05),在5、10、15日龄10-HDA分泌量分别提高84.65%、26.65%和56.66%,全期10-HDA的产量平均值比基础日粮组提高11.82%,说明w=5%硬脂酸更有利于工蜂10-HDA的合成。并且添加硬脂酸后,10-HDA的分泌高峰提前,由原来的20日龄提前至15日龄,表明,在花粉饲料中添加相应质量分数的硬脂酸,能促进10-HDA合成,在短时间内提高蜂王浆中10-HDA的产量。
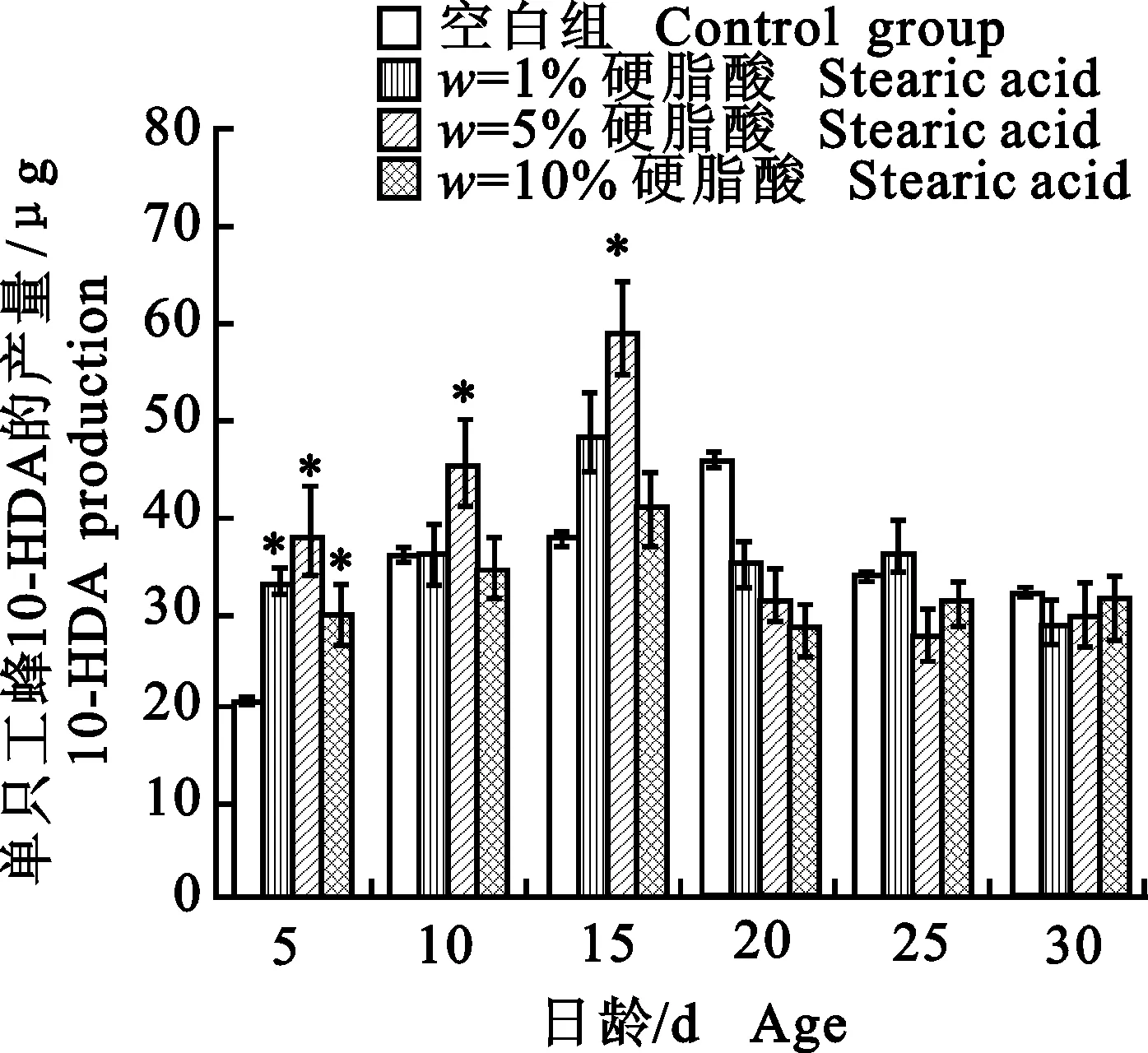
图中数据为“平均数±标准差”;单星号表示差异显著(P<0.05)。图2同。
Data are “mean ± SD”, and single asterisks indicate statistical significance atP< 0.05. The same in Fig. 2.
图1饲喂硬脂酸后工蜂合成10-HDA的产量
Fig.1Effect of stearic acid on 10-HDA
synthesis in worker bees
2.2饲喂癸酸对工蜂合成10-HDA的影响
由图2可知,与空白组比较,w=1%、2.5%、5%的癸酸组均能提高15日龄前工蜂上颚腺10-HDA的分泌量。其中,在10日龄时,w=1%癸酸组的工蜂头部10-HDA合成量达到最大值,为每只54.31 μg;在15日龄时,w=2.5%、5%癸酸组的工蜂头部10-HDA合成量达到最大值。由图2还可以看出,添加w=1%癸酸的作用效果更显著,该组在5、10、15日龄工蜂头部10-HDA的合成量均显著高于空白组(P<0.05),10-HDA分泌高峰提前至10日龄,且全期10-HDA产量的平均值较空白组提高13.37%。15日龄后,与相应日龄段空白组相比,除w=1%硬脂酸组在30日龄时,工蜂10-HDA的合成量增加5.58%外,其他各组的10-HDA合成量均降低,其中,w=1% 癸酸组工蜂在20、25日龄时10-HDA的合成量分别下降29.24%、10.54%,w=2.5%癸酸组工蜂在20、25、30日龄时的合成量分别下降21.69%、18.56%、8.5%,w=5%癸酸组则分别下降40.76%、4.97%、8.84%,表明,后期癸酸无法促进工蜂高效合成10-HDA。

图2 饲喂癸酸后工蜂合成10-HDA的产量
2.3饲喂硬脂酸对ETF-β和KAT基因表达的影响
为研究饲喂硬脂酸对10-HDA合成相关酶基因表达的影响,采用半定量RT-PCR技术检测工蜂上颚腺ETF-β和KAT基因表达水平的变化。由图3和图4可知,空白组ETF-β和KAT基因的表达量均随日龄的增加而增加,且在20日龄时表达量最高。而在基础日粮中添加w=5%硬脂酸后,5、10、15日龄工蜂ETF-β和KAT基因的表达量均高于空白组,且这2个基因的表达高峰由原来的20日龄分别提前至15日龄与10日龄。表明,添加硬脂酸能增加10-HDA生物合成相关酶基因的表达,从而提高10-HDA的产量。
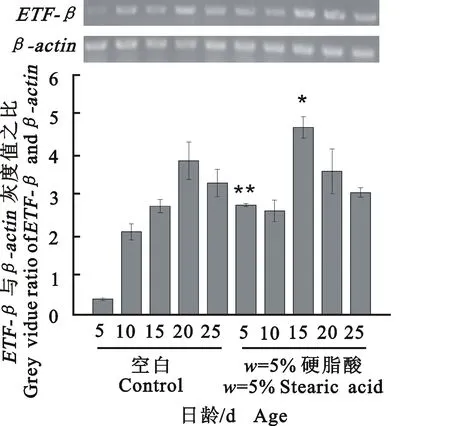
单星号表示差异显著(P<0.05),双星号表示差异极显著(P<0.01)。图4、图5、图6同。
Single asterisks indicate statistical significance atP<0.05 and double asterisks indicate statistical significance atP< 0.01. The same for Fig.4, Fig.5, Fig.6.
图3w=5%硬脂酸对ETF-β基因表达的影响
Fig.3Effect ofw=5% stearic acid on the
expression ofETF-βgene

图4 w=5%硬脂酸对KAT基因表达的影响
2.4饲喂癸酸对ETF-β和KAT基因表达的影响
由图2可知,w=1%的癸酸饲料比w=2.5%、5%的癸酸饲料更利于促进工蜂腺体10-HDA的合成。因此,选择w=1%癸酸,分析其对10-HDA合成相关酶基因ETF-β及KAT表达水平的影响。由图5和图6可知,空白组中ETF-β和KAT基因表达量均随日龄的增加而增加,在20日龄时,表达量达到最高。在饲料中添加w=1%癸酸后,10、15日龄工蜂ETF-β和KAT基因的表达量均显著高于空白组(P<0.05),且这2个基因的表达高峰由原来的20日龄分别提前至15日龄与10日龄。表明,在花粉饲料中添加w=1%癸酸后,能增加10-HDA生物合成相关酶基因ETF-β及KAT的表达,进而提高10-HDA的产量。

图5 w=1%癸酸对ETF-β基因表达的影响

图6 w=1%癸酸对KAT基因表达的影响
3结论与讨论
本研究主要在工蜂基础日粮中添加不同质量分数的硬脂酸和癸酸,采用高效液相色谱法测定不同日龄段工蜂上颚腺中10-HDA的产量,以分析外源添加物质对工蜂合成10-HDA的影响。同时,采用半定量RT-PCR技术分析硬脂酸和癸酸对10-HDA生物合成相关酶基因表达的影响,结果显示,与空白组相比,15日龄前,在花粉饲料中添加w=5%硬脂酸、w=1%癸酸均能有效提高工蜂上颚腺10-HDA的产量(P<0.05),且能使10-HDA分泌高峰提前,由原来的20日龄分别提前至15日龄和10日龄。另外,添加硬脂酸和癸酸均可使工蜂在15日龄前ETF-β和KAT基因的表达量增加,其增加趋势与10-HDA在工蜂体内合成量的增加趋势基本一致。说明,外源硬脂酸和癸酸通过影响10-HDA生物合成相关酶ETF-β和KAT的基因表达来影响10-HDA的合成。
本研究显示,硬脂酸及癸酸均可作为外源物质被工蜂利用,提高10-HDA生物合成相关酶基因的表达,促进工蜂上颚腺10-HDA的合成。根据已有报道[10],硬脂酸作为10-HDA合成的起始物质,经羟基化修饰及β氧化后最终生成10-HDA。因此,添加硬脂酸后,工蜂上颚腺10-HDA的合成量提高且参与脂肪酸β氧化的相关酶表达量也相应增加。另外,添加癸酸后,10-HDA的合成量提高,脂肪酸β氧化酶的表达量也增加。因此,推测癸酸可能通过增加碳链先合成硬脂酸,再进一步转化生成10-HDA,但具体的分子调控过程还需进一步研究。
Reference:
[1]贺春玲,嵇保中,刘曙文,等.10-羟基-2-癸烯酸研究进展及展望[J].中国农学通报,2007,23(6):227-231.
HE CH L,JI B ZH,LIU SH W,etal.Prpgress and prospects in research of 10-Hydroxy-z-Decenoic acid[J].ChineseAgriculturalScienceBulletin,2007,23(6):227-231(in Chinese with English abstract).
[2]石晶,凌树森,孙维林.10-羟基癸烯酸对小鼠免疫功能的影响[J].中国药理学通报,1990,6(3):175-178.
SHI J,LING SH S,SUN W L.The effect of 10-HDA on immune function of mice[J].ChinesePharmacologicalBulletin,1990,6(3):175-178 (in Chinese with English abstract).
[3]NAGAI T,SAKAI M,INOUE R,etal.Antioxidative activities of some commercially honeys,royal jelly,and propolis[J].FoodChemistry,2001,75(2):237-240.
[4]侯春生,刘顺春,陈崇羔.蜂王浆中活性小分子物质BHT对小白鼠抗衰老作用的影响[J].中国蜂业,2007,58(12):12-13.
HOU CH SH,LIU SH CH,CHEN CH G.Effects of the small molecule material BHT in royal jelly on anti-aging of the mouse[J].ApicultureOfChina,2007,58(12):12-13(in Chinese with English abstract).
[5]PLETTNER E,SUTHERLAND G R J,SLESSOR K N,etal.Why not be a queen Regioselectibity in mandibular secretions of honeybee castes[J].JournalofChemicalEcology,1995,21(7):1017-1029.
[6]PLETTNER E,SLESSOR K N,WINSTON M L,etal.Caste-selective pheromone biosynthesis in honeybees[J].Science,1996,271(5257):1851-1853.
[7]PLETTNER E,SLESSOR K N,WINSTON M L.Biosynthesis of mandibular acids in honeybees(Apismellifera):De novo synthesis,route of fatty acid hydroxylation and caste selectiveβ-oxidation[J].InsectBiochemistryandMolecularBiology,1998,28(1):31-42.
[8]肖瀛,徐焰.生物合成10-HDA的代谢途径[J].食品科学,2005,26(9):555-557.
XIAO Y,XU Y.Biosynthetic pathway of 10-HDA[J].FoodScience,2005,26(9):555-557(in Chinese with English abstract).
[9]王镜岩,朱圣庚,徐长法.生物化学 [M].第3版,下册.北京:高等教育出版社,2002:236-237.
WANG J Y,ZHU SH G,XU CH F.Biochemistry [M].3rd ed,Volume Ⅱ.Beijing:Higher Education Press,2002:236-237(in Chinese).
[10]周延清,张永华,张喻,等.怀地黄3-酮脂酰CoA-硫解酶基因的克隆、序列特征和时空表达分析[J].中草药,2013,44(1):76-84.
ZHOU Y Q,ZHANG Y H,ZHANG Y,etal.Gene cloning,features of sequence,and analysis on temporal and spatial expression ofRehmanniaglutinosaf.hueichingensis3-ketoacyl CoA-thiolase[J].ChineseTraditionalandHerbalDrugs,2013,44(1):76-84(in Chinese with English abstract).
[11]FIDALEO M,ARNAULD S,CLEMENCET M C,etal.A role for the peroxisomal 3-ketoacyl-CoA thiolase B enzyme in the control of PPARa-mediated upregulation of SREBP-2 target genes in the liver[J].Biochimie,2011,93(5):876-891.
[12]方文富,郭海坤,胡发明,等.不同配比花粉与黄豆粉饲料对意蜂王浆的影响[J].中国蜂业,2013,64(Z3):12-16.
FANG W F,GUO H K,HU F M,etal.The effect of different ratio of pollen and soybean powder on royal jelly ofApismelliferaligustica[J].ApicultureofChina,2013,64(Z3):12-16(in Chinese with English abstract).
[13]杨威,罗源源,王晓燕,等.高效液相色谱法测定合成10-HDA的含量分析[J].化学与黏合,2009,31(2):64-66.
YANG W,LUO Y Y,WANG X Y,etal.Determination of synthetic 10-HDA with HPLC method[J].ChemistryandAdhesion,2009,31(2):64-66(in Chinese with English abstract).
Effects of Feeding Stearic Acids and Decanoic Acids on 10-HDA Synthesis in Worker Honeybee
LIU Li, YANG Xiaohui and WANG Ruiming
(School of Bioengineering,Qilu University of Technology, Jinan250353, China)
To investigate the influence of stearic acids and decanoic acids on the synthesis of 10-HDA and the expression of genes related to the biosynthesis in worker honeybee, 10-HDA production and the related gene mRNA levels were detected by adding different mass fraction of stearic acids and decanoic acids into the pollen feed from the feeding point of view. HPLC and semi-quantitative RT-PCR were used separately in the experiment. The results showed that adding different mass fraction of stearic acids and decanoic acids in the pollen feed could improve the synthesis of 10-HDA to a certain extent, in which the groups ofw=5% stearic acids andw=1% decanoic acids had significant effect on the synthesis of 10-HDA (P<0.05) relative to the control groups for the bees in 5, 10, 15 day old. And compared with the blank group, the average productions of 10-HDA were increased by 11.82%, 13.37% respectively in the whole period. In addition, with addition ofw=5% stearic acids andw=1% decanoic acids in the pollen feed, the 10-HDA secretion peak of worker bees was changed respectively from the original 20 days to 15 days and 10 days of age in advance. Meanwhile,ETF-βandKATmRNA levels were up-regulated by feeding the pollen with exogenous substances before 15 days of worker honeybee. In conclusion, stearic acids and decanoic acids could up-regulate the expressions ofETF-βandKATby which promote the synthesis 10-HDA synthesis and increase the yield of 10-HDA in a short time.
Stearic acid;Decanoic acid;10-HDA;ETF-β;KAT; HPLC
2015-12-21
2016-01-22
The National Natural Science Foundation of China (No.31201281 and 31171727); Shandong Province Young Scientist Research Award Fund Scheme (No. BS2013SW029).
LIU Li, female,master student. Research area: microbial enzyme technology. E-mail: liuli890216@163.com
WANG Ruiming, male, doctoral supervisor. Research area: microbial enzyme technology. E-mail: ruiming3k@163.com
(责任编辑:郭柏寿Responsible editor:GUO Baishou)
2015-12-21修回日期:2016-01-22
国家自然科学基金(31201281,31171727);山东省优秀中青年科学家科研奖励基金计划(BS2013SW029)。
刘丽,女,硕士研究生,研究方向为微生物酶技术。E-mail:liuli890216@163.com
王瑞明,男,博士生导师,研究方向为微生物酶技术。E-mail:ruiming3k@163.com
S896.3
A
1004-1389(2016)07-0973-06
网络出版日期:2016-06-30
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20160630.1624.008.html
