右美托咪定对布比卡因所致神经细胞毒性的保护作用
2016-07-14陈根殷王旭光
陈根殷,王旭光
右美托咪定对布比卡因所致神经细胞毒性的保护作用
陈根殷,王旭光
摘要:目的探讨右美托咪定对布比卡因所致神经细胞毒性的保护作用。方法体外培养小鼠神经母细胞瘤细胞株N2a细胞,取对数期细胞分为4组:对照组细胞培养液不加任何药物;布比卡因组细胞中加入1 000µmol/L布比卡因;50、200µmol/L右美托咪定浓度组细胞中加入1 000µmol/L布比卡因后,再分别加入50、200µmol/L右美托咪定。各组细胞加入药物后继续培养24 h,以MTT法检测细胞存活率;流式细胞术检测细胞凋亡、活性氧(ROS)水平、线粒体膜电位及Caspase-3的表达。结果在1 000µmol/L布比卡因作用下,各药物组N2a细胞的存活率明显降低,同时线粒体膜电位显著下降,而细胞的凋亡率、胞内ROS水平和Caspase-3表达则显著升高;50、200µmol/L右美托咪定可抑制布比卡因引起的N2a细胞毒性,使细胞的存活率及线粒体膜电位均明显升高,同时降低细胞的凋亡率、胞内ROS水平和Caspase-3表达,200µmol/L右美托咪定的变化较50µmol/L更为明显。结论右美托咪定可减轻布比卡因对N2a细胞的毒性作用,其可能是通过抑制ROS的生成、改变线粒体膜电位、降低Caspase-3的表达,从而抑制细胞的凋亡来实现的。
关键词:右美托咪定;布比卡因;细胞凋亡;活性氧;流式细胞术;神经损伤;线粒体膜电位
布比卡因作为一种酰胺类局部麻醉药,因具有良好的麻醉和镇痛效果而被广泛应用于硬膜外镇痛、神经阻滞和椎管内麻醉。然而研究发现其对神经元有一定的损伤作用,布比卡因神经毒性的机制尚未完全阐明,有研究认为与其引起神经细胞内源性抗凋亡分子表达下调或活性下降,从而导致神经元坏死和凋亡有关,其神经毒性已引起麻醉学与疼痛治疗学领域的广泛关注[1-2]。右美托咪定是一种新型高选择性的α2肾上腺素能受体激动剂,具有镇静、镇痛、抗焦虑及抑制交感神经活性,减少应激反应等特性。有研究表明右美托咪定可通过增加抗凋亡蛋白生成和减少促凋亡蛋白生成,降低神经细胞的凋亡,从而增强神经细胞的生存能力[3-5]。但右美托咪定对布比卡因诱导的神经细胞凋亡是否也有影响,目前尚少见报道。本研究探讨右美托咪定对布比卡因所致神经损伤的影响,并进一步探讨其可能作用机制。
1 材料与方法
1.1实验材料小鼠神经母细胞瘤细胞株N2a细胞购自上海通派生物科技有限公司;右美托咪定购自江苏恒瑞制药有限公司;MEM细胞培养基和胎牛血清购自美国Gibco公司;布比卡因和MTT购自美国Sigma公司;细胞凋亡检测试剂盒、活性氧(ROS)检测试剂盒、线粒体膜电位检测试剂盒、Caspase-3检测试剂盒和流式细胞仪(型号:FACSCantoⅡ)均购自美国BD公司。
1.2细胞培养用含有10%胎牛血清的MEM培养基培养N2a细胞,到80%单层融合时传代。
1.3MTT法检测神经细胞增殖取对数生长期细胞,1×105cell/mL接种于96孔培养板,每孔加100µL,在37℃、5% CO2条件下培养24 h后,分别加入1 000µmol/L布比卡因和不同浓度的右美托咪定(0、10、20、50、100、200、400µmol/L),对照组加入相应体积的PBS,每组设8个平行孔。用药后继续培养24 h,然后每孔加入20µL MTT(5 g/L),继续培养4 h。倾去培养液,每孔加入100µL DMSO溶解,以测定波长为570 nm,参考波长为450 nm于酶标仪测定其吸光度,重复3次。根据公式计算存活率:细胞存活率(%)=处理组吸光度/对照组吸光度×100%。
1.4实验分组根据MTT及预实验结果,本实验设4组,对照组:细胞培养液不加任何药物。布比卡因(Bup)组:细胞中加入1 000µmol/L布比卡因。50µmol/L右美托咪定浓度(Dex1)组、200µmol/L右美托咪定浓度(Dex2)组:细胞中加入1 000µmol/L布比卡因后再分别加入50、200µmol/L右美托咪定。
1.5流式细胞术检测细胞凋亡细胞加药培养24 h后收集细胞,取约5×105重悬的细胞,加入500µL Annexin V-FITC结合液混匀,再加入5µL Annexin V-FITC,然后加入5µL PI染色液,混匀后避光室温放置15 min,随即进行流式细胞仪检测。
1.6细胞内ROS的测定细胞于6孔培养板加药培养24 h后,每孔加入浓度为10 μmol/L的DCFH-DA,37℃细胞培养箱内孵育20 min,用无血清细胞培养液洗细胞3次,然后收集细胞,流式细胞术检测细胞内的荧光强度。
1.7线粒体膜电位检测细胞于6孔培养板加药培养24 h后,每孔加入500µL JC-1染色工作液(5 mg/L),充分混匀,继续37℃培养20 min,收集细胞,加500µL JC-1染色缓冲液,用流式细胞仪检测。较高线粒体膜电位时,JC-1形成聚合体,产生红色荧光;较低线粒体膜电位时,JC-1聚合体分解成单体,产生绿色荧光。以JC-1单体与聚合体的荧光强度比值来衡量线粒体膜电位的变化。
1.8流式细胞术检测Caspase-3表达的变化收集各组细胞,加入2%多聚甲醛于冰上孵育30 min,300×g离心5 min去上清;0.5 mL 0.2%的Tween缓冲液重悬细胞,室温下孵育15 min。离心收集细胞,加入50µL染色缓冲液和10µL Alexa Flour 647标记的Caspase-3抗体,避光孵育30 min,加入1 mL 0.1%Tween缓冲液。离心去上清,加入500µL染色缓冲液,然后上机检测。
1.9统计学方法采用SPSS 17.0软件进行统计学分析,计量数据用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1MTT实验结果与对照组相比,浓度为1 000 µmol/L的布比卡因明显抑制细胞的增殖,具有较强的细胞毒性作用;应用20~400µmol/L右美托咪定作用于细胞能明显抑制布比卡因的细胞毒性,提高N2a细胞的存活率,与布比卡因组(即0µmol/L浓度组)比较差异有统计学意义(F=9.109,P<0.05)。见图1。

Fig.1 Effects of different doses of dexmedetomidine on bupivacaine-induced neurotoxicity图1 右美托咪定对布比卡因细胞毒性的影响
2.2右美托咪定对N2a细胞凋亡的影响布比卡因作用24 h后,与对照组相比,各药物组N2a细胞的凋亡率显著增高(P<0.01)。Dex1组和Dex2组细胞的凋亡率较Bup组均明显下降,Dex2组较Dex1组下降更为明显,差异均有统计学意义(均P<0.01),见表1、图2。
2.3右美托咪定对N2a细胞内ROS的影响与对照组相比,各药物组N2a细胞内的ROS水平显著增高(P<0.01)。Dex1组和Dex2组ROS水平较Bup组下降,Dex2组较Dex1组下降更为明显,差异均有统计学意义(均P<0.01),见表1、图3。
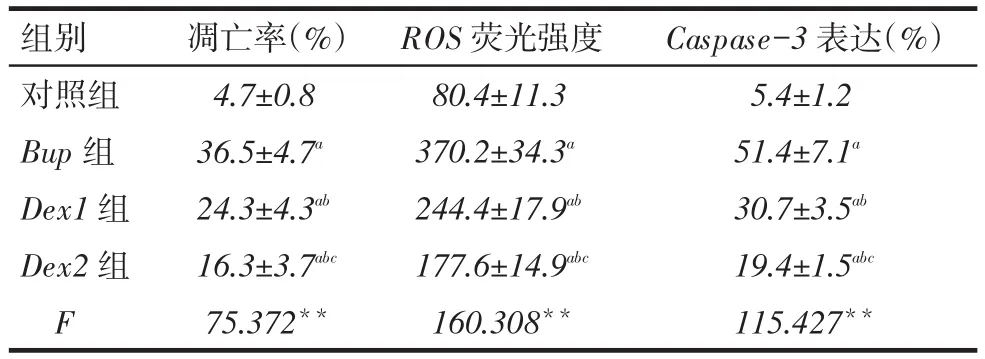
Tab.1 The rate,ROS activity,and expression level of Caspase-3 in N2a cells detected by FCM表1 流式细胞术检测N2a细胞的凋亡率、ROS水平及Caspase-3表达 (n=5,x±s)
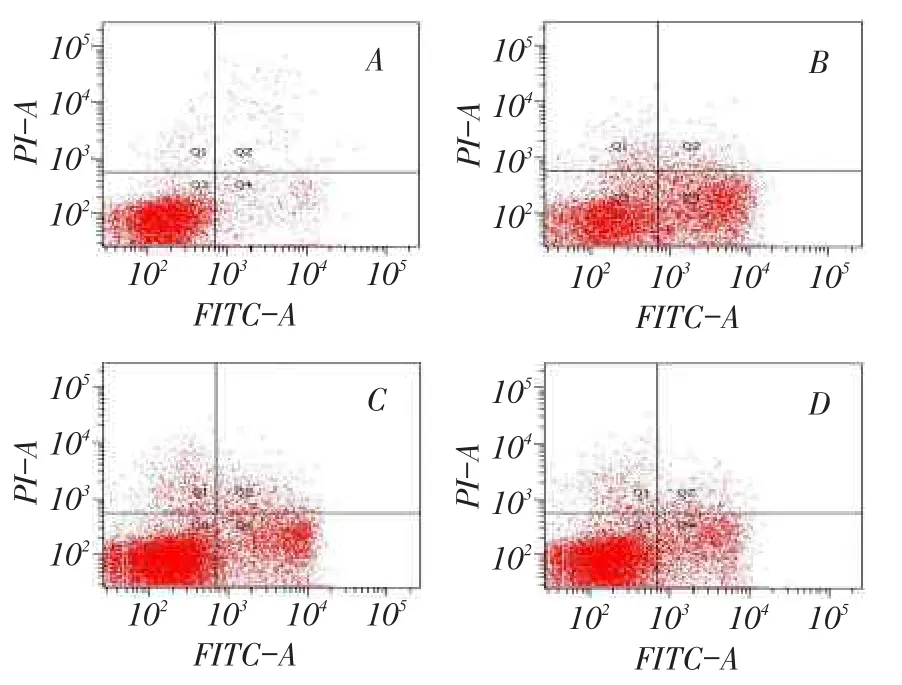
Fig.2 The apoptotic rates of four groups measured by FCM图2 流式细胞术检测各组细胞的凋亡

Fig.3 The ROS activity measured by FCM图3 流式细胞术检测细胞ROS的变化
2.4右美托咪定对N2a细胞线粒体膜电位的影响与对照组相比,各药物组N2a细胞内线粒体膜电位显著下降(P<0.01)。Dex1组和Dex2组细胞线粒体膜电位较Bup组明显上升,Dex2组较Dex1组上升更为显著,差异均有统计学意义(均P<0.01),见表2、图4。

Tab.2 The mitochondrial membrane potential(MMP)measured by FCM表2 流式细胞术检测各组细胞线粒体膜电位 (n=5,x±s)
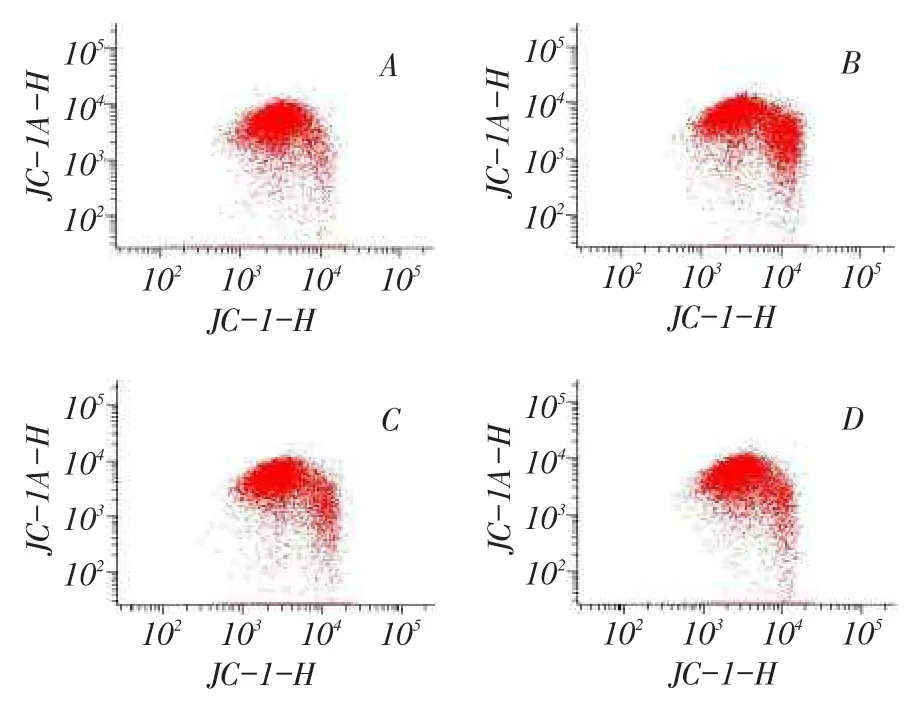
Fig.4 The mitochondrial membrane potential(MMP)measured by FCM图4 流式细胞术检测各组细胞线粒体膜电位
2.5右美托咪定对N2a细胞Caspase-3表达的影响与对照组相比,各药物组N2a细胞Caspase-3表达均显著增加(P<0.01)。Dex1组和Dex2组N2a细胞Caspase-3表达较Bup组显著下降,Dex2组较Dex1组下降更显著,差异均有统计学意义(均P<0.01),见表1、图5。

Fig.5 Caspase-3 expression of N2acells detected by FCM图5 流式细胞术检测Caspase-3的表达
3 讨论
临床和实验研究均发现布比卡因对神经元具有一定损伤作用,且具有时间和剂量依赖性,并且临床上常用的剂量就可引起神经损伤。目前布比卡因神经毒性的机制尚未完全阐明,现有研究认为,布比卡因导致患者出现运动和感觉异常的原因在于其可引起神经细胞神经元坏死和凋亡[6-7]。布比卡因可通过干扰氧化磷酸化和抑制线粒体呼吸链复合物Ⅰ,使ATP生成减少,并可诱导细胞产生大量ROS,促使电压依赖性阴离子通道开放,导致Cl-流入线粒体内,使线粒体的渗透压增高、膜电位降低和通透性增大,释放促凋亡因子,并激活Caspase-3,导致细胞凋亡[8-9]。
本课题组前期实验结果显示,布比卡因可抑制N2a细胞的增殖,并具有剂量依赖性,其半数抑制浓度IC50为1 060µmol/L。本研究采用1 000µmol/L的布比卡因进行实验。而在右美托咪定系列浓度组中,20µmol/L以上浓度组均可抑制布比卡因的细胞毒性,但在作用机制研究中20µmol/L浓度组和布比卡因组比较差异无统计学意义,所以本实验采用50µmol/L和200µmol/L浓度组作为低、高两个浓度进行后续机制实验。实验结果显示,在浓度为1 000 µmol/L布比卡因作用下,N2a细胞的存活率明显降低,同时凋亡率及线粒体膜电位显著下降,而胞内ROS水平和Caspase-3表达则显著升高,提示布比卡因对N2a细胞存在较大的细胞毒性,其原因可能在于布比卡因刺激N2a细胞内产生大量ROS,从而启动凋亡线粒体途径,激活Caspase-3,最终导致细胞凋亡。这也与以往研究结果相一致[10]。
多项研究表明,右美托咪定尚具有稳定血流动力学及多器官保护作用[11-12],但其对神经系统的影响和作用机制尚不明确,结果也存在争议。本研究发现,实验浓度范围内的右美托咪定对N2a细胞增殖没有明显的抑制作用,且一定浓度的右美托咪定可浓度依赖性地抑制布比卡因引起的细胞毒性,显著提高N2a细胞的存活率。进一步实验发现,右美托咪定可降低布比卡因诱导的N2a细胞凋亡。ROS在布比卡因诱导N2a细胞凋亡的过程中起重要作用。本研究显示,右美托咪定能抑制布比卡因诱导的ROS过度生成,同时升高N2a细胞线粒体膜电位,抑制胞内Caspase-3表达,提示右美托咪定可减轻布比卡因对N2a细胞的毒性作用,其可能是通过抑制ROS的生成,改变线粒体膜电位,降低Caspase-3的表达,从而抑制细胞的凋亡来实现,但具体的作用机制还需进一步研究。
右美托咪定的多器官保护作用已越来越受到人们的关注,尤其在神经保护和心脏保护中,右美托咪定已显示出其独特的优越性。但目前针对右美托咪定的用药剂量及其与其他麻醉药物的相互作用等问题尚需更多、更细致的研究以使其应用更安全、更有效。
参考文献
[1]Vallerie SN,Hotamisligil GS.The role of JNK proteins in metabolism[J].Sci Transl Med,2010,2(60):60rv5.doi:10.1126/scitranslmed.3001007.
[2]Park CJ,Park SA,YoonTG,et al.BuPivaeaine induces apoptosis via ROS in the Schwann cell line[J].JDent Res,2005,84(9):852-857.
[3]Zhu YM,Wang CC,Chen L,et al.Both PI3K/Akt and ERK1/2 pathways participate in the protection by dexmedetomidine against transient focal cerebral ischemia/reperfusion injury in rats[J].Brain Res,2013,1494:1-8.doi:10.1016/j.brainres.2012.11.047.
[4]Dahmani S,Rouelle D,Gressens P,et al.Characterization of the postconditioning effect of dexmedetomidine inmouse organotypic hippocampal slice cultures exposed tooxygen and glucose deprivation[J].Anesthesiology,2010,112(2):373-383.doi:10.1097/ ALN.0b013e3 181ca6982.
[5]Ma R,Wang X,Lu C,et al.Dexamethasone attenuated bupivacaine induced injury in vitro through a threonine serine protein kinse B-dependent mechanism[J].Neuroscience,2010,167(2):329-342. doi:10.1016/j.neuroscience.2009.12.049.
[6]Liu L,Zhang X,Qian B,et al.Over-expression of heat shock protein 27 attenuates doxorubicin-induced cardiac dysfunction in mice [J].Eur JHeart Fail,2007,9(8):762-769.
[7]Sakaguchi M,Murayama K,Yabe K,et al.β-Casomorphin-5 stimulates neurite outgrowth in a mouse neuroblastoma cell line(Neuro-2a)[J].Neurosci Lett,2008,251(2):97-100.
[8]Lirk P,Haller I,Myers RR,et al.Mitigation of direct neurotoxic effects of Iidoeaine and amitriptyline by inhibition of P38 mitogen-activated protein kinase in vitro and invivo[J].Anesthesiolog,2009,104(6):1266-1273.
[9]Zorov DB,Juhaszova M,Sollott SJ.Mitoehondrial ROS-nduced ROS release:an update and review[J].Biochim Bio Phys Acta,2006,1757(5/6):509-517.
[10]Li L,Zhang QG,Lai LY,et al.Neuroprotective effect of ginkgolide B on bupivacaine-induced apoptosis in SH-SY5Y cells[J].Oxid Med Cell Longev,2013,2013:159864.doi:10.1155/2013/159864.
[11]Ibacache M,Sanchez G,Pedrozo Z,et al.Dexmedetomidine preconditioningactivates pro-survival kinasesand attenuatesregional ischemia/reperfusion injury in rat heart[J].Biochim Biophy Acta,2012,1822(4):537-545.doi:10.1016/j.bbadis.2011.12.013.
[12]Hanci V,Yurdakan G,Yurtlu S,et al.Protection effect of dexmedetomidine in a rat model of a-naphthylthiourea induced acute lung injury[J].J Surg Res,2012,178(1):424-430.doi:10.1016/j.jss. 2012.02.027.
(2015-06-01收稿2015-11-03修回)
(本文编辑陈丽洁)
Protective effects of dexmedetomidine on bupivacaine-induced neurotoxicity
CHEN Genyin,WANG Xuguang
The Affiliated Hospital of Guangdong Medical College,Zhanjiang 524001,China Corresponding AuthorE-mail:marvin009@126.com
Abstract:ObjectiveTo investigate the protective effects of dexmedetomidine on bupivacaine-induced neurotoxicity. MethodsMouse neuroblastoma cell line N2a cells were divided into four groups.The cells in the control group were incubated with no drug adding while the cells in bupivacaine group were treated with 1 000µmol/L bupivacaine for 24 h.The cells in the group Dex1 and Dex2 were incubated with 1 000µmol/L bupivacaine and 50µmol/L,200µmol/L dexmedetomidine for 24 h respectively.MTT assay was used to evaluate the cell viability.The reactive oxygen species(ROS)activity,mitochondrial membrane potential(MMP),the expression of Caspase-3 and apoptotic rate of N2a cells were detected by flow cytometry.ResultsThe cell viabilities were significantly decreased after being treated with 1 000µmol/L bupivacaine,MMP was also significantly decreased,and apoptotic rates,levels of ROS and Caspase-3 were significantly increased.The bupivacaine-induced cytotoxicity was inhibited by dexmedetomidine(50 and 200µmol/L),which resulted in the increase in the cell viability and MMP,but decrease in apoptotic rate and levels of ROS and Caspase-3.These effects were more significant in 200µmol/L dexmedetomidine group than those of 50µmol/L dexmedetomidine group.ConclusionDexmedetomidine attenuates bupivacaine-induced cytotoxicity of N2a cells,which may be related with the inhibition of ROS,the decrease in MMPand Caspase-3,and inhibitingappotosis in N2acells.
Key words:dexmedetomidine;bupivacaine;apoptosis;reactive oxygen species;flow cytometry;neurotoxicity;mitochondrial membrane potential
中图分类号:R614.1
文献标志码:A
DOI:10.11958/58574
作者单位:湛江市,广东医学院附属医院(邮编524001)
作者简介:陈根殷(1973),女,主任医师,主要从事麻醉药物基础研究
通讯作者E-mail:marvin009@126.com
