超表达GLDH拟南芥植株对高光胁迫的响应
2016-07-13彭长连
李 媚, 周 娟, 彭长连
(华南师范大学生命科学学院,广州 510631)
超表达GLDH拟南芥植株对高光胁迫的响应
李媚, 周娟, 彭长连*
(华南师范大学生命科学学院,广州 510631)
摘要:研究在短时间高光胁迫下2种基因型拟南芥植株(GLDH基因超表达植株gldh236OE和哥伦比亚野生型Col)的表型、叶绿素含量、叶绿素荧光等生理数据的变化.结果表明,超表达植株的抗坏血酸表达量显著高于野生型,高光对超表达植株叶片的伤害也小于对照野生型;野生型植株叶片叶绿素含量在高光处理前后并无明显变化,而超表达植株的叶绿素含量显著降低;PSII有效光化学效率Yield和光合电子传递速率ETR呈明显降低趋势,对照野生型的降低程度更明显,说明高光胁迫使PSII结构与功能受到一定程度的损伤与破坏,而抗坏血酸含量的增加能在一定程度上缓解高光胁迫所带来的伤害.
关键词:拟南芥; 抗坏血酸; 高光胁迫; 超表达GLDH
植物在高光胁迫下过剩的光能可能通过多种途径在叶绿体内产生有害的活性氧(ROS)[1],活性氧会导致氧化胁迫,使生物大分子、细胞膜可逆及不可逆损伤,严重时甚至引起细胞死亡[2-4],因此植物体内形成了不同的活性氧清除系统,其中抗坏血酸起着重要作用.
抗坏血酸是植物细胞中主要的抗氧化物质,它可以直接与单线态氧、超氧自由基、过氧化氢、羟自由基等活性氧反应[5].其次,抗坏血酸同时也是植物光合作用的光保护剂以及过量光能耗散机制的重要组成成分[6]:抗坏血酸作为在水水循环的一部分,有效地避免了PSII的过度还原和光损坏;抗坏血酸也可以作为紫黄质脱环氧化酶(VDE)的辅助因子参与叶黄素循环[7],而叶黄素循环在耗散过量光能以及防御光破坏中起重要作用.此外抗坏血酸还参与了一些衰老相关基因的转录调节[8],其含量的变化与植物衰老有着密切的联系.
植物抗坏血酸合成途径主要有:L-半乳糖途径[9]、半乳糖醛酸途径[10]、古洛糖途径[11]和肌醇途径[12].目前公认L-半乳糖途径是植物抗坏血酸合成的主要途径,而L-半乳糖-1,4-内酯脱氢酶( L-galactono-1,4-lactone dehydrogenase,简称GLDH)直接氧化L-半乳糖内酯生成抗坏血酸(ASC),是L-半乳糖途径中最后一步的关键酶[9,13-14].研究表明,GLDH与抗坏血酸含量以及植物衰老密切相关[15].通过反义RNA技术抑制烟草GLDH基因的表达使得转基因烟草的抗坏血酸含量降低25%左右,且细胞生长缓慢[16].相反,通过正义RNA技术增加GLDH基因的表达使得转基因烟草抗坏血酸含量增加1.5~2.0倍,细胞的生长加快,抗衰老能力增强[17].此外超表达水稻GLDH基因可提高水稻叶片抗坏血酸的含量,延缓水稻衰老,结实率增加;而干涉型水稻GLDH基因表达量下调,抗坏血酸含量减少,水稻衰老提前,结实率低[18].
本研究比较2种基因型植株在短时间高光处理前后表型、生理及其光合参数方面的变化差异,探讨拟南芥抗坏血酸合成关键酶基因(GLDH)超表达和抗坏血酸含量的增长与植物高光耐受性的关系,为抗坏血酸含量与植物衰老关系奠定理论基础.
1材料与方法
1.1植物材料
所用拟南芥(ArabidopsisthalianaL.)为哥伦比亚野生型(Col);gldh突变体株系gldh2306OE(经鉴定为GLDH基因超表达植株)图1.gldh突变体购于拟南芥突变体种子库(http://www.arabidopsis.org/).
取少量种子置于1.5 mL离心管,加入900 μL灭菌水后于4 ℃春化3 d,加入100 μL次氯酸钠消毒10 min,70%乙醇消毒1 min后在超净工作台上无菌水冲洗4~5次后间隔均匀铺于MS培养基上.10 d后即可移至营养土中生长,培养温度为18~22 ℃, 光暗周期为16 h光照/8 h黑暗, 光照强度为70~80 μmol/(m2·s).

图1 2种基因型拟南芥植株GLDH基因表达
1.2高光处理
将苗龄4周的拟南芥幼苗转移至光照强度为1 600 μmol/(m2·s)的高光下处理8 h,以相同处理下野生型拟南芥作为对照,该装置经过循环水带走绝大部分热量以避免高温胁迫.
1.3测试分析
1.3.1实时荧光定量PCR采用SYBR®PremixEX TapTMII(Tli RNaseH Plus)(Takara)试剂盒进行定量PCR,具体步骤参照试剂盒使用说明书.
1.3.2抗坏血酸含量的测定参考文献[19]的方法测定.
1.3.3叶绿素含量测定参照文献[20]的方法并做改动,将拟南芥成熟莲座叶剪碎后取鲜质量40~60 mg,加入10 mL 80%丙酮,黑暗环境浸提24 h,用紫外-可见光分光光度计于663、645 nm测定并计算叶绿素a和叶绿素b的含量.
1.3.4叶绿素荧光参数测定高光处理3 h后的植株叶片暗适应30 min后用叶绿素荧光仪进行测定,叶绿素荧光参数均由便携式荧光测定仪(PAM-2100,Germany)测定和计算得出.先测定初始荧光Fo和暗下最大荧光Fm.经光活化后,测定光下最大荧光Fm和稳态荧光Fs,光化光强度为70 μmol/(m2·s).最大光化学效率Fv/Fm,有效光化学效率Yield,电子流速率ETR和非光化学淬灭系数qN按SCHREIBER等[21]公式计算.
1.4数据分析
实验数据用Microsoft Excel 2010软件和SPSS 12.0软件进行处理.通过单因素方差分析(One Way ANOVA)检验不同处理间的差异显著性(P<0.05,差异显著).采用Sigma Plot 12.0软件作图.
2结果与分析
2.1高光对2种基因型植株表型和GLDH基因表达的影响
图2A为4周龄拟南芥植株在高光(1 600 μmol/(m2·s))胁迫处理8 h后的表型.高光处理前的GLDH基因超表达植株gldh236OE与野生型植株Col生成同等数量的莲座叶,表型无差异;将植株置于1 600 μmol/(m2·s)光强照射后,叶片逐渐卷曲,对照Col植株尤为明显,说明野生型叶片对高光更敏感.
图2B表明,高光处理前野生型和超表达GLDH植株的GLDH基因表达量无差异,相对表达量分别为1.155和1.163,在高光处理8 h后,野生型植株表达量显著下调(GLDH相对表达量为1.048),而超表达GLDH植株显著上调(GLDH相对表达量为1.29)(P<0.05).
2.2高光对2种基因型植株体内抗坏血酸含量的影响
将2种基因型植株置于1 600 μmol/(m2·s)光强8 h后,与处理前相比,野生型植株抗坏血酸含量减少了7.25%,而超表达植株增长了9.75% (图2C),显著高于野生型(P<0.05),表明抗坏血酸含量与GLDH基因的表达量呈正比.
2.3高光对2种基因型植株光和能力的影响
高光对2种基因型植株叶片叶绿素含量的影响不同:野生型植株叶片叶绿素含量在高光处理前后的差异没有统计学意义,而超表达植株叶片在高光处理后植株叶绿素a、叶绿素a+b、叶绿素a/b含量均显著降低(P<0.05)(表1).
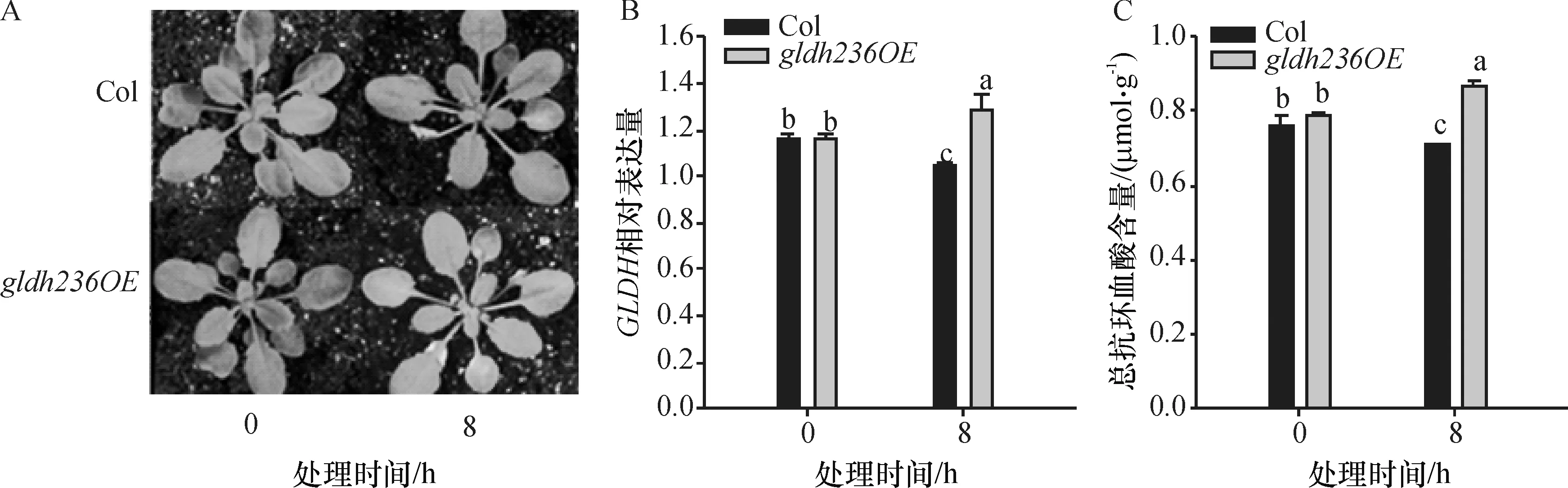
图2 高光对拟南芥野生型(Col)和超表达植株(gldh236OE)的表型(A)、GLDH基因表达量(B)、总抗坏血酸含量(C)的影响
Figure 2Effects of highlight on phenotype of wild-type (Col) and over-expression plant (gldh236OE) (A); theGLDHgene expression (B) and total ASC (C) inArabidopsis

表1 高光对拟南芥Col和gldh236OE植株叶片叶绿素含量的影响
注:不同字母表示差异具统计学意义(P<0.05)
植物受到高光胁迫后,叶片Fv/Fm、Yield、ETR、qN的变化趋势如图3所示.Fv/Fm反映了(在最适条件下经过暗适应后的)PSII的最大光化学量子产量,在正常生长条件下,Col植株叶片的Fv/Fm略高于gldh236OE,但差异并不明显(图3A),经过3 h的高光胁迫,Col和gldh236OE植株叶片的Fv/Fm分别降低了32.86%和30.98%,两者之间无明显差异.图3B为2种基因型植株叶片的PSII实际光化学量子产量(actual photo-chemical yield of PSII in the light, Yield),高光胁迫后,Col植株叶片的Yield降至处理前的50.28%,而gldh236OE则为65.64%,显著高于Col (P<0.05).Col和gldh236OE植株叶片的表观光合电子传输速率(photosynthetic electron transport rate, ETR)在高光处理前后的变化趋势与Yield相近(图3C).而高光处理3 h后的Col热耗散的非光化学猝灭系数(qN)明显上升(图3D),gldh236OE与Col趋势相近.
3讨论
在L-半乳糖途径中,定位在线粒体内膜外侧的GLDH以细胞色素c为次级底物直接氧化L-半乳糖-1,4-内酯生成L-抗坏血酸(ASC),是催化抗坏血酸生物合成最后一步的关键酶[9].有研究[15]表明GLDH对抗坏血酸的含量起着重要调节作用.在本试验中GLDH基因超表达植株在高光处理后叶片GLDH表达量显著增加,抗坏血酸的含量也显著增加;野生型植株叶片的GLDH表达量则明显下降,抗坏血酸的含量变化为相同的趋势(图1C),表明GLDH的表达量与抗坏血酸含量确实有着紧密联系.
植物进行光合作用时,叶绿体产生大量还原力,引起光合电子链的过度还原而产生ROS[22].抗坏血
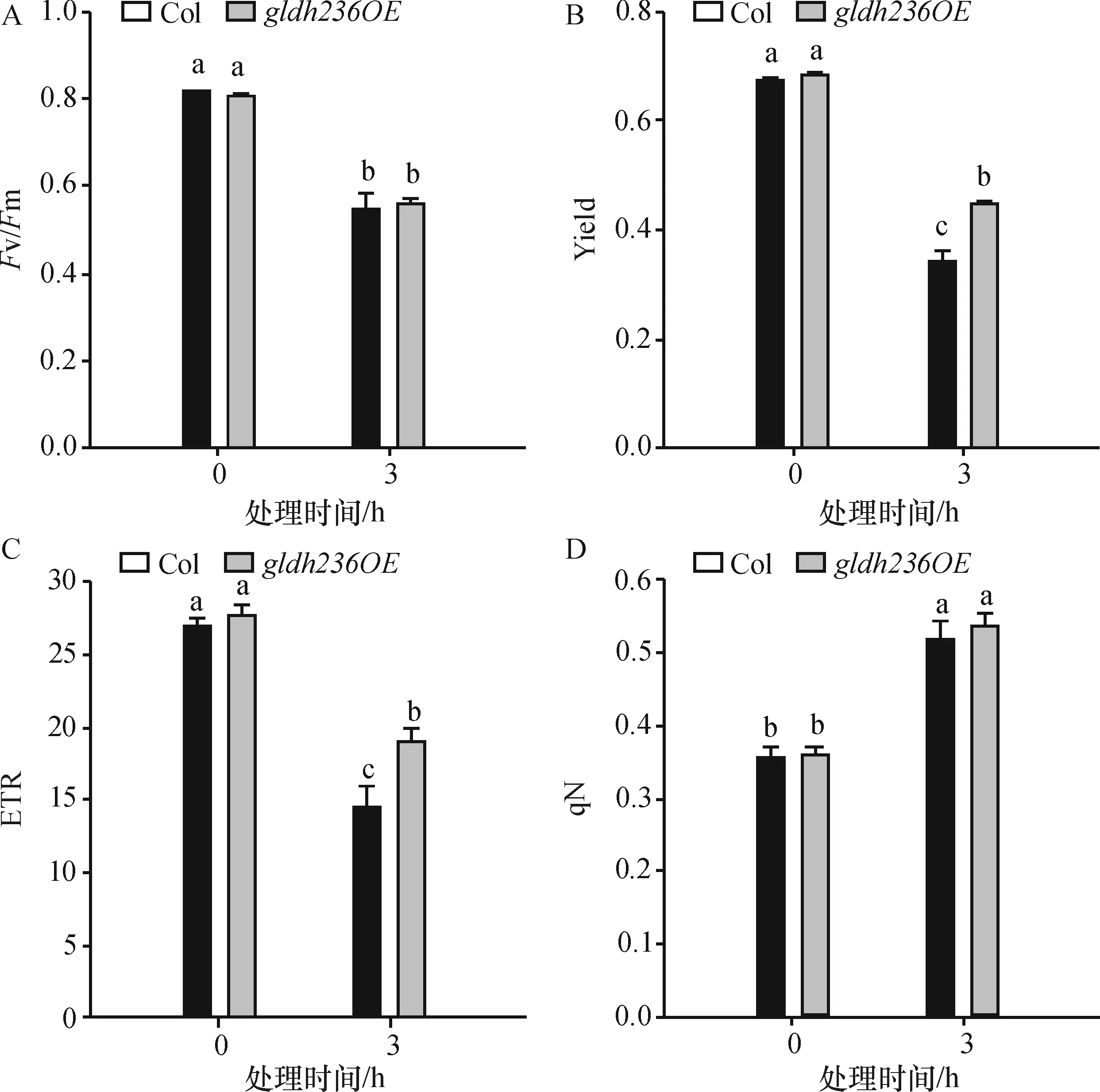
图3 高光对2种基因型植株叶片(Fv/Fm)(A),Yield(B),ETR(C) and qN(D)的影响
Figure 3Effects of highlight on chlorophyll fluorescence parameter of (Fv/Fm)(A), Yield of effective photochemical efficiency of PSII (B), ETR (C) and qN (D) in the leaves of twoArabidopsisphenotypes
酸是一种普遍存在于植物组织内的抗氧化物质,可以通过抗坏血酸-谷胱胱肽循环、水水循环、玉米黄质循环等途径清除活性氧,保护植物免于氧化伤害[7].结合拟南芥植株在高光下的表型变化(图1A),超表达植株的卷曲程度明显低于野生型,推测超表达GLDH引起抗坏血酸含量增加在一定程度上缓解植物所受到的氧化伤害,使植株叶片维持正常的表型.此外,超表达植株在高光胁迫后叶绿素a含量显著降低,而叶绿素b含量则变化不明显,导致叶绿素(a+b)含量以及叶绿素a/b比值也显著下降(表1),这可能是超表达植株适应高光的一种表现:通过降低能将光能转化为电能的叶绿素a的含量来减少由于光合电子链的过度还原所导致的活性氧的积累.
Fv/Fm值在非环境胁迫下波动小,受到胁迫时其值明显降低, 因此作为受胁迫程度的指标[23],本试验中高光处理前后拟南芥的Fv/Fm值差异显著,即PSII原初光能转化效率显著下降, 表明植物的光化学活性明显降低.同时,非光化学能量耗散增加,说明在高光强下植物能有效的调整和合理分配过量的能量,在一定程度上避免光抑制和光伤害[24-25].不过,植物叶片对强光的耗散能力也是有限的,当光合机构不能有效利用过多的激发能时,光抑制甚至光伤害也必然发生.经1 600 μmol/(m2·s)强光处理后20 min 暗适应恢复的植株,叶片PSII有效光化学效率(Yield)以及光合电子传递速率(ETR)显著低于处理前的结果,表明光合能力下降,光合电子传递受阻,植株正常的光合作用受到影响,而超表达植株的下降水平显著小于野生型,表明超表达植株叶片PSII对高光的耐受性较野生型强,因此高光胁迫下仍能维持较高的光合能力,推测植株内GLDH基因超表达使得抗坏血酸含量的增加能缓解一部分光伤害,进而减少了高光胁迫对光系统的伤害作用.
综上所述,GLDH超表达与抗坏血酸含量呈正比,超表达植株叶片抗坏血酸含量的增加能在一定程度上缓解高光伤害,使植物叶片维持正常的光合能力,适应高光的能力更强.
参考文献:
[1]ZOLLA L, RINALDUCCI S. Involvement of active oxygen species in degradation of light-harvesting proteins under light stresses[J]. Biochemistry, 2002, 41(48):14391-14402.
[2]GILL S S, TUTEJA N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiology and Biochemistry, 2010, 48(12): 914-922.
[3]刘国艳. 自由基的生物学效应及自由基清除系统的功能特性[J]. 上海交通大学学报(农业科学版), 2002, 20(s1): 93-96.
LIU G Y. The biological effects of free radicals and the characteristic of radical scavenging system[J]. Shanghai Jiao Tong University Journal(Agricultural Science), 2002,20(s1): 93-96.
[4]VASS I. Molecular mechanisms of photo-damage in the photo-system II complex[J]. Arabian Journal of Chemistry, 2012, 3(7): 212-213.
[5]NOCOTER G, FOYER C H. Ascorbate and glutathione: keeping active oxygen under control[J]. Plant Physiology, 1998, 49(1): 257-262.
[6]ALLEN J F. Photosynthesis of ATP-electrons, proton pumps, rotors, and poise[J]. Cell, 2002, 110(3): 273-276.
[7]GALLIE D R. The role of L-ascorbic acid recycling in responding to environmental stress and in promoting plant growth[J]. Journal of Experimental Botany, 2013, 64(2):433-443.
[8]NAVABPOUR S, MORISR K, ALLEN R, et al. Expression of senescence-enhanced genes in response to oxidative-stress[J]. Journal of Experimental Botany, 2003, 54(391):2285-2292.
[9]WHEELER G L, JONES M A, SMIRNOFF N. The biosynthetic pathway of vitamin C in higher plants[J]. Nature, 1998, 393(6683): 365-369.
[10]AGIUS F, GONZALEZ-LAMOTHE R, CABALLERO J, et al. Engineering increased vitamin C levels in plants by over-expression of a D-galacturonic acid reductase[J]. Nature Biotechnology, 2003, 21(2): 177-181.
[11]WOLUCKA B A, MONTAGU M V. GDP-mannose 3’,5’-epimerase forms GDP-L-gulose, a putative intermediate for thedenovobiosynthesis of vitamin C in plants[J]. Journal of Biological Chemistry, 2003, 278(48): 47483-47490.
[12]LORENCE A, CHEVONE B I, MENDES P, et al. Myo-inositol oxygenase offers a possible entry point into plant ascorbate biosynthesis[J]. Plant Physiology, 2004, 134(3): 1200-1205.
[13]SIENDONES E, GONZALEZ-REYES J A, SANTOS-OCANA C, et al. Biosynthesis of ascorbic acid in kidney bean. L-galactono-gamma-lactone dehydrogenase is an intrinsic protein located at the mitochondrial inner membrane [J]. Plant Physiology, 1999, 120(3): 907-912.
[14]BARTOLI C G, PASTORI G M, FOYER C H. Ascorbate biosynthesis in mitochondrial is linked to the electron transport chain between complexes III and IV[J]. Plant Physiology, 2000, 123(1): 335-343.
[15]TAMAOKI M, MUKAI F, ASAI N, et al. Light-controlled expression of a gene encoding L-galactono-gamma-lactone dehydrogenase which affects ascorbate pool size inArabidopsisthaliana[J]. Plant Science, 2003, 164(6): 1111-1117.
[17]TOKUNAGA T, MIYAHARA K, TABATA K, et al. Generation and properties of ascorbic acid-overproducing transgenic tobacco cells expressing sense RNA for L-galactono-1,4-lactone dehydrogenase[J]. Planta, 2005, 220(6): 854-863.
[18]LIU Y H, YU L, WANG R Z. Level of ascorbic acid in transgenic rice for l-galactono-1,4-lactone dehydrogenase overexpressing or suppressed is associated with plant growth and seed set[J]. Acta Physiologiae Plantarum, 2011, 33(4): 1353-1363.
[19]GILLESPIE K M, AINSWORTH E A. Measurement of reduced, oxidized and total ascorbate content in plants [J]. Nature Protocols, 2007,2(4): 871-874.
[20]林植芳,李双顺,林桂珠, 等. 水稻叶片的衰老与超氧物歧化酶活性及脂质过氧化作用的关系[J]. 植物学报, 1984, 26(6): 605-615.
LIN Z F, LI S S, LIN G Z, et al. Superoxide dismutase activity and lipid peroxidation in relation to senescence of rice leaves[J]. Plant Journal, 1984, 26(6): 605-615.
[21]SCHREIBER U, SCHLIWA U, BILGER W. Continuous recording of photochemical and non-photochemical quenching of chlorophyll fluorescence quenching with a new type of modulation fluorometer[J]. Photosynthesis Research, 1986, 10(12): 51-62.
[22]FOYER C H, NOCTOR G. Oxygen processing in photosynthesis: regulation and signalling[J]. New Phytologist, 2000, 146(3): 359-388.
[23]应叶青, 郭璟, 魏建芬, 等.水分胁迫下毛竹幼苗光合及叶绿素荧光特性的响应[J]. 北京林业大学学报, 2009, 31(6): 128-133.
YING Y Q, GUO J, WEI J F. Photosynthetic and chlorophyll fluorescent responses ofPhyllostachyspubescenceseedlings to water deficiency stress[J]. Journal of Beijing Forestry University, 2009, 31(6): 128-133.
[24]BAKER N R. Chlorophyll fluorescence: a probe of photosynthesis in vivo [J]. Plant Biology, 2008, 59(1): 89-113.
[25]GRAY G R, HOPE B J, QIN X Q, et al. The characterization of photoinhibition and recovery during cold acclimation inArabidopsisthalianausing chlorophyll fluorescence imaging[J]. Physiologia Plantarum, 2003, 119(3): 365-375.
【中文责编:成文英文责编:李海航】
Response to High-Light Stress in Over-Expression GLDH Arabidopsis Thaliana
LI Mei, ZHOU Juan, PENG Changlian*
(School of Life Science, South China Normal University, Guangzhou 510631, China)
Abstract:This study aims to test the highlight stress (1 600 μmol·m-2·s-1) on the echo-physiological characteristics of two gene-type plants(GLDHgene over-expression named asgldh236OEand the wild type). The results indicated that the content of total ascorbic acid in thegldh236OEwere increased, compared with the wild type (Col) plants, and the injury under highlight stress is more obvious in the wild type. The chlorophyll (Chl) content of wild type plants showed no difference before and after highlight stress while agldh236OEplant was reduced. Bothgldh236OEand wild type leaves showed a significant decrease in Yield and ETR values, however, the decrease rate for wild type was higher. This results indicated that highlight can impair the structure and function of PSII while the increase of ascorbic content can slow down the damage.
Key words:Arabidopsisthaliana; ascorbic acid; highlight stress; over-expressionGLDH
收稿日期:2015-03-31《华南师范大学学报(自然科学版)》网址:http://journal.scnu.edu.cn/n
基金项目:国家自然科学基金项目(31270287);广东省自然科学基金重点项目(2015A030311023)
*通讯作者:彭长连,研究员,Email: pengchl@scib.ac.cn.
中图分类号:Q945.3
文献标志码:A
文章编号:1000-5463(2016)01-0084-05
