阿比特龙在治疗前列腺癌方面的新进展
2016-07-10任桐林锦彬刁勇
任桐,林锦彬,刁勇Δ
(1.华侨大学 生物医学学院,福建 泉州 612021;2.厦门精艺兴业科技有限公司,福建 厦门 361004)
阿比特龙在治疗前列腺癌方面的新进展
任桐1,林锦彬2,刁勇1Δ
(1.华侨大学 生物医学学院,福建 泉州 612021;2.厦门精艺兴业科技有限公司,福建 厦门 361004)
雄性激素阻断疗法可用于治疗中晚期及转移型前列腺癌,但36个月后最终会发展为去势抵抗型前列腺癌(castration-resistant prostate cancer,CRPC)。细胞色素P450酶CYP17是雄激素合成的必需因子,因此可作为CRPC治疗的新靶点,Ⅲ期临床试验结果表明,阿比特龙联合强的松可平均延长去势难治性前列腺癌患者生存期3.9个月。通过研究发现前列腺素受体靶线轴多靶点同时治疗,临床效果显著可作为一种前列腺癌治疗的新方法。
阿比特龙;前列腺癌;CYP17
前列腺癌是欧美男性常见的恶性肿瘤,每年新增诊断人数约为240 000,是肿瘤男性死亡率第2的肿瘤,且转移性强,据统计2012年约28 000人死于该症[1]。虽然我国前列腺癌发病率远低于西方国家,但是随着生活方式的改变前列腺癌特异抗原(prostate cancer specific antigen,PSA)筛查的普及,我国前列腺癌的患病人数也呈直线型上升趋势,且其中大多数发展为晚期前列腺癌。其发展的主要机制为细胞内雄性激素受体受到雄性激素的持续刺激,目前对于前列腺癌的首选治疗方法为去势治疗(androgen-deprivation therapy,ADT),但研究显示初期显效后平均36个月后很大一部分患者发展为去势抵抗性前列腺癌(castration-resistant prostate cancer,CRPC),经过研究后发现患者在接受治疗后前列腺癌细胞内仍可继续合成少量雄性激素[2]。随后研究发现第一代雄激素受体拮抗剂酮康唑可调控雄性激素轴,但治疗效果短暂,并且酮康唑对于抑制雄性激素合成的耐受性很差。多项研究表明,在血清睾酮达到去势水平(<50 ng/dL),前列腺癌细胞内的雄激素受体(androgen receptor,AR)信号轴依然能够保持活性并对其增殖具有重要影响作用[3-4]。临床研究证实,ADT治疗后血清前列腺癌特异抗原(prostate cancer specific antigen,PSA)的增加可被二线激素治疗药物所降低,且AR通路活性与睾酮循环水平无关。
AR信号轴对于性腺外源的前列腺素剩余水平高度敏感,盐酸阿比特龙是一种口服的CYP17抑制剂[5-6],此发现对于前列腺患者类固醇激素合成信号通路的理解至关重要,且对去势抵抗性前列腺癌的治疗也开拓了新的领域,本文就阿比特龙对于前列腺癌的治疗机制和研究进展进行综述,以期对临床治疗提供理论依据。
1 雄性激素合成相关信号通路
胆固醇是所有类固醇激素的合成前体[7],包括雄性激素,前列腺素合成需要2个细胞色素P450酶(CYP11和CYP1)和2种类胆固醇脱氢酶[3β-羟基类固醇脱氢酶(3β-hydroxysteroid dehydrogenase,3β-HSD)和17β-羟基类固醇脱氢酶(17β- hydroxysteroid dehydrogenase,17β-HSD)][8],类固醇组织中CYP11、CYP17和3β-HSD的表达收转录因子类固醇生成因子1(steroidogenic factor-1,SF-1)和核受体亚家族5A组成员1(nuclear receptor subfamily 5, group A, member 1,NR5A1)的调节[9]。SF-1活性在人类生殖细胞繁殖突变或小鼠通过基因操纵导致的性腺和肾上腺素衰竭时受到抑制[10]。肾上腺皮质内促肾上腺皮质激素可通过腺苷酸活化蛋白激酶(adenosine 5’-monophosphate-activated protein kinase,AMPK)信号通路激活SF-1[11]。
雄烯二酮,脱氢表雄酮(dehydroepiandrosterone,DHEA)和DHEA硫酸盐是人体肾上腺雄激素合成信号通路的重要产物,同时也是去势治疗后前列腺患者体内剩余雄激素受体的刺激源头[12-13]。而将这些雄激素转化为睾酮需要17β-HSD蛋白酶家族的参与,而此酶在前列腺组织及其癌细胞内的调节受到HSD17B5(也称AKR1C3)的影响[14-15]。
阿比特龙为口服型CYP11和CYP17抑制剂,抑制胆固醇转化为DHEA以减少雄烯二醇和睾酮的产生[16],使其不能还原为DHT,不能作用于雄激素受体,对前列腺癌细胞起到抑制的作用。具体通路参见图1。
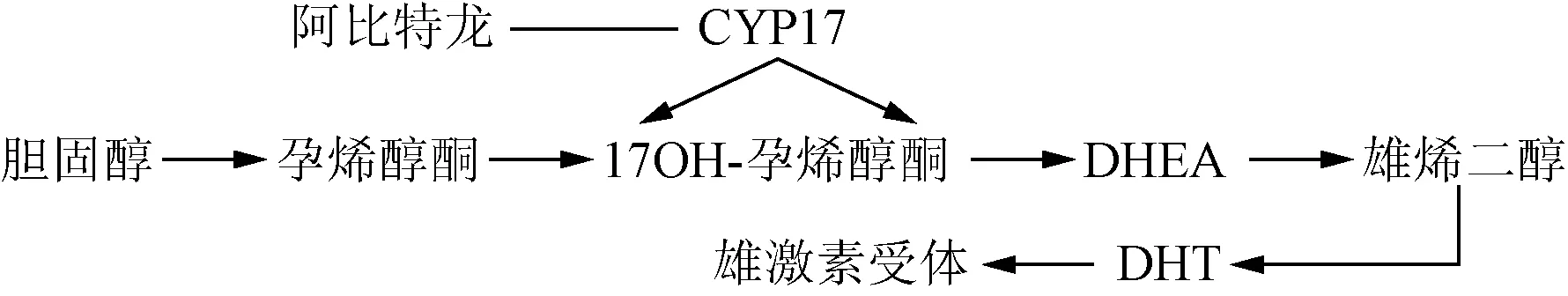
图1 阿比特龙作用通路Fig.1 Action pathway of abiraterone
2 去势抵抗性前列腺癌
去势治疗后的前列腺癌主要分为雄激素非依赖性前列腺癌(androgen independent prostate cancer,AIPC)、激素抵抗型前列腺癌(hormone resistant prostate cancer,HRPC)和去势抵抗型前列腺癌(castration-resistant prostate cancer,CRPC),依据欧洲泌尿协会的诊断指南:血清睾酮浓度达到去势水平(<50 ng/dL);2周内连续3次PSA升高,且2次较PSA最低值升高50%;抗雄激素撤退后治疗无效;内分泌治疗依然出现PSA升高或发生骨、其他脏器转移。对于去势抵抗性前列腺癌的发生和发展机制的研究较多,但是其机制核心始终是雄性激素受体,因此雄性激素受体的抑制一直是去势治疗后前列腺癌治疗的重要靶点。
首先去势治疗后失效的主要原因在于,除睾丸外其他器官和组织也具有合成前列腺素的功能,例如肾上腺、肾周围脂肪、前列腺癌细胞本身等。其次,ADT治疗主要导致前列腺癌细胞的生长停滞,对于细胞凋亡只是在初始阶段产生轻微的影响,但是体内的前列腺癌细胞完全可以适应体内循环睾酮的去势水平从而重新生长繁殖。此外,体外研究表明ADT治疗后重新生长的癌细胞干细胞标志物的表达增强且迅速寄居于肿瘤内并在AR轴内发生适应性的改变[17]。人类雄性激素受体是由X染色体上Xq11-12进行编码的,在没有受到刺激时存在于细胞质中,在接受刺激后与配体进行结合转运到细胞核中与雄激素反应元件捆绑,随即活化T细胞核因子3复原,并调节核心转录复合物[18]。在去势治疗后这些活化T细胞核因子可以进行翻译后修饰并且间接影响其他信号通路,例如蛋白激酶B(protein kinase B,PKB/Akt)、胰岛素样生长因子1(insulin-like growth factor-1,IGF-1)、白介素6(interleukin- 6,IL-6)、白介素12(interleukin- 12,IL-12)等,进一步放大了AR信号[19],对于CRPC组织AKT等信号可抑制基质细胞产生的促凋亡信号,在持续的AR信号刺激下PSA的表达不断升高,导致癌细胞在去势环境下继续生存[20]。此外,AR mRNA和蛋白质的过表达是由AR基因的扩增引起,这也进一步增加了前列腺癌细胞在去势环境下的敏感性。同样,敏感性的提高与AR配体结合域突变密切相关,这些突变使得AR的特异性识别降低,即可与其他甾体激素结合而活化[21]。上述机制中,对于AR过表达和获得性功能突变以及共激活物/共阻遏物比例变化的治疗可选用第一代抗雄激素激动剂、拮抗剂转换治疗的方法,又称为“抗雄激素撤退”疗法。临床研究表明20%~25%的CRPC患者经过治疗后血清PSA水平下降[22]。
研究显示,促性腺激素释放激素激动剂的治疗可以抑制90%以上的循环睾酮和DHT,但是前列腺内的睾酮和DHT浓度只降低了60%~80%[23]。所以抑制雄性激素性腺外来源很重要。促性腺激素释放激素激动剂虽然能够有效抑制循环睾酮达到去势水平,但是肾上腺中雄激素前体细胞依然存在,这样在ADT治疗后血清中雄烯二酮、DHEA的水平只是被轻度抑制,残留的前体细胞在肿瘤内转化成睾酮和DHT[24]。此外,在伴随其他器官转移的CRPC患者的转移器官内睾酮水平比原发性前列腺组织高4倍之多,足以刺激AR依赖基因的表达。所以,在去势环境下前列腺癌细胞可以作出一系列适应性反应,很多研究显示此种适应性反应可通过上调一些转换酶的表达(例如SRD5a1、AKR1C3、CYP17A1等)增加肾上腺皮质前体合成睾酮和DHT[25-27]。
目前,对于睾酮从头合成途径的概念还不是很清晰,一方面研究显示,经过去势治疗前列腺癌细胞内CYP17表达的上调,即前列腺癌细胞可以在细胞内部推动胆固醇转化为睾酮的整个过程的关键酶变化[28]。另一方面研究显示,前列腺癌细胞内的CYP17并不足以完成自身合成睾酮的全过程,必须依赖于肾上腺前体细胞[29]。但是无论如何,有一种观点是一致的,即CYP17表达或过表达的异常都将导致新的癌细胞生成并完成由胆固醇合成雄性激素的过程,这对于前列腺癌的治疗有着重大的意义。总之前列腺癌细胞的生长离不开雄性激素的支持,二线激素治疗药物联合酮康唑或阿比特龙是推向临床的新方法,且具有一定的治疗效果,也是对上述理论的进一步支持。同时,由于CRPC患者具有更高的雄激素基线水平,所以对于二线激素治疗有更高的敏感性,在治疗同时监测循环雄激素水平对于诊治也具有一定的指导意义。
3 阿比特龙的药理作用
酮康唑对雄激素合成信号通路中的几种酶类具有抑制作用,但是其抑制活性为非选择性抑制且活性较弱、耐受性差[30]。盐酸阿比特龙,可在体内转化为阿比特龙,抑制17 α-羟化酶/C17,20-裂解酶(CYP17),从而抑制雄激素的生物合成,在小鼠的药代动力学模型中其对于CYP17的抑制性远远超过酮康唑[31]。I期临床实验表明[31],盐酸阿比特龙在去势环境下不仅可以很好地抑制睾酮水平而且具有很好的耐受性,也没有出现像酮康唑一样的毒性反应。开放、单中心、剂量递增的临床试验表明持续阿比特龙治疗使50%~57%的患者血清PSA有所降低,且Ⅱ期临床推荐治疗剂量为1000 mg/d,在此剂量下可同时抑制糖皮质激素和雄激素的合成[32]。在糖皮质激素缺乏的情况下,盐酸阿比特龙可引发血清生上腺皮质激素释放激素的代偿性升高并可增加胆固醇向孕烯醇酮和孕酮转化的转化率(不需要CYP17的参与),后者可以作为AR受体激动剂,也可以转化为3α5α17羟基醇酮,最终通过门控通道转化为DHT[33]。此外由于盐皮质激素是由黄体酮合成,在CYP17受抑制的情况下其产物是无生物活性的。因此在缺乏皮质类固醇替代疗法的基础上应用阿比特龙会促进黄体酮的积累,从而推动盐皮质激素的过度增加和水肿、高血压、体液潴留等并发症的发生[34]。临床推荐应用小剂量的皮质类固醇激素与阿比特龙配伍使用,从而抑制孕烯醇酮、黄体酮和盐皮质激素的积累。抑制盐皮质激素副作用也能更好地发挥其抗癌效果[35]。II期临床表明,醋酸阿比特龙联合强的松可对58例多稀紫杉醇化疗治疗和复发的转移性CRPC患者进行治疗,其中36%的患者血清PSA降低50%以上,对比酮康唑具有更好的治疗效果[36]。
De Bono等[37]进行的Ⅲ期多中心临床试验对上述结果进行验证,试验对象为多稀紫杉醇化疗后CPRC,治疗药物为强的松联合阿比特龙对比强的松联合安慰剂。结果发现应用强的松联合阿比特龙组的患者生存期中位数为14.8个月,而对照组的生存期中位数为10.9个月,减少了35%的死亡风险,且具有明显的PSA降低和影像学的改变,此项研究于2011年4月获得了FDA对于阿比特龙用于难治性CPRC的批准。
4 阿比特龙的临床效果
阿比特龙只批准应用于多稀紫杉醇化疗难治性CPRC的治疗,然而更好地了解其活性机制和耐受性不良反应对于阿比特龙更广泛的应用于临床至关重要。Ryan等[38]在COUAA-302研究中期分析数据显示,此次研究将醋酸阿比特龙联合强的松对1088例转移性未接受过化疗治疗的CPRC患者进行治疗,主要观察指标为总生存率和影像学指标,实验证实在平均8个月的时间里,相对于对造组阿比特龙联合强的松减缓了癌症的扩散速度,将化疗时间由16.8个月推迟到25.2个月,减少了患者对止痛药物的需求,提高了生存率,改善了生活质量。2012年12月FDA批准其应用于所有转移性CPRC患者的治疗。
综上所述,单一的促肾上腺激素释放激素激动剂治疗对于促进前列腺癌细胞的细胞凋亡作用是不够的,因此需要阿比特龙在组合疗法中起到辅助治疗的作用,一项研究对58例局部高危前列腺癌患者在行根治性前列腺切除术前进行临床试验,观察组单独应用亮丙瑞林,实验组在前12周服用阿比特龙后12周亮丙瑞林联合阿比特龙,观察组34%的患者行根治性前列腺切除术,而对照组只有15%的患者行根治性前列腺切除术[39]。另一项研究表明促性腺激素释放激素类似物联合阿比特龙对比单独应用促性腺激素释放激素激动剂,病理显示细胞凋亡比例更高(24% vs 8%)且肿瘤有缩小迹象[40]。另外还有很多临床的案例也在研究阿比特龙诱导前列腺癌细胞凋亡的临床意义和如何提高其长期治疗的疗效。2014年,北京医院泌尿外科对3例未化疗的伴游骨转移的CPRC患者进行了醋酸阿比特龙联合泼尼松治疗,结果显示,2例患者应用药物后,PSA水平出现较大程度下降,随访期间维持疾病无进展,1例患者出现疾病进展[41]。
5 阿比特龙的不良反应
与酮康唑相比,阿比特龙的耐药性良好,但是在Ⅲ期临床中也出现了的相关不良反应,其主要不良反应为继发性盐皮质激素过多、体液潴留、水肿、高血压、低血钾等,其中水钠潴留、低血钾和高血压是由于醋酸阿比特龙抑制 CYP17 导致 ACTH 和盐皮质激素分泌过多而引起,所以提示小剂量糖皮质激素应并行管理[42]。醋酸阿比特龙可以引起肝转氨酶升高。当出现肝毒性的症状或体征时,需测定血清转氨酶,特别是血清丙氨酸氨基转移酶水平,中断醋酸阿比特龙的治疗,密切监测肝功能。如果发生重度肝毒性,应立即停用[43]。
综上所述,醋酸阿比特龙不仅为多稀紫杉醇失败的CRPC提供了一个有效的治疗手段,更重要的是揭示了雄激素信号通路在CRPC的进展中仍然发挥着重要作用的这一事实,为进一步开发治疗CRPC的新药提供了临床基础和理论依据。
[1] Siegel R, Naishadham D, Jemal A.Cancer statistics, 2012[J].CA Cancer J Clin, 2012, 62(1):10-29.
[2]Aneja S,Pratiwadi RR,Yu JB.Hypofractionated radiation ther-apy for prostate cancer: risks and potential benefits in a fiscallyconservative health care system[J].Oncology (Williston Park), 2012,26(6) :512-518.
[3]Chen Y, Clegg NJ, Scher HI.Anti-androgens and androgen-depleting therapies in prostate cancer: new agents for an established target[J].Lancet Oncol, 2009,10(10):981-991.
[4]Attard G, Reid AH, A’Hern R, et al.Selective inhibition of CYP17 with abiraterone acetate is highly active in the treatment of castrationresistant prostate cancer[J].J Clin Oncol, 2009, 27(23): 3742-3748.
[5]de Bono JS, Oudard S, Ozguroglu M, et al.Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer progressing after docetaxel treatment: a randomised open-label trial[J].Lancet,2010,376(9747):1147-1154.
[6]祁宝辉.醋酸阿比特龙酯[J].中国药物化学杂志, 2011, 21(5): 407-407.
[7]De Bono JS, Logothetis CJ, Molina A, et al.Abiraterone and increased survival in metastatic prostate cancer[J].N Engl J Med, 2011,364(21): 1995-2005.
[8]Scott HM, Mason JI, Sharpe RM.Steroidogenesis in the fetal testis and its susceptibility to disruption by exogenous compounds[J].Endocr Rev,2009,30(7):883-925.
[9]Luu-The V,Bélanger A, Labrie F.Androgen biosynthetic pathways in the human prostate[J].Best Pract Res Clin Endocrinol Metab,2008,22(2):207-221.
[10]Hoivik EA, Lewis AE, Aumo L, et al.Molecular aspects of steroidogenic factor 1 (SF-1)[J].Mol Cell Endocrinol,2010,315(1-2):27-39.
[11]Lin L, Achermann JC.Steroidogenic factor-1 (SF-1, Ad4BP, NR5A1) and disorders of testis development[J].Sex Dev,2008,2(4-5):200-209.
[12]Schimmer BP, White PC.Minireview: steroidogenic factor 1: its roles in differentiation, development, and disease[J].Mol Endocrinol,2010,24(7):1322-1337.
[13]Attard G, Reid AHM, Yap TA, et al.Phase I clinical trial of a selective inhibitor of CYP17, abiraterone acetate, confirms that castration-resistant prostate cancer commonly remains hormone driven[J].J Clin Oncol, 2008, 26(28): 4563-4571.
[14]Pfeiffer MJ, Smit FP, Sedelaar JP, et al.Steroidogenic enzymes and stem cell markers are upregulated during androgen deprivation in prostate cancer[J].Mol Med,2011,17(7-8):657-664.
[15]Fizazi K, Scher HI, Molina A, et al.Abiraterone acetate for treatment of metastatic castration-resistant prostate cancer: final overall survival analysis of the COU-AA-301 randomised, double-blind, placebo-controlled phase 3 study[J].Lancet Oncol,2012,13(10): 983-992.
[16]Danila DC, Morris MJ, de Bono JS, et al.Phase II multicenter study of abiraterone acetate plus prednisone therapy in patients with docetaxel-treated castration-resistant prostate cancer[J].J Clin Oncol, 2010, 28(9): 1496-1501.
[17]Liu YB, Karaca M, Zhang Z, et al.Dasatinib inhibits site-specific tyrosine phosphorylation of androgen receptor by Ack1 and Src kinases[J].Oncogene, 2010, 29(22):3208-3216.
[18]O’Malley BW, Kumar R.Nuclear receptor coregulators in cancer biology[J].Cancer Res,2009, 69(21):8217-8222.
[19]Hu R, Dunn TA, Wei S, et al.Ligand independent androgen receptor variants derived from splicing of cryptic exons signify hormonerefractory prostate cancer[J].Cancer Res,2009,69(1):16- 22.
[20]Harada N, Inoue K, Yamaji R,et al.Androgen deprivation causes truncation of the C-terminal region of androgen receptor in human prostate cancer LNCaP cells[J].Cancer Sci, 2012, 103(6):1022-1027.
[21]Liu C, Armstrong C, Zhu Y, et al.Niclosamide enhances abiraterone treatment via inhibition of androgen receptor variants in castration resistant prostate cancer[J].Oncotarget,2016 .DOI: 10.18632/oncotarget.8493.
[22]Cella D, Li S, Li T, et al.Repeated measures analysis of patient-reported outcomes in prostate cancer after abiraterone acetate[J].J Community Support Oncol, 2016, 14(4): 148.
[23]Mitsiades N, Chen Y, Scher HI.The AR axis as a pathogenetic mechanism and therapeutic target throughout the clinical states of prostate cancer: opportunities for second-line hormonal manipulations in castration-resistant prostate cancer[J].In: Scardino PT, Linehan WM, Zelefsky MJ, Vogelzang NJ.Comprehensive Textbook of Genitourinary Oncology, 4th ed.Baltimore: Lippincott Williams &Wilkins,2011:262-273.
[24]Capper CP, Larios JM, Sikora MJ, et al.The CYP17A1 inhibitor abiraterone exhibits estrogen receptor agonist activity in breast cancer[J].Breast Cancer Res Treat, 2016,157(1): 23-30.
[25]Ryan CJ, Smith MR, Fizazi K, et al.Abiraterone acetate plus prednisone versus placebo plus prednisone in chemotherapy-naive men with metastatic castration-resistant prostate cancer (COU-AA-302): final overall survival analysis of a randomised, double-blind, placebo-controlled phase 3 study[J].The Lancet Oncology, 2015, 16(2): 152-160.
[26]Montgomery RB, Mostaghel EA, Vessella R, et al.Maintenance of intratumoral androgens in metastatic prostate cancer: a mechanism for castration-resistant tumor growth[J].Cancer Res, 2008, 68(11):4447-4454.
[27]Chen EJ, Sowalsky AG, Gao S, et al.Abiraterone treatment in castration-resistant prostate cancer selects for progesterone responsive mutant androgen receptors[J].Clin Cancer Res, 2015, 21(6): 1273-1280.
[28]Hofland J, van Weerden WM, Dits NF, et al.Evidence of limited contributions for intratumoral steroidogenesis in prostate cancer[J].Cancer Res, 2010, 70(3):1256-1264.
[29]Pelletier G.Expression of steroidogenic enzymes and sex-steroid receptors in human prostate[J].Best Pract Res Clin Endocrinol Metab, 2008, 22(2):223-228.
[30]O’Donnell A,Judson I,Dowsett M,et al.Hormonal impact of the 17-hydroxylase/C17,20-lyase inhibitor abiraterone acetate (CB7630) in patients with prostate cancer[J].Br J Cancer,90(12):2317-2325.
[31]Attard G, Reid AH, Yap TA, et al.Phase I clinical trial of a selective inhibitor of CYP17, abiraterone acetate, confirms that castrationresistant prostate cancer commonly remains hormone driven[J].J Clin Oncol, 2008, 26(28):4563-4571.
[32]Attard G, Reid AH, Auchus RJ, et al.Clinical and biochemical consequences of CYP17A1 inhibition with abiraterone given with and without exogenous glucocorticoids in castrate men with advanced prostate cancer[J].J Clin Endocrinol Metab, 2012, 97(2):507-516.
[33]Azad AA, Eigl BJ, Murray RN, et al.Efficacy of enzalutamide following abiraterone acetate in chemotherapy-naive metastatic castration-resistant prostate cancer patients[J].European urology, 2015, 67(1): 23-29.
[34]Loriot Y, Bianchini D, Ileana E, et al.Antitumour activity of abiraterone acetate against metastatic castration-resistant prostate cancer progressing after docetaxel and enzalutamide (MDV3100)[J].Ann Oncol, 2013, 24(7):1807-1812.
[35]Danila DC, Morris MJ, de Bono JS, et al.Phase II multicenter study of abiraterone acetate plus prednisone therapy in patients with docetaxeltreated castration-resistant prostate cancer[J].J Clin Oncol, 2010, 28(28):1496-1501.
[36]Ryan CJ, Smith MR, Fong L, et al.Phase I clinical trial of the CYP17 inhibitor abiraterone acetate demonstrating clinical activity in patients with castration-resistant prostate cancer who received priorketoconazole therapy[J].J Clin Oncol, 2010, 28(9):1481-1488.
[37]de Bono JS, Logothetis CJ, Molina A, et al.Abiraterone and increased survival in metastatic prostate cancer[J].N Engl J Med, 2011,364(21):1995-2005 .
[38]Ryan CJ, Smith MR, de Bono JS, et al.Interim analysis (IA) results ofCOU-AA-302, a randomized, phase III study of abiraterone acetate (AA) in chemotherapy-naive patients (pts) with metastatic castrationresistant prostate cancer (mCRPC)[J].J Clin Oncol,2012,30(18):LBA4518.
[39]Richie JP, Montgomery RB, Logothetis CJ, et al.Effect of neoadjuvant abiraterone acetate (AA) plus leuprolide acetate (LHRHa) on PSA, pathological complete response (pCR), and near pCR in localized high-risk prostate cancer (LHRPC): Results of a randomized phase II study[J].J Urol,2013, 189(4):e272.
[40] Efstathiou E, Davis JW, Troncoso P, et al.Cytoreduction and androgen signaling modulation by abiraterone acetate (AA) plus leuprolide acetate (LHRHa) versus LHRHa in localized high-risk prostate cancer (PCa): preliminary results of a randomized preoperative study[J].J Clin Oncol,2012,30(15):4556.
[41]马宏, 朱刚, 万奔, 等.醋酸阿比特龙治疗 3 例未化疗有骨转移去势抵抗性前列腺癌[J].北京大学学报 (医学版), 2014, 46(4): 653-656.
[42]Petrylak DP, Gandhi JG, Clark WR, et al.Phase I results from a phase I/II study of orteronel, an oral, investigational, nonsteroidal 17,20-lyase inhibitor, with docetaxel and prednisone (DP) in metastatic castrationresistant prostate cancer (mCRPC)[J].J Clin Oncol.2012,30(15):4656.
[43]Dreicer R, Agus DB, Bellmunt J, et al.A phase III, randomized, doubleblind, multicenter trial comparing the investigational agent orteronel (TAK-700) plus prednisone (P) with placebo plus P in patients with metastatic castration-resistant prostate cancer (mCRPC) that has progressed during or following docetaxel-based therapy[J].J Clin Oncol,2012,30(15):TPS4693.
(编校:王俨俨)
Clinical progress of abiraterone in the treatment of metastatic prostatic cancer
REN Tong1, LIN Jin-bin2, DIAO Yong1Δ
(1.School of Biomedical Sciences, Hua Qiao University, Quanzhou 612021, China; 2.Jingyixingye Science and Technology Co., LTD.,Xiamen 361004, China)
Although androgen deprivation therapy can be used in the treatment of advanced and metastatic prostate cancer, but after an average of 36 months, it will develop into castration resistant prostate cancer(CRPC).The cytochrome P450 enzyme CYP17 is an essential step in androgen synthesis, so it could be a new critical therapeutic target in CRPC.In a phase III multicenter study, abiraterone in combination with prednisone improved median overall survival of men with CRPC by 3.9 months.The study found that prostaglandin receptor target spool multiple targets for treatment at the same time, whose clinical effect is obvious and could be used as a new method for treatment of prostate cancer.
testis; abiraterone; prostate cancer; CYP17
10.3969/j.issn.1005-1678.2016.07.61
任桐,女,硕士,研究方向:抗肿瘤药物,E-mail:740312053@qq.com;刁勇,通信作者,男,博士,教授,研究方向:抗肿瘤药物,E-mail:diaoyong@hqu.edu.cn。
R697+.3
A
