β-catenin在胃癌中的表达及其机制
2016-07-10王海波刘延军陈树伟武文龙李凤臣
王海波,刘延军,陈树伟,武文龙,李凤臣
(解放军第107医院 胃肠外科,山东 烟台 264002)
β-catenin在胃癌中的表达及其机制
王海波Δ,刘延军,陈树伟,武文龙,李凤臣
(解放军第107医院 胃肠外科,山东 烟台 264002)
目的 探讨Wnt信号通路中心调控分子β-catenin在胃癌中的表达及其在胃癌发病中的作用机制。方法 利用shRNA病毒沉默BGC-823胃癌细胞株中的β-catenin的表达,利用空载病毒感染细胞株作为对照组,实时荧光定量PCR及Western blot检测病毒沉默效果,将转染后的细胞株注入裸鼠颈部构建裸鼠胃癌模型,每周检测2组裸鼠皮下肿瘤生长情况并测量记录皮下瘤块直径。成瘤裸鼠模型饲养8w后分离完整皮下瘤块,统计瘤块数量及瘤块重量。Western blot检测2组裸鼠皮下瘤块中Wnt信号通路相关分子DKK1、c-myc、CyclinD1的表达变化。结果 β-catenin沉默后的BGC-823胃癌细胞株注射裸鼠,其皮下瘤块的数量、直径以及重量均较对照空载病毒转染的BGC-823胃癌细胞株注射的裸鼠少,差异具有统计学意义(P<0.05),且β-catenin沉默组裸鼠,其瘤块中DKK1、c-myc、CyclinD1的表达水平较对照组裸鼠显著降低(P<0.05)。 结论 β-catenin通过上调DKK1、c-myc、CyclinD1的表达促进胃癌细胞的增殖,因此β-catenin在胃癌发生发展过程中具有重要作用,其可能作为评估胃癌预后的诊断指标。
β-catenin;胃癌;Wnt信号通路;BGC-823胃癌细胞株
胃癌是全球高发的恶性肿瘤之一,尤其是在广大的农村地区,由于饮食卫生等因素的影响,胃癌全球每年新发病例已增至150万[1- 2]。虽然流行病学调查显示胃癌的发病和感染幽门螺杆菌[3-4]、霉菌毒素[5]和亚硝酸盐的摄入量、吸烟等因素有关[6-8],但由于胃癌的病因较复杂,因此目前胃癌的发病机制尚不明确。同时由于胃癌早期无明显症状,周围血液供应以及淋巴分布丰富,导致胃癌较容易发生转移,这些综合导致其预后差,病死率高[9]。因此,探究胃癌的发病机制以及转移复发机制,寻找预防和治疗的有效途径,是胃癌研究的重点[9-10]。Wnt信号通路下游核心分子β-catenin在众多肿瘤的发病以及癌细胞的增殖侵袭转移中具有一定的促进作用[11],如结直肠癌[12],乳腺癌以及肝癌[13],因此Wnt信号通路下游核心分子β-catenin成为许多肿瘤化疗药物的靶位点[14-15]。但是对于β-catenin在胃癌中的作用目前尚不可知,本研究旨在探究β-catenin在胃癌中的表达及其作用机制。
1 材料与方法
1.1 材料 DMEM培养基和TRIzol购自Thermo公司;G418、青霉素、链霉素、Trypsin-EDTA购自上海煊翎有限公司;胎牛血清、DKK1抗体、c-myc抗体、CyclinD1抗体以及actin抗体购自上海银海圣生物科技有限公司;M-MLV逆转录试剂盒购自Invitrogen公司;实时荧光定量PCR荧光染料SYBR Green Supermix购自美国BIO-RAD公司;β-catenin、actin实时荧光定量PCR引物均由上海杰李公司合成,引物序列如下:β-catenin Forward:ACTTGCACTCCTGCTAGCATGCT;β-catenin Reverse:ACCCTGTGAACCTGTACTGACCT;actin Forward:ACTCACTGG-CAACCTGTACTGC;actin Reverse:TGACCTGTGAAATGTCTGT-GGAC。
β-catenin shRNA病毒购自Ambion公司,且经上海生工公司测序鉴定。BGC-823胃癌细胞株购自上海生命科学院细胞研究所。8周龄Balb/c雄性裸鼠12只(合格证号:沪动 20160382 284952)购买于南京模式动物医学中心。
1.2 方法 2014年1月~2015年1月在解放军第107医院中心实验室完成本研究。
1.2.1 BGC-823胃癌细胞株培养:BGC-823胃癌细胞株用DMEM培养基静置培养于37 ℃、含5%CO2的细胞培养箱中,DMEM培养基中添加有10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素。当细胞密度约70%时用Trypsin-EDTA消化2 mins左右以1:3比例传代。
1.2.2 沉默BGC-823胃癌细胞株中β-catenin的表达:纯化并测量β-catenin shRNA病毒浓度,计算病毒的使用量(加入的病毒量范围在 MOI=35),感染实验分为2组,一组是直接添加β-catenin shRNA病毒作为实验组,一组添加等滴度的对照病毒载体作为对照组,感染6h后换液。
1.2.3 检测病毒沉默效果及稳转株的筛选:转染24 h后,提取细胞总RNA和蛋白,分别进行实时荧光定量PCR及Western blot(灰度值采用Image J计算,n=3)检测β-catenin干扰情况。用含有筛选浓度G418(500 mg/L)的DMEM培养基培养感染后细胞约2 w,并利用稀释法挑选稳定低表达β-catenin的单克隆细胞株,将单克隆细胞株培养于含有300 mg/L G418的DMEM培养基中,扩增稳转株。
1.2.4 MTT法检测稳转株体外增殖能力:将2株稳转株接种于96孔板中,,每孔2×103个细胞,分别于细胞培养的12、24、48、72 h加20 μL用PBS配制5 mg/mL MTT溶液(上海煊翎有限公司,货号M0793),避光继续孵育4 h后每孔加入100 μL DMSO充分溶解结晶物,在酶联免疫检测仪(深圳雷杜, Multiskan MK3)570 nm处测量各孔的吸光值,计算细胞相对数量的变化。
1.2.5 裸鼠的饲养及裸鼠胃癌模型的构建:裸鼠饲养于SPF级层流室中,温度为28 ℃,相对湿度应保持在40%~60%,每小时需要通风换气约15次,每日维持10 h光照,12 h明暗周期。取扩增后的稳转株以及对照细胞株,将2珠细胞制作成108/mL的单细胞悬液,每只裸鼠1 mL皮下注射,每组6只,每周观察裸鼠皮下成瘤情况记录。
1.2.6 检测2组裸鼠皮下肿瘤生长情况并记录:使用游标卡尺(上海首丰精密仪器有限公司,型号573-10)每周检测2组裸鼠皮下肿瘤生长情况并测量记录皮下瘤块的直径,连续监测8 w,8 w后麻醉(4%水合氯醛,0.1 mL/20 g,腹腔注射)裸鼠,分离完整皮下瘤块,统计瘤块数量并使用精密天平(上海驰唐精密仪器,型号FA2204S)称量瘤块重量。将取下的皮下瘤块冻于-80 ℃,以备后续的检测。
1.2.7 Western blot检测2组裸鼠皮下瘤块中Wnt信号通路相关分子的表达:将取下的皮下瘤块用组织研磨机磨碎,提取瘤块总蛋白,然后BCA法测量蛋白浓度,蛋白样品电泳、转膜、封闭、一抗孵育、二抗孵育、胶片的压片检测、凝胶图象分析瘤块中DKK1、c-myc、CyclinD1的表达变化。
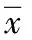
2 结果
2.1 BGC-823胃癌细胞株中β-catenin的沉默效果 为了鉴定siRNA慢病毒的沉默效果,利用Real-time PCR和Western blot分别检测BGC-823胃癌细胞株中β-catenin的表达,图1显示沉默组较对照组mRNA以及蛋白的表达量显著降低(P<0.05),这表明siRNA慢病毒沉默β-catenin表达效果显著。见图1。
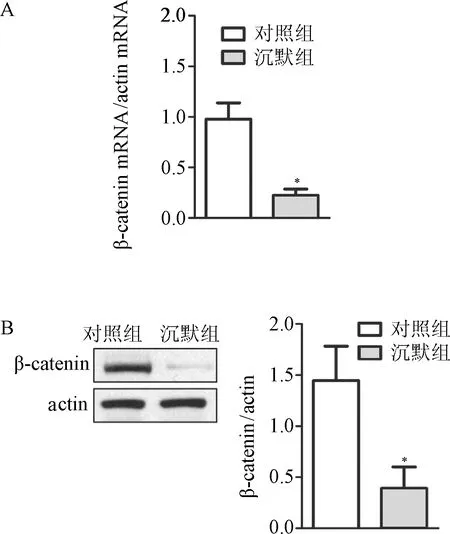
图1 BGC-823胃癌细胞株中β-catenin的沉默效果*P<0.05,与对照组相比Fig.1 The silence effect of β-catenino in BGC-823gastric *P<0.05,compared with control group
2.2 MTT法检测细胞存活率 为检测稳转株体外增殖能力,利用 MTT法探究2组稳转细胞株细胞存活率变化,发现在沉默60 h后2组的细胞存活率存在明显差异,在570 nm处对照组和沉默组的吸光度分别为(0.19±0.02) vs(0.09±0.03),差异具有统计学意义(P<0.05),这表明β-catenin可能参与细胞增殖的调控。见图2。
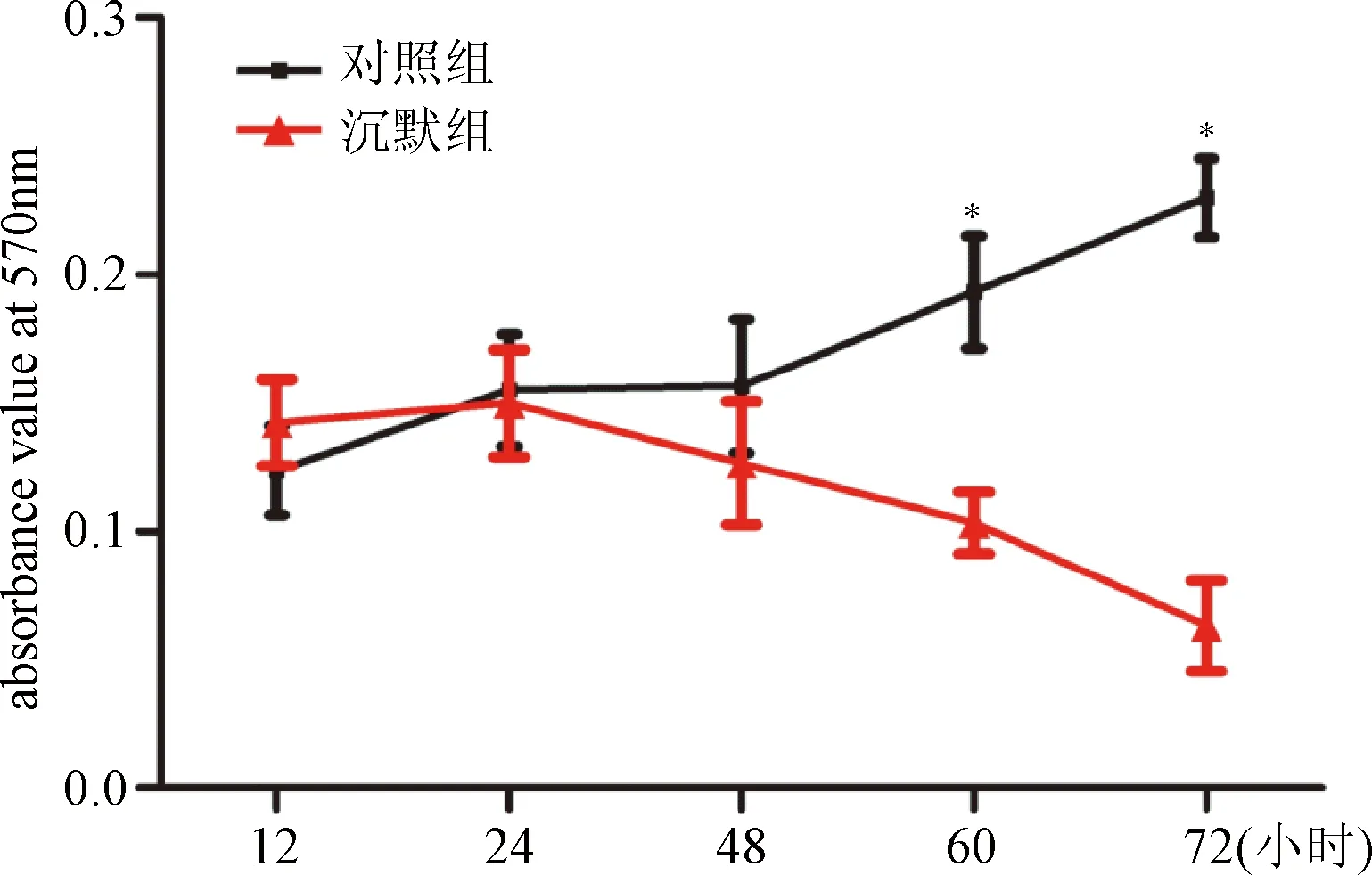
图2 2组稳转株细胞增殖能力检测±s)*P<0.05,与对照组相比Fig.2 The proliferation ability of the two stabilizing expression *P<0.05,compared with control group
2.3 裸鼠皮下肿瘤生长变化 裸鼠皮下肿瘤生长情况每周检测2组裸鼠皮下肿瘤生长情况,其中对照组小鼠即转染空载体病毒的BGC-823胃癌细胞株注射小鼠,4 w后其腋下成瘤率为100%(8/8),实验组小鼠即转染siRNA慢病毒的BGC-823胃癌细胞株注射小鼠,其成瘤率为25%(2/8),连续检测8 w并记录皮下瘤块的直径,如图3所示,对照组小鼠皮下肿瘤块直径大于沉默组小鼠肿瘤块直径,于荷瘤第6 w 2组间差异显著增加[(1.22±0.91)vs (0.67±0.07)cm],差异有统计学意义(P<0.05),这表明对照组小鼠肿瘤块的生长速度明显快于实验组小鼠,这提示β-catenin可能对胃癌肿瘤的生长具有一定的促进作用。

图3 裸鼠胃癌肿瘤模型皮下肿瘤体积±s)*P<0.05,与对照组相比Fig.3 The tumor volume of subcutaneous tumor in stomach tumor model of*P<0.05,compared with control group
2.4 2组裸鼠肿瘤模型瘤块的生长结果 计数每只小鼠取下的皮下瘤块并于微量电子秤中称量,记录并统计2组小鼠肿瘤块的数量和质量,结果发现对照组小鼠瘤块数(3.25±0.75)个/只,而沉默组小鼠瘤块数(0.76±0.34)个/只,差异有统计学意义(P<0.05)。对比2组瘤块的重量可发现,对照组小鼠瘤块重约(12.25±1.29) mg/只,而沉默组小鼠瘤重约(4.19±0.86)mg/只,差异有统计学意义(P<0.05),这进一步表明β-catenin对胃癌肿瘤的生长具有一定的促进作用。
2.5 Western blot检测2组裸鼠皮下瘤块中Wnt信号通路相关分子的表达将取下的皮下瘤块提取总蛋白,Western blot检测2组裸鼠皮下瘤块中Wnt信号通路相关分子DKK1、c-myc、CyclinD1的表达变化。如图4所示,β-catenin沉默后不仅胃癌瘤块数量和重量下降,瘤块直径较小,而且瘤块中DKK1、c-myc、CyclinD1的表达均较对照组小鼠瘤块的相应蛋白的相对表达量分别为(0.381±0.021 vs 0.913±0.011), (0.323±0.014vs 1.001±0.017),(0.425±0.034 vs 0.981±0.026),2组比较差异均有统计学意义(P<0.05)。
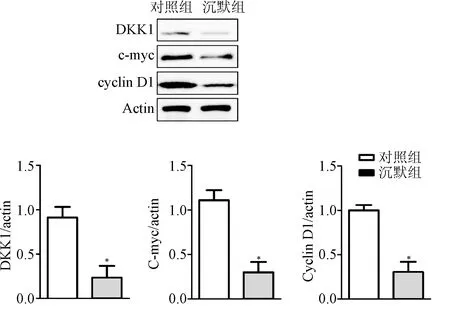
图4 β-catenin对胃癌瘤块组织中DKK1、c-myc 和CyclinD1表达的影响*P<0.05,与对照组相比Fig.4 Effect of β-catenin on protein levels of DKK1, c-myc and CyclinD1*P<0.05,compared with control group
3 讨论
胃癌影响患者的饮食,导致患者消瘦以及免疫力下降,成为治疗的难点之一[16],虽然目前手术治疗仍为胃癌治疗的主要措施,但是由于术后众多的并发症如出血、转移复发等[17-18],寻找积极有效的胃癌治疗靶分子势在必行,亦成为研究的热点[19],目前已经发现的胃癌治疗靶位点有miRNA-301a,VEGF受体,PTEN等[20]。在许多癌症组织基因的表达谱中发现,Wnt信号通路的重要负性调控因子AXIN多发生缺失突变,Wnt信号通路的异常激活,如Wnt信号通路在结肠癌中异常激活促进结肠癌细胞增殖相关因子的表达。但是目前对于胃癌组织中异常激活的Wnt信号通路其在胃癌发生发展中的作用尚不清楚,因此本课题组探究 Wnt信号通路与胃癌的机制关联。
Wnt信号通路是以启动这一信号通路的Wnt蛋白命名的,其包括经典的 Wnt 信号通路即Wnt-β-catenin通路和非经典的 Wnt 通路即Wnt-Ca2+或Wnt-NK 通路。激活的Wnt蛋白结合结合细胞受体激活胞内一系列蛋白,其中下游较为核心的蛋白为β-catenin包括由140个氨基酸组成的N端结构域和反式激活域的C端结构域。在胞浆中β-catenin与细胞骨架蛋白不断结合与解离,通过调控细胞骨架介导细胞的迁移,这在肿瘤细胞的侵袭转移中具有一定的促进作用[21]。作为转录因子,β-catenin在细胞内聚积并转至细胞核内,与淋巴样增强结合因子(lymphoid enhancer-binding factor 1, LEF1)、c-myc以及cyclinD1基因启动子区域结合并激活转录因子Tcf/LEF家族,上调c-myc和cyclin D1基因的表达[22],促进细胞的增殖和侵袭[23]。此外β-catenin还参与上皮细胞间质化[24]以及细胞的氧化应激,促进细胞的异型性[25]。它扮演着一个重要的调控细胞的粘附、迁移、变形以及细胞增殖、分化等过程的核心分子[26]。
本研究发现β-catenin蛋白沉默后的BGC-823胃癌细胞株注射的裸鼠,其皮下瘤块的数量、直径以及重量均较对照空载体病毒感染的BGC-823胃癌细胞株注射的裸鼠少(P<0.05),这表明β-catenin在胃癌细胞毒增殖、胃癌的发生发展过程中具有重要作用,且在β-catenin沉默组裸鼠的瘤块组织中DKK1、c-myc、CyclinD1的表达水平较对照组裸鼠显著降低(P<0.05),这表明β-catenin可上调DKK1、c-myc、CyclinD1的表达,进而促进胃癌细胞的增殖,因此β-catenin作为一个癌基因,其可能在胃癌预后的评估诊断中具有重要价值。
综上所述,胃癌组织中异常激活的Wnt信号通路促进β-catenin的核转移,β-catenin通过上调DKK1、c-myc、CyclinD1的表达促进胃癌细胞的增殖,因此β-catenin在胃癌发生发展过程中具有重要作用,其可能作为评估胃癌预后的诊断指标,在胃癌的诊疗中具有重要的临床价值。
[1] Ye XS, Yu C, Aggarwal A, et al.Genomic alterations and molecular subtypes of gastric cancers in Asians[J].Chin J Cancer, 2016, 35(1): 42.
[2]Veisani Y, Delpisheh A.Survival rate of gastric cancer in Iran; a systematic review and meta-analysis[J].Gastroenterol Hepatol Bed Bench, 2016, 9(2): 78-86.
[3]Zhang WH, Chen XZ, Yang K, et al.Risk Factors and Survival Outcomes for Postoperative Pulmonary Complications in Gastric Cancer Patients[J].Hepatogastroenterology, 2015, 62(139): 766-772.
[4]Guo T, Yang L, Liu Y, et al. Risk factors of cholecystitis after radical gastrectomy for gastric cancer[J].Zhonghua Weichang Waike Zazhi, 2016, 19(4): 406-408.
[5]雷红宇,袁慧,邬静,等.圆弧青霉菌毒素-青霉酸人工抗原的合成与鉴定[J].生物工程学报 2008,24(5):898-902.
[6]Mihmanli M, Ilhan E, Idiz UO, et al.Recent developments and innovations in gastric cancer[J].World J Gastroenterol, 2016, 22(17): 4307-4320.
[7]Zhang MJ, Zhang GL, Yuan WB, et al.[Risk factors analysis of postsurgical gastroparesis syndrome and its impact on the survival of gastric cancer after subtotal gastrectomy][J].Zhonghua Weichang Waike Zazhi, 2013, 16(2): 163-165.
[8]Ma Z, Zhang R, Xue Q, et al.Analysis of prognostic factors of 110 patients with metastatic ovarian tumors from gastric cancer[J].Zhonghua Weichang Waike Zazhi, 2016, 19(3): 287-291.
[9]Kilic L, Ordu C, Yildiz I, et al.Current adjuvant treatment modalities for gastric cancer: From history to the future[J].World J Gastrointest Oncol, 2016, 8(5): 439-449.
[10]den Hoed CM, Kuipers EJ.Gastric Cancer: How Can We Reduce the Incidence of this Disease?[J].Curr Gastroenterol Rep, 2016, 18(7): 34.
[11]李春辉,潘理会,佟晓波,等.Wnt信号通路的组件蛋白DKK-1、β-链接素及周期素D1蛋白表达与胃癌的相关性[J].中国老年学,2015,35(5):1171-1173.
[12]李凤玉,吕洋,刘博,等肠三叶因子与Wnt/β-Catenin信号通路在结直肠癌中的表达及其与患者预后的关系[J].中国老年学.2015,35(22):6441-6444.
[13]Ma L, Ji L, Yu Y, et al.Novel molecular targets for diagnosis and treatment of hepatocellular carcinoma[J].Discov Med, 2015, 19(102): 7-14.
[14]Jiang W, Tian Y, Jiang S, et al.MicroRNA-376c suppresses non-small-cell lung cancer cell growth and invasion by targeting LRH-1-mediated Wnt signaling pathway[J].Biochem Biophys Res Commun, 2016, 473(4): 980-986.
[15]卞保祥,宋子琰,熊光苏.舒林酸对人胰腺癌细胞PANC-1增殖和凋亡的影响及机制探讨[J].中国生化药物,2014,34(7):23-26.
[16]Choi WJ, Kim J.Nutritional Care of Gastric Cancer Patients with Clinical Outcomes and Complications: A Review[J].Clin Nutr Res, 2016, 5(2): 65-78.
[17]Degiuli M, De Manzoni G, Di Leo A, et al.Gastric cancer: Current status of lymph node dissection[J].World J Gastroenterol, 2016, 22(10): 2875-2893.
[18]Bushan K, Sharma S, Attarde N.Minimal invasive gastric surgery: A systematic review[J].South Asian J Cancer, 2015, 4(3): 140-142.
[19]黄荧,魏嘉,刘宝瑞.K-ras 突变在胃癌预后及靶向治疗中的研究进展[J].中华肿瘤杂志,2016,38(2): 81-85.
[20]Jia S, Cai J.Update on Biomarkers in Development of Anti-angiogenic Drugs in Gastric Cancer[J].Anticancer Res, 2016, 36(3): 1111-1118.
[21]Undi RB, Gutti U, Sahu I, et al.Wnt Signaling: Role in Regulation of Haematopoiesis[J].Indian J Hematol Blood Transfus, 2016, 32(2): 123-134.
[22]Guo L, Yilamu D, Sun L, et al.Association among the expression of beta-catenin, cyclin D1 and estrogen receptor-beta in human breast cancer[J].Exp Ther Med, 2015, 10(4): 1423-1428.
[23]牛磊,郗洪庆,陈凛.Lgr5-Wnt/β-catenin信号通路与胃癌干细胞的研究进展[J].解放军医学院学报, 2014,35(12): 1268-1272.
[24]苏克举,王旭,何华,等.肿瘤干细胞标志物Musashi1与实体肿瘤关系的研究进展[J].吉林大学学报(医学版), 2015,41(2): 429-432.
[25]Zhang Z, Zhou C, Chang Y, et al.Long non-coding RNA CASC11 interacts with hnRNP-K and activates the WNT/beta-catenin pathway to promote growth and metastasis in colorectal cancer[J].Cancer Lett, 2016, 376(1): 62-73.
[26]Wang Z, Chen Q.beta-catenin knockdown inhibits the proliferation of human glioma cells and[J].Exp Ther Med, 2016, 11(3): 1059-1064.
(编校:王俨俨)
Expression of β-catenin in gastric cancer and its mechanism
WANG Hai-boΔ, LIU Yan-jun, CHEN Shu-wei, WU Wen-long, LI Feng-chen
(Department of Gastrointestinal Surgery, No.107 Hospital of PLA, Yantai 264002, China)
ObjectiveTo study the expression of β - catenin, key molecular of Wnt signaling pathway in gastric cancer and its mechnism.MethodsUsing shRNA virus to silence the expression of β - catenin in BGC - 823 gastric cancer cell lines and using virus without shRNA as the control group.The silence effect of shRNA virus were detected by real-time quantitative flouorescence PCR and Western blot,then transfected into nude mice to construct gastric cancer nude mice model.The subcutaneous tumor growth situation(measure tumor diameter) were detected in two groups of nude mice model every week.After 8 weeks number and weight of subcutaneous tumor were recorded.The DKK1, c-myc and CyclinD1 related to Wnt signaling pathways in subcutaneous tumor in two groups of nude mice were detected by Western blot.ResultsAfter silence of β-catenin in BGC - 823 gastric cancer cell lines, the number, diameter and weight of the subcutaneous tumor block in β-catenin were less than empty carrier control group, with statistically significant difference(P<0.05).The expression of DKK1, c - myc, CyclinD1 levels significantly reduced in β-catenin silent group of nude mice than control group (P<0.05).Conclusionβ-catenin upregulates the expressions of DKK1, c - myc, CyclinD1 to promote gastric cancer cell proliferation, hence β - catenin plays an important role in the process of gastric cancer and it may be valuable diagnosis index in the prognosis of gastric cancer.
β-catenin; gastric cancer; Wnt signaling pathway; BGC-823 gastric cancer cell lines
10.3969/j.issn.1005-1678.2016.07.10
王海波,通信作者,男,博士,副教授,研究方向:胃肠疾病,wang13145362398@163.com。
R735.2
A
