细叶百合低温解除休眠过程中鳞茎内糖分及相关酶的研究
2016-07-05刘芳陈业雯李丹丹廉华吴瑕杨瑾李雨琦谢守峰陈学武黑龙江八一农垦大学农学院黑龙江大庆6339大连经济技术开发区振兴园林绿化有限公司辽宁大连6600
刘芳,陈业雯,李丹丹,廉华,吴瑕,杨瑾,李雨琦,谢守峰,陈学武(.黑龙江八一农垦大学农学院,黑龙江 大庆 6339;.大连经济技术开发区振兴园林绿化有限公司,辽宁 大连 6600)
细叶百合低温解除休眠过程中鳞茎内糖分及相关酶的研究
刘芳1*,陈业雯1,李丹丹1,廉华1,吴瑕1,杨瑾2,李雨琦1,谢守峰1,陈学武1
(1.黑龙江八一农垦大学农学院,黑龙江 大庆 163319;2.大连经济技术开发区振兴园林绿化有限公司,辽宁 大连 116600)
通过低温处理打破细叶百合鳞茎休眠,探讨细叶百合鳞茎解除休眠过程中的糖类化合物及蔗糖、淀粉代谢酶的变化规律。结果表明,鳞茎休眠解除过程中伴随着旺盛的糖类代谢活动,淀粉含量下降,淀粉酶活性升高。内层鳞片在冷藏60 d时可溶性糖含量达到峰值,贮藏前期,蔗糖含量,蔗糖合成酶(SS)和蔗糖磷酸合成酶(SPS)活性上升,SPS和SS协同控制蔗糖代谢及转运。冷藏条件下鳞片及顶芽内淀粉向可溶性糖方向代谢过程中促进了腺苷二磷酸葡萄糖焦磷酸化酶(A G Pase)活性的增加。各种淀粉代谢相关酶在鳞茎冷藏不同时期和不同部位的作用规律不同。鳞茎各个部位总可溶性糖含量与蔗糖、葡萄糖含量及淀粉磷酸化酶(SP)、SS、α-及β-淀粉酶活性都存在显著或极显著的正相关性。糖类代谢成为鳞茎休眠解除的物质基础。
细叶百合;鳞茎;休眠;冷藏;糖类化合物
http://cyxb.lzu.edu.cn
刘芳,陈业雯,李丹丹,廉华,吴瑕,杨瑾,李雨琦,谢守峰,陈学武.细叶百合低温解除休眠过程中鳞茎内糖分及相关酶的研究.草业学报,2016,25(5):60-68.
LIU Fang,CHEN Ye-W en,LI Dan-Dan,LIA N H ua,WU Xia,YANG Jin,LI Y u-Qi,XIE Shou-Feng,CHEN Xue-W u.Changes in carbohydrate status and related enzy m es of Lilium pumilum bulbs during breaking dorm ancy under refrigerated conditions.Acta Prataculturae Sinica,2016,25(5):60-68.
细叶百合(Lilium pumilum)观赏性很强,又兼有药用和食用的价值。秋季鳞茎收获后即进入休眠状态。未解除休眠的鳞茎种植后不能正常发芽,低温处理能有效解除百合鳞茎的休眠,鳞茎休眠的解除及鳞茎长期冷藏技术对百合产业的发展具有重要的作用。休眠期间,鳞茎外部形态变化不明显,但其内部仍发生着非常复杂的生理生化反应。百合鳞茎的贮藏物质中很大一部分为碳水化合物,其中淀粉和蔗糖是主要的积累形式,也是休眠解除过程中的信号物质,许多基因和酶的表达受他们变化的响应,其代谢成为人们研究鳞茎休眠与萌发的突破口。
在低温处理打破休眠过程中,鳞茎内发生“低温糖化”现象[1-2],主要贮藏物质淀粉水解,淀粉向可溶性糖转化,可溶性碳水化合物积累。夏宜平等[3]指出总可溶性糖含量的转折点可以作为休眠解除的生理标志。蔗糖磷酸合成酶(sucrose phosphate synthase,SPS)、蔗糖合成酶(sucrose synthase,SS)与蔗糖代谢密切相关[4-5]。植物生长发育中SS既可催化蔗糖合成又可催化蔗糖分解,但一般认为SS主要起分解蔗糖作用,为细胞壁提供合成底物和合成淀粉,在细胞壁或是合成淀粉的组织中其活性最高。SPS在蔗糖代谢中起重要的作用,有研究表明SPS活性与蔗糖形成呈正相关,而与淀粉积累呈负相关关系[6]。SS、SPS、淀粉合成酶等作为蔗糖、淀粉合成的限速酶,其活性的变化在改变蔗糖和淀粉含量的同时,也影响休眠的解除[7-8]。鳞茎不同部位的淀粉含量存在明显差异[9-10]。糖类化合物含量及糖代谢相关酶的变化规律因百合种类的不同而存在差异,有关细叶百合鳞茎休眠解除的糖类化合物及相关代谢酶学特性和表达规律不曾有人报道,本研究试图从细叶百合鳞茎解除休眠过程中的碳水化合物代谢规律及其与鳞茎发芽的关系入手,明确糖类及蔗糖、淀粉相关酶的变化规律,同时利用相关分析对糖类化合物和蔗糖、淀粉代谢相关酶之间的相关性进行系统的研究。以期为揭示细叶百合鳞茎休眠解除的生理生化标志及休眠机理提供理论支持。
1 材料与方法
1.1 材料及处理
供试材料为从凌源引种的野生种细叶百合,鳞茎周径4~6 c m。2012年10月中旬采收细叶百合休眠鳞茎置于5℃冰箱中冷藏,冷藏介质为珍珠岩。低温处理阶段,每12 d取样一次,每次随机取30个鳞茎,分成外层、内层鳞片、顶芽、鳞茎盘4个部分,测定其生理指标。
1.2 试验项目及方法
淀粉及可溶性糖(soluble sugar,T SS)含量采用蒽酮比色法[11]测定,α-淀粉酶、β-淀粉酶活性采用3,5-二硝基水杨酸法[11]测定;蔗糖、果糖、葡萄糖含量、蔗糖合成酶(SS)、蔗糖磷酸合成酶(SPS)活性测定采用文献[12]的方法;糖代谢相关酶液的提取参照吴沙沙[13]的方法。可溶性淀粉合成酶(soluble starch synthase,SSS)、腺苷二磷酸葡萄糖焦磷酸化酶(adenosine diphosphate glucose focal phosphorylase,A G Pase)参照谭彩霞[14]的方法;淀粉磷酸化酶(starch phosphorylase,SP)活性测定采用无机磷比色法[15]。所有试验项目重复3次。
1.3 数据处理
采用Excel软件进行试验数据计算和处理,利用SPSS软件进行相关性分析。
2 结果与分析
2.1 细叶百合鳞茎低温解除休眠过程中糖类化合物含量的变化
糖类代谢在百合鳞茎低温贮藏过程中起重要作用。由表1可知,鳞片淀粉含量随冷藏时间的延长逐渐下降。顶芽在整个贮藏过程中淀粉含量先下降再上升再下降,在冷藏48 d时含量最高,84 d时淀粉含量最低。鳞茎盘淀粉含量先上升后下降,冷藏24 d时淀粉含量最高,84 d时含量最低。冷藏期内百合鳞茎各部位可溶性糖含量都有上升趋势。内层鳞片在冷藏60 d时含量最高。冷藏48~60 d是鳞片可溶性糖发生变化的转折点。可溶性糖中蔗糖所占比重较高。鳞茎蔗糖含量变化趋势与可溶性糖含量的变化趋势一致。鳞片、顶芽内淀粉、可溶性糖及蔗糖含量在冷藏前后都有显著变化,鳞茎盘内可溶性糖及蔗糖含量在冷藏前后差异也很显著。葡萄糖是百合鳞茎内糖代谢过程中重要的可利用糖分。鳞茎各部位葡萄糖含量整个冷藏期内波动性较大,鳞茎各部位冷藏后期葡萄糖含量均比冷藏0 d时高。顶芽葡萄糖含量在冷藏前后变化幅度最大。外层鳞片果糖含量较低,冷藏0~84 d内外层鳞片整体变化趋势不明显。内层鳞片果糖含量的变化趋势与外部鳞片有很大差异,冷藏24 d果糖含量迅速升至峰值,内层鳞片含量高于外层鳞片。鳞茎盘和顶芽果糖含量冷藏期整体表现为上升趋势,顶芽和鳞茎盘内果糖及葡萄糖在冷藏前后变化显著。

表1 细叶百合鳞茎冷藏过程中糖类化合物含量的变化Table 1 The changes of sugar content of L.pumilum bulbs during cold storage m g/g F W
2.2 细叶百合鳞茎低温解除休眠过程中淀粉-糖代谢关键酶活性的变化
由表2可知,低温冷藏过程中,百合鳞茎各部位蔗糖合成酶SS活性变化均呈整体上升趋势。0~24 d变化幅度不大,12 d时外层鳞片和顶芽内SS含量升高,内层鳞片和鳞茎盘SS含量有所下降。24~60 d内各部位SS含量增加迅速,48 d时顶芽和内层鳞片增长比较明显。内层鳞片和顶芽SS在84 d活性最大,顶芽冷藏过程中SS活性高于其他部位。鳞茎盘冷藏60 d活性达到峰值。鳞茎冷藏后期SS代谢比较活跃。鳞片SPS活性先上升后下降,鳞茎盘SPS变化呈“上升-下降-上升-下降”的双峰曲线,顶芽冷藏0~48 d内SPS活性逐渐递增,36~84 d内SPS的活性变化平缓。顶芽内SPS活性冷藏24~84 d时均高于其他部位。外层鳞片冷藏36 d时SPS活性出现峰值,内层鳞片SPS活性冷藏48 d时活性最大,鳞茎盘中SPS活性的峰值出现在冷藏60 d时。鳞片及顶芽内SS、SPS活性在冷藏前后差异显著。

表2 细叶百合鳞茎冷藏过程中蔗糖及淀粉代谢酶活性的变化Table 2 The changes of sucrose and starch metabolizing enzymes activity of L.pumilum bulbs during cold storage
鳞茎顶芽和鳞茎盘在冷藏过程中,α-淀粉酶活性逐渐增加。鳞茎盘α-淀粉酶活性高于其他部位,在冷藏24~84 d内淀粉酶活性变化幅度较大。顶芽内α-淀粉酶在冷藏初期活性较低,在冷藏24~84 d内活性逐渐增加。内外层鳞片在冷藏期内α-淀粉酶活性的变化趋势不同于顶芽和鳞茎盘,外层鳞片α-淀粉酶活性高于内层鳞片。冷藏过程中内外层鳞片α-淀粉酶的变化波动性较大,鳞片α-淀粉酶活性整体上呈上升趋势。鳞茎各部位β-淀粉酶活性与α-淀粉酶活性的变化趋势相似。顶芽β-淀粉酶活性呈递增趋势,内外层鳞片、鳞茎盘β-淀粉酶活性在贮藏过程中呈波动性变化。内外层鳞片β-淀粉酶活性比较接近,顶芽β-淀粉酶活性最低,鳞茎盘活性最高。说明在鳞茎贮藏过程中,鳞茎盘内淀粉的代谢也很活跃。鳞茎各部位淀粉酶活性贮藏前后变化比较明显。
SSS主要参与支链淀粉中分支链的合成。鳞茎各部位在冷藏期内SSS活性呈波动性变化,外层鳞片和鳞茎盘SSS活性较冷藏初期相比水平较低。顶芽在冷藏84 d时SSS活性高于冷藏初期的休眠鳞茎。内部鳞片在冷藏48 d内活性没有明显变化,48 d后SSS活性有所增加。淀粉磷酸化酶SP可以将淀粉转变为1-磷酸葡萄糖。12~60 d内,鳞片SP活性随贮藏时间的延长逐渐升高,冷藏60 d时活性升至最高点,顶芽和鳞茎盘36 d后SP活性逐渐升高。鳞茎贮藏84 d时SP活性较高。腺苷二磷酸葡萄糖焦磷酸化酶(A G Pase)在许多植物贮藏器官中都有发现,它是淀粉生物合成的一个限速酶,能催化由1-磷酸葡萄糖与三磷酸腺苷反应形成腺苷二磷酸葡萄糖并释放焦磷酸的反应。鳞片A G Pase活性高于鳞茎盘,鳞茎盘高于顶芽。总体来看,鳞片A G Pase活性在冷藏48 d内逐渐降低,48 d后活性上升,鳞茎冷藏60~72 d及出芽阶段,A G Pase活性保持较高水平。顶芽和鳞茎盘中A G Pase活性在冷藏期内活性变化范围不大。
2.3 细叶百合鳞茎冷藏过程中糖类化合物及相关酶的相关性分析
为明确低温解除休眠过程中鳞茎中糖类物质与相关酶的作用机理,本试验对鳞茎中淀粉、可溶性糖类及蔗糖、淀粉代谢相关酶的相关性进行了统计(表3)。鳞茎各部位糖分及相关酶之间的相关性差异水平有所不同。除了外层鳞片和鳞茎盘中淀粉含量与SSS活性呈正相关外,鳞茎各部位淀粉与所测7种糖代谢酶指标均为负相关关系,外层鳞片、内层鳞片和鳞茎盘中淀粉含量与总可溶性糖、蔗糖、葡萄糖含量及SS、SP、α-及β-淀粉酶活性负相关性极显著。顶芽内淀粉与总可溶性糖含量相关系数为-0.407,相关性不显著。低温冷藏期内,鳞茎各部位α-及β-淀粉酶、SP活性三者之间均为显著或极显著正相关关系,说明它们都是促进淀粉降解的。内层鳞片中SSS与α-及β-淀粉酶之间、A G Pase与α-及β-淀粉酶之间、A G Pase与SSS活性之间正相关性都很显著,说明冷藏条件下内层鳞片淀粉向可溶性糖方向代谢过程中促进了SSS活性的增加。鳞茎盘中SSS与α-及β-淀粉酶存在极显著负相关,鳞片及顶芽A G Pase与SP间为正相关,鳞茎盘中A G Pase与SP间也为正相关关系,由此可见,各种淀粉代谢相关酶类在鳞茎不同部位的作用是不相同的。鳞茎各个部位总可溶性糖含量与蔗糖、葡萄糖含量及SS、SP、α-及β-淀粉酶活性都存在显著或极显著的正相关性。不同部位的蔗糖与SS活性间的正相关性也达到了极显著的水平。外层鳞片、内层鳞片、顶芽、鳞茎盘中蔗糖含量与SPS活性间相关系数分别为0.312,0.351,0.878,0.741,其中顶芽、鳞茎盘相关性极显著。内外鳞片的SS与SPS活性间相关系数为0.574,0.192。顶芽、鳞茎盘中SS与SPS存在极显著正相关性,说明顶芽、鳞茎盘中SS与SPS都是有利于蔗糖和可溶性糖含量的升高,而不利于淀粉的积累。
3 讨论
百合鳞茎中的主要贮藏物质是淀粉。冷藏期间,鳞茎为了维持正常的生理代谢活动,必须不断地消耗贮藏的养分。植物体内糖类含量的变化是低温条件下植物代谢较为敏感的生理指标之一,淀粉在维持碳水化合物供需平衡中起着重要作用[16-18]。贮藏器官在低温下常导致可溶性碳水化合物的积累[2],已有的研究多以整个鳞茎为材料,鳞茎各个部位变化的差异尚少见报道。本试验结果表明,百合种球鳞片的淀粉含量在冷藏期间总体上呈下降的趋势,这与前人的研究结果基本一致[3,9-10]。顶芽和鳞茎盘淀粉含量变化起伏较多,百合鳞茎低温处理过程中,除顶芽外,鳞片及鳞茎盘中淀粉含量与淀粉酶活性以及淀粉含量与可溶性糖含量之间都存在极显著负相关关系(P<0.01),整个鳞茎的总可溶性糖含量与α-及β-淀粉酶活性都存在显著或极显著的正相关性。顶芽淀粉酶活性与淀粉之间的相关性较低,鳞茎各部位淀粉、可溶性糖及淀粉酶的变化趋势并不完全一致,在低温处理过程中,冷藏前期的鳞茎盘和冷藏中期顶芽的淀粉含量有升高现象,在马铃薯(Solanum tuberosum)的低温糖化中也有类似的报道[19],可能是因为鳞茎冷藏初期,鳞茎休眠程度较深,细胞代谢较弱,鳞片中富含的大量淀粉少部分降解即可满足整个鳞茎的能量代谢所需。从而导致鳞茎盘和顶芽内淀粉向可溶性糖的转化受阻。
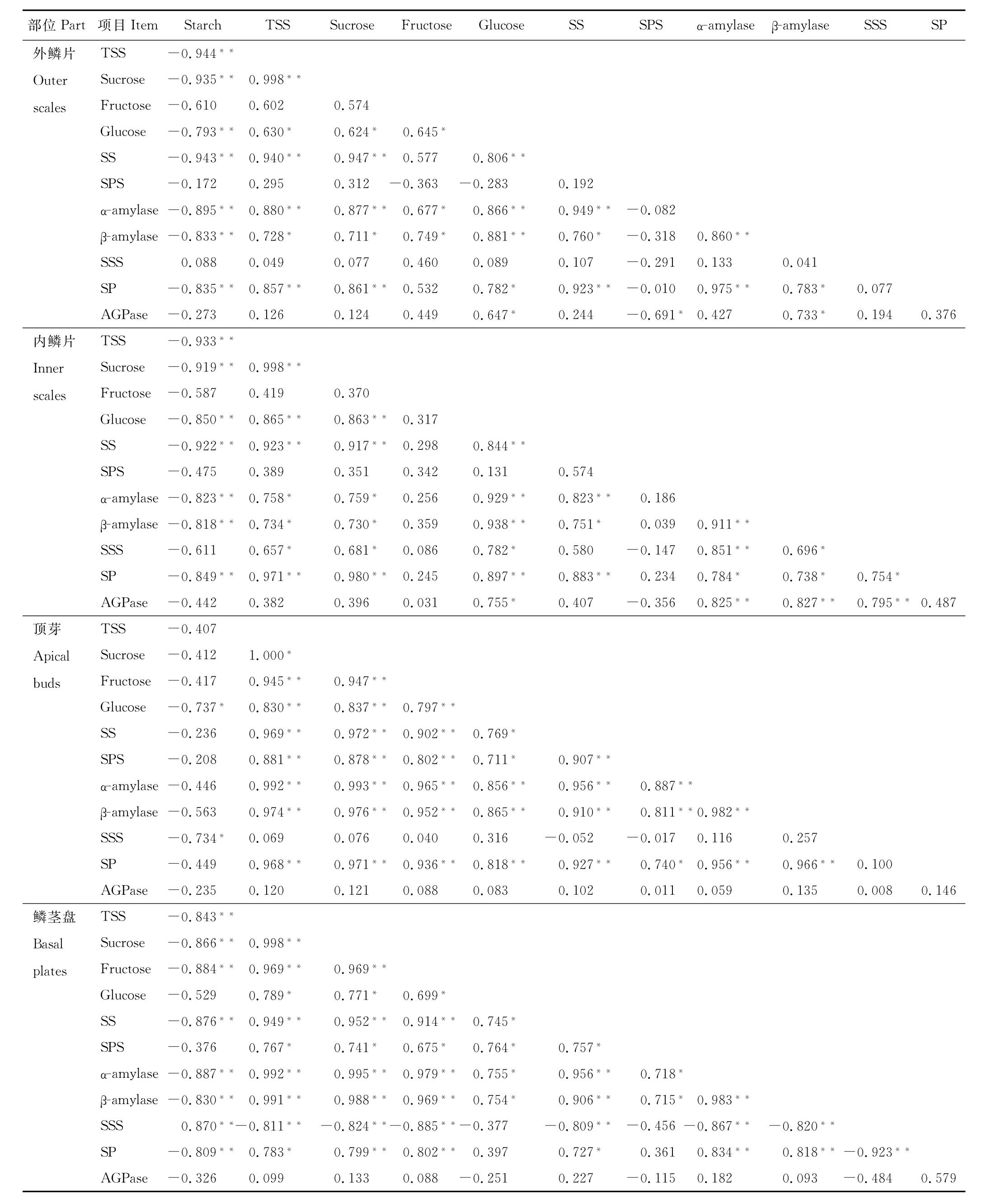
表3 细叶百合鳞茎内糖类化合物及相关代谢酶的相关分析Table 3 Correlation analysis of sugars and corresponding enzymes in bulbs of L.pumilum
夏宜平等[3]指出百合种球生产企业在判定种球冷藏是否完成生理指标时,通常以可溶性糖含量达到峰值为种球打破休眠的临界点。本研究结果表明,蔗糖在可溶性糖中所占比值较高,种球各部位蔗糖含量变化趋势与可溶性糖含量一致,蔗糖含量总体呈上升趋势,内层鳞片在冷藏60 d可溶性糖的积累量达最大,说明此时内层鳞片细胞代谢发生了明显的转变。顶芽内蔗糖含量变化与顶芽生长情况相符合,SS为促进蔗糖合成的代谢酶,碳水化合物代谢的需求影响着SS活性的变化[20]。顶芽蔗糖与SS活性间存在极显著的正相关性。这与Legnani等[21]的研究是一致的。说明顶芽中蔗糖含量与顶芽的萌发有关,SS参与了百合鳞茎休眠解除过程中鳞茎组织中蔗糖的代谢。顶芽、鳞茎盘中SS与SPS存在极显著正相关关系,说明顶芽、鳞茎盘中SS与SPS都是有利于蔗糖和可溶性糖含量的升高,而不利于淀粉的积累。低温贮藏前期,鳞茎整体来看,蔗糖含量,蔗糖代谢关键酶SS 和SPS均呈上升趋势,这与亚洲百合鳞茎内的变化是一致的[22],百合鳞茎中蔗糖与酶可能存在某种动态平衡关系,蔗糖分解酶活性的增加可能受高含量的蔗糖诱导。植物体内运输的蔗糖具有信号功能,可以诱导某些相关基因的表达,使另一些基因被阻遏[22-24]。SPS和SS协同控制蔗糖代谢及转运。细叶百合鳞茎中还原糖含量较低,整个冷藏过程中还原糖含量的变化幅度不大,体现了蔗糖与淀粉的转化关系。顶芽内葡萄糖和果糖在冷藏过程中总体呈上升趋势,说明顶芽在萌发过程中单糖的利用量较高。而且在研究中发现,冷藏后期,鳞片中蔗糖含量降低的同时,顶芽内可溶性糖含量增加,还原糖含量也增加,低温冷藏期间,鳞片中大量淀粉降解为可溶性糖合成蔗糖,蔗糖可能通过鳞茎盘转运至顶芽,供其解除休眠及萌发所用。
球根休眠期间,主要是磷酸化酶的作用下促进能源的释放反应的磷酸代谢过程[25],所以该期物质消耗较少,在休眠解除过程中淀粉酶的水解作用为主。SP还可活化抗坏血酸,从而促进了休眠的通过和芽的生长。这与本研究前期试验中A SP活性的增加是相符的。本试验发现休眠鳞茎的SP及淀粉酶活性较低,随着休眠的觉醒,体内的各种代谢活动开始加强,两种酶活性也开始加强,尤其淀粉酶活性在芽萌动时迅速增强。研究还表明冷藏阶段,鳞茎各部位淀粉酶与SP活性表现为显著正相关关系,说明它们在淀粉降解过程中的作用为协同作用。由于在休眠时,体内的各种代谢活动都很低,需要能量少,而当解除休眠时,随着细胞内各种活动的加强,为供应发芽生长所需要的能量逐渐增加,因此,淀粉磷酸化酶及淀粉酶活性加强,以水解淀粉生成糖及能量,供应细胞的糖代谢和磷代谢,满足发芽生长的需要。G A3能促进块茎解除休眠,G A3亦能增加淀粉酶的活性,β-淀粉酶活性在冷藏60 d时迅速增加可能是块茎休眠解除的体现。鳞茎各个部位总可溶性糖含量与SS、SP、α-及β-淀粉酶活性都存在显著或极显著的正相关关系。在各种糖类代谢酶的互作影响下,低温解除鳞茎休眠过程中保证了淀粉与可溶性糖之间的物质转化。为休眠的彻底解除和萌发奠定了物质基础。另外,淀粉降解过程中,SP可催化淀粉降解产生葡萄糖-1-磷酸(G-1-P),G-1-P能作为底物用于A G Pase催化的淀粉合成过程[26]。冷藏后期SP与A GPase都呈现增加的趋势,而且鳞片及顶芽A G Pase与SP间表现为正相关关系说明冷藏条件下鳞片及顶芽内淀粉向可溶性糖方向的代谢过程中促进了A G Pase活性的增加。Sergeeva等[27]的研究也表明马铃薯块茎萌发时A G Pase活性较休眠块茎活性高,A G Pase可能是休眠打破的一个重要的生理决定因素。
低温冷藏期间,百合鳞茎各个部位都发生着代谢变化,芽是整个鳞茎休眠解除活动的中心,但芽的生长发育不是独立的,鳞片和芽以及根都是靠鳞茎盘紧紧联系在一起的。鳞茎休眠的解除以及萌发形成植株的过程所需物质能量主要是鳞片中贮藏的碳水化合物提供。通过本研究可知,鳞片淀粉的变化幅度明显大于顶芽及鳞茎盘。内部鳞片的变化大于外部鳞片。而外部鳞片的可溶性糖含量要大于内部鳞片。顶芽在整个过程中可溶性糖含量一直保持较高水平,还原糖的变化幅度也较大,冷藏期内SS及SPS的活性均较高,而淀粉代谢相关酶类活性却很低。顶芽内自身糖类储备较少,但鳞茎萌发的外在体现主要是出芽长度的增加,顶芽萌发伸长需要大量物质能量供应,不断增加的糖分可能来源于鳞片,鳞茎盘很可能是百合鳞茎物质代谢与转运的平台。关于百合鳞茎盘内结构和物质代谢的研究很少,它与鳞茎其他部位间的物质联系以及它的纽带作用还需更深入的研究,这对明确百合鳞茎复杂的物质代谢规律是非常重要的。
References:
[1]Miller W B,Langhans R W.Low te m perature alters carbohydrate m etabolis m in Easter lily bulbs.H ortScience,1990,25(4):463-465.
[2]Shin K S,Chakrabarty D,Paek K Y.Sprouting rate,change of carbohydrate contents and related enzy m es during cold treatm ent of lily bulblets regenerated in vitro.Scientia H orticulturae,2002,96:195-204.
[3]Xia Y P,H uang C H,H e G F,etal.Changes of carbohydrates m etabolis m and enzy m es activities in low te m perature storage for bulbs of Lilium oriental hybrids.Acta H orticulturae Sinica,2006,33(3):571-576.
[4]Botha F C,Black K G.Sucrose phosphate synthase and sucrose synthase activity during m aturation ofinternodaltissue in sugarcane.A ustralian Journal of Plant Physiology,2000,27(1):81-85.
[5]Sun H M,H e L,W ang W W,etal.M echanis m of starch-sucrose m etabolis m regulated by IB A as well as G A3during dcale cutting propagation in Lilium.Scientia A gricultura Sinica,2011,44(4):798-806.
[6]H uber S C,H uber J L.Role and regulation of sucrose-phosphate synthase in higher plants.A nnual Review of Plant Physiology and Plant M olecular Biology,1996,47:431-445.
[7]Li X Q,Zhang D P.Gene expression activity and path way selection for sucrose m etabolis m in developing storage root of sweet potato.Plant & Cell Physiology,2003,44(6):630.
[8]Edurne B,Francisco J.Sucrose synthase catalyzes the de novo production of A D P glucose linked to starch biosynthesis in heterotrophic tissues of plants.Plant & Cell Physiology,2003,44(5):500.
[9]Sun H M,Li T L,Li Y F.Starch m etabolis m and sprouting of bulb in Lilium davidii var.U nicolor stored at different cold te m peratures.Acta H orticulturae Sinica,2004,31(3):337-342.
[10]Tu S P,M u D,Liu C.The physiological and bioche mical changes oflily bulbs during dorm ancy release with cold treatm ent.Acta A griculturae U niversitatis Jiangxiensis,2005,27(3):404-407.
[11]Li H S.Principle and Technology of Plant Physiological and Bioche mical Experim ents[M].Beijing:Higher Education Press,2000.
[12]Shanghai Institute of Plant Physiology,The Chinese Acade m y of Sciences.The Guide of M odern Plant Physiology Experim ent[M].Beijing:Science Press,1999.
[13]W u S S.Rules of Source-sink Exchange of the Bulb of Oriental Lily‘sorbonne’[D].Beijing:Beijing Forestry U niversity,2012.
[14]Tan C X.Expressions of Starch Synthase Genes and Starch Synthesis in W heat Grains[D].Yangzhou:Yangzhou U niversity,2009.
[15]Gao J F.Plant Physiology Experim ent Instruction[M].Beijing:Higher Education Press,2006.
[16]Geigenberger P.Regulation of starch biosynthesis in response to a fluctuating environ m ent.Plant Physiology,2011,155:1566-1577.
[18]Ge J,Yang C J,Yang Z M,etal.Q uality of mixed naked oats(Avena nuda)and alfalfa(Medicagosativa)silage.Acta Prataculturae Sinica,2015,24(4):104-113.
[19]Eilleen P O,Rickey Y Y,Alejandro G M.Low te m perature sweetening in potato tubers.Plant Physiology,1995,145:335-341.
[20]Touchette B W,Burkholder J M.O verview of the physiological ecology of carbon m etabolis m in seagrasses.Journal of Experim ental M arine Biology and Ecology,2000,250(1-2):169-205.
[21]Legnani G,W atkins C B,Miller W B.Effects of hypoxic and anoxic controlled atm ospheres on carbohydrates,organic acids,and ferm entation products in Asiatic hybrid lily bulbs.Postharvcst Biology and Technology,2010,56(1):85-94.
[22]H e L.Suerose M etabolic M echanis m of Liliu m Asiatic Bulb during Bulb Develop m ent and Cooling Storage[D].Shenyang:Shenyang A gricultural U niversity,2011.
[23]Koch K E.Carbohydrate m odulated gene expression in plants.A nnual Review of Plant Physiology and Plant M olecular Biology,1996,47:509-540.
[24]Srneekens S,Rook F.Sugar sensing and sugar m ediated signal transduction in plants.Plant Physiology,1997,115:7-13.
[25]W ang P,Lian Y,Jin L J.The research on the regulation of enzy m es during dorm ancy and dorm ancy releasing.Acta A griculturae Boreali-Sinica,2003,18(1):33-36.
[26]S weetlove L J,M üller-Rber B,Lothar W,etal.The contribution of adenosine 5′-diphosphoglucose pyrophosphorylase to the control of starch synthesis in potato tubers.Planta,1999,20(9):330-337.
[27]Sergeeva L I,Claassens M M J,Ja m ar D C L,etal.Starch-related enzy m es during potato tuber dorm ancy and sprouting.Russian Journal of Plant Physiology,2012,59(4):556-564.
[3]夏宜平,黄春辉,何桂芳,等.东方百合鳞茎冷藏解除休眠的养分代谢和酶活性变化.园艺学报,2006,33(3):571-576.
[5]孙红梅,何玲,王微微,等.IB A与G A3调控百合鳞片扦插繁殖的“淀粉-蔗糖”代谢机制.中国农业科学,2011,44(4):798-806.
[9]孙红梅,李天来,李云飞.不同贮藏温度下兰州百合种球淀粉代谢与萌发关系初探.园艺学报,2004,31(3):337-342.
[10]涂淑萍,穆鼎,刘春.百合鳞茎低温解除休眠过程中的生理生化变化研究.江西农业大学学报,2005,27(3):404-407.
[11]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[12]中国科学院上海植物生理研究所.现代植物生理学实验指南[M].北京:科学出版社,1999.
[13]吴沙沙.东方百合‘索邦’鳞茎源—库转换规律研究[D].北京:北京林业大学,2012.
[14]谭彩霞.小麦籽粒淀粉合成酶基因表达与淀粉合成的关系[D].扬州:扬州大学,2009.
[15]高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006.
[18]葛剑,杨翠军,杨志敏,等.紫花苜蓿和裸燕麦混贮发酵品质和营养成分分析.草业学报,2015,24(4):104-113.
[22]何玲.亚洲百合鳞茎发育和低温贮藏过程中蔗糖代谢机制研究[D].沈阳:沈阳农业大学,2011.
[25]王鹏,连勇,金黎甲.马铃薯块茎休眠及萌发过程中几种酶活性的变化.东北农学报,2003,18(1):33-36.
Changes in carbohydrate status and related enzymes of Lilium pumilum bulbs during breaking dormancy under refrigerated conditions
LIU Fang1*,C H E N Ye-W en1,LI Dan-Dan1,LIA N H ua1,W U Xia1,Y A N G Jin2,LI Yu-Qi1,XIE Shou-Feng1,C H E N Xue-W u1
1.Collegeof Agriculture,Heilongjiang Bayi Agricultural University,Daqing 163319,China;2.Zhenxing Landscaping Incorporated Com pany atthe Dalian Economic and Technological Develop ment Zone,Dalian 116600,China
T he changes in carbohydrate levels and related enzy m e activities during breaking dorm ancy under low te m perature were studied in Lilium pumilum.Sugar m etabolic activity was strong during breaking dorm ancy and the starch content of bulbs decreased,w hile a m ylase activity re m ained high.T he concentration of soluble sugars peaked at 60 d of storage.In the early phase of storage,the sucrose content,and the activities of sucrose synthase(SS)and sucrose phosphate synthase were rising,synergistically controlling sucrose m etabolis m and transport.U nder refrigeration the m etabolis m of starch to soluble sugar pro m oted an increase in A G Pase activity.T he functions and changes of enzy m es involved in starch m etabolis m in different parts of the bulb were different.T here were significantly or very significantly positive correlations of total soluble sugar content with the contents of sucrose and glucose,and the activities of starch phosphorylase,SS,and alpha and betaa m ylases in different parts of bulbs.Sugar m etabolis m was the prim ary m etabolic activity for breaking dorm ancy of bulbs.
Lilium pumilum;bulb;dorm ancy;cold storage;sugar
.E-m ail:byndliufang@163.com
10.11686/cyxb2015343
2015-07-15;改回日期:2015-09-30
黑龙江八一农垦大学大学生创新创业训练计划项目(X C2015001),黑龙江八一农垦大学‘校内培育课题资助计划’(X Z R2015-01)和黑龙江省农垦总局科技攻关项目(H N K125 BZ D-02-17)资助。
刘芳(1980-),女,黑龙江双城人,实验师,博士。E-m ail:byndliufang@163.com
