模拟移动床色谱法拆分甲霜灵对映体
2016-06-22陈贤铬徐俊烨章伟光
陈 韬, 陈贤铬, 徐俊烨, 范 军*, 俞 英, 章伟光,*
(1. 华南师范大学化学与环境学院, 广东 广州 510006; 2. 广州研创生物技术发展有限公司, 广东 广州 510663)
模拟移动床色谱法拆分甲霜灵对映体
陈韬1,陈贤铬1,徐俊烨2,范军1*,俞英1,章伟光1,2*
(1. 华南师范大学化学与环境学院, 广东 广州 510006; 2. 广州研创生物技术发展有限公司, 广东 广州 510663)
摘要:模拟移动床(SMB)色谱作为一种精确、高效的制备色谱技术引起研究者的极大关注。本文以EnantioPak OD填料为手性固定相,正己烷-乙醇(70∶30, v/v)为流动相,在四区模拟移动床上手性拆分甲霜灵外消旋体。采用旋光检测器研究甲霜灵异构体在手性柱上的洗脱顺序;探讨进样浓度、进样流速、各区流速和切换时间等条件对手性分离甲霜灵外消旋体的影响,并与制备色谱进行比较。结果表明:S-(+)-甲霜灵先于R-(-)-甲霜灵被流动相洗脱,R-(-)-甲霜灵在色谱柱上的保留强于S-(+)-甲霜灵;在线性和非线性条件下,模拟移动床都能很好地拆分甲霜灵外消旋体,在优化SMB工艺条件下,S-(+)-甲霜灵和R-(-)-甲霜灵的光学纯度都大于99%;在样品质量浓度为15 mg/mL的条件下,模拟移动床色谱分离的样品量显著高于制备色谱,而流动相消耗仅为后者的1/9。这对于发展大规模色谱拆分甲霜灵工艺具有良好的指导意义。
关键词:模拟移动床色谱;洗脱体积法;手性分离;甲霜灵;洗脱顺序
手性药物对映体在生物体内表现出截然不同的活性,某种对映体具有良好的药效,而其他可能无效,甚至有害[1]。超过25%的商品化农药具有手性特征,但多数仍以外消旋体销售。随着立体化学、环境化学和生命科学的快速发展,手性问题在农药研究中受到重视[2,3]。快速、高效获得光学纯的手性产品成为当前研究热点之一。其中,手性固定相-色谱分离技术[4-6]不仅能对手性对映体进行定性、定量分析,还可用于制备规模的分离。

甲霜灵(图1)是一种在农业中普遍使用的高效杀菌剂[18],其R-异构体具有极强的杀菌效果[19],因此,得到光学纯R-异构体对减少农药使用、降低环境中农药的残留具有重要意义。本文采用EnantioPak OD手性填料,以正己烷-乙醇为流动相,在四区模拟移动床色谱上手性分离甲霜灵外消旋体,研究了进样浓度、进样流速、二区和三区流速、切换时间等操作参数对甲霜灵分离的影响。

图1 甲霜灵对映体的分子结构Fig. 1 Molecular structures of metalaxyl enantiomers
1实验部分
1.1仪器与试剂
岛津LC-15C型高效液相色谱仪,配有Rheodyne 7725型手动进样器(20 μL定量环)和SPD-20A型紫外可见光检测器(日本岛津公司); LC-3000高效液相制备色谱仪(北京创新通恒科技有限公司);模拟移动床色谱配备4台NP7000C型溶剂输送泵(江苏汉邦科技有限公司),以VICI八通旋转阀(美国VALCO公司)控制色谱柱的切换;IBZ Chiralyser-MP型旋光检测器(德国IBZ MESSTECHNIK GMBH)。
甲霜灵(分析纯,98%)(湖北武汉丰竹林化学科技有限公司); 1,3,5-三叔丁基苯(分析纯,纯度>98%)(上海阿拉丁生化科技股份有限公司);正己烷和无水乙醇(分析纯)(天津大茂化学试剂厂); EnantioPak OD分析型色谱柱(150 mm×4.6 mm, 5 μm)和8根EnantioPak OD半制备手性柱(100 mm×10.0 mm, 10 μm)(广州研创生物技术发展有限公司)。
1.2实验方法
1.2.1色谱柱的均一性研究
分别在8根色谱柱上注入1.0 mg/mL甲霜灵外消旋体溶液20 μL,在优化的色谱条件下进行分离,获得甲霜灵对映体在色谱柱上的出峰时间、柱效、分离因子和分离度等数据;再以1,3,5-三叔丁基苯获得死时间(t0)和系统死时间(tD)。根据公式(1)计算空隙率(ε):
(1)
其中Q为流动相流速(mL/min),Vcol为色谱柱的柱体积(mL)。
1.2.2SMB拆分甲霜灵外消旋体
1.2.2.1SMB分离简述
SMB分离甲霜灵对映体的工作在汉邦提供的模拟移动床设备上完成。在四区模拟移动床系统中串联8根EnantioPak OD柱(100 mm×10.0 mm)形成一个闭合回路,每区2根;依据洗脱体积法[20,21]确定系统运行的参数,如各区流速(Qi)、切换时间(t*)和进样流速等;启动系统,由进样泵将一定质量浓度的甲霜灵溶液泵入系统,在EnantioPak OD手性柱上完成拆分,分别接收提取液和提余液;通过高效液相色谱法测定提取液和提余液中甲霜灵异构体的纯度。
1.2.2.2洗脱体积的确定
以高效液相色谱法在EnantioPak OD (100 mm×10.0 mm)柱上分离甲霜灵外消旋体,从色谱图上分别得到两种对映体的洗脱时间,进而计算洗脱体积。此时,流动相为正己烷-乙醇(70∶30, v/v)混合溶液,样品质量浓度为10.0 mg/mL,进样体积为20 μL,紫外检测波长为220 nm。
1.2.2.3SMB操作参数的确定与优化
以洗脱体积法确定SMB操作参数时,应满足以下关系:
QⅠ×t*≥VR,B,Ⅰ
(2)
QⅡ×t*≥VR,A,Ⅱ
(3)
QⅢ×t*≤VR,B,Ⅲ
(4)
QⅣ×t*≤VR,A,Ⅳ
(5)
其中QⅠ、QⅡ、QⅢ、QⅣ为各区流速(mL/min);VR,j,i(j=A, B)为第i区j组分的保留体积(mL), A为弱保留组分,B为强保留组分;t*为切换时间(min),受系统和色谱柱压力的控制。
在本研究中,改变进样浓度、进样流速、二区和三区流速、切换时间等条件来研究SMB分离甲霜灵的影响,优化操作参数以期获得最佳的分离效果。
1.2.3高效液相制备色谱分离甲霜灵
在LC-3000型高效液相制备色谱仪上,应用EnantioPak OD (100 mm×10.0 mm)开展甲霜灵对映体的制备分离研究。色谱条件:流动相为正己烷-乙醇(70∶30, v/v)混合溶液;样品质量浓度为15.0 mg/mL,进样体积为0.4 mL,进样间隔为3.2 min;紫外检测波长为220 nm。
1.2.4HPLC法测定甲霜灵异构体的纯度
将上述提取液或提余液注入EnantioPak OD分析柱(150 mm×4.6 mm),以正己烷-乙醇(70∶30, v/v)混合液为流动相进行色谱分离。此时,进样体积为10 μL,流动相流速为1.0 mL/min,紫外检测波长为220 nm。
2结果与讨论
2.1色谱柱的均一性结果
模拟移动床的分离原理及切换模式意味着每根色谱柱在整个体系中均占据同等地位,在不同的时刻都要承担相应的分离任务,因此性能相近的手性柱才能保证模拟移动床系统稳定运行。如表1所示,在正己烷-乙醇(70∶30, v/v)为流动相的条件下,甲霜灵两对映体的平均保留时间分别为3.090 min和5.095 min,分离度为3.707, RSD (n=8)为1.8%;以1,3,5-三叔丁基苯测得平均孔隙率为0.656 9, RSD (n=8)为0.52%,说明色谱柱具有良好的均一性。在后续工作中,以色谱柱的平均值作为设定模拟移动床操作参数的标准。

表 1 8根半制备EnantioPak OD色谱柱的均一性测试结果
ε: porosity. Chromatographic conditions: mobile phase, hexane-ethanol (70∶30, v/v); sample mass concentration, 1.0 mg/mL; injection volume, 20 μL; detection wavelength, 220 nm; flow rate, 3.0 mL/min; column temperature, 25 ℃.
2.2SMB操作参数对甲霜灵分离的影响
2.2.1操作参数的优化方法
在SMB相关研究中,主要通过三角形理论[1,8]、洗脱体积法[20,21]、驻波设计法[22]和建模优化法[21]等确定其操作参数。在三角形理论中,需要测定吸附等温线,样品消耗量高,同时不同样品浓度下的三角形分离区域不同,参数确定周期较长;而洗脱体积法具有快速、样品消耗量少等特点,在获得每个组分的保留体积的基础上,初步确定SMB操作参数,再进行调整和优化。本文选择以洗脱体积法来确定SMB的操作参数。
图2为甲霜灵外消旋体在EnantioPak OD半制备柱上分离的色谱图。计算可知,强保留组分B的保留体积为21.18 mL,取弱保留组分A最早和最晚出峰的保留体积7.92 mL和12.24 mL代入公式(2)~(5)得到:
QⅠ×t*≥21.18 mL
QⅡ×t*≥12.24 mL
QⅢ×t*≤21.18 mL
QⅣ×t*≤7.92 mL

图2 甲霜灵在EnantioPak OD半制备柱上的HPLC色谱图Fig. 2 HPLC chromatogram of metalaxyl enantiomers on an EnantioPak OD semi-preparative columnChromatographic conditions are the same as in Table 1.
设定切换时间t*为6.0 min,则QⅠ≥3.53 mL/min,QⅡ≥2.04 mL/min,QⅢ≤3.53 mL/min,QⅣ≤1.32 mL/min。在实际应用中,存在传质阻力和轴向弥散等非理想因素,因此以参数代替来确定各区的初始流量,再根据实验结果优化和调整工艺条件。
2.2.2进样浓度的影响
增大进样浓度可以大幅提高模拟移动床分离的样品量。在切换时间为6 min,模拟移动床从Ⅰ区到Ⅳ区的流速分别为3.53、1.34、1.74、1.32 mL/min,进样流速为0.40 mL/min的条件下,研究样品浓度对甲霜灵分离的影响。

表 3 进样流速对SMB分离甲霜灵性能的影响
Switch time: 6 min.
如表2所示,样品质量浓度从1.0 mg/mL增大到30.0 mg/mL (即操作点A1到A5),提取液纯度均大于99%,说明此时第Ⅱ区的洗脱体积足以洗脱弱保留组分。但提余液的纯度随样品质量浓度的增大变化显著。不大于15.0 mg/mL时,提余液纯度均大于99%;而增大到30.0 mg/mL时,样品纯度减小至90.98%。说明随着质量浓度增大,第Ⅲ区洗脱体积将强保留组分从色谱柱上洗脱进入提余液。
2.2.3进样流速的影响
增大进样流速亦可提高进样量,达到提高SMB的处理效率的目的。通过减小第Ⅱ区流速或增大第Ⅲ区流速以增大进样流速,研究其对甲霜灵分离的影响(见表3)。

表 2 样品质量浓度对SMB分离性能的影响
在样品质量浓度为15.0 mg/mL,第Ⅲ区流速为1.80 mL/min的条件下,将第Ⅱ区流速从1.60 mL/min逐步减小至1.30 mL/min,相应进样流速从0.20 mL/min增加到0.50 mL/min (见表3中B1~B5)。结果表明,提余液的纯度基本不变,而提取液纯度从99.36%迅速降低到91.50%,这是由于降低第Ⅱ区流速后,弱保留组分不能完全被洗脱而进入提取液中。
在样品质量浓度为15.0 mg/mL,第Ⅱ区流速为1.34 mL/min的条件下,第Ⅲ区流速从1.84 mL/min逐步增加到1.98 mL/min (见表3中B6~B9),提取液和提余液的纯度同时降低,这可能是因为第Ⅲ区流速增大,使洗脱体积增大,强保留组分部分被洗脱到提余液中;此外,尽管第Ⅱ区流速和洗脱体积不变,但由于进样量增大,更多的弱保留组分分布在第Ⅱ区,需要更大的洗脱体积才能洗脱弱保留组分,故提取液纯度也降低了。
2.2.4第Ⅱ区和第Ⅲ区流速的影响
保持进样流速不变,同时改变第Ⅱ~Ⅲ区的流速亦对SMB分离产生影响。如表4所示,切换时间为6 min,样品质量浓度为30 mg/mL,进样流速为0.4 mL/min的条件下,同时减小第Ⅱ、Ⅲ区的流速(见表4中C1~C3),提取液纯度从99.38%减小到98.69%,而提余液纯度从86.56%增大到95.68%;进一步增大进样流速到0.6 mL/min (见表4中C4~C7),提取液的纯度从98.63%减小到89.03%,而提余液的纯度从71.04%增大到89.13%。可能是因为降低第Ⅱ区流速,减小第Ⅱ区的洗脱体积,已不能满足洗脱全部弱保留组分的要求,进入提取液的弱保留组分增加,提取液的纯度降低。随着第Ⅲ区流速减小,相应减小第Ⅲ区的洗脱体积,不足以洗脱更多的强保留组分,故提余液的纯度增加。
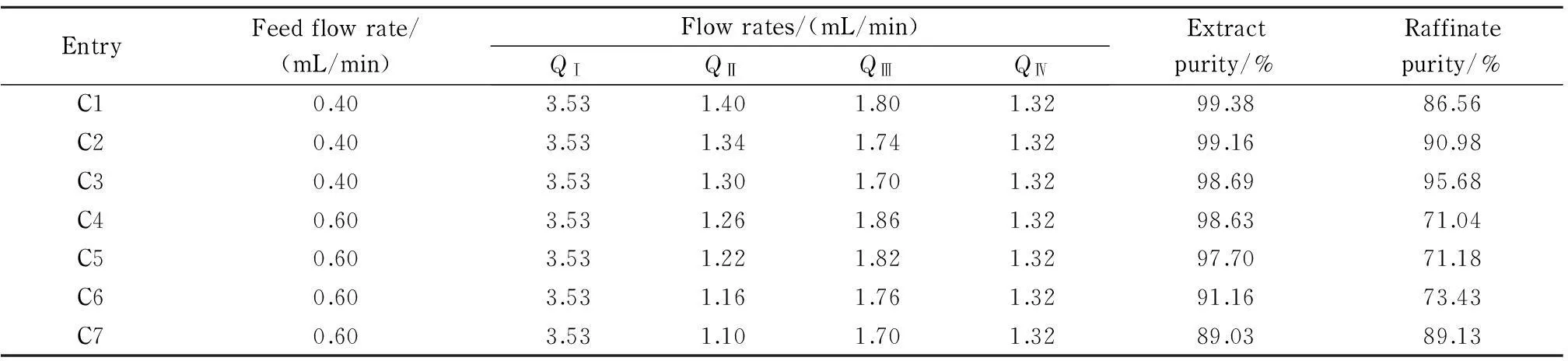
表 4 第Ⅱ区和第Ⅲ区流速对SMB分离性能的影响
Switch time: 6 min; feed mass concentration: 30 mg/mL.
2.2.5切换时间的影响
SMB的切换时间对其分离性能的影响非常显著。在进样质量浓度为30.0 mg/mL,进样流速为0.6 mL/min,第Ⅰ到IV区的流速依次为3.53、1.26、1.86、1.32 mL/min的条件下,研究切换时间对SMB分离性能的影响(见表5)。

表 5 切换时间对SMB分离性能的影响
结果表明,随着切换时间从6.0 min减小到5.0 min,提取液的纯度从98.63%减小到71.83%,而提余液的纯度从71.04%增大到99.67%。说明各区流速不变时,随着切换时间的减小,用于第Ⅱ区和第Ⅲ区的洗脱体积都减小,则第Ⅱ区的洗脱体积逐渐不足以洗脱弱保留组分,部分弱保留组分进入提取液;第Ⅲ区的洗脱体积洗脱强保留组分的量减小,进入提余液的强保留组分减小,提余液的纯度上升。
2.2.6柱尾浓度分布分析
图3为操作点B2和C1条件下的柱尾浓度分布图。在操作点B2条件下(见图3a), 2号色谱柱对应提取液出口,此时甲霜灵弱保留组分的含量很少,强保留组分的含量很高,在流动相自左向右的洗脱下得到高纯度的提取液;6号色谱柱对应提余液出口,此时甲霜灵弱保留组分的含量很高,强保留组分的含量很少,得到高纯度的提余液(见表3)。

图3 操作点(a)B2和(b)C1的柱尾浓度分布图Fig. 3 Concentration distribution of entries (a) B2 and (b) C1
在操作点C1条件下(见图3b), 2号色谱柱对应提取液出口,此时甲霜灵弱保留组分的含量很少,强保留组分的含量很高,在流动相自左向右的洗脱下,得到高纯度的提取液(见表4); 6号色谱柱对应提余液出口,此时甲霜灵弱保留组分含量和强保留组分含量相差不大,弱保留组分含量大于强保留组分,在流动相的洗脱下,弱保留组分和一部分强保留组分都进入提余液。
2.3制备色谱分离甲霜灵的结果
在LC-3000型高效液相制备色谱上制备分离甲霜灵对映体,并与SMB分离甲霜灵的结果(见表3中操作点B8)进行比较。结果表明,在相同样品浓度的条件下,SMB的样品处理量为540 mg/h,约为高效液相制备色谱的5倍,而流动相消耗量为0.31 L/g,仅为高效液相制备色谱的1/9,说明采用SMB的样品处理量更高,而溶剂消耗更低。
2.4甲霜灵对映体的洗脱顺序
对操作点B2下的提余液和提取液进行HPLC分析,分别采用紫外检测器和旋光检测器进行检测(见图4)。
从图4a可知,提取液和提余液的纯度均大于99%。图4b中,使用EnantioPak OD手性柱,以正己烷/乙醇(70∶30, v/v)为流动相时,S-(+)-甲霜灵的保留弱于R-(-)-甲霜灵,先被洗脱,而R-(-)-甲霜灵则较晚被流动相洗脱。

图4 操作点B2条件下提余液和提取液的HPLC色谱图Fig. 4 HPLC chromatograms of the extract and raffinate products under B2 operation conditionsa. UV detector; b. optical rotation detector.
3结论
本文使用EnantioPak OD手性柱,以正己烷/乙醇(70∶30, v/v)为流动相,采用四区模拟移动床手性分离甲霜灵外消旋体。8根半制备色谱柱具有良好的均一性;以洗脱体积法初步确定SMB的运行参数,研究了进样浓度、进样流速、各区的流速和切换时间等因素对SMB分离的影响,通过优化SMB运行参数得到甲霜灵的两种异构体。本研究为开发工业规模色谱分离手性样品提供了一定的理论基础和实验依据。
参考文献:
[1]Rajendran A, Paredes G, Mazzotti M. J Chromatogr A, 2009, 1216(4): 709
[2]Ma Y, Chen L H, Lu X T, et al. Ecotox Environ Safety, 2009, 72(7): 1913
[3]Ye J, Zhao M R, Liu J, et al. Environ Pollut, 2010, 158(7): 2371
[5]Shen J, Ikai T, Okamoto Y. J Chromatogr A, 2014, 1363: 51
[6]Tu H S, Fan J, Tan Y, et al. Chinese Journal of Chromatography, 2014, 32(5): 452
涂鸿盛, 范军, 谭艺, 等. 色谱, 2014, 32(5): 452
[7]Mazzotti M, Storti G, Morbidelli M. J Chromatogr A, 1997, 769(1): 3
[8]Aniceto J P S, Silva C M. Sep Purif Rev, 2015, 44(1): 41
[9]Migliorini C, Gentilini A, Mazzotti M, et al. Ind Eng Chem Res, 1999, 38(10): 2400
[10]Pedeferri M, Zenoni G, Mazzotti M, et al. Chem Eng Sci, 1999, 54(17): 3735
[11]Juza M, Mazzotti M, Morbidelli M. Trends Biotechnol, 2000, 18(3): 108
[12]Langel C, Grossmann C, Jermann S, et al. Ind Eng Chem Res, 2010, 49(23): 11996
[13]Cavoy E, Deltent M F, Lehoucq S, et al. J Chromatogr A, 1997, 769(1): 49
[14]Fuereder M, Panke S, Bechtold M. J Chromatogr A, 2012, 1236: 123
[15]Wang X, Ching C B. Chem Eng Sci, 2005, 60(5): 1337
[16]Jermann S, Alberti A, Mazzotti M. J Chromatogr A, 2014, 1364: 107
[18]Li Y B, Dong F S, Liu X G, et al. Food Chem, 2013, 141(1): 10
[19]Zadra C, Marucchini C, Zazzerini A. J Agric Food Chem, 2002, 50(19): 5373
[20]Wei F, Li M, Huang F M, et al. J Chromatogr A, 2011, 1218(20): 2906
[21]Wei F, Shen B, Chen M J, et al. Ind Eng Chem Res, 2012, 51(16): 5805
[22]Soepriatna N, Wang N H L, Wankat P C. Adsorption, 2014, 20(1): 37
Enantioseparation of metalaxyl racemate by simulated moving bed chromatography
CHEN Tao1, CHEN Xiange1, XU Junye2, FAN Jun1*, YU Ying1, ZHANG Weiguang1,2*
(1. School of Chemistry and Environment, South China Normal University, Guangzhou 510006, China;2. Guangzhou Research & Creativity Biotechnology Co. Ltd., Guangzhou 510663, China)
Abstract:Due to some advantages such as high precision, high efficiency and low consumption of organic solvents, chromatographic separation technique by simulated moving bed (SMB) has attracted considerable attention in the past decades. Herein, the enantioseparation of metalaxyl racemate on EnantioPak OD columns has been carried out by SMB chromatography with the mixture of hexane-ethanol (70∶30, v/v). The elution order of two metalaxyl enantiomers under current chromatographic conditions was determined by HPLC with the optical rotation detector. Then, the influence of running parameters, such as the concentration, flow rate and switch time on the resolution of metalaxyl racemate has been studied in detail. In addition, the separation results from SMB and the preparative chromatography have been compared under the same concentrations. The results showed that the retention of S-(+)-metalaxyl was weaker than R-(-)-metalaxyl and S-(+)-metalaxyl was eluted first. Most importantly, metalaxyl racemate was well separated by SMB chromatography under linear or non-linear conditions, and the purity of each enantiomer product was over 99%. Furthermore, the amount separated by SMB was much more than by the preparative chromatography with racemate concentration of 15 mg/mL, and the mobile phase consumption was one-ninth of the latter. In brief, these results provide us important information for the future development of large-scale chromatographic separation of metalaxyl enantiomers.
Key words:simulated moving bed (SMB) chromatography; elution volume approach; chiral separation; metalaxyl; elution order
DOI:10.3724/SP.J.1123.2015.10024 [4]Shen J, Okamoto Y. Chem Rev, 2015, 10.1021/acs. chemrev.5b00317
*收稿日期:2015-10-16
基金项目:国家自然科学基金项目(21171059,21275056);科技部中小型企业技术创新基金项目(13C26214404534);广东省科技计划项目(2014A010101145,2012B010900043);广州市科技计划项目(2013J4400027,201508020093).
中图分类号:O658
文献标识码:A
文章编号:1000-8713(2016)01-0068-06
色谱手性分离专刊·研究论文
*通讯联系人.Tel:(020)39310187,E-mail:wgzhang@scnu.edu.cn(章伟光);fanj@scnu.edu.cn(范军).
Foundation item: Project of National Natural Science Foundation of China (21171059, 21275056); Innovation Fund for Technology Based Firms, Ministry of Science and Technology, China (13C26214404534); Science and Technology Project of Guangdong Province, China (2014A010101145, 2012B010900043); Guangzhou Science and Technology Project, China (2013J4400027, 201508020093).
