高分子手性固定相的研究进展
2016-06-22戴荣继王慧婷孙维维邓玉林刘秀洁
戴荣继, 王慧婷, 孙维维, 邓玉林, 吕 芳, 刘秀洁
(北京理工大学生命学院, 北京 100081)
高分子手性固定相的研究进展
戴荣继*,王慧婷,孙维维,邓玉林,吕芳,刘秀洁
(北京理工大学生命学院, 北京 100081)
摘要:手性药物的应用对人类健康产生了深远影响。随着化学、材料、生命等学科的发展,人们对手性药物分离分析的研究日趋深入。色谱法在手性药物分离分析中得到了广泛应用,手性固定相的选择是实现手性色谱拆分的关键。以高分子材料作为手性固定相并对其进行衍生以优化手性分离性能是近些年的研究热点。本文介绍了近几年高分子手性固定相在手性分离中的研究进展,并对其发展前景进行了展望。
关键词:高分子材料;手性固定相;手性分离;进展;综述
手性(chirality)是指化合物的分子式和结构式相同,因分子空间排列不同导致两个分子互为镜像和实物的现象[1]。手性药物(chiral drug)是指药物分子结构中引入手性中心后得到的一对互为实物与镜像的对映异构体(enantiomer)。这些对映异构体的理化性质基本相似,仅旋光性质有所差别。目前在约2 000种常用药物中有近500种药物以外消旋体的形式存在。外消旋体药物中可能只有一种对映异构体有药效,其镜像分子却有毒副作用或药效相反或无药效:如左旋巴比妥酸盐抑制神经活动而右旋巴比妥酸盐却兴奋神经;右旋甲状腺素钠可降低血脂而左旋甲状腺素钠对心脏有毒副作用;抗菌药左旋氧氟沙星的药效高于其右旋体数倍。对映异构体也对香料化学和农业化学方面有重要作用:如S-型的香芹酮呈香菜味,R-型却具有荷兰薄荷香味;农药溴氰菊酯的8个异构体中,(3R,1R,S)异构体的杀虫活性是(3S,1S,R)的70多倍。手性药物的分离分析在生物和化学领域一直是研究热点。
色谱法利用固定相与外消旋体之间的作用力不同使流动相洗脱时各组分保留时间不同而实现分离的目的。色谱法以其优良的识别能力成为目前应用最广泛的手性拆分方法,尤其在手性药物的分离分析和纯度检测等方面。常用的手性色谱分离技术包括高效液相色谱法(HPLC)、气相色谱法(GC)、毛细管电色谱法(CEC)等。根据待分离化合物的分子结构选择合适的手性色谱柱非常重要。本文综述了近几年国内外用于拆分手性药物的不同类型的高分子手性固定相及其在色谱分析中的应用。
1环糊精类手性固定相
环糊精(cyclodextrin, CD)是由D-吡喃葡萄糖单元通过α-1,4-糖苷键连接而成的环状结构分子,主要包括α、β、γ3种类型。分子成锥筒形,形成一个空腔洞穴,洞穴的孔径由吡喃葡萄糖的个数决定,空腔内部疏水外部亲水,β-环糊精(β-CD)的结构如图1所示。手性药物的极性基团与环糊精洞口的羟基相互作用,疏水部分则嵌入环糊精洞穴中,形成了稳定性不同但可逆的包合物,使环糊精具有良好的手性识别能力[2]。

图1 β-环糊精的结构Fig. 1 Structure of β-cyclodextrin
多个环糊精单元在高分子链上即构成了环糊精聚合物(cyclodextrin polymer, CDP)。环糊精聚合物保留了环糊精的包合识别功能还兼具聚合物良好的机械强度、稳定性和化学可调性,同时在溶解性上也有一定的改变[3]。目前环糊精聚合物已广泛应用于手性分离中。环糊精聚合物主要分为以下几种:交联型CDP,利用环糊精中的活性羟基与带双官能团或多官能团的化合物交联聚合,其中对环氧氯丙烷为交联剂制成的CDP的研究最多;聚合型CDP,通过在环糊精上引入可聚合基团,再通过合适的条件引发单体聚合;固载化CDP,通过将环糊精连接到高分子载体上制备而成[4]。3类CDP的结构如图2所示。

图2 环糊精聚合物的结构类型[4]Fig. 2 Structures of CDPs[4]
1.1在液相色谱手性分离中的应用
以CD作为手性固定相的高效液相色谱法是手性化合物分离分析的重要手段。CD手性固定相可通过物理涂敷或化学键合制备[5-8]。
1.1.1物理涂敷的CD手性固定相
物理涂敷即通过物理的方法,利用硅胶的吸附特性将CD及其衍生物直接涂敷在裸露的硅球表面,是一种简单有效的固定相制备方法。Ong等[9,10]合成了苯氨基甲酰基和3,5-二甲基苯氨基甲酰基衍生的阳离子型β-CD手性选择剂,通过咪唑鎓盐的β-CD制备而成,用物理涂敷的方法得到了4种新型的β-CD手性固定相,成功分离了18种外消旋的芳基醇并发现手性选择剂单-6-(3-辛基咪唑盐)-6-脱氧苯基氨基甲酰-环糊精氯 (OPCCD)的手性选择能力最佳,且外消旋体芳环的对位带有吸电子基团时更容易实现手性拆分。
CDP手性固定相也可用涂敷方式制备。Carbonnier等[11]首先通过2-羟丙基-β-环糊精在一定反应条件下与环氧氯丙烷缩聚,随后将共聚物物理吸附固定到多孔二氧化硅的表面上。利用不同的多环分子评价其对对映体的分离能力,实验结果证明化合物的双芳香环同时进入选择剂空腔时,选择剂对其有协同包合作用。
1.1.2化学键合的CD手性固定相
化学键合固定相是指将CD及其衍生物通过共价键的形式键合到硅球表面,该制备方法稳定性较强。近些年来CD手性固定相的研究大部分集中于开发新型CD衍生物及通过不同类型链(醚键、尿素、三唑等)键合CD或CD衍生物于硅胶上。
Zhou等[12-14]通过醚键将离子化的β-CD(三内鎓以及咪唑鎓盐)和席夫碱衍生的β-CD手性固定相键合到硅胶上。其中离子型手性固定相在极性有机相下对16种芳香醇对映异构体和两种外消旋药物实现了良好拆分。Chelvi等[15]研发了杯芳烃包覆的手性固定相,通过(羟基丙氧基-β-CD)丙基甲硅烷基键合的二氧化硅和杯芳烃含氧阴离子在N-甲基-2-吡咯烷酮中发生取代反应而生成;该组的Zhao等[16]制备的福霉素帽形-(3-(2-O-β-环糊精)-2-羟基丙氧基)-丙基甲硅烷基键合手性固定相包含利福霉素和β-CD两个手性结合位点,利福霉素作为协同手性选择剂与CD产生协同效应,因此具有更好的手性分离效果,该手性固定相对华法令、柳胺苄心定等16种手性异构体分离较好。
Varga等[17]开发了尿素链连接的新型CD手性固定相,通过将(6-单脲基-6-单脱氧)-全甲基化β-CD键合到手性固定相上,比前人得到的手性柱的分离效果更好,甚至优于商品化的Nucleodex-β-CD手性柱。结果表明苊香豆醇、苯丙香豆素、克拉匹多等系列手性对映体都能在该柱上达到较好的分离。早在1999年Zhang课题组[18]就首次报道了通过尿素键合的CD手性固定相,该课题组[19]2008年合成了单-6-叠氮基-6-脱氧-对-氯苯基氨基甲酸酯化β-CD,它能够与π-碱性外消旋体发生强烈的π-π反应,实现了对11种哌嗪衍生物和6种外消旋体的分离。2013年该组[20]将七取代的6-叠氮基-6-脱氧-2,3-双氧-对-氯苯氨基甲酰化β-CD与硅胶反应,得到的一种多脲键合β-CD手性固定相材料,在极性有机相下对锇苯配合物手性异构体进行分离,这是CD手性固定相拆分手性金属中心锇苯配合物的首次报道。
Wang等[21]报道了基于三唑链连接的新型CD手性固定相,通过对比单三唑链与多重链手性固定相,发现多重链手性固定相的稳定性和分离效果均更佳。2014年Huang等[22]用硫醇-烯点击化学将单/双(10-十一碳烯)苯基氨基羰基-CD固定于3-巯基官能化硅胶上,成功合成了具有明确结构的新型CD手性固定相(CD-CSP),该固定相能够分离15种外消旋化合物。2015年Zhou等[23]合成了一种新的环糊精衍生物单体(6A-N-烯丙基氨基-6A-脱氧)-3-氯-4-甲基-苯基氨基甲酰-β-CD,并将其键合于γ-巯基功能化硅胶的表面上。该手性柱对5种外消旋体化合物实现了良好拆分。2015年Wang等[24]制备了球形β-CD-二氧化硅杂化材料,被分别引入到介孔材料的孔隙通道和孔壁框架的β-CD、乙烷、三嗪基和3,5-二甲基苯基官能团可以提供多重相互作用。该手性柱对某些手性、酸性、苯胺和苯酚化合物表现为多种色谱分离功能,包括外消旋体拆分、阴离子交换和非手性分离与正相/反相色谱的典型特征。结果表明,该手性柱在正相色谱模式下可对苯乙醇腈、1-苯基乙醇和1-苯基-2-丙醇等12种外消旋体完成一定程度的拆分,在反相色谱模式下能够对阿替洛尔、1-苯基乙醇和美西律等12种外消旋体完成一定程度的拆分。
聚合物新型CD固定相在高效液相色谱中的应用包括:2012年Zhang等[25]使用单分散杂交技术通过-CHCH2基团将苯基丙氨酸印迹聚合物键合于二氧化硅微球上,通过与β-CD和甲基丙烯酸两个功能单体对比,说明双功能单体合成的分子印迹聚合物的吸附容量更好,并成功实现了苯基丙氨酸对映异构体的基线分离。2015年王雨潇等[26]利用缩聚法合成了β-CDP,随后将其以化学键合的方式连接到二氧化硅微球上,并对这种键合型手性固定相进行了表征,通过液相色谱法分离安息香、特布他林、普萘洛尔、尼莫地平和氧氟沙星等手性药物。与十八烷基硅烷键合硅胶固定相在相同的色谱条件下进行对比,CDP键合硅胶手性固定相对手性药物的拆分能力更强。β-CDP键合硅胶的合成路线如图3所示。
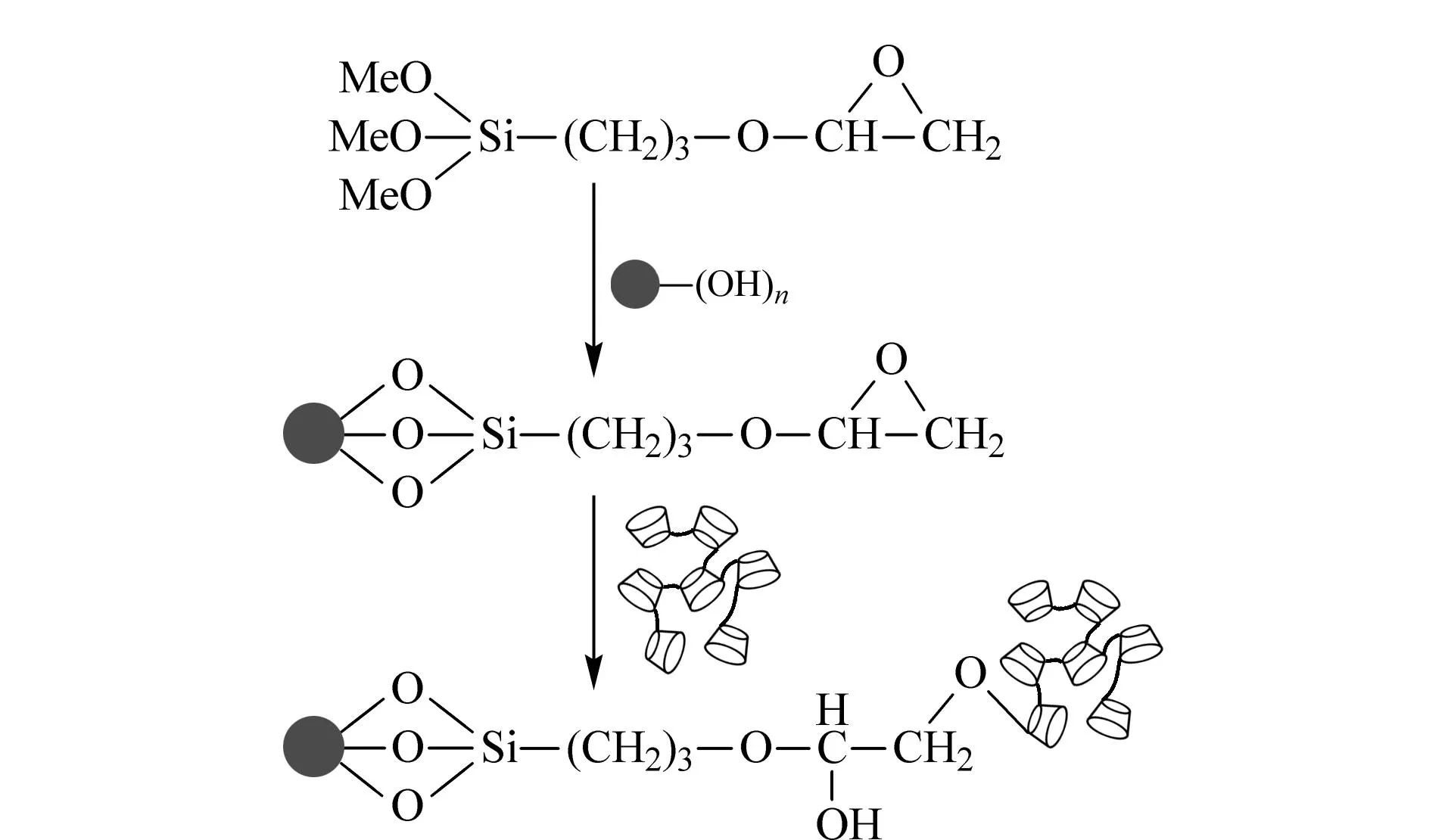
图3 β-CDP键合硅胶的合成路线[26]Fig. 3 Scheme of the synthesis of β-CDP bonded on silica gel[26]
1.2在毛细管电色谱中的应用
毛细管电色谱集成了毛细管电泳和液相色谱的分离模式,通过电渗流驱动流动相及带电溶质经过色谱分离柱,根据各组分在色谱固定相和流动相间的吸附、分配平衡常数及电泳淌度的差异得以分离。毛细管电色谱柱包括开管柱、填充柱及整体柱,以环糊精作为手性分离的固定相在上述三种色谱柱中均有应用。
1.2.1开管柱
开管柱一般使用较小的毛细管,通过在毛细管内壁固定或蚀刻键合手性选择剂等方法制成,简单经济且快速高效。Hong等[27]将硫酸化的β-CD固定在双层氢氧化物中,形成的手性β-CD固定相能对1-苯基-1,2-乙二醇进行手性分离。他们[28]随后通过微波将β-CD的溴乙酸盐取代物固定在胺化石英毛细管内壁形成固定相,使1-苯基-1,2-乙二醇实现基线分离。Li等[29]通过静电聚合作用将聚二烯丙基二甲基氯化铵固定在毛细管内壁上,负电荷的纳米颗粒随后吸附并被固定在管壁内侧,得到的手性柱能实现唑吡酮和扑尔敏等的分离。Deng等[30]将硫酸化的α-CD作为固定相,在7 min内对奥硝唑对映异构体完成分离。Li等[31]以正硅酸乙酯和钛酸丁酯为无机前驱体,柠檬酸-β-CD(CA-β-CD)为有机体,通过溶胶-凝胶法制备CA-β-CD/硅胶-二氧化钛(SiO2-TiO2)有机-无机杂化毛细管电色谱开管柱,并对其制备条件进行优化。应用该杂化开管柱在CEC-MS上对酪氨酸和色氨酸对映体进行了拆分。
聚合物新型CD固定相在开管柱中的应用很多,Chu等[32]把合成的多种新的超支化-聚碳硅烷改性CD(G2-HP-β-CD)固定在毛细管内壁上作为手性固定相,结果表明,G2-HP-β-CD柱能够提供稳定的运行环境,对氧氟沙星和扑尔敏对映异构体的分离效果比较好。Liang等[33]把β-CD功能化的石墨烯氧化磁性纳米复合材料作为可调节的固定相,聚双甲基硅氧烷微通道在外加磁场定位条件下可在极短时间内分离色氨酸对映异构体。2015年Pedehontaa等[34]使用聚电解质多层(PEM)涂层开发了开管毛细管电色谱(OT-CEC)非共价手性固定相。这些手性涂层是由交替冲洗分离毛细管使用的三甲基-β-CD(pCD+)聚合物作为手性选择阳离子和阴离子聚合物制成。这是第一个基于离子CDP层组件的OT-CEC手性固定相,PEM涂层的组合对于手性分离有促进作用。作者还发现最佳固定相是基于一种pCD+/聚(4-苯乙烯磺酸钠)/pCD+的3层涂层,它对于中性和阴离子溶质的手性分离效果很好。
1.2.2填充柱
Wang等[35]通过点击反应制备全苯基异氰酸酯基CD衍生物手性固定相,该手性柱能够分离某些芳基乙醇异构体。Yang等[36]研究金纳米颗粒(9.5±2.5) nm经巯基化的β-CD功能化形成手性固定相,该固定相可完成对二硝基苯氨基酸及3种手性药物的分离。
1.2.3整体柱
Hsieh等[37]利用硅酸甲酯与β-CD进行溶胶-凝胶反应形成具有多孔性网状结构的硅胶,该熔融硅胶毛细管柱可对羟基萘二磺酸对映异构体和几种同分异构体进行分离。Guo等[38]通过芳基叠氮和末端炔的Huisgen环加成反应将β-CD共价结合到硅胶柱上,得到了亲水性β-CD手性柱并成功实现了布洛芬的分离。Li等[39]把经过CD修饰的金纳米颗粒键合到硫醇化多孔聚合物整体柱的表面,得到的手性柱能对氯苯那敏、佐匹克隆、托比卡胺进行分离。2015年Ghanem等[40]以2,3,6-三(苯基氨基甲酰基)-β-CD-6-甲基丙烯酸酯作为功能性单体制备的手性柱能对卡布特罗、异环磷酰胺、1-茚满醇等10多种手性药物实现基线分离。
整体柱中聚合物固定相的研究一直是热点,Li等[41]通过将NH2-β-CD、天门冬氨酸-β-CD和羟丙基-β-CD等单体与甲基丙烯酸甘油酯(GMA)上环氧基进行开环反应,然后键合于固定相表面,制备poly(GMA-co-EDMA)(EDMA=乙二醇二甲基丙烯酸酯)整体柱。该柱能够对氨基酸类手性化合物进行分离。Lv等[42]在poly(GMA-co-EDMA)整体柱上共价键合乙二胺-β-CD(EDA-β-CD),该手性柱能够对布洛芬对映异构体进行分离。2011年Gu等[43]第一次用甲基丙烯酸酯-β-CD单体与交联剂EDMA聚合制备毛细管电色谱手性固定相,实现了对环己烯巴比妥的良好分离。李英杰等[44]将烯丙基缩水甘油醚(AGE)和β-CD在碱性条件下作用得到带有α烯基的环糊精衍生物4-(3-烯丙氧-2-羟基)丙氧基-β-环糊精(PCD),利用这种衍生物和GMA为功能单体,在毛细管中通过原位聚合反应,一步法制备了新型-β-环糊精聚合物毛细管电色谱手性整体柱。在CEC模式下,应用制备的手性整体柱对3种氨基酸和手性药物愈创甘油醚对映体进行拆分,并考察了有机调节剂、缓冲溶液pH值及柱温对拆分效果的影响。结果显示,在最优色谱条件下,4种对映体均得到基线分离,分析时间小于8 min,新型手性整体柱具有较强的手性拆分能力,且重现性好、操作简单。Bragg等[45]通过β-CD上的伯醇羟基与GMA上的环氧基反应获得GMA-β-CD,然后将GMA-β-CD和EDMA交联,制得的手性柱成功分离了32种手性化合物。Marwa等[46]以2,3,6-三苯氨甲酰基-β-CD-6-甲基丙烯酸酯与二甲基丙烯酸乙二醇酯在毛细管中原位聚合后制备了毛细管整体柱,以甲醇和水为流动相对普萘洛尔、异环磷酰胺、阿普洛尔和1-茚满醇等手性药物实现了基线分离。该方法所制备的毛细管柱机械稳定性和重复性好,流动相温和、经济,可与纳升级反相液相色谱联用,扩大了毛细管柱的适用范围。
2多糖型手性固定相
多糖型手性固定相主要包括纤维素、直链淀粉以及它们的衍生物所制得的固定相[47]。多糖如纤维素和直链淀粉都是由D-葡萄糖单元构成,虽然它们本身有一定的手性识别能力,但直接用作手性固定相时选择性比较低,衍生后则表现出较好的手性识别能力[48],结构如图4所示。

图4 淀粉及纤维素类商品化手性固定相的结构[48]Fig. 4 Commercialized chiral stationary phase structures of starch and cellulose[48]
2.1在液相色谱手性分离中的应用
2.1.1涂敷型手性固定相
日本的Okamot课题组[49]对多糖类手性固定相进行了深入系统的研究,制备了上百种多糖类衍生物涂敷型手性固定相。如经典的涂敷型纤维素-三(3,5-二甲基苯基氨基甲酸酯)手性固定相(Chiralpak OD柱)和直链淀粉-三(3,5-二甲基苯基氨基甲酸酯)手性固定相(Chiralpak AD柱)对外消旋体都显示了较强的识别能力,能拆分70%左右的常见手性化合物[50]。该课题组[51]使用吡啶基和联吡啶基异氰酸酯对微晶纤维素羟基进行修饰,制备了手性柱,结果表明,该手性柱对芳香族氨基酸类物质有较好的分离能力。2012年Tang等[52]采用4种不同取代位置的氯甲基苯基异氰酸酯两两选择性取代纤维素2,3,6-位上的羟基,并考察其手性识别能力。其中纤维素-2,3-二(3-氯-4-甲基苯基甲酸酯)-6-(3,5-二甲基苯基甲酸酯)和纤维素-2,3-二(3,5-二甲基苯基甲酸酯)-6-(3-氯-4-甲基苯基甲酸酯)手性识别能力最强。
2.1.2键合型手性固定相
虽然涂敷型CSPs具有广泛的手性识别能力,但其无法在二氯甲烷等流动相中使用的缺陷限制了它的进一步应用。2011年Okamoto小组[53]将未衍生的纤维素溶解后涂敷于氨丙基硅胶并加入二异氰酸酯双官能键合试剂进行键合反应,最后衍生剩余羟基。该方法简化了6-位上羟基的保护与脱保护步骤。Tang等[54]制备了纤维素-2,3-二(3,5-二甲基苯基氨基甲酸酯),然后与3-环氧丙氧基三乙氧基硅烷进行开环反应,最后用3,5-二甲基苯基异氰酸酯衍生剩余的羟基得到手性固定相。Tang等[55]通过4-(三甲氧基硅基)苯基衍生纤维素羟基,再利用三乙氧基硅基的缩聚反应制备键合型手性固定相,乙酰丙酮钴、三氟蒽基乙醇等手性化合物被分离,该方法还用于叔丁基苯基氨基甲酸酯多糖类衍生物手性固定相的制备[56-58]。
2.2在毛细管电色谱中的应用
Xiao等[59]用纤维素-三(3,5-二甲苯基氨基甲酸酯)涂敷在聚丙烯酰胺处理毛细管,考察了制备的手性柱对12种包括酸性、中性以及碱性手性化合物的拆分,其中成功分离了9种手性化合物且重复性和稳定性良好。Perez-Fernandez等[60]用纤维素-三(甲苯基氨基甲酸酯)和纤维素-三(4-氯-3-甲苯基氨基甲酸酯)制备了两种新型纤维素手性固定相,对包括除草剂、杀虫剂和杀真菌剂的16种手性农药进行拆分,前者成功分离了7种手性农药,后者成功分离了9种。
2.3在膜分离中的应用
膜分离技术与色谱分离技术相比成本低、能耗低、稳定性强、易于连续操作。杨猛[61]用乙基纤维素分别制备了手性固定相和手性膜,考察了它们对手性化合物的分离效果,结果表明该手性固定相能对9种手性化合物实现不同程度的分离;在手性膜对(R,S)-2-苯基-1-丙醇的拆分实验中,对映体过剩值(ee)达到90%以上。Yoshikawa等[62-64]以三醋酸纤维素(CTA)为原料并加以修饰,制备了一系列纳米纤维素膜并考察其对光学纯氨基酸的分离效果,发现纳米纤维素膜表现出良好的手性识别和拆分能力。
3金属-骨架化合物手性固定相
金属-有机骨架材料(metal-organic frameworks, MOFs)是由金属离子(或金属簇)与含氮氧等多齿有机配体(如芳香多酸和多碱等)利用分子组装和晶体工程方法构建的一类具有周期性一至三维网络结构的多孔晶体材料,又名多孔配位聚合物[65,66]。
3.1在液相色谱手性分离中的应用
MOFs材料具有多孔性、高比表面积、多功能性和化学稳定性等特点,近年来新MOFs材料不断地被合成,在高效液相色谱中具有广泛的应用前景。
对手性MOFs的研究目前还处于初始阶段:2007年第一篇关于手性MOFs分离手性化合物的报道出现,Nuzhdin等[67]首先合成了手性[Zn2(bdc)(L-lac)(dmf)]·DMF(bdc=对苯二甲酸, L-lac=L-乳酸, dmf和DMF=二甲基甲酰胺),用该固定相制成的手性柱在不同条件下成功分离了烷基苯基亚砜类化合物;Padmanaban等[68]制备了(Zn4O(BTB)4/3(BDC))(BTB=苯-1,3,5-三苯甲酸酯,BDC=对苯二甲酸)手性柱并分离了1-苯基乙醇;2012年Tanaka等[69]制备了(R)-MOF-silica手性柱并成功分离了烷基苯基亚砜类物质,分离度达到1.33。袁黎明课题组先后在2013、2014年用4种金属-骨架化合物制备了手性固定相,应用[(CH3)2NH2][Cd(bpdc)1.5](bpdc=4′,4-联苯双酯)手性固定相对1-(4-氯苯基)乙醇、联糠醛、1,2-二苯乙醇酮等10种手性化合物[70]; [Zn2(D-Cam)2(4,4′-bpy)]n(D-Cam=D-樟脑酸,bpy=联吡啶)手性固定相对1-(9-蒽基)-2,2,2-三氟乙醇、1-(1-萘基)-乙醇、联糠醛等9种手性化合物[71]; [Cd2(D-Cam)3]·2Hdma54dma52H2O(dma=二甲胺)手性固定相对1,1′-2-萘酚、1,2-二苯乙醇酮、1,2-二苯基-1,2-乙二醇等9个手性化合物[72]; [Cu2(D-Cam)2(4,4′-bpy)]手性固定相对1-(9-蒽基)-2,2,2-三氟乙醇、1-(1-萘基)-乙醇、2-苯基-1-丙醇等6个化合物[73]实现了不同程度的拆分。
3.2在气相色谱手性分离中的应用
MOFs材料因其比表面积高、孔尺寸大和热稳定性高,故较适合用作气相色谱固定相。近年来,已有一些研究小组将MOFs材料作为固定相制备了气相色谱填充柱,但该类研究仍处于初级阶段。2006年Chen等[74]首次将金属-有机骨架材料用于气相色谱固定相。他们使用微多孔晶体Zn-(BDC)(4,4′-Bipy)0.5(4,4′-Bipy=4,4′-联吡啶)作固定相分离了烷烃类混合物。2011年袁黎明课题组[75]合成了一种三维单手螺旋结构的MOFs材料[{Cu(sala)}n],用动态涂渍的方法制备了气相色谱固定相,该固定相能够对香茅醛、樟脑、丙氨酸和亮氨酸等11种手性化合物进行分离(见表1),柱效可达3 600塔板/m。随后该课题组[76]合成了具有固有手性拓扑结构的三维开放骨架材料Co(D-Cam)1/2(bdc)1/2(tmdpy)(tmdpy=4,4′-(1,3-丙二基)双吡啶),并把该材料涂渍到毛细管柱制备手性固定相。该固定相能够对香茅醛、柠檬烯和谷氨酸等6种手性化合物进行分离,且柱效达到3 100塔板/m。该课题组[77]用Co(D-Cam)1/2(bdc)1/2(tmdpy)作毛细管柱内壁的粗糙化材料,静态法涂渍全戊基-β-CD固定相,与未结合该材料的两种固定相的分离效果对比,其结合促进分离效果明显。该课题组[78]使用一种具有蜂巢状三维通道的手性金属-有机骨架材料[Mn3(HCOO)4(D-Cam)]n涂敷制备的手性柱能对丙氨酸、蛋氨酸、亮氨酸和苯基-琥珀酸4种手性化合物进行拆分,柱效达1 760塔板/m。该课题组[79]使用D-樟脑酸有机配体合成了一种具有钻石网络结构和左手螺旋通道的多孔手性MOFs材料InH(D-C10H14O4)2(D-C10H14O4),将其涂渍制备手性柱,能对香茅醛、1-苯基-1,2-乙二醇、苯乙醇等7种手性化合物进行拆分,且柱效达3 000塔板/m。该课题组[80]在2015年将手性MOFs材料InH(D-C10H14O4)2(D-C10H14O4)用作毛细管柱内壁的粗糙化材料,然后静态法涂渍全戊基-β-CD固定相,对照两种未结合的固定相,发现结合后的固定相分离效果更佳。手性MOFs材料作为一种新型手性固定相具有一定的应用前景。

表 1 [{Cu(sala)}n]手性柱对外消旋手性化合物的拆分[75]
a) trifluoroacetyl isopropyl ester derivate; b) trifluoroacetyl derivate; c) isopropyl ester derivate.
3.3在毛细管电色谱手性分离中的应用
2012年Yan课题组[81]将ZIF-8(沸石咪唑酯骨架-8)晶体用于毛细管电泳,实验结果表明该材料作为拟固定相(pseudostationary phase)对邻、间、对-硝基苯酚和苯二酚的拆分具有加强作用;2013年Huang等[82]、Li等[83]、Xu等[84]用金属-骨架化合物对一些化合物进行了分离,但都未能拆分手性化合物。袁黎明课题组[85]首先合成了手性MOFs材料[Zn2(D-Cam)2(4,4′-bpy)]n并将其制成毛细管电色谱开管柱,考察了缓冲溶液的pH值、流动相中乙腈的含量以及缓冲溶液的浓度对二氢黄酮和吡喹酮2种手性化合物拆分的影响。该课题组[86]还合成了具有开放金属位点的手性MOFs材料[In3O(obb)3(HCO2)(H2O)]·solvent,分别采用独立填充和与硅胶混合填充毛细管电色谱手性柱(柱A和柱B),对1,2-二苯基-1,2-乙二醇、克伦特罗和1-苯基-1,2-乙二醇进行拆分,发现柱A比较长的柱B分离时间更短。
4蛋白质类手性固定相
蛋白质是由很多氨基酸组成的具有复杂三维结构的高分子聚合物,其亚单位L-氨基酸具有手性特异性,因此蛋白质具有识别手性化合物的能力。蛋白质类手性固定相的优点是可使用水作流动相且手性选择能力良好;缺点是稳定性差和载样量小,影响其在制备色谱中的应用。
高效液相色谱法中常以牛血清白蛋白(BSA)[87,88]、人血清白蛋白(HSA)[89]、α1-酸性糖蛋白(α1-AGP)[90]和卵类粘蛋白(OV)等作为手性固定相。Bhushan等[91]以茚三酮作为可逆的标记试剂,利用AGP手性固定相对2种含硫氨基酸、半胱氨酸(Cys)和D,L-青霉胺(PenA)进行分离,优化了分离条件使分离度大于2并进行制备。林丽娜等[92]以α1-酸性糖蛋白为手性固定相,以抗胆碱药甲溴后马托品溴化物及硫酸阿托品的对映体为拆分对象建立了相应的方法。结果表明,α1-酸性糖蛋白手性固定相可以使二者得到完全分离。Akapo等[93]使用AGP为手性固定相,对福莫特罗的4种立体异构体建立了分离分析方法并进行了验证。章伟光课题组[94,95]通过羰基咪唑键合BSA到硅胶上得到键合BSA手性柱,在反相色谱体系中拆分了色氨酸、匹多莫德、N-(2,4-二硝基苯基)氨基酸衍生物、甘草素、安息香和氧氟沙星等,并对流动相的pH值、离子强度、进样浓度和柱温等条件进行了考察。该课题组[96]发现使用有机修饰剂会改变BSA的空间构型和立体环境从而对BSA的拆分能力产生影响。在对N-(2,4-二硝基苯基)-脯氨酸(DNP-pro)和N-(2,4-二硝基苯基)-丝氨酸(DNP-ser)进行拆分时发现流动相中乙腈的含量、pH值等条件的改变会引起手性识别反转现象,且二者存在协同效应(见图5),这一发现对日后的研究具有一定意义。关于HSA和OV也有相关报道:HSA与聚GMA-EDMA结合[97]后对氨基酸的拆分效果较好;OV柱[98]对人血清中的多沙唑嗪对映体进行拆分。Yao等[99]利用BSA对β-CD衍生化,以2,4,6-三氯基-1,3,5-三嗪作为交联剂,该手性固定相对色氨酸、氢化苯偶姻、苯丙氨酸和扁桃酸的对映体进行了拆分。

图5 pH值引起(a)DNP-pro和(b)DNP-ser在BSA手性固定相上洗脱顺序的逆转[96]Fig. 5 pH-induced reversal of elution order on the BSA-CSP (a for DNP-pro and b for DNP-ser)[96]
5大环抗生素手性固定相
大环抗生素(macrocyclic antibiotic)类化合物分子有几个到几十个手性中心,它们有立体的环状结构、芳香基团和氨基、羟基等活性基团。大环抗生素类手性固定相除具有手性识别能力外还具有高稳定性,相体系转化时不发生老化和变性,因此在对映异构体化合物的分离方面应用前景良好[100]。
大环抗生素手性固定相已应用于液相色谱的手性药物拆分。Ghassempour等[101]用含氨基的硅烷化试剂与大环抗生素直接反应,分别得到了万古霉素手性固定相和万古霉素降解产物手性固定相,并对6个手性化合物实现了拆分,分离因子最高达9.7,表现出一定的手性分离能力。张大同等[102]使用含氨基的硅烷化试剂与大环抗生素间接反应,以1,6-二异氰酸酯作为间隔臂制得了万古霉素手性固定相,再与苯异氰酸酯反应后制得了苯异氰酸酯衍生化万古霉素手性固定相。结果表明,万古霉素手性固定相对拉米夫定、拉米夫定的L-薄荷醇酯、酞胺哌啶酮和盐酸氟西汀均达到了基线分离,苯异氰酸酯衍生化手性固定相实现了拉米夫定、拉米夫定的L-薄荷醇酯和酞胺哌啶酮的基线分离。Sipos等[103]用包括游壁菌素(Astec chirobiotic T and T2)、糖苷游壁菌素(Chirobiotic TAG)、万古霉素(Chirobiotic V)和糖苷万古霉素(Chirobiotic VAG)在内的5种大环糖肽抗生素商品柱,以0.1%三乙胺醋酸盐的甲醇为流动相,对4种特定的手性异恶唑琳衍生物进行了分离。Fernandes等[104]使用Chirobiotic T、Chirobiotic TAG、Chirobiotic V和Chirobiotic R(瑞斯托菌素)大环抗生素手性商品柱在反相模式条件下对7对氧杂蕙酮衍生物对映体等度洗脱,其中6对手性化合物得到一定程度的分离。张丹丹等[105]应用3种大环抗生素类手性固定相Chirobiotic V、Chirobiotic T和Chirobiotic R对盐酸克伦普罗对映体进行拆分,发现在新极性有机相模式下且流动相中同时含有三乙胺和乙酸时,Chirobiotic V和Chirobiotic T手性固定相对盐酸克伦普罗对映体可实现一定程度的分离,而结构中缺少羧基的Chirobiotic R手性固定相无法对其分离,因此推测盐酸克伦普罗对映体与大环抗生素类固定相之间的离子相互作用是实现对映体分离的最主要分离机制。Hefnawy等[106]使用大环抗生素Chirobiotic V成功拆分了大鼠血浆中的特他洛尔。
6结语
手性与生命过程息息相关,随着化学、材料、生命等学科的发展,寻找分离效率高、稳定性好、适用范围广的手性固定相从而实现对复杂手性药物的识别与分离已十分必要,同时仍需对手性固定相的识别机理、新型固定相材料的设计及合成方法、新型手性分离技术进行更加深入的研究。
参考文献:
[1]Yuan L M. Chiral Recognition Materials. Beijing: Science Press, 2010
袁黎明. 手性识别材料. 北京: 科学出版社, 2010
[2]Koppenhoefer B, Graf R, Holzschuh H, et al. J Chromatogr A, 1994, 666: 557
[3]Li N, Zhang Y H, Xiong X L. Polymer Bulletin, 2005(6): 1
李宁, 张韵慧, 熊晓莉. 高分子通报, 2005(6): 1
[4]Liang Y. [MS Dissertation]. Changsha: Hunan Normal University, 2007
梁源. [硕士学位论文]. 长沙: 湖南师范大学, 2007
[5]Tang J, Zhang S, LinY Z, et al. Sci Rep, 2015, 5: 11523
[6]Zhao J, Lu X H, Wang Y, et al. J Chromatogr A, 2015, 1381: 253
[7]Yao X B, Tan T T, Wang Y. J Chromatogr A, 2014, 1326: 80
[8]Lin C, Liu W, Fan J, et al. J Chromatogr A, 2013, 1283: 68
[9]Ong T T, Wang R Q, Muderawan I W, et al. J Chromatogr A, 2008, 1182: 136
[10]Wang R Q, Ong T T, Ng S C. J Chromatogr A, 2008, 1203: 185
[11]Carbonnier B, Janus L, Deratani A, et al. E-Polymers, 2003, 4: 1
[12]Zhou Z M, Li X. Anal Chim Acta, 2010, 678(2): 208
[13]Li X, Zhou Z M, Zhou W H, et al. Analyst, 2011, 136(23): 5017
[14]Li X, Zhou Z M, Xu D, et al. Talanta, 2011, 84(4): 1080
[15]Chelvi S K T, Yong E Y H. J Chromatogr A, 2008, 1203: 54
[16]Zhao J, Tan D, Chelvi S K T, et al. Talanta, 2010, 83(1): 286
[17]Varga G, Tarkanyi G, Nemeth K, et al. J Pharm Biomed Anal, 2010, 51(1): 84
[18]Zhang L F, Wong Y C, Chen L, et al. Tetrahedron Lett, 1999, 40(9): 1815
[19]Zhang Z B, Zhang W G, Luo W J, et al. J Chromatogr A, 2008, 1213: 162
[20]Lin C, Liu W N, Fan J, et al. J Chromatogr A, 2013, 1283: 68
[21]Wang Y, Young D J, Tan T T Y, et al. J Chromatogr A, 2010, 1217: 7878
[22]Huang G, Ou J J, Zhang X D. Electrophoresis, 2014, 35(19): 2752
[23]Zhou J, Pei W J, Zheng X X, et al. J Chromatogr Sci, 2015, 53(5): 676
[24]Wang L T, Dong S Q, Han F, et al. J Chromatogr A, 2015, 1383: 70
[25]Zhang Z H, Zhang M L, Liu Y N, et al. Sep Purif Technol, 2012, 87(1): 142
[26]Wang Y X, Bao J M, Li Y X. Fine Chemicals, 2015(9): 968
王雨潇, 包建民, 李优鑫. 精细化工, 2015(9): 968
[27]Hong J E, Yang Y, Su P, et al. Anal Chem, 2009, 64(4): 393
[28]Hong J E, Su P, Farooq M U, et al. Anal Lett, 2010, 43(15): 2372
[29]Li M, Liu X, Jiang F Y, et al. J Chromatogr A, 2011, 1218: 3725
[30]Deng X L, Yuan Y Z, Adams E. Talanta, 2013, 106: 186
[31]Li Y J, Xu H M, Lü R J, et al. Chinese Journal of Analysis Laboratory, 2015, 34(3): 292
李英杰, 徐红梅, 吕仁江, 等. 分析试验室, 2015, 34(3): 292
[32]Chu Y J, Xu W C, Edgar J S, et al. Appl Polym Sic, 2011, 122(4): 216
[33]Liang R P, Liu C M, Meng X Y, et al. J Chromatogr A, 2012, 1266: 92
[34]Pedehontaa-Hiaa G, Guerrouache M, Carbonnier B, et al. Chromatographia, 2015, 18(7/8): 533
[35]Wang Y, Xiao Y, Tan T Y, et al. Electrophoresis, 2009, 30(4): 705
[36]Yang L, Chen C J, Liu X, et al. Electrophoresis, 2010, 31(10): 1697
[37]Hsieh M L, Li G Y, Chau L K, et al. J Sep Sci, 2008, 31(10): 1819
[38]Guo Z, Jin Y, Liang T, et al. J Chromatogr A, 2009, 1216: 257
[39]Li M, Tarawally M, Liu X, et al. Talanta, 2013, 109: 1
[40]Ghanem A, Ahmed M, Ishii H, et al. Talanta, 2015, 132: 301
[41]Li Y, Song C, Zhang L, et al. Talanta, 2010, 80(3): 1378
[42]Lv Y, Mei D, Pan X, et al. J Chromatogr B, 2010, 878(26): 2461
[43]Gu C, Shamsi S A. Electrophoresis, 2011, 32(19): 2727
[44]Li Y J, Liang H, Lü R J, et al. Scientia Sinica Chimica, 2010, 40(11): 1682
李英杰, 梁辉, 吕仁江, 等. 中国科学: 化学, 2010, 40(11): 1682
[45]Bragg W, Shamsi S A. J Chromatogr A, 2012, 1267: 144
[46]Marwa A, Ashraf G. J Chromatogr A, 2014, 1345: 115
[47]Addadi K, Sekkoum K, Belboukhari N, et al. Chirality, 2015, 27(5): 332
[48]Tang M, Lin H S, Zheng C. Pharmacy Today, 2010(1): 7
唐敏, 林汉森, 郑澄. 今日药学, 2010(1): 7
[49]Okamoto Y, Yashima E. Angew Chem Int Ed, 1998, 37(8): 1021
[50]Okamoto Y, Kaida Y. J Chromatogr A, 1994, 666: 403
[51]Katoh Y, Tsujimoto Y, Yamamoto C, et al. Polym J, 2010, 43: 84
[52]Tang S W, Li X F, Wang F, et al. Chirality, 2012, 24(2): 167
[53]Tang S, Liu G, Li X, et al. J Sep Sci, 2011, 34(15): 1763
[54]Tang S, Ikai T, Tsuji M, et al. J Sep Sci, 2010, 33(9): 1255
[55]Tang S, Ikai T, Tsuji M, et al. Chirality, 2010, 22(1): 165
[56]Li J Q, Ikai T, Okamoto Y. J Sep Sci, 2009, 32(17): 2885
[57]Sugiura Y, Yamamoto C, Ikai T, et al. Polym J, 2010, 42(1): 31
[58]Shen J, Ikai T, Okamoto Y. J Chromatogr A, 2010, 1217: 1041
[59]Xiao L D, Ren A W, Jing D, et al. Electrophoresis, 2008, 29(4): 919
[60]Perez-Fernandez V, Dominguez-Vega E, Chankvetadze B, et al. J Chromatogr A, 2012, 1234: 22
[61]Yang M. [MS Dissertation]. Kunming: Yunnan Normal University, 2008
杨猛. [硕士学位论文]. 昆明: 云南师范大学, 2008
[62]Sueyoshi Y, Fukushima C, Yoshikawa M. J Membrane Sci, 2010, 357: 90
[63]Kawasaki T, Yoshikawa M. Desalin Water Treat, 2013, 51(25/26/27): 5080
[64]Sueyoshi Y, Utsunomiya A, Yoshikawa M. J Membrane Sci, 2012, 401: 89
[65]Wei W Y, Fang J, Kong H N, et al. Progrss in Chemistry, 2005, 17(6): 1110
魏文英, 方键, 孔海宁, 等. 化学进展, 2005, 17(6): 1110
[66]Zhai R, Jiao F L, Lin H J, et al. Chinese Journal of Chromatography, 2014, 32(2): 107
翟睿, 焦丰龙, 林虹君, 等. 色谱, 2014, 32(2): 107
[67]Nuzhdin A L, Dybtsev D N, BryliakovK P, et al. J Am Chem Soc, 2007, 129(43): 12958
[68]Padmanaban M, Mueller P, Lieder C, et al. Chem Commun, 2011, 47(44): 12089
[69]Tanaka K, Muraoka T, Hirayama D, et al. Chem Commun, 2012, 48: 8577
[70]Zhang M, Pu Z J, Chen X L, et al. Chem Commun, 2013, 49: 5201
[71]Zhang M, Xue X D, Zhang J H, et al. Anal Methods, 2014, 6(2): 341
[72]Zhang M, Wang B J, Zi M, et al. Asian J Chem, 2014, 26(8): 2226
[73]Zhang M, Zhang J H, Zhang Y, et al. J Chromatogr A, 2014, 1325: 163
[74]Chen B L, Liang C D, Yang J, et al. Angew Chem Int Ed, 2006, 45(9): 1390
[75]Xie S M, Zhang Z J, Wang Z Y, et al. J Am Chem Soc, 2011, 133(31): 11892
[76]Xie S M, Zhang X H, Zhang Z J, et al. Anal Bioanal Chem, 2013, 405(10): 3407
[77]Liu H, Xie S M, Ai P, et al. Chem Plus Chem, 2014, 79(8): 1103
[78]Xie S M, Zhang Z J, Yuan L M. Chemical Journal of Chinese Universities, 2014, 35(8): 1652
谢生明, 张泽俊, 袁黎明. 高等学校化学学报, 2014, 35(8): 1652
[79]Xie S M, Zhang X H, Zhang Z J, et al. Anal Lett, 2013, 46(5): 753
[80]Yang J R, Xie S M, Liu H, et al. Chromatographia, 2015, 78(7/8): 557
[81]Li L M, Wang H F, Yan X P. Electrophoresis, 2012, 33(18): 2896
[82]Huang H Y, Lin C L, Cheng Y J. Anal Chim Acta, 2013, 779: 96
[83]Li L M, Yang F, Wang H F. J Chromatogr A, 2013, 1316: 97
[84]Xu Y Y, Xu L F, Qi S D, et al. Anal Chem, 2013, 85(23): 11369
[85]Fei Z X, Zhang M, Zhang J H, et al. Anal Chim Acta, 2014, 830: 49
[86]Fei Z X, Zhang M, Xie S M, et al. Electrophoresis, 2014, 35(24): 3541
[87]Hong T T, Zheng Y, Hu W W, et al. Anal Biochem, 2014, 464: 43
[88]Liang R P, Meng X Y, Liu C M, et al. Microfluid Nanofluid, 2014, 16(1/2): 195
[89]Pfaunmiller E L, Hartmann M, Dupper C M. J Chromatogr A, 2012, 1269: 198
[90]Matsunaga H, Haginaka J. J Chromatogr A, 2014, 1363: 96
[91]Bhushan R, Kumar R. J Chromatogr A, 2009, 1216(15): 3413
[92]Lin L N, Zhang H Y, Guo X J. Journal of Shenyang Pharmaceutical University, 2010, 27(1): 52
林丽娜, 张华燕, 郭兴杰. 沈阳药科大学学报, 2010, 27(1): 52
[93]Akapo S, McCrea C, Gupta J, et al. J Pharmaceut Biomed, 2009, 49(3): 632
[94]Wang Q Y, Xiong Y J, Lu B Z, et al. Chirality, 2013, 25(9): 487
[95]Xiong Y J, Su W C, Zhang W G, et al. Chinese Journal of Analytical Chemistry, 2012, 40(1): 89
熊雅进, 苏文翠, 章伟光, 等. 分析化学, 2012, 40(1): 89
[96]Wang Q Y, Xiong Y, Lu B, et al. J Sep Sci, 2013, 36(8): 1343
[97]Yao C H, Qi L, Qiao J, et al. Talanta, 2010, 82(4): 1332
[98]Liu K, Zhong D F, Chen X Y. J Chromatogr B, 2010, 878(26): 2415
[99]Yao B X, Yang X M, Guo L Z, et al. J Chromatogr Sci, 2014, 52(10): 1233
[100]Zhang S Q, He S H. Chemical Reagents, 2013, 35(5): 427
张淑琼, 何树华. 化学试剂, 2013, 35(5): 427
[101]Ghassempour A, Abdollahpour A, Tabarheydar K, et al. Chromatographia, 2005, 61(3/4): 151
[102]Zhang D T, Cai X J. Chinese Journal of Analytical Chemistry, 2008, 36(6): 849
张大同, 蔡小军. 分析化学, 2008, 36(6): 849
[103]Sipos L, Ilisz I, Nonn M, et al. J Chromatogr A, 2012, 1232: 142
[104]Fernandes C, Tiritan M E, Cassd Q, et al. J Chromatogr A, 2012, 1241: 60
[105]Zhang D D, Zhang X L. Journal of Analytical Science, 2015, 31(3): 393
张丹丹, 张晓琳. 分析科学学报, 2015, 31(3): 393
[106]Hefnawy M, Asiri Y A. Chirality, 2011, 23(4): 333
Advances in polymer materials as chiral stationary phase
DAI Rongji*, WANG Huiting, SUN Weiwei, DENG Yulin, LÜ Fang, LIU Xiujie
(School of Life Science, Beijing Institute of Technology, Beijing 100081, China)
Abstract:The applications of chiral drugs had a profound impact on human health. With the development of disciplines of chemistry, materials and life science, the research on the separation and analysis of chiral drugs became intensified. Chromatography and the selection of chiral stationary phase played important roles in resolving chiral drugs. The optimization of polymer materials and their derivatives as chiral stationary phase become the main issue in recent years. Recent studies as well as prospects in polymer materials used as chiral stationary phase are presented in this paper.
Key words:polymer materials; chiral stationary phase; chiral separation; advances; review
DOI:10.3724/SP.J.1123.2015.10023
*收稿日期:2015-10-15
基金项目:国家自然科学基金项目(81503353).
中图分类号:O658
文献标识码:A
文章编号:1000-8713(2016)01-0034-10
色谱手性分离专刊·专论与综述
*通讯联系人.Tel:(010)68949331,E-mail:dairongji@bit.edu.cn.
Foundation item: National Natural Science Foundation of China (Grant No. 81503353).
