濒危羊踯躅自然居群的遗传多样性和遗传结构分析
2016-06-17程马龙戴亮芳罗向东刘梦露程彦秋谢建坤
程马龙,戴亮芳,罗向东,刘梦露,周 毅,程彦秋,谢建坤
濒危羊踯躅自然居群的遗传多样性和遗传结构分析
程马龙,戴亮芳,罗向东*,刘梦露,周毅,程彦秋,谢建坤
(江西师范大学 生命科学学院,南昌 330022)
摘要:利用12对微卫星(SSR)分子标记对涉及6省8个羊踯躅自然居群193个体的遗传多样性和遗传结构进行分析,探讨羊踯躅遗传多样性水平与分化程度的可能原因,为羊踯躅的保护提供科学依据。结果显示:(1)12对SSR引物共扩出260个等位基因,每个位点的平均等位基因数为21.667,平均有效等位基因数(Ne)为5.425,平均多态信息含量(PIC)为0.900;物种水平的Shannon 多样性指数(I)为1.768,基因多样性指数(H)为0.777。(2)江西金溪(JX)的羊踯躅居群的遗传变异最丰富,福建政和(ZH)的遗传多样性水平最低。(3)基于无限等位基因模型(IAM)的遗传分化系数(Fst)为0.142,基因流(Nm)为1.522;AMOVA分析显示羊踯躅居群内变异(87.71%)大于居群间变异(12.29%)。(4)遗传距离法聚类NJ分析和Structure分析均表明,8个自然群体被分为三大类群;Mantel检测发现,羊踯躅遗传距离与地理距离无显著相关性。研究表明,羊踯躅最好以就地保护为主,应优先保护江西金溪(JX)居群,同时增加对福建政和(ZH)和湖北京山(JS)居群的保护权重。讨论了羊踯躅较高遗传多样性和中等程度分化的可能原因。
关键词:羊踯躅;SSR;遗传多样性;濒危植物保护
羊踯躅(R.molle),又名黄杜鹃、闹羊花等,是中国杜鹃花科羊踯躅亚属中仅有的1个原生种[1],具有较高的观赏价值,是杜鹃花色品种改良的重要资源[2-3]。此外,羊踯躅全株器官均含有多种活性成分,具有重要的药用价值,其提取物可治疗温疟、慢性肾小球肾炎、高血压和类风湿等病[4-5];对血吸虫和作物害虫也具有非常好的灭杀效果[6]。
20世纪80年代以前,羊踯躅遍及华中、华南,尤其在江苏、浙江、安徽、江西和湖北等省比较多见,西南地区也有少量分布。但由于人们多年来的滥挖乱采及生境的破坏,羊踯躅的生殖环节受到严重影响,羊踯躅野外分布的地区和种群数量急剧减少,栖息地已呈“岛屿化”,有些省份野外已难见其踪影,羊踯躅濒于灭绝的风险日益加剧,亟待加以保护[7]。
遗传多样性分析是评价和保护稀有濒危物种的重要指标,能够反映一个物种适应环境的能力和对环境变迁持续进化的潜力和效应,它能为确定濒危植物优先保护种群和制定有效的取样策略提供重要依据[8]。简单重复序列(Simple sequence repeat,SSR),广泛存在于真核基因组中,具有共显性、高度重复性、高度丰富性等优点,是研究群体遗传多样性的理想工具[9-10]。为了揭示濒危羊踯躅自然居群遗传多样性和遗传结构特征,利用课题组前期开发的12对羊踯躅微卫星(SSR)标记分析其自然居群的遗传多样性和遗传结构,研究结果可为羊踯躅野生资源保护和可持续利用策略的制定提供科学依据。
1材料和方法
1.1材料采集
实验材料采集于2014和2015年的4月中旬至
5月上旬,样品采自江西省金溪县、鄱阳县、永修县,福建省政和县,安徽省金寨县,湖南省邵东县,湖北省京山县,浙江省磐安县,共8个居群,合计193份个体样品,每个个体样品间隔至少10 m,采集好的样品用冰袋盒保存带回实验室,液氮速冻后,放入-80℃冰箱保存。利用GIS数据采集器记录各采样点地理经纬度,各居群的基本情况见表1。
1.2DNA提取和PCR扩增
参照王军等[11]方法提取羊踯躅幼叶基因组DNA。采用1%琼脂糖凝胶电泳和紫外分光光度计检测DNA样品的浓度和纯度,-20 ℃下保存备用。15 μL的PCR扩增体系包括7.5 μL 2×TaqPCR green mix(北京鼎国昌盛生物技术有限公司提供),上下游SSR引物(表2)各1.0 μL,ddH2O 4 μL,基因组DNA 1.5 μL。反应条件为:94 ℃预变性3 min;94 ℃变性45 s,55 ℃(部分引物56 ℃)退火45 s,72 ℃复性1 min,35个循环;72 ℃延伸7 min,最后4 ℃保存。扩增产物以20 bp DNA ladder作为分子量标记,在8%非变性聚丙烯酰胺凝胶中电泳,缓冲液为1×TBE(pH 8.3)。150 V恒压电泳90 min,银染染色[12],在灯箱上拍照。
1.3数据统计与分析
根据分子量大小估计一对等位基因,记录条带的碱基数大小(例如,分子量大小为120 bp的纯合条带可记为120/120;分子量为120 bp和126 bp的杂合条带记为120/126),条带缺失记为“0/0”,得到SSR表型数据。首先,利用 GenALEx 6.1软件[13]计算各遗传多样性指数;利用POPGENE计算Nei’s多样性指数(H)、遗传分化系数(Fst)及基因流(Nm)[14];其次,利用GenALEx 6.1软件中的分子方差(AMOVA)功能进一步分析遗传变异在羊踯躅居群间、居群内的遗传分化水平;随后采用PowerMarker V3.25软件对各位点分析多态性信息量(PIC)指数,计算遗传距离(D)和遗传一致度(GI);运用Neighbor joining(NJ)算法构建聚类图,并利用GenALEx 6.1计算地理距离,经Mantel检测,分析其与遗传距离的相关性。最后采用STRUCTURE 2.3.4软件分析群体结构[15],估计最佳群体组数K,K取1~13,10次重复,采用Structure Harvester计算△K值作为最佳K值衡量标准[16]。
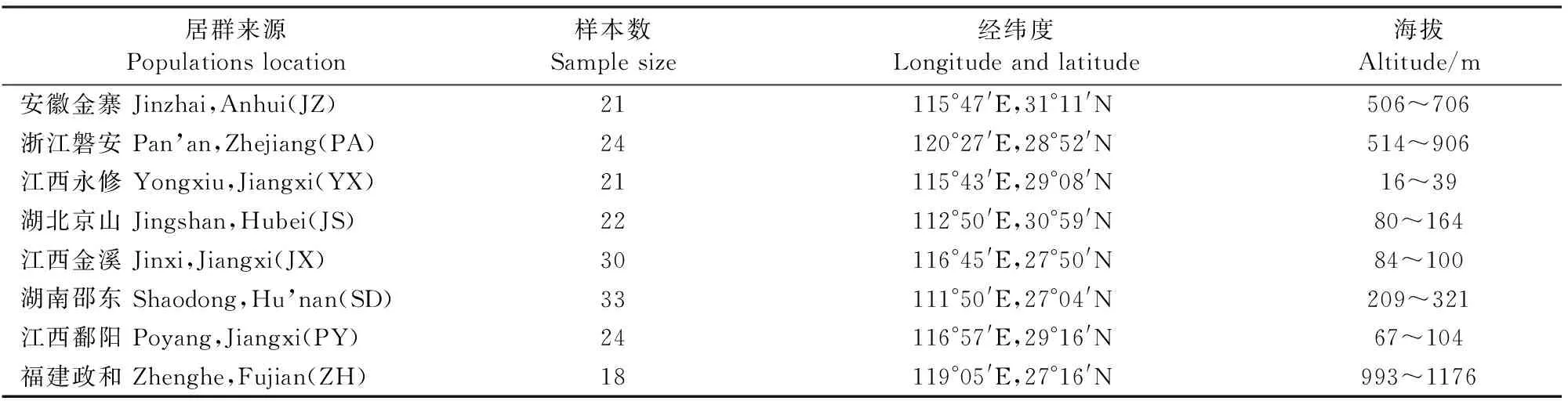
表1 羊踯躅居群采样基本数据
2结果与分析
2.1羊踯躅SSR位点多态性
本研究利用12个多态性引物对羊踯躅8个自然居群共193个个体进行SSR分析,总共扩出260个等位基因,平均每个位点等位基因数为21.667,扩增片段长度在90~182 bp之间。本研究所用的12对SSR引物多态性较好,扩增条带清晰,如图1中引物HD88对邵东群体扩增结果所示。分析表明,不同位点扩增出的等位基因数差异较大,其中位点变异最少的是HD83,为14个,最多的是HD34、HD39和HD64,均为26个(表2)。12个位点的多态性信息含量(PIC)在0.790~0.941,平均值为0.900,显示羊踯躅遗传背景的复杂性。各位点的遗传分化系数Fst值差异也较明显,处于0.067~0.251,平均值为0.142,表明居群内变异大于居群间变异。
2.2羊踯躅自然居群的遗传多样性
遗传多样性分析结果显示(表3),8个羊踯躅自然居群中的有效等位基因数为4.087~6.905,平均为5.425,其中最高为金溪(JX)居群,政和(ZH)居群最低。Nei’s基因多样性指数(H)变化范围为0.706~0.820,平均值为0.777,8个居群的遗传变异(Nei’s基因多样性)排序由低到高依次为政和(ZH)<京山(JS)<永修(YX)<鄱阳(PY)<金寨(JZ)<磐安(PA)<邵东(SD)<金溪(JX)。Shannon指数(I)平均值为1.768(1.493~2.009),其遗传多样性排序顺序与Nei’s基因指数(H)的结果基本一致(表3)。综合各遗传多样性参数的分析结果表明,金溪(JX)地区羊踯躅群体内蕴含较丰富的遗传变异,邵东(SD)、磐安(PA)次之,金寨(JZ)、鄱阳(PY)、永修(YX)、京山(JS)4个地区居群遗传多样性水平居中,政和(ZH)居群遗传多样性水平最低。
M.20 bp DNA ladder
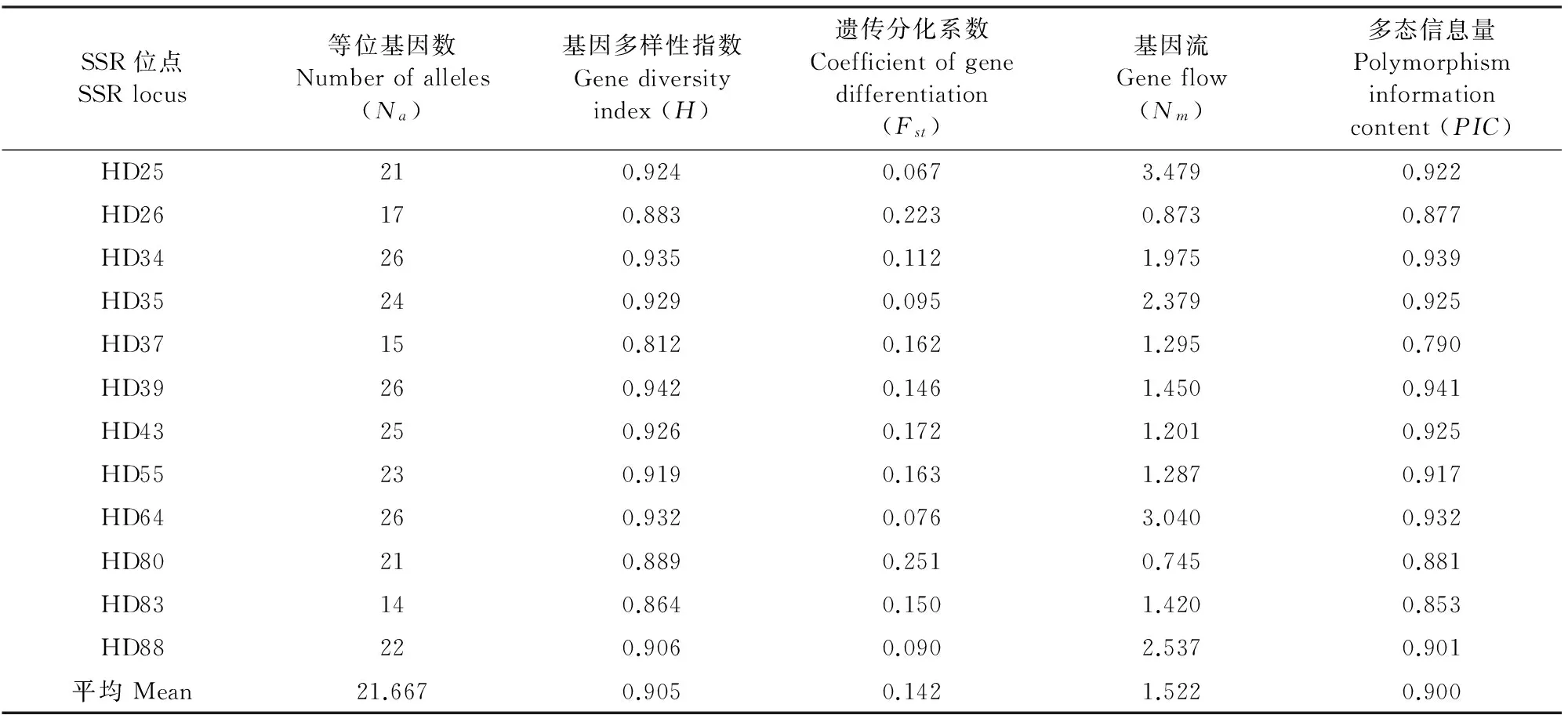
表2 羊踯躅12个SSR位点遗传多样性
2.3羊踯躅自然居群的遗传结构特征
2.3.1羊踯躅自然居群的AMOVA分析羊踯躅8个自然居群遗传分化水平的分子方差分析结果表明(表4),羊踯躅群体的变异大部分存在于居群内(87.71%),居群间的遗传变异为12.29%(P<0.001)。该结果与由Nei’s指数计算的群体间分化系数(Fst=0.142)检测的结果一致。同时,羊踯躅居群平均基因流Nm为1.522(表2),表明羊踯躅居群间可能通过杂交或基因渗透产生一定程度的基因交流,从而削弱了因遗传漂变引起的居群间分化程度。
2.3.2羊踯躅居群间遗传距离与NJ聚类分析遗传距离(D)和遗传一致度(GI)分析表明(表5),羊踯躅各居群Nei’s遗传距离及遗传一致度的平均值分别为0.142 6和0.866 2,表明各居群亲缘关系比较近。浙江磐安(PA)与湖南邵东(SD)居群遗传一致度最大,为0.905 4,同时遗传距离最小,为0.099 4。江西永修(YX)与福建政和(ZH)居群一致度最小,为0.805 5,两者间遗传距离最大,为0.216 3。经Mantel检测发现,羊踯躅各居群间的遗传距离与地理距离无显著相关(r=-0.164,P=0.248)。
不同羊踯躅居群所构建的NJ聚类结果(图2)表明,8个居群主要分为3个类群,永修(YX)、京山(JS)居群为Ⅰ类,金寨(JZ)、金溪(JX)、政和(ZH)和鄱阳(PY)居群聚为Ⅱ类,磐安(PA)与邵东(SD)2个居群间遗传距离最小,关系最密切,聚为Ⅲ类。
2.3.3羊踯躅自然居群的Structure分析基于贝叶斯算法的Structure结果显示,羊踯躅各居群出现了一定的遗传分化(图3)。△K最大值所对应的K值为3,表明羊踯躅自然居群Structure分析的最适K值为3。Structure分析结果显示,羊踯躅8个居
群可分成3大组,分别用3种颜色来表示(图4),可以看出,金寨(JZ)、金溪(JX)、政和(ZH)居群聚为一组,磐安(PA)、邵东(SD)、鄱阳(PY)居群聚为一组,永修(YX)、京山(JS)为一组。进一步比较分析发现,Structure分析结果与基于遗传距离法的NJ聚类结果基本一致,即除鄱阳(PY)居群外,其余7个居群的聚类结果完全一致。进一步对8居群分为3组进行AMOVA分析发现,羊踯躅组间遗传变异为6.86%(表4),组间平均分化系数Φst为0.069(P<0.001),再次说明羊踯躅自然居群组内变异大于组间变异。

表3 羊踯躅自然居群的遗传多样性
注:居群代号同表1;下同。
Note:Population codes are same as table 1;The same as below.
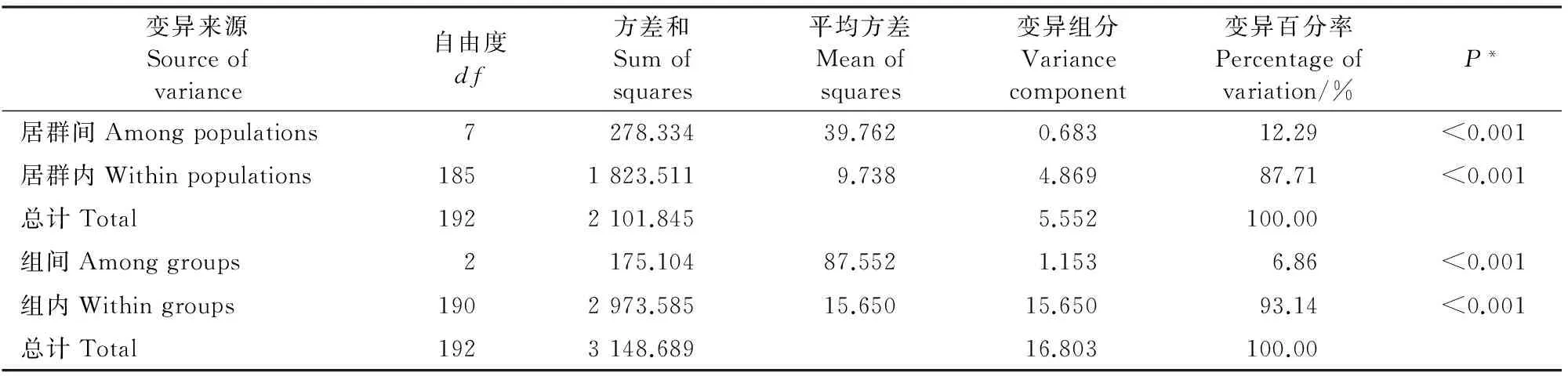
表4 羊踯躅遗传分化水平的方差分析(AMOVA)
注:*P值表示比观测值变异大的概率,这个概率是通过把居群中的样本经过1 000次随机排列改变计算得到的。
Note:*Pvalues are the probabilities of having a more extreme variance component than the observed values alone.Probabilities were calculated by 1 000 random permutations of individuals across populations.

表5 Nei’s遗传距离(下三角)与遗传一致度(上三角)
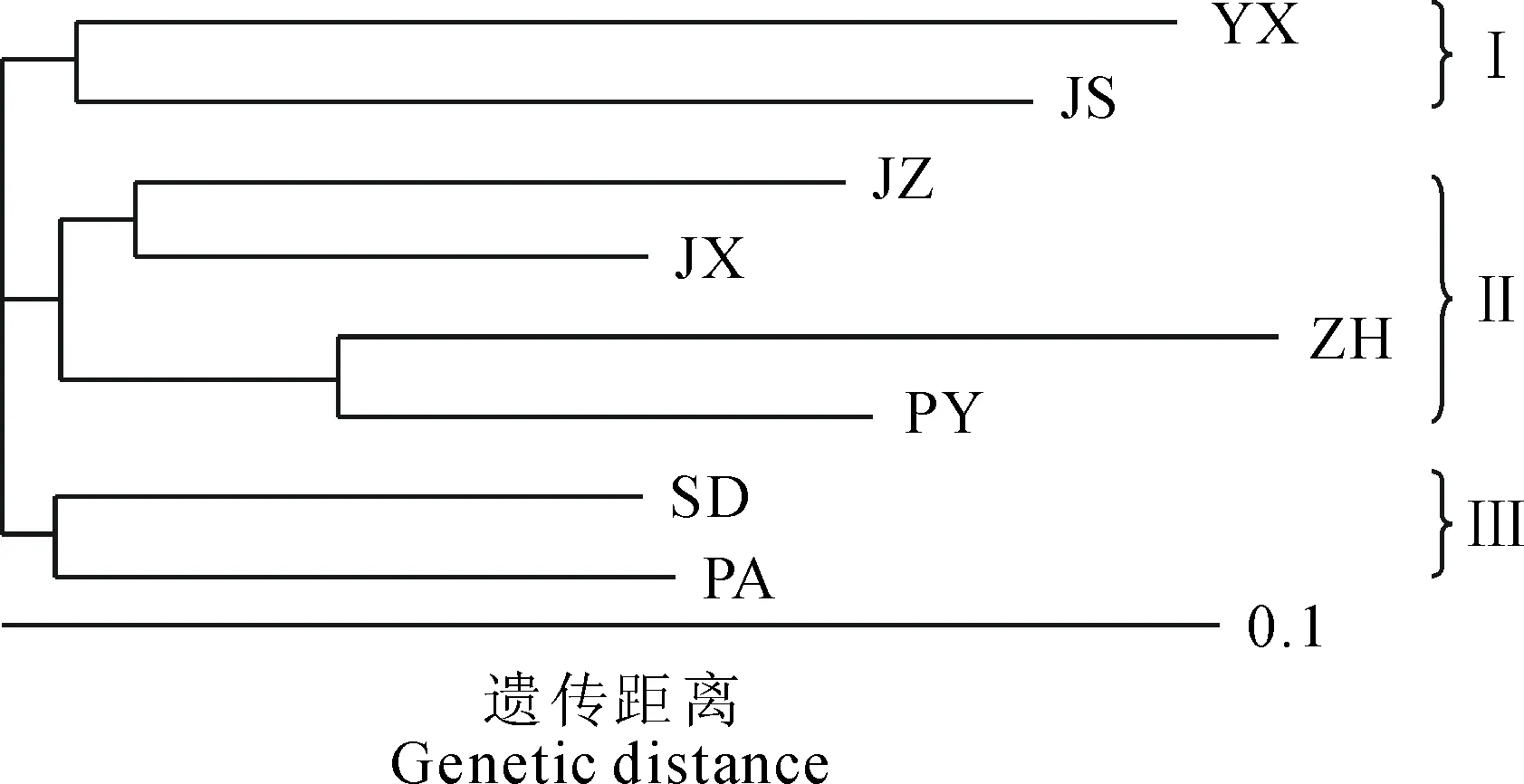
图2 羊踯躅群体间NJ聚类分析
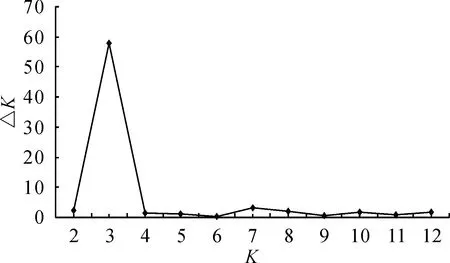
图3 利用△K对群体结构进行分析

1~8分别为JZ、PA、YX、JS、JX、SD、PY和ZH居群;相同的颜色代表一个类群。
3讨论
遗传多样性是物种长期生存和保持进化潜力的物质基础,是生物多样性保护的重要组成部分。一般而言,特有种、濒危种的遗传多样性水平较低[17],但也有些能保持较高水平的遗传多样性[18]。羊踯躅是中国羊踯躅亚属中仅有的一个原生种,由于其药用价值和园艺观赏价值,人为滥挖造成生境破坏,分布逐渐呈现片断化,最终导致羊踯躅成为濒危种[19]。本研究中,12对SSR标记分析显示羊踯躅具有较高的遗传多样性(PIC=0.900,I=1.768,H=0.777),高于此前利用ISSR标记分析江西羊踯躅的遗传多样性[20](I=0.5007,H=0.3342)以及同属的美容杜鹃[21](I=0.4972,H=0.3386),稍低于SSR标记分析的66个杜鹃品种遗传多样性[22](PIC=0.838,I=2.2293),究其原因,一方面可能研究的自然居群大小及生态类型不同所致;另一方面可能是羊踯躅为多年生、寿命较长植物,原本分布范围较为广泛,长期的居群演化和延续已使其沉积较多遗传变异,只是后期过度采挖及其生境遭破坏出现片断化,但片断化时间不长,遗传多样性处在散失阶段。
片断化生境对种群的遗传结构和遗传多样性水平产生很大影响。一般而言,生境片断化降低有效居群大小,造成物种适应环境能力下降,同时也可能会因为遗传漂变和近交衰退而使居群间产生遗传分化,进而降低该种群的生存能力,由此在后代产生遗传瓶颈[23]。我们的研究显示,羊踯躅种群间分化系数Fst为0.142,属中等程度分化[24],且遗传变异主要存在于居群内。AMOVA分析也表明羊踯躅群体变异中87.71%发生于居群内,居群间遗传变异仅为12.29%,基于Structure分析分为三组后的AMOVA分析也揭示居群内遗传变异大于居群间遗传变异。上述指标表明,羊踯躅经历居群片断化之后居群内呈中等程度的分化,究其原因可能是居群间还存在一定程度基因流。Slatkin[25]认为当Nm>1时,基因流可以抵消居群间因遗传变异引起的居群分化,本研究中羊踯躅居群间Nm为1.522,表明影响羊踯躅8个居群遗传结构的主要因素可能是基因流,而花粉和种子的扩散是植物基因流主要两种形式[26]。根据杜鹃花科花粉具粘性和种子细小具有膜翅特征[22],推测虫媒和风媒是较远距离传播基因流的主要方式。
此外,分布区气候因子、生境多样性及人工栽培等因素,均对遗传多样性及遗传结构变异模式产生较大影响[27]。我们野外实地调查发现,羊踯躅主要分布在海拔20~1200 m的山脊或沿路山坡,各省羊踯躅居群所处生境有很大不同。邵东(SD)、政和(ZH)及江西3个居群属于非保护区内居群,多处于已垦荒的丘陵,多与里白科、杜鹃科等灌木伴生,人类开垦、砍伐挖掘等因素干扰比较明显,致使羊踯躅居群数量锐减,剩下的多以零散分布为主。京山(JS)、金寨(JZ)、磐安(PA)3个居群处在森林自然保护区,多与杉科、松科等乔木伴生,自然居群生境破坏较少,但也遭到了不同程度人为因素的破坏。因此对羊踯躅野生居群的保护亟需重视。本研究的Structure分析和NJ聚类分析均表明,8个居群可以分为三大类,均显示永修(YX)、京山(JS)聚为一组,磐安(PA)、邵东(SD)聚为一组,金寨(JZ)、金溪(JX)、政和(ZH)居群聚为一组,表明各自然居群的遗传多样性与地理距离无直接相关性。由于该物种的海拔分布、生境和种群数量各不相同,羊踯躅的保护最好以就地保护为主。金溪(JX)的遗传多样性水平比较高,应优先保护;但由于政和(ZH)和京山(JS)居群均有一定数量的野生幼苗,应增加保护权重。另外,迁地保护、植物组织培养之后人工栽培也是保存野生羊踯躅的遗传多样性有效途径,而具体取样策略还待进一步对幼苗遗传多样性进行分析之后制定。
参考文献:
[1]张长芹.杜鹃花[M].北京:中国建筑工业出版社,2003.
[2]张长芹,罗吉凤.杜鹃花新品种‘金踯躅’和‘紫艳’[J].园艺学报,2002,29(5):502-502.
ZHANG C Q,LUO J F.NewRhododendronvarieties—‘Jinzhizhu’ and ‘Ziyan’ [J].ActaHorticulturaeSinica,2002,29(5):502-502.
[3]URESHINO K,MIYAJIMAL I,AKABANE M.Effectiveness of three-way crossing for the breeding of yellow-flowered evergreen azalea[J].Euphytica,1998,104:113-118.
[4]LIU Z L,GOH S H,HO S H.Screening of Chinese medicinal herbs for bioactivity againstSitophiluszeamaisMotschulsky andTriboliumcastaneum(Herbst)[J].JournalofStoredProductsResearch,2007,43(3):290-296.
[5]CHENG X A,XIE J J,HU M Y,etal.Induction of intracellular Ca2+and pH changes in Sf9 insect cells by rhodojaponin-III,a natural botanic insecticide isolated fromRhododendronmolle[J].Molecules,2011,16(4):3 179-3 196.
[6]蔡雄,赵红梅.羊踯躅提取物对日本血吸虫虫卵肉芽肿影响[J].中兽医医药杂志,2012,3:50-52.
CAI X,ZHAO H M.Influence ofRhododendronmolleextraction on egg granuloma caused by Schistosomajaponicum [J].JournalofTraditionalChineseVeterinaryMedicine,2012,3:50-52.
[7]WANG S,LIN S,ZHU C,etal.Highly acylated diterpenoids with a new 3,4-secograyanane skeleton from the flower buds ofRhododendronmolle[J].OrganicLetters,2010,12(7):1 560-1 563.
[8]EDUARDOV C,MARIE-STÉPHANIE S,PAUL G,etal.Genetic structure in peripheral Western European populations of the endangered speciesCochleariapyrenaica(Brassicaceae) [J].PlantSystematics&Evolution,2011,297:75-85.
[9]SUTAPA D,GIRIRAJ K,BIKRAM P S,etal.Development of genic-SSR markers by deep transcriptome sequencing in pigeonpea [Cajanuscajan(L.) Millspaugh][J].BMCPlantBiology,2011,11:17-17.
[10]TAN C C,WU Y Q,CHARLES M T,etal.Development of simple sequence repeat markers for bermudagrass from its expressed sequence tag sequences and preexisting sorghum SSR markers[J].Mol.Breeding,2012,29:23-30.
[11]王军,杨传平,刘桂丰.木本植物基因组DNA提取及鉴定[J].植物研究,2006,26(5):589-594.
WANG J,YANG C P,LIU G F.Extraction of genomic DNA from woody plants and its identification[J].BulletinofBotanicalResearch,2006,26(5):589-594.
[12]高东,杜飞,朱有勇.低背景、高分辨率PAGE简易银染法[J].遗传,2009,31(6):668-673.
GAO D,DU F,ZHU Y Y.Low-background and high-resolution contracted silver-stained method in polyacrylamide gels electrophoresis[J].Hereditas,2009,31(6):668-673.
[13]PEAKALL R,SMOUSE P E.GENALEX 6,genetic analysis in Excel.Population genetic software for teaching and research[J].MolecularEcologyNotes,2006,6:288-295.
[14]YEH F C,YANG R C.Boyle T.POPGENE VERSION 1.31,Microsoft window-based freeware for population genetic analysis[M].Edmonton,University of Alberta,Canada,1999.
[15]PRITCHARD J K,STEPHENS M,DONNELLY P.Inference of population structure using multilocus genotype data[J].Genetics,2000,155:945-959.
[16]EVANNO G,REGNAUT S,GOUDET J.Detecting the number of clusters of individuals using the software Structure:a simulation study[J].MolecularEcology,2005,14:2 611-2 620.[17]HAMRICK J L,GODT M J W.Effects of life history traits on genetic diversity in plant species [J].PhilosophicalTransactionsoftheRoyalSocietyinLondon,SeriesB,1996,351:1 291-1 298.
[18]RICHTER T S,SOLTIS P S,SOLTIS D E.Bottleneck-induced dissolution of self-incompatibility and inbreeding consequences inAsterfurcatus(Asteraceae) [J].AmericanJournalofBotany,1994,94:965-971.
[19]罗向东,戴亮芳,罗建林,等.濒危黄杜鹃的离体快速繁殖体系研究[J].西北植物学报,2010,30(4):645-651.
LUO X D,DAI L F,LUO J L,etal.Invitromicropropagation of the endangeredRhododendronmolleG.Don [J].ActaBot.Boreal.-Occident.Sin.,2010,30(4):645-651.
[20]周毅.中国特有植物羊踯躅遗传多样性的ISSR分析[D].南昌:江西师范大学,2007.
[21]赵冰,郑茜子,李厚华.秦岭山区美容杜鹃5个野生种群遗传多样性的ISSR分析[J].广西植物,2015,35(5):761-767.
ZHAO B,ZHENG X Z,LI H H.Genetic diversity of five wild populations ofRhododendroncalophytumin Qinling,China by ISSR analysis [J].Guihaia,2015,35(5):761-767.
[22]周泓.杜鹃花品种资源多样性研究及品种分类体系构建[D].杭州:浙江大学,2012.
[23]YAO X H,ZHANG J J,YE Q G,etal.Fine-scale spatial genetic structure and gene flow in a small,fragmented population ofSinojackiarehderiana(Styracaceae),an endangered tree species endemic to China [J].PlantBiology,2011,13(2):401-410.
[24]WRIGHT S.Evolution and the genetics of populations,vol 4,variability within and among natural populations [M].Chicago,University of Chicago Press,1978.
[25]SLATKIN M.Estimating levels of gene flow in natural populations [J].Genetics,1981,99(2):323-335.
[26]李海生,陈桂珠.海南岛红树植物海桑遗传多样性的ISSR分析[J].生态学报,2004,24(8):1 657-1 663.
LI H S,CHEN G Z.Genetic diversity of mangrove plantSonneratiacaseolarisin Hainan Island based on ISSR analysis [J].ActaEcologicaSinica,2004,24(8):1 657-1 663.
[27]易能君,施季森,王明庥.林木群体遗传多样性和多位点遗传结构[J].生物多样性,1996,4(3):153-159.
YI N J,SHI J S,WANG M X.Genetic diversity and multilocus structure in forest trees [J].ChineseBiodiversity,1996,4(3):153-159.
(编辑:宋亚珍)
Genetic Diversity and Genetic Structure Analysis on Natural Populations of EndangeredRhododendronmolleG.Don
CHENG Malong,DAI Liangfang,LUO Xiangdong*,LIU Menglu,ZHOU Yi,CHENG Yanqiu,XIE Jiankun
(College of Life Science,Jiangxi Normal University,Nanchang 330022,China)
Abstract:In the present study,12 pairs of simple sequence repeat (SSR) primers were used to evaluate genetic diversity and genetic structure of Rhododendron molle G.Don in eight populations from six provinces.The results showed that:(1)A total of 260 alleles with an average 21.667 alleles per locus were amplified from 193 individuals.Average values of number of effective alleles (Ne) and polymorphism information content (PIC) were 5.425 and 0.900,respectively.This species has higher genetic diversity and gene flow among different populations.For R.molle,the Shannon’s information index (I) and Nei’s gene diversity (H) were 1.768 and 0.777,respectively.(2)Comprehensive analysis suggested that Jinxi (Jiangxi Province) population exhibits great level of variability,whereas the population of Zhenghe (Fujian Province) exhibits the lowest level of variability.(3)The genetic differentiation coefficient (Fst) based on infinite allele model (IAM) was 0.142 and the gene flow (Nm) was 1.522,respectively.Analysis of molecular variance (AMOVA) revealed that the genetic variation mainly occurred within populations (accounted for 87.71%),more than inter-populations (accounted for 12.29%).(4)The results of neighbor joining (NJ) analysis based on genetic distance and structure analysis showed that eight populations were clustered into three groups.The mantel test showed there was no significant correlation between genetic distance and geographical distance in R.molle.Our results indicated the priority should be given to in situ conservation,natural populations in Jinxi,Zhenghe,and Jingshan (Hubei Province) deserve prior conservation.The possible formation of the high level genetic diversity and the moderate differentiation of R.molle were also discussed.Key words:Rhododendron molle G.Don;SSR;genetic diversity;conservation of endangered plant
文章编号:1000-4025(2016)04-0674-07
doi:10.7606/j.issn.1000-4025.2016.04.0674
收稿日期:2016-01-02;修改稿收到日期:2016-03-09
基金项目:国家自然科学基金(31360147,31260255);江西省自然科学基金(20151BAB204008)
作者简介:程马龙(1990- ),男,在读硕士研究生,主要从事植物生态与分子生物学研究。E-mail:422281228@qq.com *通信作者:罗向东,博士,教授,主要从事植物遗传与分子生物学研究。E-mail:xdluolf@163.com
中图分类号:Q346.+5
文献标志码:A
