恶性神经胶质瘤脑膜脊髓播散转移15例临床病例分析
2016-06-15李珊陈建新李岩康庄康勋张红梅李文斌
李珊 陈建新 李岩 康庄 康勋 张红梅 李文斌
恶性神经胶质瘤脑膜脊髓播散转移15例临床病例分析
李珊陈建新李岩康庄康勋张红梅李文斌
摘要目的:通过分析15例发生脑膜脊髓播散转移的脑胶质瘤患者的临床表现,对其特点进行归纳总结。方法:回顾性分析首都医科大学附属北京世纪坛医院脑胶质瘤科2011年1月至2015年9月收治15例发生脑膜脊髓播散转移的脑胶质瘤患者,其中WHOⅡ级5例,Ⅲ级6例,Ⅳ级4例;原发于脑干1例,原发于脊髓2例,原发于幕上12例。15例患者中行活检术1例,近全切除4例,完全切除10例。结果:患者出现的症状包括:腰背疼痛、浅感觉异常、肢体感觉和运动功能障碍、二便失禁、癫痫发作等。出现脑膜脊髓播散的中位时间为10(1.5~80)个月。发生脑膜脊髓播散后患者接受的治疗手段包括:全身化疗,全脊柱放疗,椎管内鞘注化疗,靶向治疗。15例患者的中位生存期为20(9~83)个月,自发生脑膜、脊髓播散至死亡的中位生存期为6(2~48)个月。结论:恶性神经胶质瘤患者发生脑膜脊髓播散转移后生存期短,预后不佳,选择合适的患者进行放疗、化疗及鞘内注射化疗等多种治疗方法可使某些患者生存获益。
关键词神经胶质瘤软脑膜脊髓转移
作者单位:首都医科大学附属北京世纪坛医院脑胶质瘤科(北京市100038)
脑胶质瘤是最常见的中枢神经系统恶性肿瘤,Ⅳ级脑胶质瘤患者的中位生存期仅14.6个月,发病率以每年1.2%的速度增长。随着手术、放疗、化疗等综合治疗手段的发展,改善了脑胶质瘤患者的总生存,加之影像学的进步,既往报道发生率较低的脑胶质瘤患者脑膜、脊髓播散转移,现在临床上并不少见。本研究收集首都医科大学附属北京世纪坛医院脑胶质瘤科2011年1月至2015年9月收治的脑膜、脊髓播散转移患者15例总结如下。
1 材料与方法
1.1临床资料
15例患者均来自首都医科大学附属北京世纪坛医院脑胶质瘤科2011年1月至2015年9月收治的脑胶质瘤病例,资料收集均经患者本人或家属知情同意,其中男性10例,女性5例,中位发病年龄31(15~44)岁;按照WHO分级:Ⅱ级胶质瘤5例(33.3%)(星形细胞瘤4例,少突星形细胞瘤1例),Ⅲ级胶质瘤6例(40.0%)(间变少突星形细胞瘤1例,间变少突胶质细胞瘤2例,间变星形细胞瘤2例,Ⅲ级胶质瘤1例),Ⅳ级胶质母细胞瘤4例(26.7%);原发部位:脊髓2例(13.3%),脑干1例(6.7%),幕上12例(80.0%)。
1.2治疗情况
15例患者中1例行活检术,4例为近全切除,10例为完全切除。经病理确认后,10例高级别胶质瘤(Ⅲ级和Ⅳ级)患者均接受了标准的Stupp方案治疗,即同步放化疗加6个周期的替莫唑胺化疗。Ⅱ级胶质瘤患者中,1例患者接受单纯放疗,1例接受单药替莫唑胺化疗,2例接受放化疗,1例未接受抗肿瘤治疗。
2 结果
2.1手术至发生脑膜、脊髓播散时间
15例患者均出现脊髓播散。出现脑膜、脊髓播散的中位时间为10(1.5~80)个月,其中5例Ⅱ级患者出现脑膜、脊髓播散的时间分别为1.5个月(原发脊髓)、3个月(原发丘脑)、4个月(颅内多发)、16个月(原发左额)、64个月(原发左额颞);6例Ⅲ级患者中,1例原发脊髓者出现全脑全脊髓播散的时间为5.5个月,3例原发于额叶患者出现脊髓播散的时间分别为6、14、80个月,1例原发于颞叶患者出现脊髓播散时间为10个月,1例原发于丘脑患者出现脊髓播散时间为8个月;4例Ⅳ级患者出现播散的时间分别为8.5个月(原发脑干)、11个月(原发丘脑)、19个月(原发颞叶)、20个月(原发顶枕叶)。
2.2症状
患者出现脑膜、脊髓播散后的症状包括:腰背疼痛(5例)、肢体感觉和运动功能障碍(11例)、二便失禁(7例)、癫痫发作(5例)等。
2.3脑脊液蛋白水平和影像学表现
全组患者中12例患者的脑脊液蛋白水平异常升高(正常值0.15~0.45 g/L),最高者>3.0g/L,2例患者脑脊液蛋白水平正常,1例患者脑脊液蛋白水平不详。7例患者脊髓增强核磁共振显示有结节状突起,其余为点状、条状、弥漫样异常强化信号(表1)。
2.4治疗过程
发生脑膜脊髓播散后7例患者接受全身化疗联合椎管内鞘注化疗(其中1例患者同时接受靶向治疗),3例患者接受全脊柱放疗、全身化疗联合椎管内鞘注化疗,1例患者接受全脊柱放疗联合椎管内鞘注化疗,1例患者接受单纯椎管内鞘注化疗,1例患者接受椎管内鞘注化疗联合靶向治疗,2例患者未接受任何抗肿瘤治疗。化疗药物有替莫唑胺、卡氮介、顺铂、替尼泊苷和伊立替康,鞘内注射药物为甲氨蝶呤(10 mg/次,3~10次),靶向药物为贝伐珠单抗(5 mg/kg,2周1次)。
2.5预后
所有患者的末次随访时间为2015年9月,无1例失访,15例患者共11例死亡,15例患者的中位生存期(overall survival,OS)为20(9~83)个月,自发生脑膜脊髓播散至死亡的中位生存期为6(2~48)个月。
11例死亡患者中Ⅱ级患者死亡2例,OS分别为9、77个月;Ⅲ级患者死亡6例,OS分别为10、11、13、20、24、83个月;Ⅳ级患者死亡3例,OS分别为13、20、25个月。此11例患者发生脑膜、脊髓播散至死亡的平均生存期为6.9个月。
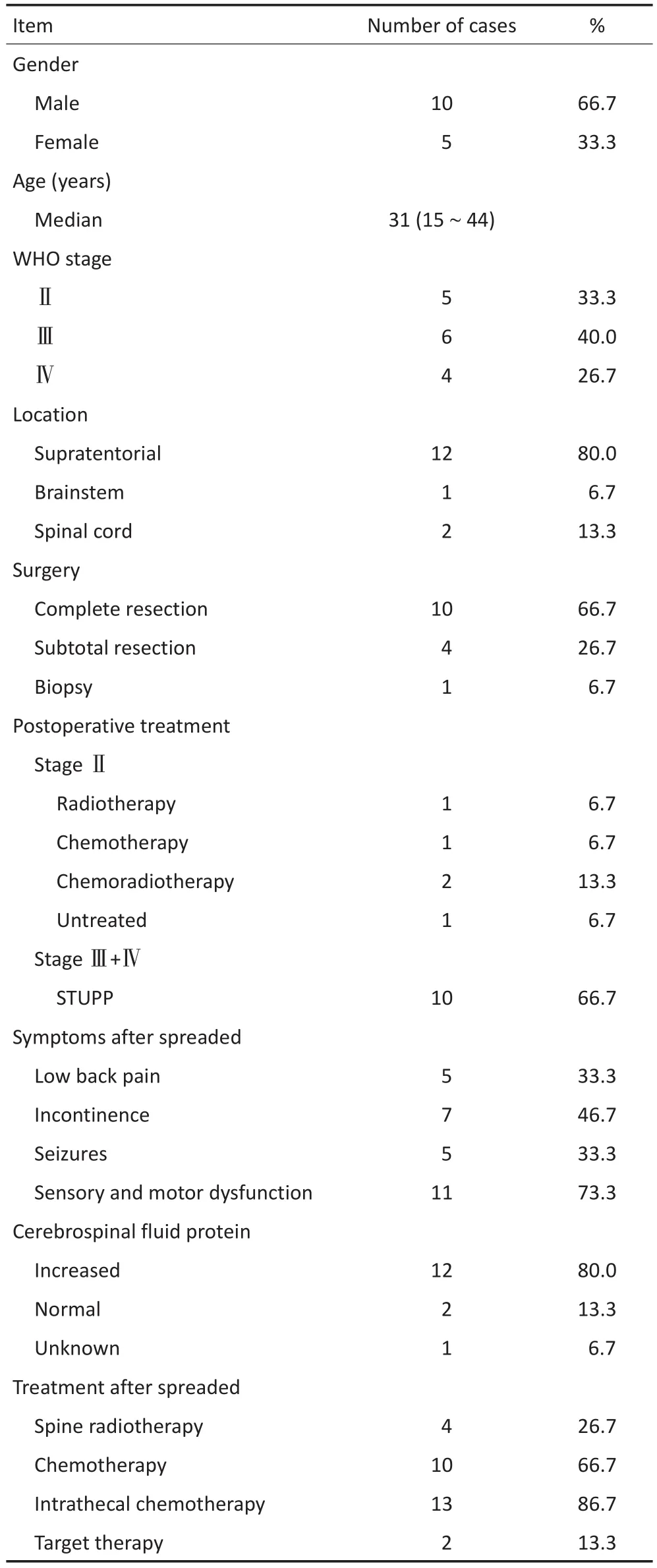
表1 15例脑胶质瘤患者临床资料Table 1 Characteristics of the patients
病例1:男性17岁。2013年3月行颈髓3-6肿瘤切除术;病理示间变少突星形细胞瘤;2013年10月出现脑膜脊髓播散(图1A),行全脑全脊髓放射治疗及全身静脉化疗;2014年7月复查病情稳定(图1B),疾病控制6个月;2014年11月脊膜表面点、线状增强增多,颈7水平出现一新发结节(图1C);2015年3月死亡。
病例2:女性21岁。2013年8月行脑干胶质母细胞瘤切除术;2013年9月术后复查(图2A)及2014年3月口服替莫唑胺期间复查(图2B);2014年5月出现腰痛、双下肢感觉运动功能丧失,二便失禁;2014年5月提示全脊髓播散(图2C);2014年10月死亡。
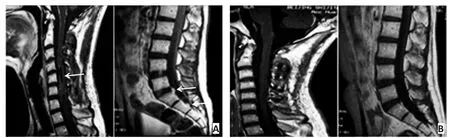
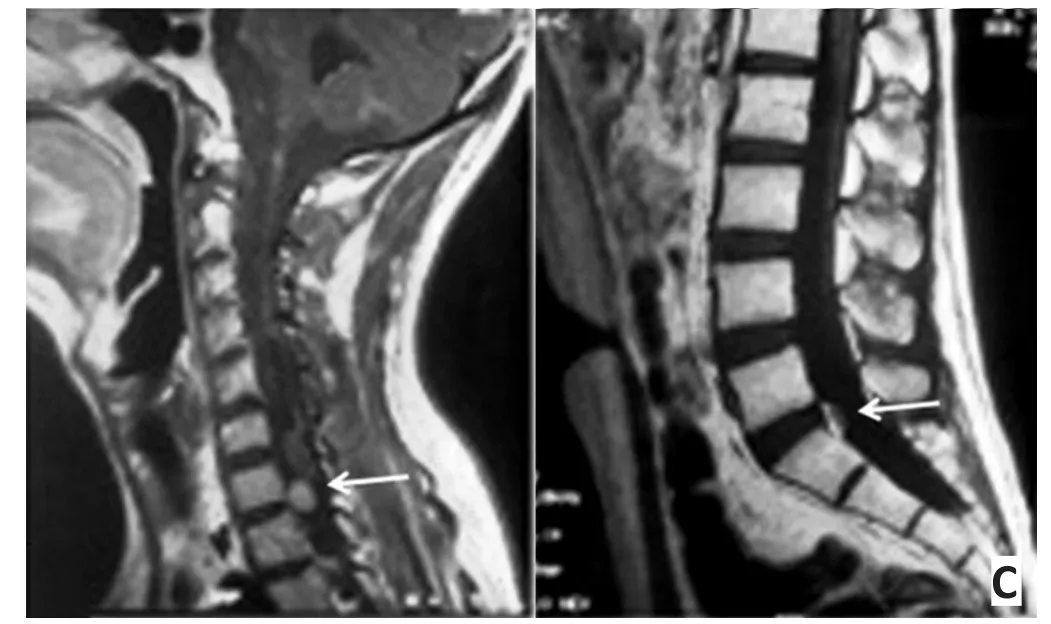
图1 病例1:17岁男性(颈髓3-6肿瘤切除术)Figure 1 Case 1: a 17-year-old man underwent a C3-6 tumor resection
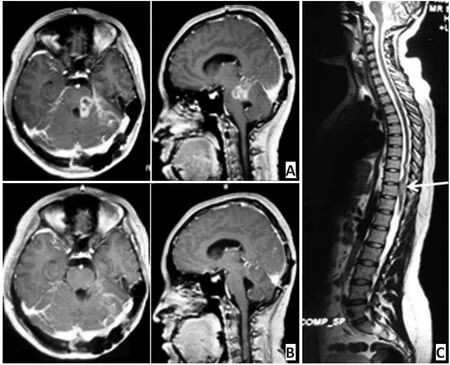
图2 病例2:21岁女性(脑干胶质母细胞瘤切除术)Figure 2 Case 2: a 21-year-old woman accepted brainstem glioblastoma resection
3 讨论
脑胶质瘤是一种易发生颅内转移的恶性肿瘤,最常见的复发部位位于手术切除的边缘或治疗野内,颅外以及脊髓转移的发生概率较小。1931年Cairns和Russell第一次提出了胶质母细胞瘤有随着神经轴发生播散的潜力,而首例患者的报道是在1980年。一项含有600例患者持续10年的大型临床观察发现,胶质母细胞瘤患者发生有症状脊髓播散的概率为2%[1]。儿童高级别胶质瘤(间变性星形细胞瘤和胶质母细胞瘤)的脊髓播散概率为3.1%[2]。随着现代诊疗技术特别是核磁共振技术的进步,患者生存期的延长以及临床医生对这一现象的重视,脊髓播散概率可能更高。
脊髓播散多发生在疾病晚期,一旦出现脊髓播散,提示患者预后较差。国外学者报道从患者出现症状、确诊播散至死亡的时间小于12个月。Shahideh等[1]总结了37篇关于胶质母细胞瘤发生脊髓播散的文章,患者从接受颅内手术至发生脊髓播散的中位时间为10个月(95%CI:7.48~12.52),而从脊髓播散至死亡的时间为3个月(95%CI:2.44~3.55)。将年龄、性别、手术、辅助治疗及对脊髓播散的治疗纳入单因素回归分析未显示差异有统计学意义。本研究中15例患者自发生脑膜脊髓播散至死亡的中位生存期为6个月,其中3例胶质母细胞瘤患者从脊髓播散至死亡的平均生存期为6.8个月,高于国外文献报道的时间,可能与此3例患者均接受全脊髓放疗、静脉化疗及鞘内注射化疗等综合治疗有关。
导致发生播散转移的相关因素目前仍不明确,可能与开颅术、放化疗导致的免疫抑制及肿瘤临近脑室等因素相关[3]。肿瘤细胞可能通过直接扩散、脉管系统及脑脊液播散到脊髓的蛛网膜下腔[4]。目前较为认同的是,脱落至脑脊液中的肿瘤细胞,是导致脑胶质瘤患者发生播散转移的主要原因。幕上胶质母细胞瘤发生脑脊液播散的概率为15%~25%[5],幕下胶质母细胞瘤的发生率则高达60%[6]。肿瘤细胞可转移至脑脊液接触到的任何地方,其中包括脑室腹腔引流管引流的腹腔[7]。胶质母细胞瘤被证实可随着白质束发生播散,进而发生转移[8]。在脑脊液播散途径中,进入脑室是其中至关重要的一环,涉及到肿瘤细胞对基底膜及脉络丛的直接侵犯。有研究认为肿瘤越靠近脑脊液循环通路,越易发生胶质瘤细胞在蛛网膜下腔的播散,开颅术中开放脑室增加了播散概率,但另一些学者持反对态度,因为有患者在未接受开颅术的情况下仍发生脊髓转移[9]。本研究12例原发于幕上患者共5例术中曾进入脑室,3例原发灶位于丘脑,其余2例病灶位于额叶。结合国内外文献,本研究组认为术中进入脑室有可能是导致胶质瘤脑脊液播散的一个因素,但不是必然的原因,这与外科切除术式、操作是否规范、肿瘤分期、患者的病程、肿瘤细胞生物学行为、患者免疫状态均相关,两者之间有无相关性仍需要循证医学证据验证。TP53突变、1p19q缺失等基因水平分子标志物均未能预测何种患者是发生播散转移的高危人群[10]。有研究认为髓内转移与胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)有关,GFAP阴性患者更易发生软脑膜转移,因此低分化星形细胞瘤细胞更易沿着脑脊液途径发生播散[11]。
临床医师可能由于发生率较低而忽略脑胶质瘤患者发生脊髓转移的临床症状。有研究提示临床上缺乏软脑膜转移的征象是因为肿瘤细胞仅浸润神经根而不是破坏它们[6]。一旦出现神经根的破坏,就会出现相应的临床症状。本研究患者大多是在病程中出现原发病灶不能解释的临床症状,如二便失禁、腰背疼痛、下肢感觉运动功能障碍,其他脊髓转移常见的临床症状包括感觉异常、神经根疼痛、颈肩痛、下肢轻瘫、截瘫和性功能障碍。脊髓转移的常见部位为胸段脊髓下段、腰段脊髓上段、腰骶部含马尾部位[12]。本组中有2例患者为原发于脊髓的胶质瘤,随着病程进展,出现全脑膜全脊髓播散。也有报道脊髓胶质母细胞瘤播散至颅腔的病例[13],在脑脊液流速减慢的部位,加之重力的作用,如大脑外侧裂、基底池,最易发生软脑膜转移[14]。
对于脊髓转移的诊断,主要依据影像学检查,因为患者一旦出现脑膜脊髓转移,手术及活检的可能性较小。脑脊液的细胞学检查在脊髓播散的检测方面并不敏感[8],脑脊液蛋白的升高也许可以作为脑膜脊髓转移的一个参考指标。本研究共13例患者出现脑脊液蛋白升高,其中2例原发脊髓胶质瘤患者在治疗后出现脑脊液蛋白的显著下降,需要临床上进一步扩大样本的验证。CT影像上可见线状增强、结节状突起,但核磁的诊断更具优势,敏感性更高,T1加权像为相对低信号强度,T2加权像为相对高信号强度,优势在于可多维成像,除外椎骨衍生的伪影,鉴别髓内和髓外病变,并且可避免电离辐射[11]。
目前对脑膜脊髓播散的治疗效果仍差强人意,对这类患者实施根治性手术切除的可能性几乎没有,其他的治疗选择包括姑息性手术减压缓解疼痛,避免截瘫。经放疗科医生评估后,合适的患者可行脊髓放疗,常规剂量为45~50 Gy,分割剂量为每次1.8~2.0 Gy。Corradini等[15]在16例接受脊髓放疗的胶质瘤患者中发现,放疗剂量大于45 Gy的患者生存期优于放疗剂量小于45 Gy的患者,脊髓原发胶质瘤患者的生存期优于颅内胶质瘤出现脊髓转移的患者(P<0.001),不良反应有脊髓水肿和组织黏连[16],严重者可出现脊髓坏死、截瘫,因颅内胶质瘤患者发现脊髓转移时多为疾病晚期,短期内病情很快恶化,故本研究中仅4例患者接受脊髓放疗。全身静脉化疗方案在脊髓转移胶质瘤中的研究有限,均为回顾性或个案报道。本研究15例患者中2例在当地医院接受静脉化疗,故化疗药物涵盖了替莫唑胺、卡氮介、顺铂、替尼泊苷和伊立替康等。整体而言,脊髓转移患者的治疗主要参考颅内复发胶质瘤的治疗,选择可透过血脑屏障的药物,如替莫唑胺,替尼泊苷、亚硝脲类等[17]。本研究15例患者中13例患者接受鞘内注射化疗,观察到2例原发脊髓胶质瘤患者在给予腰椎穿刺鞘内注射甲氨蝶呤后出现临床症状改善,生存质量提高,脑脊液蛋白下降。本研究组认为对胶质瘤脊髓弥漫性播散患者的效果可能优于灶状转移的患者,但对生存期的作用也不明确,需进行严格设计的前瞻性研究进行探讨。靶向治疗药物贝伐珠单抗在脊髓复发胶质瘤的治疗也是处于尝试阶段,对可否延长生存并无定论[18]。但无论给予何种治疗,其主要目的均在于缓解症状和尽可能改善患者生存质量,对预后的受益有限,大部分患者从出现转移至死亡的时间为2~20个月,平均时间为2~3个月,有研究认为年轻患者的预后略好[12]。
本研究中15例患者出现了原发灶不能解释的临床症状,加之病灶可能位于脑脊液循环通路附近,或处于肿瘤的晚期,这时可能需要临床医师积极地进行脊髓核磁检查进行证实。近些年,有相当数量的研究试图通过分析胶质瘤的分子遗传学明确转移和非转移的胶质母细胞瘤之间的区别,发现部分染色体会发生变异、原癌基因扩增、抑癌基因缺失及突变[19]。常规行脊髓核磁检查、脑脊液检查、对未出现临床症状的患者进行早期干预,这些手段是否可使患者临床获益,目前仍不明确。对临床医师而言,恶性神经胶质瘤伴脑膜脊髓播散转移的治疗仍然任重而道远。选择合适的患者进行放疗、化疗及鞘内注射化疗等多种治疗方法也许可使某些患者生存获益。
参考文献
[1]Shahideh M,Fallah A,Munoz DG,et al.Systematic review of primary intracranial glioblastoma multiforme with symptomatic spinal metastases,with two illustrative patients[J].J Clin Neurosci,2012,19(8): 1080-1086.
[2]Benesch M,Wagner S,Berthold F,et al.Primary dissemination of highgrade gliomas in children: experiences from four studies of the Pediatric Oncology and Hematology Society of the German Language Group(GPOH)[J].J Neurooncol,2005,72(2):179-183.
[3]Fakhrai N,Czech T,Diekmann K,et al.Glioblastoma with spinal seeding [J].Strahlenther Onkol,2004,180(7):455-457.
[4]Hübner F,Braun V,Richter HP.Case reports of symptomatic metastases in four patients with primary intracranial gliomas[J].Acta Neurochir (Wien),2001,143(1):25-29.
[5]Arita N,Taneda M,Hayakawa T.Leptomeningeal dissemination of malignant gliomas.Incidence,diagnosis and outcome[J].Acta Neurochir(Wien),1994,126(2-4):84-92.
[6]Witoonpanich P,Bamrungrak K,Jinawath A,et al.Glioblastoma multiforme at the corpus callosum with spinal leptomeningeal metastasis[J].Clin Neurol Neurosurg,2011,113(5):407-410.
[7]Alatakis S,Malham GM,Thien C.Spinal leptomeningeal metastasis fromcerebral glioblastoma multiforme presenting with radicular pain.Case report and literature review[J].Surg Neurol,2001,56(1):33-38.
[8]Geer CP,Grossman SA.Interstitial fluid flow along white matter tracts: a potentially important mechanism for the dissemination of primary brain tumors[J].Neurooncol,1997,32(3):193-201.
[9]Bae JS,Yang SH,Yoon WS,et al.The clinical features of spinal leptomeningeal dissemination from malignant gliomas[J].J Korean Neurosurg Soc,2011,49(6):334-338.
[10]Ng WH,Yeo TT,Kaye AH.Spinal and extracranial metastatic dissemination of malignant glioma[J].J Clin Neurosci,2005,12(4):379-382.
[11]Maslehaty H,Cordovi S,Hefti M.Symptomatic spinal metastases of intracranial glioblastoma: clinical characteristics and pathomechanism relating to GFAP expression[J].J Neurooncol,2011,101(2):329-333.
[12]Birbilis TA,Matis GK,Eleftheriadis SG,et al.Spinal metastasis of glioblastoma multiforme: an uncommon suspect[J]? Spine,2010,35 (7):264-269.
[13]Medhkour A,Chan M.Extremely rare glioblastoma multiforme of the conus medullaris with holocord and brain stem metastases,leading to cranial nerve deficit and respiratory failure:a case report and review of the literature[J].Surg Neurol,2005,63(6):576-582.
[14]Chou YL,Loh JK,Hwang SL.Surgery of spinal cord pilocytic astrocytoma complicated by leptomeningeal dissemination to the brain and spine andrapidprogression[J].Formosan Journal of Surgery,2013,46:65-69.
[15]Corradini S,Hadi I,Hankel V,et al.Radiotherapy of spinal cord gliomas: A retrospective mono-institutional analysis[J].Strahlenther Onkol,2015,192(3): 139-145.
[16]Kahn J,Loeffler JS,Niemierko A,et al.Long-term outcomes of patients with spinal cord gliomas treated by modern conformal radiation techniques[J].Int J Radiat Oncol Biol Phys,2011,81(1):232-238.
[17]Chamberlain MC.Temozolomide for recurrent low-grade spinal cord gliomas in adults[J].Cancer,2008,113(5):1019-1024.
[18]Chamberlain MC,Johnston SK.Recurrent spinal cord glioblastoma: salvage therapy with bevacizumab[J].J Neurooncol,2011,102(3):427-432.
[19]Ohgaki H,Dessen P,Jourde B,et al.Genetic pathways to glioblastoma: a population-based study[J].Cancer Res,2004,64(19):6892-6899.
(2015-12-02收稿)
(2016-03-02修回)
(编辑:邢颖校对:孙喜佳)
李珊专业方向为神经系统肿瘤的临床及基础研究。
E-mail:flower1946@126.com

·MDT论坛·
Clinical characteristics of 15 glioma cases with leptomeninges and spinal cord metastases
Shan LI,Jianxin CHEN,Yan LI,Zhuang KANG,Xun KANG,Hongmei ZHANG,Wenbin LI
Correspondence to: Wenbin LI;E-mail: neure55@126.com
Department of Glioma,Beijing Shijitan Hospital,Capital Medical University,Beijing 100038,China
AbstractObjective: To retrospectively analyze and summarize the clinical characteristics of 15 glioma cases that led to leptomeninges and spinal cord metastases in Department of Glioma,Beijing Shijitan Hospital,Capital Medical University since 2011.Methods: A total of 15 cases were considered,including 5 patients with World Health Organization gradeⅡ,6 patients with gradeⅢ,and 4 patients with gradeⅣ.One patient had a tumor at the brain stem,two patients had tumors at the spinal cords,and the other patients had tumors at the hemispheres.One case received biopsy,4 cases received subtotal resection,and 10 cases received complete resection.Results: Symptoms included low back pain,sensory and motor dysfunction,incontinence,and seizures.After the metastases spread to the cerebrospinal region,patients were treated with chemotherapy,whole spine radiotherapy,intrathecal chemotherapy,and target therapy.The median time of leptomeninges and spinal cord metastasis dissemination appearance was 10 months(1.5-80 months)since surgery.The median overall survival time of the 15 patients was 20 months(9-83 months),and the median survival time was 6 months(2-48 months)after leptomeninges and spinal cord metastases.Conclusion: The prognosis of glioma patients with leptomeninges and spinal cord metastases was poor,and a proportion of the patients who received appropriate treatment might have a better survival.
Keywords:glioma,leptomeninges,spinal cord,metastasis
doi:10.3969/j.issn.1000-8179.2016.06.279
通信作者:李文斌neure55@126.com
作者简介
