微波辅助蛋白质水解-反相高效液相色谱法测定罗非鱼皮中的羟脯氨酸
2016-06-14杨发树张艳红张凤枰刘耀敏范秀丽
赵 艳,宋 军,杨发树,张艳红,张凤枰,刘耀敏,范秀丽
(通威股份有限公司水产畜禽营养与健康养殖农业部重点实验室,成都 610041)
微波辅助蛋白质水解-反相高效液相色谱法测定罗非鱼皮中的羟脯氨酸
赵艳,宋军,杨发树,张艳红,张凤枰,刘耀敏,范秀丽
(通威股份有限公司水产畜禽营养与健康养殖农业部重点实验室,成都610041)
摘要:为测定罗非鱼(Oreochromis niloticus)皮中羟脯氨酸含量,建立了微波辅助蛋白质水解-反相高效液相色谱法。实验采用9-芴基甲氧基羰酰氯(FMOC-Cl)为衍生试剂,应用ZORBAX SB-C18色谱柱,以0.05 mol/L的醋酸钠溶液和甲醇为流动相进行梯度洗脱,DAD检测器在262 nm处进行检测,外标法定量。结果显示,羟脯氨酸线性关系良好,相关系数为0.999 9,回收率92.00%~103.25%,相对标准偏差2.53%~3.61%,检出限为0.2 mg/g。
关键词:微波辅助蛋白质水解;反相高效液相色谱法;罗非鱼皮;羟脯氨酸
羟脯氨酸(hydroxyproline,HYP)是胶原蛋白的主要组成成分,不属于20种常见的氨基酸。目前,常见的三种胶原蛋白是Ⅰ、Ⅱ、Ⅲ型,其中Ⅰ型胶原蛋白是动物皮的主要成分之一,它含有大量的脯氨酸和羟脯氨酸(HYP)。羟脯氨酸约占胶原蛋白中氨基酸总量的10%,而在其它蛋白质中含量甚微,这使得它几乎成为胶原蛋白所特有的成分,因而可通过测定羟脯氨酸含量来计算胶原蛋白的含量,从而确定胶原蛋白的总体水平[1]。
目前,测定羟脯氨酸的方法有多种,包括分光光度法[2-3]、毛细管电泳法[4-5]、离子色谱法[6]、高效液相色谱法[7-9]和高效液相色谱串联质谱法[10-12]等,其中以高效液相色谱法最为常用。羟脯氨酸通常以蛋白质的形式存在于样品中,首先需要进行水解,解离为游离态羟脯氨酸后才能测定。目前通常用常规酸水解法[13]。然而常规酸水解方法耗时,步骤繁琐,且水解过程不易控制。而采用微波辅助蛋白质水解样品,避免以上麻烦,并且易于控制酸水解条件,重现性好。目前利用微波辅助蛋白质水解前处理方法,采用高效液相色谱仪测定羟脯氨酸的系统研究,在国内尚未见报道。本实验采用微波辅助蛋白水解结合反相高效液相色谱法对罗非鱼皮中的羟脯氨酸的测定进行了研究。
1材料与方法
1.1仪器、试剂和材料
实验用罗非鱼鱼皮从市场购买。
Agilent 1260 高效液相色谱仪,G4212B DAD检测器 美国Agilent公司;ETHOS 1微波水解仪 意大利Milestone公司;Allegra 64 R离心机 BECKMAN COULTER公司;KQ5200B型超声波清洗器 昆山市超声仪器有限公司;CP225D 电子分析天平 德国Sartorius公司。
L-羟脯氨酸(L-HYP,纯度99%)标准品、 9-芴基甲氧基羰酰氯(FMOC-Cl) Sigma-Aldrich公司;乙腈、甲醇(色谱纯) 美国Fisher公司;乙酸钠、硼酸(均为分析纯) 国药集团化学试剂公司;其它试剂均为优级纯;水为Milli-Q Gradient超纯水。
1.2标准溶液和衍生溶液的配制
准确称取50 mg羟脯氨酸(99%),用0.1 mol/L的HCI溶液定容至100 mL容量瓶,配成质量浓度为0.5 mg/mL标准品储备液,可根据需要稀释成系列标准溶液。
0.05 mol/L FMOC衍生试剂配制:称取0.13 g FMOC,用丙酮溶解,并定容至10 mL。
0.2 mol/L硼酸缓冲液(pH 9.0):用NaOH调节pH值。
1.3HPLC分析条件
色谱柱:ZORBAX SB-C18色谱柱,150 mm×4.6 mm,5 μm;流速:1 mL/min;柱温:30 ℃;检测器:DAD检测器,波长为262 nm;进样体积:20 μL。流动相A:甲醇,流动相B:0.05 mol/L的醋酸钠溶液;梯度洗脱条件见表1。

表1 梯度洗脱条件
1.4供试样品溶液的制备
1.4.1样品水解
1.4.1.1常规酸水解法
参照文献[13]水解方法进行样品前处理。所有样品重复3次测定,结果取平均值。
1.4.1.2微波辅助蛋白质水解法
将样品解冻、绞碎,准确称取样品50 mg(精确至0.01 mg)于微波水解石英杯中,加入6 mol/L HCL溶液0.5 mL,依次放置于水解槽中,水解主控罐内加入6 mol/L HCI溶液120~150 mL,盖好水解罐。将水解罐放入密封装置中,拧紧,插入温度传感器,抽真空,充入高纯氮气以保护样品,重复3 次。在1 000 W 功率条件,常温至160 ℃升温20 min,160 ℃温度保持20 min,当温度冷却至室温后打开密封装置,取出水解槽,将微波水解瓶逐一取下后,将水解液全部转移至50 mL容量瓶中,用2 mol/L的氢氧化钠溶液调至中性,超纯水定容至50 mL。
1.4.2衍生
取过滤后的稀释液100 μL于5 mL 具塞离心管中,依次加入硼酸缓冲液900 μL,FMOC衍生试剂300 μL,漩涡混匀,衍生10 min,0.22 μm滤膜过滤,待高效液相色谱仪测定。
2结果与分析
2.1样品前处理条件的选择
2.1.1微波辅助蛋白质水解条件的优化
固定微波时间20 min,考察不同微波水解温度(140 、150、160 、170 ℃)的影响(图1),以及固定微波温度,考察不同微波水解温度保持时间(10、20、30 min)对实验结果的影响(图2),最终选择160 ℃温度保持20 min为最佳条件。
2.1.2微波水解法与常规水解法的比较
采用微波法水解测定样品中羟脯氨酸含量的同时,运用传统的常规酸水解法110 ℃水解22 h进行测定,并将测得的结果用T检验法进行了比较,结果见表2。结果表明,两种水解方法测定结果的相对偏差均小于3.0%,经T检验,微波水解法与常规水解法测定结果不存在显著差异(P>0.05),在所选择的条件下微波辅助蛋白质水解测定结果与常规法一致。

图1 不同微波水解温度的HYP含量变化曲线
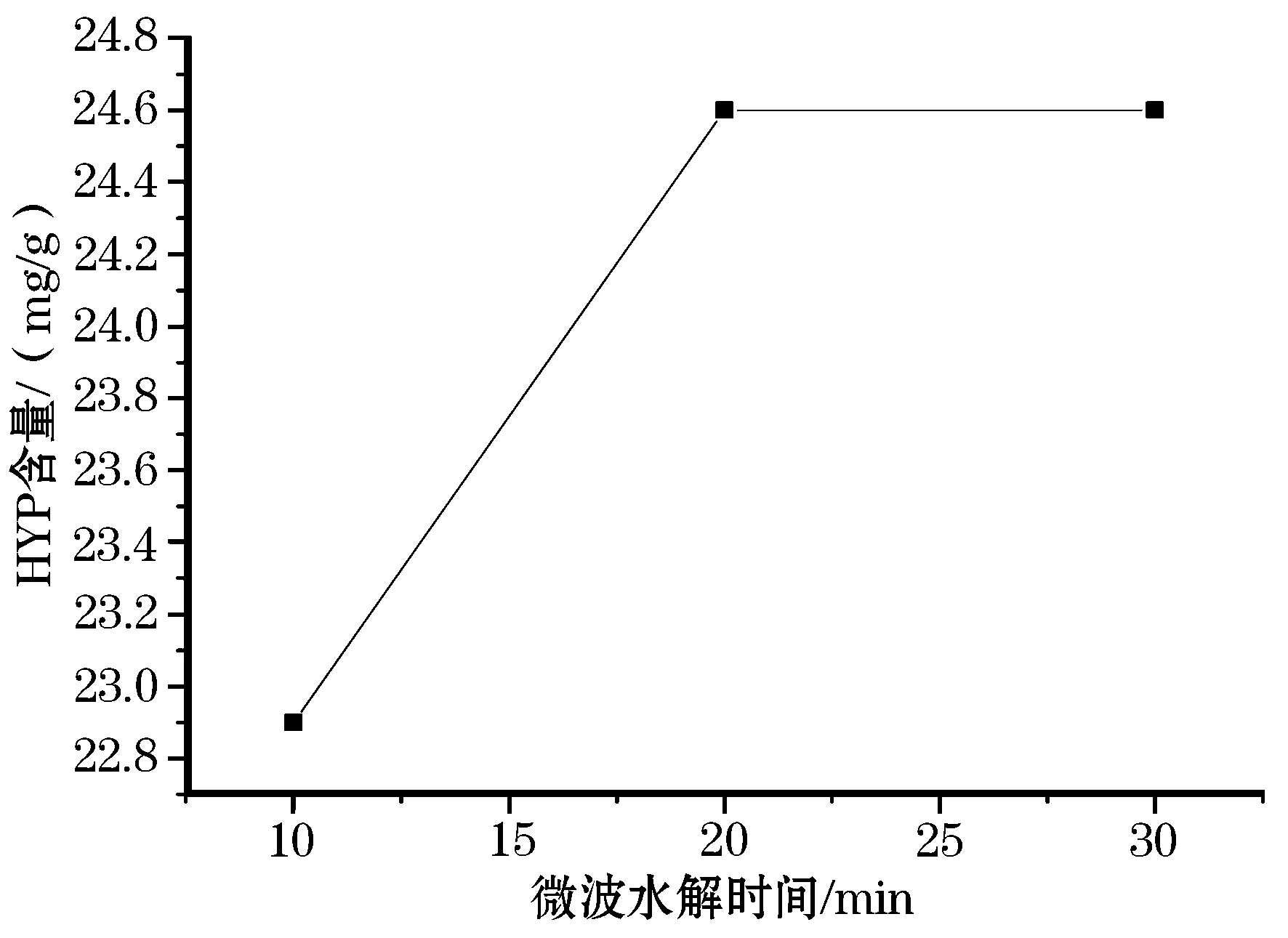
图2 不同微波水解时间的HYP含量变化曲线
2.1.3衍生试剂的选择
氨基酸分析中常用的柱前衍生试剂有邻苯二甲醛(OPA)、丹磺酰氯(DANSYL-C1)、异硫氰酸苯酯(PITC) 和9-芴基甲氧基羰酰氯 (FMOC-Cl)等。OPA只能与一级胺反应,DANSYL-C1与PITC虽能与羟脯氨酸直接反应,但前者反应活性较差,速度慢,后者需专门的衍生装置在无水条件下进行。鱼皮的水解产物中存在很多种氨基酸,大部分为一级胺,因此国内外有不少文献采用双衍生剂的方法,即先用OPA封闭所有的一级胺,除去OPA与一级胺衍生物后,再用FMOC-Cl与羟脯氨酸反应,方法复杂、费时。本试验采用FMOC-Cl直接衍生罗非鱼鱼皮水解液,通过优化液相色谱分离条件即可分离出羟脯氨酸,并排除了其它干扰峰。

表2 两种水解方法羟脯氨酸含量的比较(n=3)
2.2高效液相色谱分析条件的选择
采用Agilent 1260 高效液相色谱仪,比较ZOBAX XDB C18柱和ZOBAX SB-C18柱对羟脯氨酸的分离效果,发现ZOBAX XDB C18柱出峰时间靠前,且峰形较差,而使用ZOBAX SB-C18柱取得了良好的分离效果,标准品分离效果见图3和图4。

图3 ZOBAX XDB C18色谱柱分离图
2.3线性关系及检出限的考察
将羟脯氨酸配制成1,2,5,10,25,50 μg/mL的系列标准溶液。按照上述色谱条件进样,以HYP浓度为横坐标(x) ,对应的峰面积为纵坐标(y) ,绘制标准曲线,见图5。回归方程:y=106.312 9x+2.919 8,相关系数为0.999 9,表明在1~50 μg/mL 范围内线性关系良好。以3倍信噪比计算检出限,本方法检出限为0.2 mg/g。
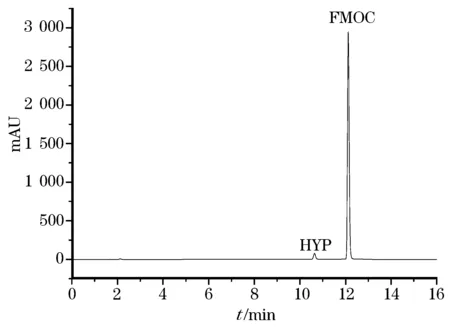
图4 ZORBAX SB-C18色谱柱的分离图
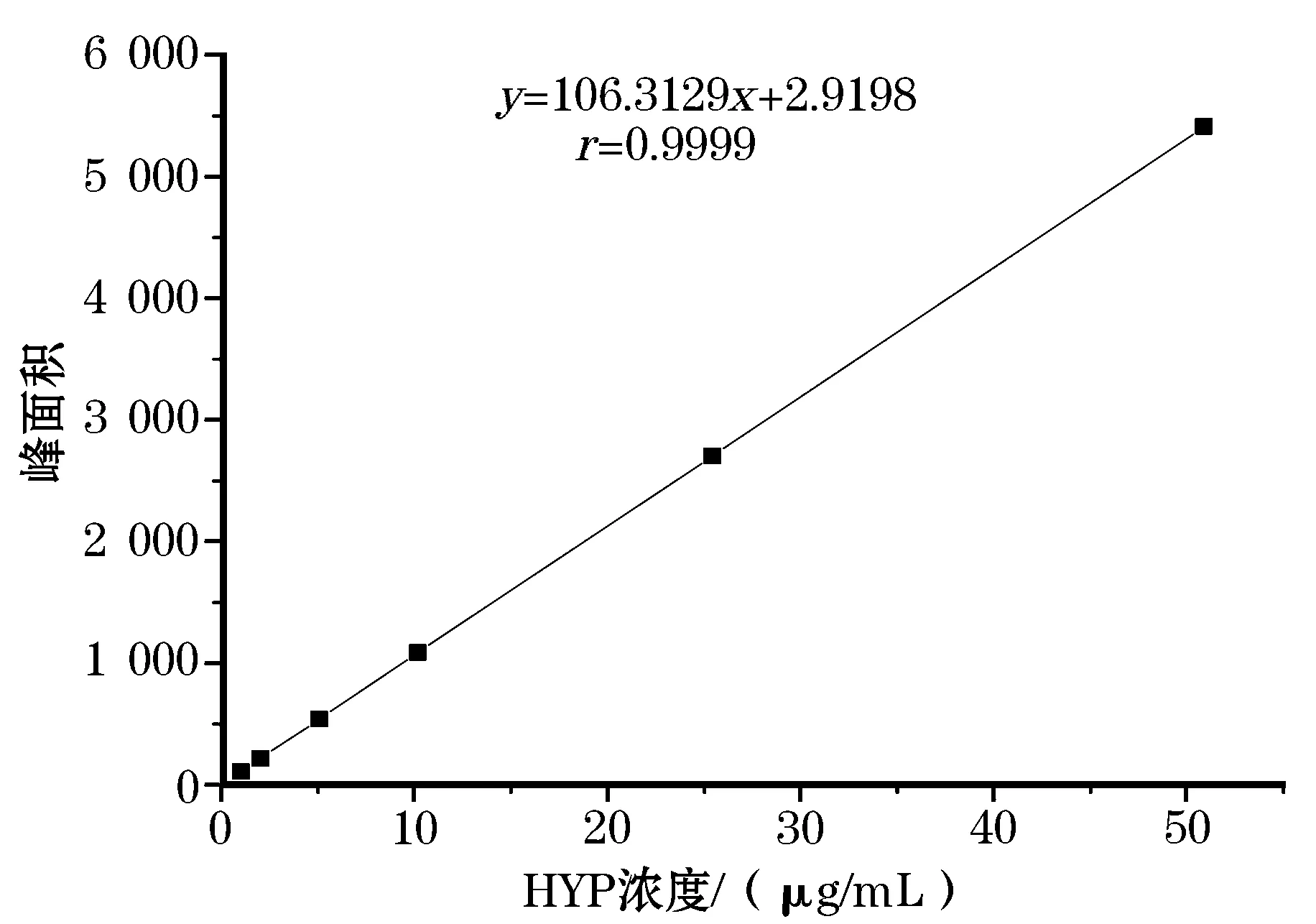
图5 HYP峰面积与标液浓度标准曲线
2.4方法的精密度和回收率试验
为考察方法的精密度和可靠性,在样品中分别添加3个浓度水平的标准溶液,每水平3个平行样,按照1.4样品溶液制备方法进行处理,用1.3仪器条件进行测定,回收率结果见表2。结果显示,羟脯氨酸的回收率92.0%~103.0%,相对标准偏差2.53%~3.61%,符合试验要求。
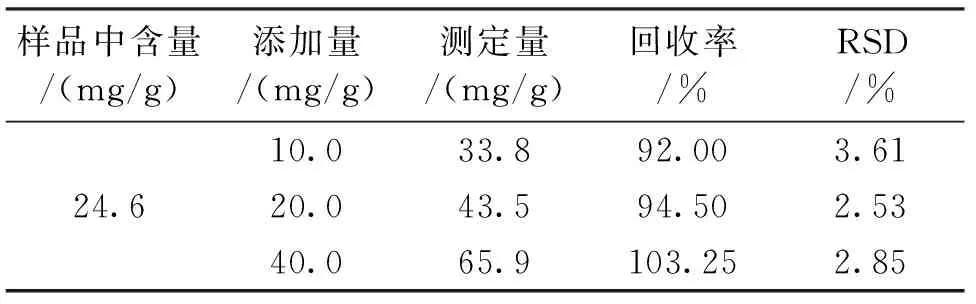
表3 羟脯氨酸的回收率和测定的相对标准偏差(n=3)
2.5罗非鱼皮中羟脯氨酸的测定
按照1.4样品溶液制备方法进行处理,对罗非鱼皮中的羟脯氨酸进行了提取,按照1.3仪器条件进行测定,得到羟脯氨酸的HPLC 图谱,见图6。

图6 罗非鱼鱼皮中羟脯氨酸的色谱图
3讨论
3.1微波辅助蛋白质水解的优势
对比微波水解法和常规水解方法,两种水解方法测定结果的相对偏差均小于3.0%,经T检验,微波水解法与常规水解法测定结果不存在显著差异(P>0.05)。而且微波水解时间约为常规水解方法的1/10,大大缩短了分析时间,提高了检测效率。
3.2衍生试剂及液相色谱条件的选择
罗非鱼皮中存在很多氨基酸及其代谢物,大部分为一级胺,可以和OPA迅速发生反应,而HYP具有二级胺结构,不能直接与OPA反应,但可与异硫氰酸苯酯(PITC)或FMOC反应并形成稳定的衍生物。有些研究用OPA与一级胺衍生物,再用FMOC衍生羟脯氨酸进行分离。此法虽选择性好但样品处理费时,不适合处理大批量样品。本试验采用FMOC-Cl直接衍生罗非鱼鱼皮水解液,并选用适合分离极性化合物的ZOBAX SB-C18色谱柱,通过优化液相色谱分离条件即可分离出羟脯氨酸,并排除了其它干扰峰。
利用微波辅助蛋白质水解-反相高效液相色谱法测定罗非鱼皮中的羟脯氨酸,方法简便快速、重现性好、分离效果良好、灵敏度高、检测结果可信度高,可以满足鱼皮中羟脯氨酸的检测需要。
参考文献:
[1]邹晓莉,黎源倩,曾红燕,等.反相高效液相色谱 法测定人肌腱中的胶原蛋白[J].色谱,2006,24 (3):263-266.
[2]张俊杰,曾庆孝.比色法测定鱼鳞中羟脯氨酸的研究[J].食品科技,2004,(4):83-85.
[3]郭恒斌,曾庆祝.分光光度法测定鱼皮中羟脯氨酸含量[J].食品研究与开发,2007,28 (10):145-148.
[4]薛静,梁恒,李甜,等.毛细管电泳-电致化学发光法测定人尿中脯氨酸和羟脯氨酸[J].分析化学,2005,33(6):785-788.
[5]Dong Y L,Yan N,Li X,et al.Rapid and sensitive determination of hydroxyproline in dairy products using micellar electrokinetic chromatography with laser-induced fluorescence detection[J].J Chromatogr A,2012,1233(7):156-160.
[6]张怡评,易瑞灶,陈晖,等.离子色谱法测定鱼鳞胶原蛋白中羟脯氨酸含量方法的研究[J].中国海洋药物,2011,30(4):45-48.
[7]崔勇,刘智,张博,等.反相高效液相色谱柱前衍生法测定保健食品中羟脯氨酸的含量[J].中国卫生检验杂志,2008,18(11):2247-2248,2259.
[8]Ikehara T,Habu N,Nishino I,et a1.Determination of hydroxyproline in rat urine by high-performance liquid chromatography with electrogenerated chemiluminescence detection using tris(2,2′-bipyridyl) ruthenium(Ⅱ)[J].Anal Chim Acta,2005,536:129-133.
[9]Hutson P R,Crawford M E,Sorkness R L.Liquid chromatographic determination of hydroxyproline in tissue[J].J Chromatogr B,2003,791:427-430.
[10]Colgravea M L,Allingham P G,Jonesc A.Hydroxyproline quantification for the estimation of collagen in tissue using multiple reaction monitoring mass spectrometry[J].J Chromatogr A,2008,1212(1-2):150-153.
[11]Kindt E,Gueneva-Boucheva K,Rekhter M D,et a1.Determination of hydroxyproline in plasma and tissue using electrospray mass spectrometry[J].J Pharmaceut Biomed,2003,33(5):1081-1092.
[12]夏金根,陈波,姚守拙.高效液相色谱-质谱联用测定胶原蛋白中的羟脯氨酸[J].色谱,2008,26(5):595-598.
[13]DB37/T 2094-2012,水产品中羟脯氨酸含量的测定 高效液相色谱法[S].
(责任编辑:邓薇)
Determination of hydroxyproline in the skin of Oreochromis niloticus by reversed-phase high performance liquid chromatography after microwave-assisted acid hydrolysis of protein
ZHAO Yan,SONG Jun,YANG Fa-shu,ZHANG Yan-hong,ZHANG Feng-ping,LIU Yao-min,FAN Xiu-li
(KeyLaboratoryofAquatic,Livestock,PoultryNutritionandHealthyCulturing,MinistryofAgriculture,TongweiCo.,Ltd.,Chengdu610041,China)
Abstract:A method was established for the determination of hydroxyproline in the skin of tilapia(Oreochromis niloticus)by reversed-phase high performance liquid chromatography after microwave-assisted acid hydrolysis of protein.After derivatization by 9-fluorenylmethyl chloroformate (FMOC-Cl),separation and quantification was achieved on a ZORBAX SB-C18column by gradient elution with methanol and 0.05 mol/L sodium acetate buffer.The detection was carried out with diode array detector (DAD)by absorbance at 262 nm.The external standard calibration curves were used for quantification.There were good linear correlations for hydroxyproline (r=0.999 9).Average spike recovery of hydroxyproline was 92.00%~103.25%,with relative standard devitations 2.53%~3.61%,and the limit of detection for hydroxyproline was 0.2 mg/g.This method is simple,sensitive,reproducible and suitable for the determination of hydroxyproline in fish skin.
Key words:microwave-assisted acid hydrolysis of protein;reversed-phase high performance liquid chromatography;skin of Oreochromis niloticus;hydroxyproline
收稿日期:2015-06-02;
修订日期:2015-12-09
第一作者简介:赵艳(1983-),女,高级工程师,研究方向为水产品营养评价和食品及饲料产品质量安全检测。E-mail:zhao518yan@126.com
中图分类号:TS254.7
文献标识码:A
文章编号:1000-6907-(2016)03-0099-05
资助项目:四川省科技支撑计划项目(2011NZ0071)
