胰腺癌的多靶点治疗研究进展
2016-06-13潘有礼侯彦秋赵成建
潘有礼 侯彦秋 赵成建
胰腺癌的多靶点治疗研究进展
潘有礼 侯彦秋 赵成建
胰腺癌是一种恶性程度极高的肿瘤。国内外多方面的研究均证实单一靶点的治疗对胰腺癌的效果有限,而且不能有效地改善胰腺癌患者的生存质量。目前对胰腺癌的研究已鉴定出许多潜在的治疗靶点。本文主要从靶向治疗特别是从多靶点治疗胰腺癌方面进行了综述。
胰腺癌;多靶点;靶向治疗
胰腺癌是高度恶性的消化系统肿瘤。胰腺癌患者的总体5年生存率仍低于5%,而且这个数字在过去的25年里都没有较大的改变[1]。绝大部分的胰腺癌患者都呈现出局部晚期或者转移性症状,这些患者的平均生存期分别为6~10个月及3~6个月[2]。虽然10%~15%的患者可以进行肿瘤切除,但是大多数患者在外科切除后最终都出现肿瘤的复发或转移。考虑到传统化疗的局限性,开发更好的诊断和治疗策略对于胰腺癌患者来说仍是当务之急。2008年,深入且全面的基因组分析指出了大量的基因改变影响了胰腺癌细胞中12条主要的信号通路,而以上信号通路在67%~100%的胰腺癌病例中都发生了改变[3]。这些数据表明针对胰腺癌的治疗应该靶向这些复杂且交叉的信号通路,而不是单一地靶向一个基因的产物(见图1)。本综述总结了胰腺癌靶向治疗特别是多靶点治疗方面的一些重要进展。
1 临床试验中的靶向治疗
1.1 信号转导通路
1.1.1 Ras信号通路 KRAS是Ras基因家族的一员。当其被信号分子如表皮生长因子受体(EGFR)激活后,Ras蛋白就会释放GDP而与GTP结合,从而呈活化状态并且激活下游的信号通路,如Raf、MAP 2K、MAPK和PI 3K-Akt信号级联网络(见图2)。KRAS的突变在胰腺癌患者中是非常常见的,它参与胰腺肿瘤的起始或者早期发病过程。
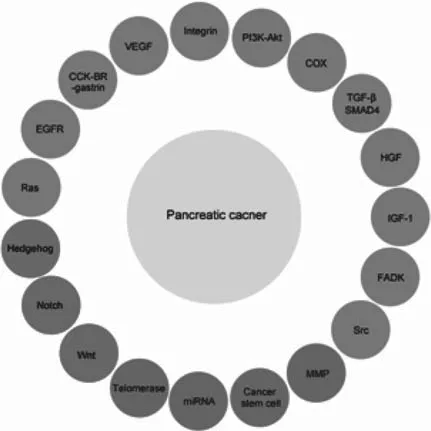
图1 参与胰腺癌发生的信号通路注:miRNA指microRNA;MMP指的是基质金属蛋白酶;图中标注的蛋白在促进肿瘤生长、抵制凋亡以及促进肿瘤的侵袭与转移方面起着重要的作用

图2 胰腺癌中癌性信号级联通路的一个示意图注:(a)配体与整合素受体、VEGF受体、CCK-BR-gastrin受体、HGF受体以及IGF-1受体的结合激活信号级联通路包括PI 3K-Akt和Ras通路,进而影响下游靶点如NFκB、mTOR和MAPK。(b)TGFβ与TGFBR 1和TGFBR 2形成复合物,这个复合物导致SMAD 2和SMAD 3的磷酸化。(c)胚胎发育的信号通路。简写:CD,胞质域
一种靶向Ras突变蛋白的通过提高免疫力来杀死肿瘤的肽疫苗作为一种辅助疗法已经在胰腺癌患者身上进行过评价[4]。进一步的研究评价了将该肽疫苗与巨噬细胞集落刺激因子或白介素-2联用后产生的效应[5]。
从Ras到其发挥功能,它必须经历转录后的修饰,以便它可以与细胞膜相连接,该过程是由法呢酰基转移酶介导的。一种法呢酰基转移酶抑制剂(FTI)替吡法尼(Tipifarnib),与吉西他滨的联合使用后在临床Ⅲ期试验中的治疗效果是让人失望的[6]。其他的化合物包括一个组蛋白脱乙酰基转移酶抑制剂romidepsin,它可以抑制Ras介导的信号通路,从而引起细胞周期的停滞。另外还包括salirasib化合物,它可以使Ras从细胞膜的结合位点上脱落。以上这些化合物与吉西他滨联用后具有临床活性,但还需要进一步地验证。Ras信号通路下游的主要成分MAP 2K已经成为靶向治疗的靶点之一。在一个临床Ⅱ试实验中,MAP 2K的抑制剂PD 184532并没有显示出明显的抗肿瘤活性[7]。但是,MAP 2K和其他激酶(如EGFR)的联合抑制在临床前的研究中被证实是有效的,从而表明这种策略对胰腺癌可能具有治疗作用[8-9]。
1.1.2 表皮生长因子受体通路 EGFR是ErbB家族中的一个跨膜的受体酪氨酸激酶。EGFR以及它的配体如EGF和TGF-α的过表达在胰腺癌中是比较常见的[10-11]。一个口服性的EGFR小分子抑制剂埃罗替尼(erlotinib),在一个针对晚期胰腺癌患者的临床Ⅲ期试验中,与吉西他滨联用后导致患者生存期明显性地延长[12]。2005年,埃罗替尼是第一个被FDA批准用于治疗胰腺癌的靶向药物。其他的正在进行临床试验的EGFR抑制剂包括吉非替尼(gefitinib)[13-14]和拉帕替尼(lapatinib)[15]。
1.1.3 促胃液素-胆囊收缩素B受体通路 肽激素促胃液素是由位于胃窦和十二指肠的G细胞所分泌,同时它可作为胃癌、结直肠癌和胰腺癌的生长因子。CCK-BR(促胃液素-胆囊收缩素B受体)、促胃液素前体以及完全酰胺化的促胃液素分别在95%、55%~91%和23%的胰腺癌病例中表达[16]。一个选择性的CCK-BR拮抗剂(gastrazole),在针对晚期胰腺癌患者的临床试验中[17],疗效高于安慰剂(placebo),但是低于5-氟尿嘧啶。另外一个口服性抑制剂Z-360在实验室中已产生很好的治疗效果[18],并且与吉西他滨联合使用时胰腺癌患者是可以耐受的。
1.2 血管发生 血管发生对实体瘤的生长是必需的,并且它主要是通过VEGF家族蛋白及其受体来介导(见图2)。VEGF在超过90%的胰腺癌病例中存在过表达,因此,它是一个治疗胰腺癌的热门靶点。
贝伐单抗是一个针对VEGF的人源化抗体,已被批准用于治疗结直肠癌。然而,在一个针对晚期胰腺癌患者的临床Ⅲ期试验中,贝伐单抗与吉西他滨的联合使用并没有呈现任何的生存优势。而评价贝伐单抗与其他药物或治疗手段联用治疗胰腺癌的临床试验也正在开展中。索拉非尼(sorafenib)是一个多靶点的激酶抑制剂,它可以抑制VEGF受体(VEGFR)、血小板起源的生长因子受体(PDGFR)、SCFR(也叫c-KIT)、Raf 1以及FLT 3,而这些激酶与肿瘤的生长及血管发生密切相关。在2005年,索拉非尼被批准用于治疗晚期的肾癌。但是,一个临床Ⅱ期的试验得出结论:尽管索拉非尼可以被患者耐受,但是它在晚期的胰腺癌患者身上是无效的。
位于细胞表面的整合素受体与细胞外基质之间可以相互作用,同时介导多种信号通路(见图2)。这些受体参与肿瘤的形成过程,包括肿瘤的生存、侵袭和转移。αVβ3和αVβ5整合素诱导肿瘤的血管发生分别主要通过碱性的成纤维细胞生长因子和VEGF。Cilengitide可以抑制这些整合素,但在一个针对晚期胰腺癌患者的临床Ⅱ期试验中,与吉西他滨单用时相比,Cilengitide并没有显示出明显的生存优势[19]。其他的抗整合素的试剂,包括针对α5β1的抗体(Volociximab)以及一个α 2的抑制剂(E 7820),正在进行临床试验。
1.3 基质金属蛋白酶 基质金属蛋白酶(MMPs)是一个锌依赖的蛋白水解酶家族,它们可以降解细胞外基质,同时对肿瘤扩散和新生血管的形成是必需的。MMPs与它们的天然抑制剂之间的不平衡是胰腺癌中的常见事件之一。尽管MMPs抑制剂在实验室中产生了很好的治疗效果,但是它们在三个临床Ⅲ期试验中均未达到预期的期望[20-22]。
2 其他潜在的治疗靶点
2.1 信号转导通路
2.1.1 PI 3K-Akt通路 一旦被Ras或者EGFR所激活,PI 3K就激活Akt,而Akt又有很多的下游靶点,其中包括哺乳动物中的雷帕霉素靶点(mTOR)以及转录因子NFκB(见图2)。mTOR和NFκB在细胞增殖、生存、抵抗凋亡、血管发生以及侵袭方面具有重要作用。此外,HMGA-1转录因子在胰腺癌中也是高表达,该转录因子可以激活PI 3K-Akt信号同时可介导吉西他滨的耐药[23],因此,HMGA-1也是治疗胰腺癌的靶点之一[24-25]。
塔西莫司是一个mTOR的抑制剂,已被批准用于治疗肾癌,但其针对胰腺癌的治疗效果是有限的[26]。其他的mTOR的抑制剂包括依维莫司和西罗莫司目前正在临床Ⅱ期试验中进行评价。由于mTOR的表达与胰腺癌患者的生存期之间无紧密联系,因此mTOR抑制剂与其他标准或靶向治疗联合使用是必要的[27-28],
一种起源于香料姜黄根的物质姜黄素可以抑制NFκB进而抑制NFκB所调节的基因产物的表达,如Bcl 2、BclXL、COX 2、cyclin D 1及survivin。以上这些蛋白在胰腺癌细胞的生存方面发挥着重要作用[29-30]。姜黄素也可改变胰腺癌中miRNAs的表达(microRNAs)[31]。姜黄素与吉西他滨联用以及单用的临床Ⅱ期试验显示出胰腺癌患者对姜黄素是可以耐受的,同时姜黄素在这些患者身上是具有生物活性的[32]。一个NFκBSTAT 3的口服性抑制剂RTA 402正在临床Ⅰ~Ⅱ期试验中接受评价。硼替佐米是一个蛋白酶体的抑制剂,它可以阻止IκBβ的降解,因此是一个NFκB的内源性抑制剂(见图2)。硼替佐米被批准用于治疗顽固性的多发性骨髓瘤,但令人失望的是,在一个治疗胰腺癌的临床Ⅱ期试验中,硼替佐米单用或与吉西他滨联用并没有显示出任何的生存优势[33]。该结果可能与蛋白酶体的抑制在胰腺癌细胞中导致其他抗凋亡或促有丝分裂信号通路的激活有关[34]。
2.1.2 环氧合酶通路 环氧合酶在花生四烯酸转化成前列腺素的过程中发挥着重要作用。COX 1在体内是组成性表达并具有维持稳态的作用。而COX 2可被生长因子、细胞因子等所诱导,并且它在90%的胰腺癌病例中表达量都会上调[35]。NSAIDs抑制COX 2后能够在体内外抑制胰腺癌的增殖与血管发生[36]。塞来昔布、吉西他滨和阿瑞匹坦三者的联合用药可使胰腺癌患者的平均生存期为13个月,1年存活率为64%,同时明显改善患者的生活质量。吉西他滨、塞来昔布和姜黄素三者联用的临床Ⅲ期试验正在进行中。
2.1.3 TGFβ-SMAD 4通路 TGFβ是由表皮细胞、内皮细胞、造血细胞和间质细胞所分泌的细胞因子。TGFBR 1、TGFBR 2和SMAD 4基因的突变分别在约1%、4%以及50%的胰腺癌病例中被检测到[37]。SMAD 4的失活可以废除TGFβ所介导的肿瘤抑制功能,但也保留了一些TGFβ可促进肿瘤的反应,例如表皮到间质的转换,该过程可使细胞具有迁移性和侵袭性[38]。
基于TGFβ的治疗策略目前正在开发之中,其中包括针对TGFBR 1和TGFBR 2的抑制剂[39-40]。一个识别TGF-β 2的反义寡聚核苷酸序列AP 12009目前正在针对恶性黑色素瘤、胰腺癌和结直肠癌的临床Ⅰ~Ⅱ期试验中进行评价。
2.1.4 肝细胞生长因子受体通路 MET癌基因编码肝细胞生长因子(HGF)受体,它在约78%的胰腺癌中过表达[41]。正常情况下,HGF由间质细胞所产生,然后它作用于表皮细胞进而促进组织再生。然而,在低氧的环境下,肿瘤相关的成纤维细胞分泌HGF,然后HGF促进血管发生、肿瘤生长、细胞运动和细胞外基质的破裂,进而导致侵袭和转移(见图2)。采用一个合成的竞争性的HGF拮抗剂[42]以及一个针对MET受体的抗体[43]来靶向HGF通路已经在实验室中取得了令人鼓舞的效果。ARQ 197是MET受体酪氨酸激酶的抑制剂,目前它正在临床Ⅱ期试验中接受评价,而临床Ⅰ期的试验显示ARQ 197可以被患者耐受。
2.1.5 胰岛素样生长因子受体通路 胰岛素样生长因子Ⅰ(IGF-Ⅰ)受体是一个跨膜的受体酪氨酸激酶,在64%的胰腺癌中过表达。IGF-Ⅰ受体凭借多条信号级联通路包括PI 3KAkt、MAPK以及STAT通路来使细胞抵抗凋亡及促进细胞生长(见图2)。通过酪氨酸激酶抑制剂NVP-AEW 541、一个显性负性突变体以及RNA干扰来抑制IGF-Ⅰ受体均在体内外可以抑制胰腺癌细胞的生长并且可以增加化疗和放疗所诱导的细胞凋亡[44]。另外,同时抑制KRas还可以增强IGF-Ⅰ受体抑制剂的治疗效应[45]。抗IGF-Ⅰ受体的人源化抗体能够在体内增加吉西他滨和EGFR抑制剂的抗肿瘤效应。由于以上发现,cixutumumab、MK-0646、吉西他滨和埃罗替尼四者联用治疗胰腺癌的临床Ⅰ~Ⅱ期试验正在开展之中。
2.1.6 粘着斑激酶通路 粘着斑激酶(FADK)是一个细胞质内的非受体酪氨酸激酶,它可以介导细胞的运动与生存,并且与整合素信号通路密切相关(见图2)。48%的胰腺癌都表达FADK,更重要的是,FADK与IGF-Ⅰ受体具有共同的信号通路[46]。IGF-Ⅰ受体和FADK的双靶点抑制剂NVP-TAE 226在体内已经显示出明显的抗肿瘤活性。
2.1.7 Src通路 Src是非受体酪氨酸蛋白激酶Src家族中的一员。在正常的情况下,Src呈现出磷酸化且失活的状态,但在很多的恶性肿瘤中却是激活的状态,包括70%的胰腺癌。Src在细胞增殖、生存、运动、侵袭、对化疗的耐药以及血管发生方面起着重要作用。因此,Src是一个治疗胰腺癌的理想靶点(见图2)。Src激酶抑制剂在体内可以有效地抑制胰腺癌的生长和转移[47-48]。达沙替尼是一个口服性的多靶点抑制剂,它的靶点包括Src、BCR-ABL、PDGFR、ephrin A受体2和SCFR,已被批准用于治疗慢性骨髓和急性淋巴白血病。达沙替尼正在一个针对转移性的胰腺癌患者的临床Ⅱ期试验中接受评价,相关的化合物如塞卡替尼也在其中进行评价。
2.2 胚胎的信号通路
2.2.1 Hedgehog通路 Hedgehog信号通路的激活由两个跨膜蛋白所控制,分别是起肿瘤抑制作用的PTC 1蛋白和SMO癌蛋白(见图2)。PTC 1在正常情况下抑制SMO,但是PTC 1的失活突变以及hedgehog蛋白与PTC 1蛋白相结合等机制就可以解除上述抑制,进而导致下游转录反应的激活。SHH在70%的胰腺癌中都表达[49],而IHH在胰腺癌细胞中的表达与正常组织相比增加了35倍[50]。Hedgehog通路引起肿瘤发生的机制包括hedgehog蛋白对细胞周期调节者的影响,凭借PI 3K-Akt信号通路保护细胞免受凋亡,稳定Bcl 2和BclXL以及与活化的Ras和血管发生相互合作。环杷明可抑制Hedgehog信号通路,它主要与SMO相结合。研究显示环杷明对多种消化道肿瘤具有抑制活性,包括胰腺癌[51]。环杷明也可提高放疗和化疗的敏感性、抑制肿瘤的转移以及与EGFR抑制剂联用时可增强抗肿瘤活性[52]。
2.2.2 Notch通路 Notch信号通路的激活可以导致跨膜受体被γ-分泌酶切割,然后其释放后的胞质域进入细胞核与转录因子相结合,进而调控基因的表达(见图2)。Notch信号主要作为Ras、EGFR和TGF-β信号的下游从而在胰腺癌的发生中发挥着重要作用,同时还可促进肿瘤的血管发生。利用siRNA或者姜黄素来下调Notch 1在体外可以抑制胰腺癌细胞的生长同时诱导调亡[53-54]。Notch 3在大约70%的胰腺癌中表达并且可被siRNA和γ-分泌酶抑制剂(GSI和L-685,458)所抑制[55]。
2.2.3 Wnt通路 Wnt信号通路参与胚胎发育以及成年组织的自我更新过程,它与很多癌症密切相关,包括肝癌、结直肠癌、乳腺癌、前列腺癌、肾癌和血液性的恶性肿瘤。任何Wnt信号激活者的获得性功能突变或者Wnt信号抑制者的失去性功能突变都可导致Wnt信号通路的异常激活,进而导致癌症的发生与发展(见图2)。Wnt异常激活的现象发生在65%的胰腺癌中[56]。抑制Wnt信号通路进而抑制胰腺癌细胞的增殖同时诱导细胞凋亡的策略已经在实验室中被广泛应用,包括使用β-catenin相互作用的蛋白1、一个淋巴增强子因子的显性负性突变体以及针对β-catenin或者硫酸酯酶类的siRNA。另外,Wnt信号通路还可以被hedgehog和SMAD 4信号通路正向调节[57]。因此,Wnt信号通路也可成为联合抑制的作用靶点。
CXC因子受体4(CXCR 4)及其配体SDF 1在肿瘤生长、血管发生及肿瘤转移中发挥着重要作用。体内阻断CXCR 4可以通过抑制经典的Wnt通路来抑制胰腺癌的生长[58]。此外,一种CXCR 4的拮抗剂普乐沙福在体内可以减少CXCR 4和CD 133(胰腺癌干细胞的标志物之一)阳性的胰腺癌细胞的转移[59]。
2.3 端粒酶 位于染色体末端的端粒正常情况下会随着细胞的每一次分裂而缩短,因此决定着一个细胞固有的寿命。大多数的恶性肿瘤细胞都会显示出较强的端粒酶活性。端粒酶是一个反转录酶,在95%的胰腺癌中过表达[60],这就为开发抗端粒酶的药物提供了一个理论基础。GV 1001是一种端粒酶的肽疫苗,已在临床Ⅰ/Ⅱ期的试验中显示出很好的治疗效果[61]。该疫苗正在针对局部晚期的转移性胰腺癌患者的临床Ⅲ期TeloVac试验中与吉西他滨和卡培他滨联用进行评价。
2.4 MicroRNAs MiRNAs是一类小的内源性的非编码性的RNA分子,它可以调控多种基因的表达。基因的表达谱分析显示出至少有100个miRNA的前体在胰腺癌或者结缔组织中异常表达[62]。基于miRNA的抗癌治疗具有一定的理论优势,即一个miRNA通过转录后的修饰可调控多个靶点。治疗的策略包括肿瘤抑制miRNAs的合成以及通过编码载体或抗miRNA寡聚核苷酸来沉默癌性的miRNAs。以上治疗手段在胰腺癌中的治疗效果是有限的,但在乳腺癌和神经胶质瘤中产生了很好的效果。
2.5 肿瘤干细胞 肿瘤干细胞拥有与正常干细胞相关的重要特性,即自我更新和分化的能力。胰腺癌干细胞可以通过其细胞表面的标志物来鉴定,例如CD 133、CD 44、CD 24和Nanog表皮特异抗原。研究表明,胰腺癌干细胞在异质性的肿瘤细胞群落中只占一小部分,它可以促进肿瘤的发展、转移并且导致细胞对化疗和放疗的耐药[63-65]。基于以上原因,肿瘤干细胞被认为是肿瘤经临床治疗后复发的根源。肿瘤干细胞存在多个信号通路,包括PTEN、SHH、Notch和Wnt通路等,这就为抗肿瘤干细胞的治疗策略提供了理论基础。当然,进一步的研究还需开展来深入理解胰腺癌干细胞的生物学性质,以利于开发有效的治疗手段。
3 结论
目前,多种治疗手段的结合仍是治疗晚期胰腺癌患者的主要依据,这些手段包括靶向治疗与传统化疗或放疗相结合。为了产生临床相关的效应,治疗的策略应该要么是水平形式的,即几条致癌通路同时被抑制,要么是垂直形式的,即一条主要通路上的多个节点都被抑制,以上策略通常称为多靶点治疗,一个典型例子将塞来昔布、姜黄素和吉西他滨三者联用来治疗胰腺癌。除了协同抗增殖和协同促凋亡的反应之外,塞来昔布和姜黄素还可增加吉西他滨的抗肿瘤活性。联合治疗或多靶点治疗,再加上诊断工具的革新及预测性标志物的完善,最终可改变胰腺癌患者的黯淡前景。
[1] Siegel R,Ma J,Zou Z,et al.Cancer statistics,2014[J].CA Cancer J Clin,2014,64(1):9-29.
[2] Rahib L,Smith BD,Aizenberg R,et al.Projecting cancer incidence and deaths to 2030:the unexpected burden of thyroid,liver,and pancreas cancers in the United States[J].Cancer Res,2014,74:2913-2921.
[3] Jones S,Zhang X,Parsons DW,et al.Core signaling pathways in human pancreatic cancers revealed by global genomic analyses[J].Scien ce,2008,321(5897):1801-1806.
[4] Toubaji A,Achtar M,Provenzano M,et al.Pilot study of mutant ras peptide-based vaccine as an adjuvant treatment in pancreatic and colorectal cancers[J].Cancer Immunol Immunother,2008,57(9):1413-1420.
[5] Gjertsen MK,Buanes T,Rosseland AR,et al.Intradermal ras peptide vaccination with granulocyte-macrophage colony-stimulating factor as adjuvant:Clinical and immunological responses in patients with pancreatic adenocarcinoma[J].Int J Cancer,2001,92(3):441-450.
[6] Van Cutsem E,van de Velde H,Karasek P,et al.Phase III trial of gemcitabine plus tipifarnib compared with gemcitabine plus placebo in advanced pancreatic cancer[J].J Clin Oncol,2004,22(8):1430-1438.
[7] Rinehart J,Adjei AA,Lorusso PM,et al.Multicenter phase II study of the oral MEK inhibitor,CI-1040,in patients with advanced nonsmall-cell lung,breast,colon,and pancreatic cancer[J].J Clin Oncol,2004,22(22):4456-4462.
[8] Miyabayashi K,Ijichi H,Mohri D,et al.Erlotinib prolongs survival in pancreatic cancer by blocking gemcitabine-induced MAPK signals[J].Cancer Res,2013,73(7):2221-2234.
[9] Tan N,Wong M,Nannini MA,et al.Bcl-2/Bcl-xL inhibition increases the efficacy of MEK inhibition alone and in combination with PI 3 kinase inhibition in lung and pancreatic tumor models[J].Mol Cancer Ther,2013,12(6):853-864.
[10] Navas C,Hernandez-Porras I,Schuhmacher AJ,et al.EGF receptor signaling is essential for k-ras oncogene-driven pancreatic ductaladenocarcinoma[J].Cancer Cell,2012,22(3):318-330.
[11] Fitzgerald TL,Lertpiriyapong K,Cocco L,et al.Roles of EGFR and KRAS and their downstream signaling pathways in pancreatic cancer and pancreatic cancer stem cells[J].Advances in biological regulation,2015,59:65-81.
[12] Moore MJ,Goldstein D,Hamm J,et al.Erlotinib plus gemcitabine compared with gemcitabine alone in patients with advanced pancreatic cancer:a phase III trial of the National Cancer Institute of Canada Clinical Trials Group[J].J Clin Oncol,2007,25(15):1960-1966.
[13] Fountzilas G,Bobos M,Kalogera-Fountzila A,et al.Gemcitabine combined with gefitinib in patients with inoperable or metastatic pancreatic cancer:a phase II Study of the Hellenic Cooperative Oncology Group with biomarker evaluation[J].Cancer Invest,2008,26(26):784-793.
[14] Dennison SK,Jacobs SA,Wilson JW,et al.A phase II clinical trial of ZD 1839(Iressa)in combination with docetaxel as first-line treatment in patients with advanced breast cancer[J].Invest New Drugs,2007,25(6):545-551.
[15] Safran H,Miner T,Resnick M,et al.Lapatinib/gemcitabine and lapatinib/ gemcitabine/oxaliplatin:a phase I study for advanced pancreaticobiliary cancer[J].Am J Clin Oncol,2008,31(2):140-144.
[16] Morton M,Prendergast C,Barrett TD.Targeting gastrin for the treatment of gastric acid related disorders and pancreatic cancer[J].Trends Pharmacol Sci,2011,32(4):201-205.
[17] Chau I,Cunningham D,Russell C,et al.Gastrazole(JB 95008),a novel CCK 2/gastrin receptor antagonist,in the treatment of advanced pancreatic cancer:results from two randomised controlled trials[J].Br J Cancer,2006,94(8):1107-1115.
[18] Kawasaki D,Emori Y,Eta R,et al.Effect of Z-360,a novel orally active CCK-2/gastrin receptor antagonist on tumor growth in human pancreatic adenocarcinoma cell lines in vivo and mode of action determinations in vitro[J].Cancer Chemother Pharmacol,2008,61(5):883-892.
[19] Friess H,Langrehr JM,Oettle H,et al.A randomized multi-center phase II trial of the angiogenesis inhibitor Cilengitide (EMD 121974) and gemcitabine compared with gemcitabine alone in advanced unresectable pancreatic cancer[J].BMC Cancer,2006,6(8):285.
[20] Bramhall SR,Rosemurgy A,Brown PD,et al.Marimastat as first-line therapy for patients with unresectable pancreatic cancer:a randomized trial[J].J Clin Oncol,2001,19(15):3447-3455.
[21] Bramhall SR,Schulz J,Nemunaitis J,et al.A double-blind placebocontrolled,randomised study comparing gemcitabine and marimastat with gemcitabine and placebo as first line therapy in patients with advanced pancreatic cancer[J].Br J Cancer,2002,87(2):161-167.
[22] Moore MJ,Hamm J,Dancey J,et al.Comparison of gemcitabine versus the matrix metalloproteinase inhibitor BAY 12-9566 in patients with advanced or metastatic adenocarcinoma of the pancreas:a phase III trial of the National Cancer Institute of Canada Clinical Trials Group[J].J Clin Oncol,2003,21(17):1095-1102.
[23] Piscuoglio S,Zlobec I,Pallante P,et al.HMGA 1 and HMGA 2 protein expression correlates with advanced tumour grade and lymph node metastasis in pancreatic adenocarcinoma[J].Histopatholo gy,2012,60(60):397-404.
[24] Liau SS,Ashley SW,Whang EE.Lentivirus-mediated RNA interference of HMGA 1 promotes chemosensitivity to gemcitabine in pancreatic adenocarcinoma[J].J Gastrointest Surg,2006,10(9):1254-1263.
[25] Trapasso F,Sarti M,Cesari R,et al.Therapy of human pancreatic carcinoma based on suppression of HMGA1 protein synthesis in preclinical models[J].Cancer Gene Ther,2004,11(9):633-641.
[26] Ito D,Fujimoto K,Mori T,et al.In vivo antitumor effect of the mTOR inhibitor CCI-779 and gemcitabine in xenograft models of human pancreatic cancer[J].Int J Cancer,2006,118(9):2337-2343.
[27] Azzariti A,Porcelli L,Gatti G,et al.Synergic antiproliferative and antiangiogenic effects of EGFR and mTor inhibitors on pancreatic cancer cells[J].Biochem Pharmacol,2008,75(5):1035-1044.
[28] Tuncyurek P,Mayer JM,Klug F,et al.Everolimus and mycophenolate mofetil sensitize human pancreatic cancer cells to gemcitabine in vitro:a novel adjunct to standard chemotherapy?[J].Eur Surg Res,2007,39(6):380-387.
[29] Reuter S,Eifes S,Dicato M,et al.Modulation of anti-apoptotic and survival pathways by curcumin as a strategy to induce apoptosis in cancer cells[J].Biochem Pharmacol,2008,76:1340-1351.
[30] Wang Z,Desmoulin S,Banerjee S,et al.Synergistic effects of multiple natural products in pancreatic cancer cells[J].Life Sci,2008,83(8):293-300.
[31] Sun M,Estrov Z,Ji Y,Coombes KR,et al.Curcumin(diferuloylmethane)alters the expression profiles of microRNAs in human pancreatic cancer cells[J]. Mol Cancer Ther,2008,7(3):464-473.
[32] Dhillon N,Aggarwal BB,Newman RA,et al.Phase II trial of curcumin in patients with advanced pancreatic cancer[J].Clin Cancer Res,2008,14(14):4491-4499.
[33] Alberts SR,Foster NR,Morton RF,et al.PS-341 and gemcitabine in patients with metastatic pancreatic adenocarcinoma:a North Central Cancer Treatment Group(NCCTG)randomized phase II study[J].Ann Oncol,2005,16(10):1654-1661.
[34] Sloss CM,Wang F,Liu R,et al.Proteasome inhibition activates epidermal growth factor receptor (EGFR) and EGFR-independent mitogenic kinase signaling pathways in pancreatic cancer cells[J].Clin Cancer Res,2008,14(16):5116-5123.
[35] Li W,Mao Z,Fan X,Cui L,et al.Cyclooxygenase 2 promoted the tumorigenecity of pancreatic cancer cells[J].Tumour Biol,2014,35(3): 2271-2278.
[36] Ninomiya I,Nagai N,Oyama K,et al.Antitumor and anti-metastatic effects of cyclooxygenase-2 inhibition by celecoxib on human colorectal carcinoma xenografts in nude mouse rectum[J].Oncol Rep,2012,28(3):777-784.
[37] Goggins M,Shekher M,Turnacioglu K,et al.Genetic alterations of the transforming growth factor beta receptor genes in pancreatic and biliary adenocarcinomas[J].Cancer Res,1999,58(23):5329-5332.
[38] Levy L,Hill CS.Smad 4 dependency defines two classes of transforming growth factor {beta} (TGF-{beta}) target genes and distinguishes TGF-{beta}-induced epithelial-mesenchymal transition from its antiproliferative and migratory responses[J].Mol Cell Biol,2005,25(18):8108-8125.
[39] Melisi D,Ishiyama S,Sclabas GM,et al.LY 2109761,a novel transforming growth factor beta receptor type I and type II dual inhibitor,as a therapeutic approach to suppressing pancreatic cancer metastasis[J].Mol Cancer Ther,2008,7(4):829-840.
[40] Medicherla S,Li L,Ma JY,et al.Antitumor activity of TGF-beta inhibitor is dependent on the microenvironment[J].Anticancer Res,2007,27(6 B):4149-4157.
[41] Furukawa T,Duguid WP,Kobari M,et al.Hepatocyte growth factor and Met receptor expression in human pancreatic carcinogenesis[J].Am J Pathol,1995,147(4):889-895.
[42] Tomioka D,Maehara N,Kuba K,et al.Inhibition of growth,invasion,and metastasis of human pancreatic carcinoma cells by NK4 in an orthotopic mouse model[J].Cancer Res,2001,61(20):7518-7524.
[43] Jin H,Yang R,Zheng Z,et al.MetMAb,the one-armed 5 D 5 anti-c-Met antibody,inhibits orthotopic pancreatic tumor growth and improves survival[J].Cancer Res,2008,68(11):4360-4368.
[44] Piao W,Wang Y,Adachi Y,et al.Insulin-like growth factor-I receptor blockade by a specific tyrosine kinase inhibitor for human gastrointestinal carcinomas[J].Mol Cancer Ther,2008,7(6):1483-1493.
[45] Shen YM,Yang XC,Yang C,et al.Enhanced therapeutic effects for human pancreatic cancer by application K-ras and IGF-IR antisense oligodeoxynucleotides[J].World journal of gastroenterology:WJG, 2008,14(33):5176-5185.
[46] Liu W,Bloom DA,Cance WG,et al.FAK and IGF-IR interact to provide survival signals in human pancreatic adenocarcinoma cells[J].Carcinogenesis, 2008,29(6):1096-1107.
[47] Ischenko I,Guba M,Yezhelyev M,et al.Effect of Src kinase inhibition on metastasis and tumor angiogenesis in human pancreatic cancer[J].Angiogenesis, 2007,10(3):167-182.
[48] George TJ,Jr,Trevino JG,Liu C.Src inhibition is still a relevant target in pancreatic cancer[J].Oncologist,2014,19(2):211.
[49] Lee JJ,Perera RM,Wang H,et al.Stromal response to Hedgehog signaling restrains pancreatic cancer progression[J].Proc Natl Acad Sci,2014,111(30):E 3091-E 3100.
[50] Yauch RL,Gould SE,Scales SJ,et al.A paracrine requirement for hedgehog signalling in cancer[J].Nature,2008,455(7211):406-410.
[51] Chitkara D,Singh S,Kumar V,et al.Micellar delivery of cyclopamine and gefitinib for treating pancreatic cancer[J].Mol Pharm,2012,9(8):2350-2357.
[52] Hu WG,Liu T,Xiong JX,et al.Blockade of sonic hedgehog signal pathway enhances antiproliferative effect of EGFR inhibitor in pancreatic cancer cells[J].Acta pharmacologica Sinica,2007,28(8):1224-1230.
[53] Wang Z,Banerjee S,Li Y,et al.Down-regulation of notch-1 inhibits invasion by inactivation of nuclear factor-kappaB,vascular endothelial growth factor,and matrix metalloproteinase-9 in pancreatic cancer cells[J].Cancer Res,2006,66(5):2778-2784.
[54] Wang Z,Zhang Y,Banerjee S,Li Y,et al.Notch-1 down-regulation by curcumin is associated with the inhibition of cell growth and the induction of apoptosis in pancreatic cancer cells[J]. Cancer,2006,106(11):2503-2513.
[55] Doucas H,Mann CD,Sutton CD,et al.Expression of nuclear Notch 3 in pancreatic adenocarcinomas is associated with adverse clinical features,and correlates with the expression of STAT 3 and phosphorylated Akt[J].J Surg Oncol,2008,97(1):63-68.
[56] Zhang Y,Morris JP,Yan W,et al.Canonical wnt signaling is required for pancreatic carcinogenesis[J].Cancer Res,2013,73(15):4909-4922.
[57] Pasca di Magliano M,Biankin AV.Common activation of canonical Wnt signaling in pancreatic adenocarcinoma[J].PloS one,2007,2(11):e 1155.
[58] Wang Z,Ma Q,Liu Q,et al.Blockade of SDF-1/CXCR 4 signalling inhibits pancreatic cancer progression in vitro via inactivation of canonical Wnt pathway[J].Br J Cancer,2008,99(10):1695-1703.
[59] Zhu YY,Yuan Z.Pancreatic cancer stem cells[J].American journal of cancer research,2015,5(3):894-906.
[60] Deeb D,Gao X,Liu Y et al.Inhibition of telomerase activity by oleanane triterpenoid CDDO-Me in pancreatic cancer cells is ROS-dependent[J]. Molecules,2013,18(3):3250-3265.
[61] Middleton G,Silcocks P,Cox T,et al.Gemcitabine and capecitabine with or without telomerase peptide vaccine GV 1001 in patients with locally advanced or metastatic pancreatic cancer(TeloVac): an open-label,randomised,phase 3 trial[J].The Lancet Oncology,2014, 15(8):829-840.
[62] Collins AL,Wojcik S,Liu J,et al.A differential microRNA profile distinguishes cholangiocarcinoma from pancreatic adenocarcinoma[J].Ann Surg Oncol,2014,21(1):133-138.
[63] Li Y,Kong D,Ahmad A,et al.Pancreatic cancer stem cells:emerging target for designing novel therapy[J].Cancer Lett,2013,338(1):94-100.
[64] Visvader JE,Lindeman GJ.Cancer stem cells:current status and evolving complexities[J].Cell stem cell,2012,10(6):717-728.
[65] Cioffi M,Trabulo S,Hidalgo M,et al.Inhibition of CD 47 Effectively Targets Pancreatic Cancer Stem Cells via Dual Mechanisms[J].Clin Cancer Res,2015,21(10):2325-2337.
Pancreatic cancer is a highly malignant tumor. Many studies have confirmed that single-targeted therapy for pancreatic cancer is limited, and cannot effectively improve the quality of life of patients with pancreatic cancer. Current research on pancreatic cancer has identified many potential therapeutic targets. In this article, we reviewed the targeted therapy, particularly the multi-target treatment, for pancreatic cancer.
Pancreatic cancer; Multi-targert; Targeted therapy
10.3969/j.issn.1009-4393.2016.13.002
国家自然科学基金青年科学基金 (81402275)
四川 610213 国家知识产权局专利局专利审查协作四川中心(潘有礼 侯彦秋) 610041 四川大学华西校区生物治疗国家重点实验室 (赵成建)
潘有礼 E-mail:panyouli 8889@163.com
