新型苯并咪唑衍生物的合成及其生物活性
2016-06-12司伟杰张开心董梦雅张兰祥梅向东
司伟杰, 张 涛, 张开心, 董梦雅, 张兰祥, 梅向东
(中国农业科学院 植物保护研究所 植物病虫害生物学国家重点实验室,北京 100193)
·研究论文·
新型苯并咪唑衍生物的合成及其生物活性
司伟杰, 张涛, 张开心, 董梦雅, 张兰祥, 梅向东*
(中国农业科学院 植物保护研究所 植物病虫害生物学国家重点实验室,北京100193)
摘要:以香草醛为原料,经2步反应制得中间体——2-(4-羟基-3-甲氧基苯基)-1-氢-苯并咪唑(3); 3分别与取代苯甲酰氯,取代苯乙酰氯和取代苯磺酰氯反应,合成了13个新型的苯并咪唑衍生物(7a~7g, 8a, 8d, 8g, 9a, 9d和9g),其结构经1H NMR, IR和HR-ESI-MS表征。分别用菌丝生长速率法和曹坳程法测试了7~9的抑菌活性和除草活性。结果表明:c=100 mg·L-1时,7~9对番茄灰霉病菌,油菜菌核病菌和稻瘟病菌的抑制率分别为13.79%~65.38%, 13.88%~63.78%和34.22%~58.79%; c=300 mg·L-1时,7g对稗草和反枝苋的芽长抑制率分别为40.20%和80.84%。
关键词:香草醛; 苯并咪唑; 合成; 生物活性
含氮杂环化合物是重要的农药、医药和精细化工品中间体,其应用非常广泛[1-4]。其中苯并咪唑类化合物生物活性较好,具有抗菌消炎[5]、抗糖尿病[6]、抗病毒[7]、抗癌[8]、抗寄生虫[9]和抗线虫[10]等特点,在医药和农药领域倍受关注。以苯并咪唑类衍生物为主要成分的杀菌剂,如噻菌灵、多菌灵、苯菌灵等,对子囊菌、半知菌和部分担子菌纲真菌引起的病害具有较好的预防效果。
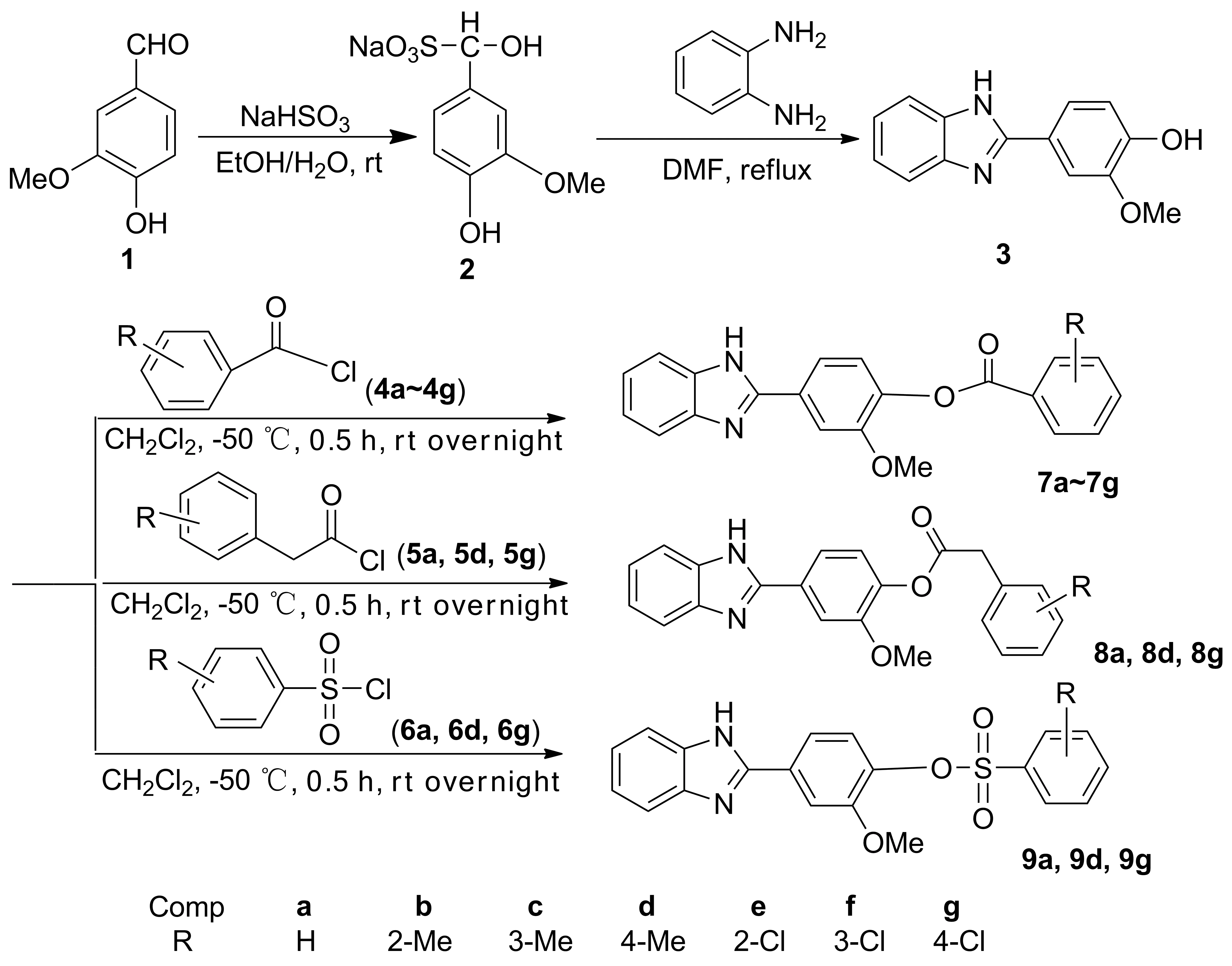
Scheme 1
酯类化合物是常见的生物活性分子。如DNA分子、杀菌剂、除草剂和植物精油等,均含有酯类物质[11]。磺酸酯类化合物常用于农药研发,如对黄瓜白粉病菌有特效的乙嘧酚磺酸酯[12]。
根据活性基团拼合理论,我们考虑将苯并咪唑环分别与取代苯甲酰氯(4a~4g)、取代苯乙酰氯(5a, 5d, 5g)和取代苯磺酰氯(6a, 6d, 6g)结合,设计并合成结构新颖的含苯并咪唑环的酯类、磺酸酯类衍生物。以香草醛(1)为原料,经2步反应制得中间体——2-(4-羟基-3-甲氧基苯基)-1-氢-苯并咪唑(3); 3分别与4a~4g, 5a, 5d, 5g和6a, 6d, 6g反应,合成了13个新型的苯并咪唑衍生物(7a~7g, 8a, 8d, 8g, 9a, 9d和9g, Scheme 1),其结构经1H NMR, IR和HR-ESI-MS表征。分别用菌丝生长速率法和曹坳程法测试了7~9的抑菌活性和除草活性。
1实验部分
1.1仪器与试剂
RY-1G型熔点仪(温度未校正);Bruker DPX 300 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);6700 FT IR型红外光谱仪(KBr压片);Agilent 6500 Series Q-TOF 型质谱仪。
2按文献[13]方法合成;其余所用试剂均为分析纯。
1.2合成
(1) 3的合成
在圆底烧瓶中加入2 12.8 g(50 mmol),邻苯二胺5.4 g(50 mmol)和DMF 80 mL,搅拌下回流反应4 h(油浴)。反应液倒入100 g碎冰中,待冰块完全溶解后抽滤,滤饼真空干燥得黄色粉末3,收率75.1%, m.p.214~216 ℃;1H NMRδ: 12.62(s, 1H), 9.48(s, 1H), 7.72(d,J=1.9 Hz, 1H), 7.61~7.58(m, 2H), 7.46(d,J=4.8 Hz, 1H), 7.14(d,J=5.3 Hz, 2H), 6.90(d,J=8.2 Hz, 1H), 3.87(s, 3H); IRν: 3 380, 3 042, 3 000, 2 965, 1 662, 1 603, 1 512, 1 435, 1 285, 1 264, 1 215, 1 130, 1 103, 1 035, 1 006, 856, 740 cm-1; HR-ESI-MSm/z: Calcd for C14H12N2O2{[M+H]+}241.089 9, found 241.089 3。
(2) 7~9的合成(以7g为例)[14]
在圆底烧瓶中加入3 1.92 g(8 mmol)和二氯甲烷20 mL,搅拌使其溶解;加入三乙胺0.8 g(8 mmol),冰盐浴冷却10 min,缓慢滴加对氯苯甲酰氯(4g)1.46 g(8.4 mmol)的二氯甲烷(5 mL)溶液,滴毕,反应30 min;于室温反应过夜。反应液依次用过饱和碳酸氢钠,饱和食盐水和水洗涤,无水硫酸镁干燥,减压浓缩后经硅胶柱层析[洗脱剂:V(乙酸乙酯) ∶V(石油醚)=1 ∶2~2 ∶1]纯化得7g。
以4a~4f, 5a, 5d, 5g和6a, 6d, 6g替代4g,用类似的方法合成7a~7f, 8a, 8d, 8g和9a, 9d, 9g。
7a: 白色粉末,收率60.2%, m.p.247~248 ℃;1H NMRδ: 12.97(s, 1H), 8.15(dd,J=5.2 Hz, 7.0 Hz, 2H), 7.98(d,J=1.8 Hz, 1H), 7.85~7.82(m, 2H), 7.80~7.78(m, 1H), 7.75(t,J=2.4 Hz, 2H), 7.70~7.66(m, 1H), 7.45(d,J=8.4 Hz, 1H), 7.22(d,J=5.1 Hz, 2H), 3.91(s, 3H); IRν: 3 062, 3 010, 2 963, 1 747, 1 603, 1 501, 1 429, 1 319, 1 261, 1 201, 1 174, 1 057, 1 024, 873, 749, 706 cm-1; HR-ESI-MSm/z: Calcd for C21H16N2O3{[M+H]+}345.116 1, found 345.115 6。
7b: 白色粉末,收率53.1%, m.p.254~256 ℃;1H NMRδ: 13.01(s, 1H), 8.08(d,J=7.5 Hz, 1H), 8.00(d,J=1.5 Hz, 1H), 7.85(dd,J=1.5 Hz, 8.1Hz, 1H), 7.58(d,J=6.4 Hz, 3H), 7.44(t,J=5.6 Hz, 3H), 7.23(d,J=4.7 Hz, 2H), 3.93(s, 3H), 2.60(s, 3H); IRν: 3 019, 2 964, 2 845, 1 743, 1 602, 1 502, 1 439, 1 269, 1 240, 1 203, 1 070, 1 034, 887, 870, 749, 735 cm-1; HR-ESI-MSm/z: Calcd for C22H18N2O3{[M+H]+}359.131 7, found 359.131 2。
7c: 白色粉末,收率57.4%, m.p.238~239 ℃;1H NMRδ: 13.01(s, 1H), 8.01~7.93(m, 3H), 7.85(dd,J=1.8 Hz, 8.3 Hz, 1H), 7.65~7.42(m, 5H), 7.26~7.22(m, 2H), 3.91(s, 3H), 2.43(s, 3H); IRν: 3 057, 2 959, 2 845, 1 746, 1 605, 1 503, 1 427, 1 276, 1 229, 1 193, 1 057, 1 030, 885, 858, 746, 736 cm-1; HR-ESI-MSm/z: Calcd for C22H18N2O3{[M+H]+}359.131 7, found 359.133 0。
7d: 白色粉末,收率60.3%, m.p.243~244 ℃;1H NMRδ:12.96(s, 1H), 7.99~8.05(m, 3H), 7.84(dd,J=1.8 Hz, 8.2 Hz, 1H), 7.64(dd,J=3.1 Hz, 5.9 Hz, 2H), 7.43(d,J=8.2 Hz, 3H), 7.22(dd,J=3.1 Hz, 5.9 Hz, 2H), 3.90(s, 3H), 2.44(s, 3H); IRν: 3 069, 3 001, 2 973, 1 747, 1 608, 1 501, 1 442, 1 266, 1 244, 1 170, 1 060, 1 034, 874, 855, 738 cm-1; HR-ESI-MSm/z: Calcd for C22H18N2O3{[M+H]+}359.131 7, found 359.131 5。
7e: 白色粉末,收率46.7%, m.p.242~243 ℃;1H NMRδ: 13.00(s, 1H), 8.13(dd,J=0.6 Hz, 1.3 Hz, 1H), 8.00(d,J=1.7 Hz, 1H), 7.85(dd,J=1.8 Hz, 8.2 Hz, 1H), 7.71~7.55(m, 5H), 7.24(d,J=2.4 Hz, 1H), 7.23(dd,J=2.4 Hz, 5.8 Hz, 2H), 3.95(s, 3H); IRν: 3 071, 3 018, 2 962, 1 758, 1 608, 1 589, 1 501, 1 430, 1 285, 1 269, 1 202, 1 087, 1 030, 887, 869, 747 cm-1; HR-ESI-MSm/z: Calcd for C21H15N2O3Cl{[M+H]+}379.077 1, found 379.076 6。
7f: 白色粉末,收率48.6%,m.p.230~231 ℃;1H NMRδ: 12.97(s, 1H), 8.12~8.10(m, 2H), 8.007~8.001(d,J=1.8 Hz, 1H), 7.86~7.83(m, 2H), 7.70~7.62(m, 3H), 7.47(d,J=8.2 Hz, 1H), 7.24(dd,J=3.1 Hz, 6.0 Hz, 2H), 3.92(s, 3H); IRν: 3 071, 2 997, 2 967, 1 716, 1 607, 1 502, 1 429, 1 280, 1 249, 1 199, 1 058, 1 028, 892, 864, 741 cm-1; HR-ESI-MSm/z: Calcd for C21H15N2O3Cl{[M+H]+}379.077 1, found 379.076 4。
7g: 白色粉末,收率50.3%, m.p.241~242 ℃;1H NMRδ:12.96(s, 1H), 8.15~8.11(m, 2H), 7.96(d,J=2.1 Hz, 1H), 7.82(dd,J=1.8 Hz, 8.2 Hz, 1H), 7.70~7.66(m, 3H), 7.54(d,J=7.5 Hz, 1H), 7.43(d,J=8.1 Hz, 1H), 7.21(dd,J=5.3 Hz, 8.7 Hz, 2H), 3.89(s, 3H); IRν: 3 070, 3 002, 2 975, 1 752, 1 591, 1 501, 1 440, 1 283, 1 260, 1 196, 1 094, 1 061, 1 035, 888, 874, 748 cm-1; HR-ESI-MSm/z: Calcd for C21H15N2O3Cl{[M+H]+}379.077 1, found 379.079 2。
8a: 白色粉末,收率43.1%, m.p.218~219 ℃;1H NMRδ: 12.92(s, 1H), 7.91(d,J=1.8 Hz, 1H), 7.78(dd,J=1.8 Hz, 8.2 Hz, 1H), 7.66(t,J=8.4 Hz, 1H), 7.55(t,J=8.5 Hz, 1H), 7.53~7.20(m, 8H), 3.99(s, 2H), 3.88(s, 3H); IRν: 3 048, 3 005, 2 962, 1 750, 1 605, 1 591, 1 500, 1 428, 1 345, 1 307, 1 266, 1 213, 1 171, 1 119, 1 028, 1 009, 865, 743, 699 cm-1; HR-ESI-MSm/z: Calcd for C22H18N2O3{[M+H]+}359.131 7, found 359.131 0。
8d: 白色粉末,收率45.2%, m.p.231~232 ℃;1H NMRδ: 12.96(s, 1H), 7.91(d,J=1.8 Hz, 1H), 7.78(dd,J=1.8 Hz, 8.2 Hz, 1H), 7.66(t,J=8.4 Hz, 1H), 7.55(t,J=8.5 Hz, 1H), 7.20~7.53(m, 7H), 3.99(s, 2H), 3.87(s, 3H), 2.45(s, 3H); IRν: 3 068, 3 010, 2 965, 1 750, 1 605, 1 591, 1 500, 1 428, 1 345, 1 307, 1 269, 1 216, 1 171, 1 119, 1 028, 1 009, 870, 743, 699 cm-1; HR-ESI-MSm/z: Calcd for C23H20N2O3{[M+H]+}373.147 4, found 373.146 8。
8g: 白色粉末,收率49.3%, m.p.234~235 ℃;1H NMRδ: 12.92(s, 1H), 7.91(d,J=1.8 Hz, 1H), 7.79~7.75(m, 1H), 7.66(t,J=8.4 Hz, 1H), 7.55(t,J=8.5 Hz, 1H), 7.20~7.51(m, 7H), 3.99(s, 2H), 3.86(s, 3H); IRν: 3 051, 3 007, 2 963, 1 750, 1 605, 1 590, 1 500, 1 431, 1 348, 1 309, 1 267, 1 215, 1 174, 1 119, 1 028, 1 006, 865, 743, 697 cm-1; HR-ESI-MSm/z: Calcd for C22H17N2O3Cl{[M+H]+}393.092 8, found 393.093 3。
9a: 白色粉末,收率55.7%, m.p.174~175 ℃;1H NMRδ: 13.03(s, 1H), 7.89~7.79(m, 5H), 7.68~7.57(m, 4H), 7.31(d,J=8.4 Hz, 1H), 7.22(d,J=4.2 Hz, 2H), 3.61(s, 3H); IRν: 3 060, 3 007, 2 963, 1 747, 1 603, 1 501, 1 429, 1 319, 1 261, 1 201, 1 174, 1 057, 1 024, 873, 749, 706 cm-1; HR-ESI-MSm/z: Calcd for C20H16N2O4S {[M+H]+}381.083 1, found 381.084 1。
9d: 白色粉末,收率58.5%, m.p.210~211 ℃;1H NMRδ: 13.06(s, 1H), 7.84(d,J=1.9 Hz, 1H), 7.78~7.73(m, 3H), 7.63(dd,J=2.0 Hz, 2.2 Hz, 2H), 7.47(d,J=8.0 Hz, 2H), 7.29~7.20(m, 3H), 3.63(s, 3H), 2.43(s, 3H); IRν: 2 976, 2 940, 2 918, 1 591, 1 501, 1 449, 1 266, 1 278, 1 246, 1 197, 1 179, 1 166, 1 089, 1 031, 867, 831, 747, 723 cm-1; HR-ESI-MSm/z: Calcd for C21H18N2O4S{[M+H]+}395.098 7, found 395.099 2。
9g: 白色粉末,收率62.3%, m.p.215~216 ℃;1H NMRδ: 13.01(s, 1H), 7.89~7.84(m, 3H), 7.80~7.74(m, 3H), 7.66(s, 1H), 7.55(d,J=6.3 Hz, 1H), 7.35(d,J=8.4 Hz, 1H), 7.23(d,J=2.9 Hz, 2H), 3.63(s, 3H); IRν: 3 100, 3 067, 2 945, 1 588, 1 501, 1 428, 1 285, 1 274, 1 250, 1 200, 1 180, 1 165, 1 087, 1 030, 859, 837, 746, 721 cm-1; HR-ESI-MSm/z: Calcd for C20H15N2O4SCl{[M+H]+415.044 1, found 415.043 6。
2结果与讨论
2.1合成
合成3的过程中,反应液颜色会出现由淡黄色到深绿色的明显变化。
在合成7~9的过程中,需保证4~6过量,使3反应完全。3与4~6的最佳摩尔比为1.00 ∶1.05。
2.2表征
由7~9的1H NMR分析可见,活泼氢(咪唑环上NH)吸收峰位于δ12.96~13.06, 苯环氢吸收峰位于δ7.20~8.15,甲氧基氢吸收峰位于δ3.61~3.91,甲基氢吸收峰位于δ2.42~2.60。以7d为例,甲基氢吸收峰位于δ2.44,甲氧基氢吸收峰位于δ3.90,苯环氢吸收峰位于δ7.22~8.05,峰型各异。
2.3生物活性
(1) 抑菌活性
采用菌丝生长速率法[15]测定了7~9(c=100 mg·L-1)对番茄灰霉病菌(B.cin),油菜菌核病菌(S.scl),稻瘟病菌(P.gri)的抑菌活性,结果见表1。
由表1可见,7~9对番茄灰霉病菌,油菜菌核病菌和稻瘟病菌的抑制率分别为13.79%~65.38%, 13.88%~63.78%和34.22%~58.79%。
(2) 除草活性
采用曹坳程法[16]测定了7~9(c=300 mg·L-1)对稗草(E.cru)和反枝苋(A.ret)的芽长抑制活性,结果见表2。
由表2可见,7g的除草活性较好,对稗草和反枝苋的芽长抑制率分别为40.20%和80.84%。
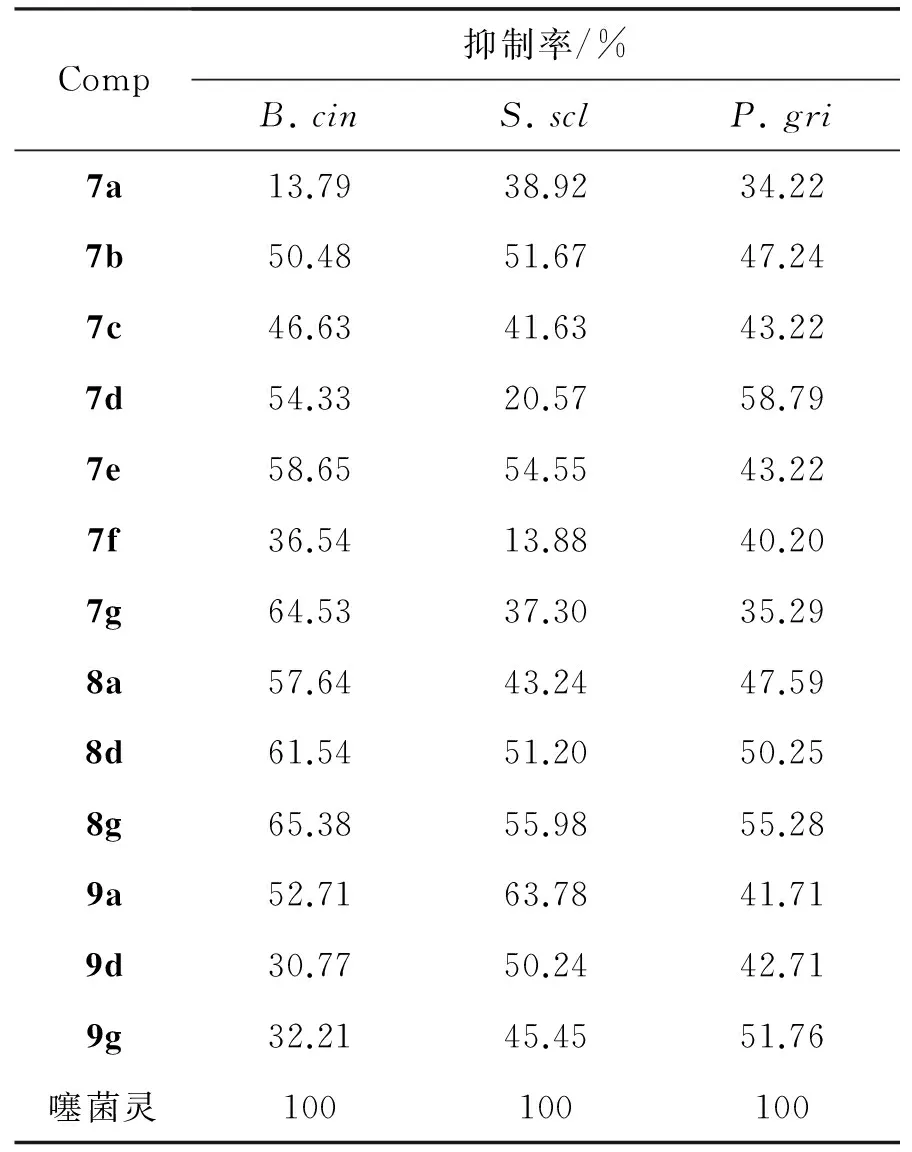
表1 7~9的抑菌活性
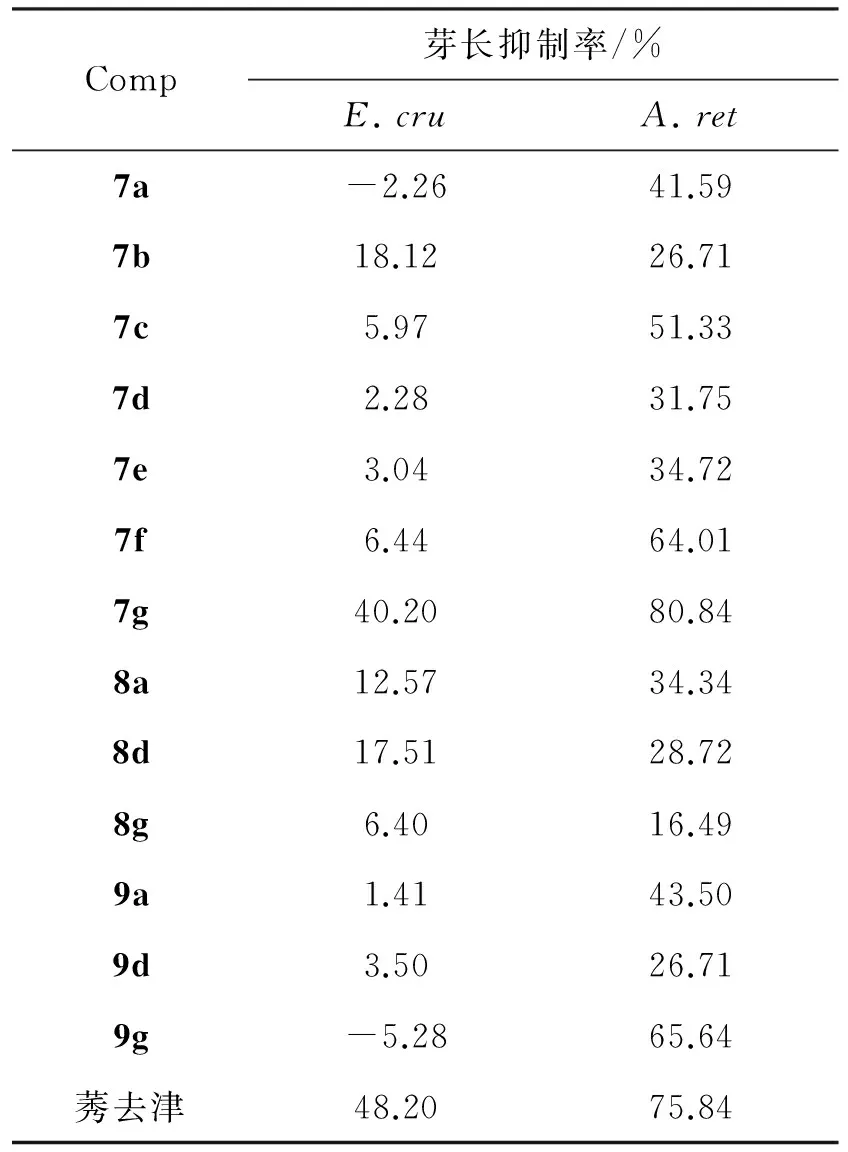
表2 7~9的除草活性
设计并合成了13个新型的苯并咪唑衍生物(7a~7g, 8a, 8d, 8g, 9a, 9d和9g)。生物活性测试结果表明:c=100 mg·L-1时,7~9对番茄灰霉病菌,油菜菌核病菌和稻瘟病菌的抑制率分别为13.79%~65.38%, 13.88%~63.78%和34.22%~58.79%;c=300 mg·L-1时,7g对稗草和反枝苋的芽长抑制率分别为40.20%和80.84%,与莠去津相近。本研究证实了该类化合物可能既有抑菌活性又有除草活性,对开发具有除草-抑菌二元活性的新型化合物有一定借鉴意义。
致谢:感谢国家自然科学基金(31321004)和973课题(2014CB932201和2012CB114104)的资助。
参考文献
[1]杨志勇. 一些含氮杂环化合物及其衍生物的合成[D].长沙:湖南大学,2014.
[2]张进,肖国民. 含氮杂环化合物的研究进展[J].石油化工,2011,40(06):579-584.
[3]李乐平. 含氮杂环化合物的合成研究[D].天津:天津大学,2004.
[4]曾润生. 含氮杂环化合物的设计与合成[D].苏州:苏州大学,2003.
[5]Kalinowska L U, Felczak A, Chęcińska L,etal. Synthesis,characterization and antimicrobial activity of silver(I) complexes of hydroxymethyl derivatives of pyridine and benzimidazole[J].Journal of Organometallic Chemistry,2014,749:394-399.
[6]Shingalapur R V, Hosamani K M, Keri R S,etal. Derivatives of benzimidazole pharmacophore:Synthesis,anticonvulsant,antidiabetic and DNA cleavage studies[J].European Journal of Medicinal Chemistry,2010,45(5):1753-1759.
[7]Tomei L, Altamura S, Bartholomew L,etal. Mechanism of action and antiviral activity of benzimidazole-based allosteric inhibitors of the hepatitis C virus RNA-dependent RNA polymerase[J].Journal of Virology,2003,77(24):13225-13231.
[8]Yoon Y K, Ali M A, Wei A C,etal. Synthesis and evaluation of novel benzimidazole derivatives as sirtuin inhibitors with antitumor activities[J].Bioorganic & Medicinal Chemistry,2014,22(2):703-710.
[9]Wilkinson C, Mcphillie M J, Zhou Y,etal. The benzimidazole based drugs show good activity against T. gondii but poor activity against its proposed enoyl reductase enzyme target[J].Bioorganic & Medicinal Chemistry Letters,2014,24(3):911-916.
[10]Rialch A, Vatsya S, Kumar R R. Detection of benzimidazole resistance in gastrointestinal nematodes of sheep and goats of sub-himalyan region of northern India using different tests[J].Veterinary Parasitology,2013,198(3):312-318.
[11]Djojoputro H, Ismadji S. Density and viscosity correlation for several common fragrance and flavor esters[J].Journal of Chemical & Engineering Data,2005,50(2):727-731.
[12]叶玉涛,范芮,闫晓静,等. 乙嘧酚磺酸酯 25% 微乳剂防治黄瓜白粉病田间药效试验[J].农药科学与管理,2013,34(3):50-52.
[13]Coban G, Zencir S, Zupkó I,etal. Synthesis and biological activity evaluation of 1H-benzimidazoles via mammalian DNA topoisomerase I and cytostaticity assays[J].European Journal of Medicinal Chemistry,2009,44(5):2280-2285.
[14]李宗英,黄晓瑛,张媛媛,等. 乙嘧酚磺酸酯合成研究评述[J].农药,2012,51(07):482-484.
[15]Zhang M, Dai Z C, Qian S S,etal. Design,synthesis,antifungal,and antioxidant activities of (E)-6-[(2-phenylhydrazono)methyl]quinoxaline derivatives[J].Journal of Agricultural and Food Chemistry,2014,62(40):9637-9643.
[16]曹坳程. 再介绍一种氯代乙酰胺类除草剂的生物测定方法[J].农药科学与管理,1992,2:11-14.
Synthesis and Bioactivities of Novel Benzimidazole Derivatives
SI Wei-jie,ZHANG Tao,ZHANG Kai-xin,DONG Meng-ya,ZHANG Lan-xiang,MEI Xiang-dong*
(State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection,Chinese Academy of Agricultural Sciences, Beijing 100193, China)
Abstract:The intermediate, 2-(4-hydroxy-3-methoxyphenyl)-1-H-benzimidazole(3), was prepared by a two-step reaction from vanilline. Thirteen novel benzimidazole derivatives (7a~7g, 8a, 8d, 8g, 9a, 9d and 9g) were synthesized by the reaction of 3 with substituted benzoyl chloride, substituted phenylacetyl chloride and substituted phenylsulfonyl chloride, respectively. The structures were characterized by1H NMR, IR and HR-ESI-MS. The antifungicidal and herbicidal activities were investigated by mycelium growth rate method and Cao Ao-cheng method, respectively. The results indicated that the inhibition rates of 7~9 against Botrytis cinerea, Sclerotinia sclerotiorum and Pyricularia grisea were 13.79%~65.38%, 13.88%~63.78% and 34.22%~58.79%, respectively, at the concentration of 100 mg·L-1. 7g exhibited good herbicidal activities against Echinochloa crusgalli and Amaranthus retroflexus at the concentration of 300 mg·L-1. The inhibition rates were 40.20% and 80.84%, respectively.
Keywords:vanilline; benzimidazole; synthesis; biological activity
收稿日期:2015-05-11;
修订日期:2016-03-28
基金项目:国家自然科学基金资助项目“棉花-害虫-天敌的互作机制”(31321004); 973课题“纳米材料与技术改善农药剂型功能的作用机制”, “害虫和寄主植物的化学通讯机制”(2014CB932201, 2012CB114104)
作者简介:司伟杰(1987-),男,汉族,河南新郑人,硕士研究生,主要从事农药合成的研究。 E-mail: siweijiezhibao@163.com通信联系人: 梅向东,博士,副研究员,硕士生导师, E-mail: xdmei@ippcaas.cn
中图分类号:O626.23; O621.3
文献标志码:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.05.15189
